Серебряная вода – Водовоз.RU
Комментировать
Целительные свойства серебра известны человечеству очень давно. Лучший пример «целебного» действия серебряной воды – священная для индийцев река Ганг, несущая желтые воды через всю территорию Индии. Многочисленные телевизионные передачи демонстрируют, как местные жители используют реку: пьют воду, моются, стирают одежду, поят и купают животных, в то же время в реку сбрасывают трупы, сливают нечистоты. И, при этом, река не превращается в рассадник инфекций, ее вода не приносит вреда, даже при круглогодичной жаре, свойственной климату Индии!
В чем причина? Еще в прошлом столетии ученые доказали, что в водах Ганга содержится большое количество ионов серебра, которые очищают воду, поэтому чудесные свойства реки – это закономерность, а не чудо. Исследования показали, что грунтовые воды реки Ганг омывают значительное природное месторождение серебра. Известно, что серебро может растворяться в воде, с образованием концентрированных растворов ионов серебра. Вода в реке Ганг обогащается ионами серебра благодаря процессу растворения природного серебра. Так происходит естественный процесс ионизации воды в реке.
Известно, что серебро может растворяться в воде, с образованием концентрированных растворов ионов серебра. Вода в реке Ганг обогащается ионами серебра благодаря процессу растворения природного серебра. Так происходит естественный процесс ионизации воды в реке.
Бактерицидные свойства серебра проявляется уже при минимальных концентрациях ионов металла в воде (0,01 мг/л). Этого достаточно для гарантированного уничтожения около 650 разновидностей патогенных бактерий, вирусов и грибков. Спектр действия ионов серебра в 40 раз шире, чем у самых дорогостоящих антибиотиков, к которым микробы быстро приспосабливаются, а от серебра погибают неизбежно. Антибактериальный эффект серебряной воды сильнее действия пенициллина в 90 раз. При этом, ионы серебра не влияют на полезную микрофлору, не вызывают дисбактериоза и абсолютно безвредны для человека.
Серебро намного лучше защищает организм от патогенной микрофлоры, чем медь и кремний, которые также обладают бактерицидным действием. Важно отметить, что в отличие от меди, кремния и других биоэлементов, серебро не является жизненно необходимым (эссенциальным) микроэлементом для человека. Эссенциальные – без которых организм не может расти, развиваться и совершать свой естественный жизненный цикл. Попав в кровоток серебро не изымается из него для решения неотложных задач обмена веществ. Оно курсирует день за днем по самым отдаленным, интимным закоулкам организма, оказывая бактерицидное действие на затаившуюся там инфекцию. В результате наступает исцеление от болезней, которые не поддаются другим методам лечения. Об этом убедительно свидетельствуют успехи применения серебра гомеопатами, которые традиционно используют серебро в малых количествах для лечения ряда заболеваний. С помощью микродоз серебра они успешно справляются с нервными и глазными болезнями, заболеваниями органов дыхания, суставов, желудочно-кишечного тракта, женскими болезнями и мочеполовыми заболеваниями. При этом, в отличие от традиционных лекарственных средств, гомеопатические препараты на основе микродоз серебра не имеют побочного действия и противопоказаний.
Эссенциальные – без которых организм не может расти, развиваться и совершать свой естественный жизненный цикл. Попав в кровоток серебро не изымается из него для решения неотложных задач обмена веществ. Оно курсирует день за днем по самым отдаленным, интимным закоулкам организма, оказывая бактерицидное действие на затаившуюся там инфекцию. В результате наступает исцеление от болезней, которые не поддаются другим методам лечения. Об этом убедительно свидетельствуют успехи применения серебра гомеопатами, которые традиционно используют серебро в малых количествах для лечения ряда заболеваний. С помощью микродоз серебра они успешно справляются с нервными и глазными болезнями, заболеваниями органов дыхания, суставов, желудочно-кишечного тракта, женскими болезнями и мочеполовыми заболеваниями. При этом, в отличие от традиционных лекарственных средств, гомеопатические препараты на основе микродоз серебра не имеют побочного действия и противопоказаний.
Употребление серебряной воды зимой эффективно защищает организм от простудных заболеваний, а в летний период – от кишечных инфекций. Регулярное поступление в организм ионов серебра с питьевой водой не только полезно, но иногда просто необходимо. Например, космонавты во время полета и моряки на подводных лодках пьют именно серебряную воду. Практика показала, что обработка бортовых запасов питьевой воды серебром обеспечивает сохранение ее высоких органолептических и санитарно-гигиенических свойств в условиях космических полетов и морских путешествий разной продолжительности. Обогащенная серебром вода страхует экипажи от возможности заразиться инфекцией. Интересно, что более половины авиакомпаний мира сегодня используют воду, обработанную серебром, для защиты пассажиров от инфекций.
Регулярное поступление в организм ионов серебра с питьевой водой не только полезно, но иногда просто необходимо. Например, космонавты во время полета и моряки на подводных лодках пьют именно серебряную воду. Практика показала, что обработка бортовых запасов питьевой воды серебром обеспечивает сохранение ее высоких органолептических и санитарно-гигиенических свойств в условиях космических полетов и морских путешествий разной продолжительности. Обогащенная серебром вода страхует экипажи от возможности заразиться инфекцией. Интересно, что более половины авиакомпаний мира сегодня используют воду, обработанную серебром, для защиты пассажиров от инфекций.
Пока в нашем организме курсируют ионы серебра, мы находимся под неусыпной опекой «личной серебряной охраны», которая обеспечивает нашу безопасность и отвратит любые попытки покуситься на наше здоровье. Это своеобразная серебряная кольчуга, которая защитит организм от посягательства любых патогенных начал. Замечено, что персонал, работающий на предприятиях по добыче и переработке серебра, болеет гораздо реже, чем в других отраслях производства, а люди с признаками аргирии (заболевание, вызванное избыточным накоплением серебра в организме) не подвержены инфекционным заболеваниям, даже если попадают в очаг инфекции.
Для получения серебряной воды в домашних условиях предлагается несколько способов. Первый способ (который нередко называют самым лучшим) – получение растворов серебра с использованием электрических ионизаторов. Постоянный электрический ток пропускают в воде между двумя электродами. Под действием тока серебро растворяется, при этом в воду в большом количестве выделяются ионы серебра. С помощью ионизаторов можно получить воду с очень большим содержание серебра.
Однако такую воду рекомендуется применять только наружно, поскольку накопление серебра в организме человека в избыточных количествах может вызывать специфическое заболевание, называемое «аргироз» или «аргирия». Проявляется оно в потемнении слизистых и кожи, которая может приобретать от серовато-голубоватого до аспидно-серого оттенка. Пигментация кожи и слизистых развивается, как правило, очень медленно, проявляясь через 5 и более лет после начала постоянного воздействия высоких доз серебра. Возможно и более быстрое развитие аргироза вследствие интенсивного лечения препаратами серебра и его приема внутрь в значительных дозах. Еще более рискованным в этом отношении является способ обогащения воды ионами серебра с помощью солей серебра. Разовая доза азотнокислого серебра (AgNO3) в 10 граммов (6,35 г в пересчете на чистое серебро) оценивается Всемирной Организацией Здравоохранения как опасная для жизни.
Еще более рискованным в этом отношении является способ обогащения воды ионами серебра с помощью солей серебра. Разовая доза азотнокислого серебра (AgNO3) в 10 граммов (6,35 г в пересчете на чистое серебро) оценивается Всемирной Организацией Здравоохранения как опасная для жизни.
Наиболее простой и доступный способ получения серебряной воды – контактный или народный: нужно «просто» поместить в воду изделие из чистого серебра не менее 999 пробы. Однако на деле этот способ не работает: все поступающие сегодня в продажу изделия из серебра имеют низкую пробу (750, 800, 875, 916, 925, 960 и 980 пробы). Кроме того, для защиты серебра от окисления они анодируются путем создания на поверхности создания оксидной плёнки, или родируются – гальваническим методом покрываются сверху тонкой пленкой из инертного металла родия, что наглухо перекрывает поступление ионов серебра в воду. Исключение составляют сувенирные серебряные монеты банков РФ – они изготавливаются из серебра 999 пробы, зачастую не анодируются и не покрываются родием, но их стоимость довольно высока для процедуры домашнего получения серебряной воды.
В ювелирных магазинах можно купить специальные «ионизаторы питьевой воды» – художественные серебряные миниатюры на цепочке с зажимом для крепления к стенке сосуда. Но, как и все прочие современные серебряные ювелирные украшения, они имеют более низкую, чем у пищевого серебра пробу и покрыты сверху защитной оксидной пленкой или родием. Это делает их абсолютно непригодными для получения серебряной воды. К тому же стоимость этих изделий подчас не уступает серебряным монетам банков РФ.
Идеальным решением получения серебряной воды в домашних условиях с достаточно высокой концентрацией ионов серебра (до 0,02 мг/л), обладающей выраженным бактерицидным действием и абсолютно безопасной для организма человека, является использование специально разработанных компанией «АкваАмулет» ионизаторов серебра для воды, получивших название «Лузанаторы». Это компактный стержень из меди, покрытый пищевым серебром высшей 999 пробы. При контакте с этим благородным металлом вода обретает абсолютно новые качества. Прежде всего, благодаря бактерицидному эффекту серебра, она может не портиться длительное время, так как в ней гибнут практически все микроорганизмы.
Прежде всего, благодаря бактерицидному эффекту серебра, она может не портиться длительное время, так как в ней гибнут практически все микроорганизмы.
Кроме того, она приобретает мягкий вкус природной родниковой воды. Серебро высшей пробы имеет идеальную кристаллическую решетку, при контакте с которой молекулы серебряной воды выстраивается в упорядоченные кластеры, подобные молекулам в талой воде. Таким образом, одновременно с ионизировнием, происходит еще и структурирование серебряной воды.
Многочисленными исследованиями доказано, что структурированная вода, помимо улучшения питания и очищения организма, существенно улучшает доставку клеткам лекарственных средств. Это позволяет наиболее полно использовать целебную силу лекарств, в силу высокой степени проникновения молекул воды с растворенными в ней препаратами непосредственно в клеточную структуру.
Получение серебряной воды с помощью Лузанатора
Чтобы получить воду, обогащенную серебром, нужно просто поместить Лузанатор в любой сосуд и наполнить его водой. Перед применением поверхность Лузанатора необходимо очистить от возможных загрязнений, следов жира и рук. Для этого изделие нужно промыть теплой водой с мылом и тщательно ополоснуть.
Перед применением поверхность Лузанатора необходимо очистить от возможных загрязнений, следов жира и рук. Для этого изделие нужно промыть теплой водой с мылом и тщательно ополоснуть.
С помощью специальной присоски Лузанатор удобно крепится к внутренней стенке графина, кувшина, кулера, помпы, чашки, или просто помещается в емкость с холодной кипяченой водой или водой очищенной от примесей с помощью кувшинного фильтра. Уже через четыре часа такую воду можно использовать для питья, умывания, полоскания ротовой полости и т. д.
Для того, чтобы активность серебряной воды всегда была высокой, а само изделие служило долго и исправно, необходимо соблюдать некоторые несложные правила:
1. Нельзя заливать Лузанатор водой из под крана, поскольку она содержит хлор, с которым серебро образует нерастворимые соединения. Чтобы воду, предназначенную для обогащения ионами серебра, избавить от хлора её нужно предварительно прокипятить или очистить с помощью кувшинного фильтра с угольным патроном. Отстаивание воды в открытом сосуде без дополнительной принудительной аэрации хлор из неё не удаляет, поскольку он тяжелее воздуха в 3,5 раза. С таким же успехом можно ожидать, что после отстаивания воды из неё улетучится попавший в неё песочек.
Отстаивание воды в открытом сосуде без дополнительной принудительной аэрации хлор из неё не удаляет, поскольку он тяжелее воздуха в 3,5 раза. С таким же успехом можно ожидать, что после отстаивания воды из неё улетучится попавший в неё песочек.
2. Лузанатор нужно постараться поместить как можно ближе ко дну сосуда, чтобы он всегда находился в воде и не контактировал с воздухом, в котором всегда присутствуют соединения серы и других агрессивных химических элементов. Сера, ртуть, йод и многие другие вещества вступают в реакцию с серебром, вызывая его потемнение. На поверхности изделия образуются нерастворимые химические соединения, блокирующие его работу. Поэтому уровень воды в сосуде с Лузанатором необходимо поддерживать таким образом, чтобы изделие было всегда покрыто водой.
3. Чтобы процесс ионизации прошел правильно, при приготовлении воды с ионами серебра необходимо отказаться от металлической посуды.
4. Если стержень Лузанатора потемнел, его необходимо очистить. Для очистки устройства понадобится обычная зубная паста. Наберите на мокрый указательный и большой палец руки каплю пасты величиной с горошину. Легкими движениями пальцев несколько раз пройдитесь по поверхности Луназатора. Он заблестит, а на пальцах останется темный налет окиси серебра. Промойте изделие от остатков пасты – оно вновь готово к работе. Необходимо помнить, что слой серебра на Лузанаторе всего 15 микрон, поэтому при очистке изделия не нужно проявлять излишнее усердие.
Для очистки устройства понадобится обычная зубная паста. Наберите на мокрый указательный и большой палец руки каплю пасты величиной с горошину. Легкими движениями пальцев несколько раз пройдитесь по поверхности Луназатора. Он заблестит, а на пальцах останется темный налет окиси серебра. Промойте изделие от остатков пасты – оно вновь готово к работе. Необходимо помнить, что слой серебра на Лузанаторе всего 15 микрон, поэтому при очистке изделия не нужно проявлять излишнее усердие.
Домашний тест на бактерицидность серебряной воды
А можно ли самому убедиться, что предлагаемые для получения серебряной воды изделие не подделка, а ионизированная вода, полученная с его помощью, обладает бактерицидным действием? В качестве ответа на этот вопрос, мы разработали простой и доступный домашний тест, дающий возможность каждому желающему убедиться в бактерицидной активности серебряной воды полученной с помощью Лузанаторов.
– Вечером завариваем 100 граммами кипятка пакетик обычного черного байхового чая для разовой заварки (например, «Принцесса Нури») в чайной чашке или стакане. Накрываем стакан любой подходящей крышкой и оставляем стоять до утра на кухонном столе.
Накрываем стакан любой подходящей крышкой и оставляем стоять до утра на кухонном столе.
– Одновременно с этим, заливаем Лузанатор одним литром холодной кипяченой или профильтрованной воды в его рабочей емкости
– Утром удаляем использованный для заварки пакетик, отжав чайной ложечкой оставшуюся в нем жидкость.
– Полученную густую заварку разливаем поровну в два стеклянных стакана с прозрачным дном (подойдут обычные граненые стаканы).
– Далее, в один из стаканов с заваркой, добавляем равное по объему количество холодной кипяченой воды.
– Во второй стакан с заваркой добавляем равное по объему количество серебряной воды, настаиваемой с вечера в емкости с Лузанатором (воду предварительно необходимо хорошо перемешать круговыми движениями емкости). Помечаем этот стакан фломастером, полоской скотча, резинкой для денег.
– Не накрывая стаканы, оставляем их на сутки стоять на кухонном столе у стенки, чтобы исключить попадание на них прямого солнечного света. Через сутки в стакане с чаем, разбавленном кипяченой охлажденной водой, начинают активно размножаются микроорганизмы, он быстро мутнеет и теряет прозрачность, что видно невооруженным глазом, особенно при просмотре через жидкость какого-либо текста. Если, в силу низкой комнатной температуры или иных причин, через сутки никаких изменений в стаканах не видно, следует продолжить наблюдение еще на 12 часов.
Через сутки в стакане с чаем, разбавленном кипяченой охлажденной водой, начинают активно размножаются микроорганизмы, он быстро мутнеет и теряет прозрачность, что видно невооруженным глазом, особенно при просмотре через жидкость какого-либо текста. Если, в силу низкой комнатной температуры или иных причин, через сутки никаких изменений в стаканах не видно, следует продолжить наблюдение еще на 12 часов.
Результаты теста на бактерицидность серебряной воды
При испытании Лузанатора в условиях водного модельного раствора (контакт с изделием при температуре +24 градусов и экспозиции 1 сутки), выполненного Головным центром гигиены и эпидемиологии Федерального медико-биологического агентства России, фактический уровень серебра в воде составил 0,02 мг/л. Вода, обработанная серебром в концентрации 0,02 мг/л, сохраняет высокие санитарно-гигиенические показатели в течение года и более. Хранить «серебряную» воду желательно в защищенном от света месте или в темной посуде, поскольку любая «прозрачность» приводит потере бактерицидных свойств. «Серебряная» вода не подлежит кипячению, но холода она не боится.
«Серебряная» вода не подлежит кипячению, но холода она не боится.
Советуем также почитать
С Новым годом и Рождеством!
Дорогие друзья, компания Водовоз.RU от всей души поздравляет Вас с наступающим Новым годом и Рождеством!
Подробнее
Природная щелочная вода Chureau
Позаботьтесь о своём здоровье вместе с природной щелочной водой Chureau!
Подробнее
Лечебная вода Kobi
Вы находитесь в поисках идеальной лечебной воды? Тогда попробуйте Kobi!
Подробнее
Написать комментарий:
Серебро в воде – Справочник химика 21
Растворимость хлорида серебра в воде при 25°С составляет только 1,7-10 моль/л, поэтому непосредственно определить энтальпию растворения невозможно Предложите способы определения энтальпии растворения. [c.114]
[c.114]
Вычислите растворимость иодида серебра в воде при 25° С исходя из величин стандартных энергий Гиббса для образования Agl(Kp), Ag+ и 1 из простых веществ. [c.307]
Прн 291 К удельная электропроводность насыщенного раствора хлорида серебра в воде равна 1,37-10- Ом- -см-. Удельная электропроводность воды прн этой температуре равна 4-10 Ом -см-, Вычислите концентрацию хлорида серебра в чистой воде, считая раствор предельно разбавленным и у =1- Воспользуйтесь данными справочника. [c.55]
Рассчитайте растворимость хлорида серебра в воде прн 323 К, если прп этой температуре э, д. с. гальванического элемента [c.60]
Дозировка серебра в воду осуществляется в специальных аппаратах — ионаторах [c.162]
Аналогичным образом можно получить золи бромида и хлорида серебра, однако эти золи менее устойчивы. Причина этого заключается в сравнительно большой растворимости этих соединений. (Растворимости иодида, бромида и хлорида серебра в воде при 20°С равны соответственно 9,7-10-9, 6,6-10 и 1,25-10-5 моль/л). Чем выше растворимость дисперсной фазы, тем легче происходит перекристаллизация коллоидных агрегатов и тем быстрее стареет золь. [c.246]
(Растворимости иодида, бромида и хлорида серебра в воде при 20°С равны соответственно 9,7-10-9, 6,6-10 и 1,25-10-5 моль/л). Чем выше растворимость дисперсной фазы, тем легче происходит перекристаллизация коллоидных агрегатов и тем быстрее стареет золь. [c.246]
Вычислите растворимость фосфата серебра в воде. [c.277]
Предложите способы определения растворимости хлорида серебра в воде (то же для хлорида натрия). [c.288]
Растворимость одного вещества в другом — свойство, присущее всем веществам. Растворимость может быть неограниченной и крайне малой, что зависит от термодинамических свойств растворяемого вещества и растворителя. Даже при чрезвычайно малой растворимости одного вещества в другом всегда имеет место переход веществ через поверхность их контакта. Любой металл растворяется в воде, однако растворимость в ряду металлов изменяется в очень широких пределах. Например, щелочные металлы бурно взаимодействуют с водой, при этом выделяется из воды водород и в растворе образуются гидроксиды металлов. Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается так называемая серебряная вода . Таким образом, одни металлы активно растворяются в воде, другие — крайне мало. Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает отрасль химической науки — электрохимия. [c.257]
Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается так называемая серебряная вода . Таким образом, одни металлы активно растворяются в воде, другие — крайне мало. Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает отрасль химической науки — электрохимия. [c.257]
Растворимость цианида и бромида серебра в воде при 25°С равна 1,414-10- и 6,928-10- моль-л- соответственно. Найти концентрацию ионов Ag+, N- и Вг- в водном растворе, насыщенном обеими солями. [c.16]
Вода, выдержанная в серебряном сосуде ( серебряная вода ), обладает бактерицидными свойствами. Пред.южи-те уравнения возможных реакций перехода серебра в воду в виде ионов Ag+. [c.121]
Задача 7. Растворимость нитрата серебра в воде при 10°С равна 1600 г/л. Какая масса нитрата серебра растворится в 2,5 кг воды при данной температуре [c.173]
Растворимость хлорида серебра в воде при 25 С равна 1,3-10 моль/л. Пользуясь предельным законом Дебая-Хюккеля, оцените его растворимость в 0,2Л/ водном растворе сульфата натрия. [c.93]
Пользуясь предельным законом Дебая-Хюккеля, оцените его растворимость в 0,2Л/ водном растворе сульфата натрия. [c.93]
Рассчитайте растворимость хлорида серебра в воде при 25 °С, используя стандартные электродные потенциалы Ag” “, Ag и СЬ, СГ. [c.99]
Определить растворимость в граммах на 1 л хлорида серебра в воде, если произведение растворимости его равно 1,78 10″ °. [c.39]
Проведение опыта. Приготовить суспензию хлорида серебра в воде сливанием растворов нитрата серебра и хлорида натрия. Отфильтровать осадок на большой воронке Бюхнера. Вынуть фильтр с осадком, прикрыть половину его черной бумагой и осветить в течение минуты с помощью ртутной лампы. Снять черную бумагу. Прикрытый участок остался белым, остальная часть фильтра потемнела вследствие быстрого разложения хлорида серебра под действием света. [c.25]
Растворимость хлористого серебра в воде s определяется из величины его произведения растворимости [c. 272]
272]
Вычисляем растворимость роданида серебра в воде при / = 1 [c.78]
Отсюда растворимость хлорида серебра в воде составляет [c.204]
В 1957 г. Деринг установил, что бромистый тропилий окисляется окисью серебра в воде или хромовой кислотой в уксусной кислоте до бензальдегида, и высказал предположение, что реакция протекает с образованием и перегруппировкой соответствующего спирта по механизму, изображенному ниже [c.490]
Растворимости иодида, бромида и хлорида серебра в воде при 20 С равны соответственно 9,7-10- , 6,6-10- и 1,25-10 моль/л). Чем выше растворимость дисперсной фазы, тем легче происходит перекристаллизация коллоидных агрегатов и тем быстрее стареет золь. [c.246]
Гидролиз галогеналканов. Галогеналканы очень медленно гидролизуются водой до алканолов. Реакция ускоряется при замене воды на гидроксиды щелочных металлов или гидроксид серебра (суспензия оксида серебра в воде) [c. 305]
305]
Действием оксида серебра в воде или с помощью ионообменных смол четвертичные галогениды аммония превращают в четвертичные аммониевые основания [c.491]
Следы серебра в воде водоемов, содержащих медь и >2-10″ % серебра, можно определить [1633] методом, основанным на гашении флуоресценции растворов 2,4,5,7-тетрабромфлуоресцеина в присутствии о-фенантролина и серебра. [c.176]
Чем меньше растворимость осадка, тем более устойчивым должен быть комплекс, в виде которого собираются растворять данный осадок. Растворимость хлорида серебра в воде весьма мала, но его можно превратить в аммиачный комплекс в соответствии с уравнением реакции [c.120]
Воду можно обеззараживать металлическим серебром. Накапливание ионоп серебра в воде происходит тем быстрее, чем больше ее соприкосновение с металлом. Поэтому для максимального увеличения поверхности с наименьше затратой металла прибегают к осаждению серебра тонким слоем на материал с развитой поверхностью— песок, кольца, бусы и т. д., через который фильтруют обеззараживаемую воду. [c.161]
д., через который фильтруют обеззараживаемую воду. [c.161]
Вычислите растворимость хлорида серебра в воде и предложите методы ее определения. nPAg i= 1,8-10- . [c.277]
Пример 8. Растворимость хлорида серебра в воде при 298 К равна 1,31-10 кмоль м . Вычислить растворимость хлорида. .серебра в растворе КС с т = 0,1 /сг-э/ o/lOOO кг. [c.266]
Растворимость хлорида серебра в воде равна 8,9-10 г в 100 г раствора при 10 °С и 19,5 10 г при 26 °С. Найдите теплоту и этропию растворения. [c.95]
Образование таких комплексов приводит к увеличению растворимости некоторых малорастворимых солей. Так, растворимость хлористого серебра в воде возрастает при добавлении аммиака, так как часть ионов Ag” образует комплекс с этим реагентом в виде растворимого диаммина серебра Ag(Nh4)2. [c.271]
Растворимость галогенидов серебра в воде увеличивается в последовательности Agi (К = 8,3-10 ) значения произведений растворимости при комнатной температуре. По >тому вначале будет образовываться желтый осадок иодида серебра, как наименее растворимого на хроматограмме будет наблюдаться желтая (верхняя) зона. Затем образуется зона осадка бромида серебра кремового цвета (промежуточная зона). В последшою очередь образуется белый осадок хлорида серебра — нижняя белая зона, темнеющая на свету вследствие фотохимического разложения хлорида серебра с выделением мелкодисперсного металлического серебра. [c.281]
По >тому вначале будет образовываться желтый осадок иодида серебра, как наименее растворимого на хроматограмме будет наблюдаться желтая (верхняя) зона. Затем образуется зона осадка бромида серебра кремового цвета (промежуточная зона). В последшою очередь образуется белый осадок хлорида серебра — нижняя белая зона, темнеющая на свету вследствие фотохимического разложения хлорида серебра с выделением мелкодисперсного металлического серебра. [c.281]
Титрованный раствор азотнокислого серебра приготовляется растворением 16,99 г чистого сухого азотнокислого серебра в воде и доведением его объема до литра. Один см этого раствора эквивалентен 0,0098 г цианистого натрия при титровании по Liebig y или 0,00355 г хлора при титровании по Mohr y или Volhard y. Достаточная точность для обычной работы получается отвешиванием сухого азотнокислого серебра. Когда же желают достигнуть большей -точности в работе, то титр раствора серебра устанавливают объемным или весовым способом с помощью чистого хлористого натрия. [c.33]
[c.33]
В медицинской практике серебро и его соединения применялись в качестве бактерицидиыА средств с времен глубокой древности. Так, уже в Египте применялись тонкие серебряные пластиики для покрытия ран. Впоследствии было нандеко. что выдержанная в серебряных сосудах вода сохраняется без загнивания в течение многих месяцев, являясь стерильной за счет тон ничтожной концентрации нонов серебра, которые в ней создаются при соприкосновении со стенками сосуда. Накопление ионов серебра в воде протекает тем интенсивнее, чем больше поверхность ее соприкосновения с металлом. Для максимального увеличения этой поверхности с наименьшей Затратой металла последний осаждают тонким слоем на песке и затем фильтруют воду через слой посеребренного песка. Полученная таким путем серебряная вода может служить д.пи обеззараживания и консервирования [c.93]
Хотя для получения катионов благородных металлов необходимы очень сильные окислители, не следует пренебрегать тем обстоятельством, что они способны самопроизвольно образовывать в водной среде ограниченное количество ионов. Например, небольшая растворимость серебра в воде проявляется в поразительном явлении, называемом олигодииамическим эффектом и связанным с воздействием твердого металла на микроорганизмы. Простые катионы се-зебра А чрезвычайно токсичны для этих организмов. VIнoгиe типы микроорганизмов вообще не в состоянии существовать на поверхности твердого серебра. Очевидно, оли-годинамический эффект обусловлен образованием небольшого, но вполне достаточного количества ионов серебра на поверхности твердого металла, поэтому с точки зрения гигиены серебряная посуда обладает большими достоинствами. И, видимо, не так далека от истины английская поговорка, что хорошо тому, кто родился с серебряной ложкой во рту. [c.351]
Например, небольшая растворимость серебра в воде проявляется в поразительном явлении, называемом олигодииамическим эффектом и связанным с воздействием твердого металла на микроорганизмы. Простые катионы се-зебра А чрезвычайно токсичны для этих организмов. VIнoгиe типы микроорганизмов вообще не в состоянии существовать на поверхности твердого серебра. Очевидно, оли-годинамический эффект обусловлен образованием небольшого, но вполне достаточного количества ионов серебра на поверхности твердого металла, поэтому с точки зрения гигиены серебряная посуда обладает большими достоинствами. И, видимо, не так далека от истины английская поговорка, что хорошо тому, кто родился с серебряной ложкой во рту. [c.351]
Сведения о спектральных и радиоактивационных методах определения серебра в водах приведены в приложениях к настояо1,ей главе. [c.176]
Серебряная вода не так полезна, как Вы думаете
В начале XX века была мода употреблять в пищу радий, сейчас мода на серебро. Мода на серебро более оправдана, ведь серебро действительно убивает бактерии, но оно убивает как вредные бактерии, так и полезные. Кстати, серебро бессильно против споровых бактерий.
Мода на серебро более оправдана, ведь серебро действительно убивает бактерии, но оно убивает как вредные бактерии, так и полезные. Кстати, серебро бессильно против споровых бактерий.
Кроме того, вместе с бактериями серебро “убивает” микрофлору желудка и кишечника, а также негативно воздействует на иммунитет. Кстати, в нормативных документах Евросоюза сказано, что предельная концентрация серебра в питьевой воде ниже, чем концентрация свинца. Неожиданно? Давайте разбираться.
Серебро относится к тяжелым металлам
Серебро состоит в одной группе с оловом, свинцом, ртутью и цинком. Уже это должно было насторожить. Токсичность серебра соизмерима с ядовитостью ртути и выше токсичности свинца. Кроме того, как известно, тяжелые металлы накапливаются в организме, поражают печень и реже почки.
Если Вы всю жизнь пользовались серебряной ложкой – не волнуйтесь, серебро химически инертно и почти не попадает с посуды в пищу. Употребление серебряной воды приводит к ослаблению иммунитета, развитию дисбактериоза, так как убивает не только бактерии, но и наиболее активные клетки организма – к ним относятся клетки иммунитета.
Как приготовить серебряную воду?
Есть два варианта:
- электрохимическое растворение
- настаивание в серебряной посуде.
Первым способом можно добиться опасных концентраций серебра, которые ведут к отравлению. Второй способ безопасен, но и бессмыслен, так как серебро очень слабо растворяется в воде при настаивании.
Почему люди верят в положительное воздействие серебра?
Ещё с древних времен считается, что серебряная вода лечит и защищает от болезней. Конечно, когда свирепствовала холера, чума и дизентерия люди открыли, что серебро позволяет с этими болезнями бороться, ведь оно действительно убивает всё на своем пути.
На весах было: быстро умереть от инфекции или же отравляться серебром, накапливая его в организме. Тогда игра стоила свеч. Но сейчас незачем отравлять организм, когда здоровью не грозят такие серьезные заболевания, а на прилавках аптек полным-полно препаратов от всех болезней.
Чего Вы хотите добиться, употребляя серебряную воду?
Хотите, чтобы в воде не было бактерий, микробов и вирусов? Уже давно существуют более современные методы очистки и обеззараживания воды, например, обратный осмос.
Хотите укрепить иммунитет? Серебряная вода его только расшатает. Попробуйте употреблять не водопроводную воду с серебром, а чистую и безопасную воду, прошедшую домашний фильтр. Через несколько месяцев Вы почувствуете положительный результат.
Хотите обработать рану? Серебро действительно подойдет для наружного применения – серебряная вода отлично дезинфицирует кожный покров, подходит для умывания и обработки ран. Раньше серебро часто применяли наружно в медицине, но с приходом дешевых, безопасных и эффективных антисептиков теперь почти не используется.
Хотите дольше жить? Серебро вам в этом точно не поможет. Оно накапливается в организме и влияет на продолжительность жизни негативно. Попробуйте заняться спортом и вести здоровый образ жизни – это сложнее, но гораздо эффективнее.
Получение серебряной воды и методы очищения жидкости | ЮВЕЛИРЦЕНТР
Целительные свойства серебра известны человечеству очень давно. В настоящее время открытием стала так называемая серебряная вода — это положительные ионы серебра, растворенные в воде. Лучший пример серебряной воды в природе — священная для индийцев река Ганг, несущая желтые воды через всю территорию Индии.
Лучший пример серебряной воды в природе — священная для индийцев река Ганг, несущая желтые воды через всю территорию Индии.
Много телевизионных передач демонстрируют, как местные жители используют реку: пьют воду, моются, стирают одежду, поят и купают животных, в то же время в реку сбрасывают трупы, сливают нечистоты… И при этом река не превращается в рассадник инфекций, ее вода не приносит вреда, даже при круглогодичной высокой температуре! В чем причина? Еще в прошлом столетии ученые доказали, что в водах Ганга наличествует большое количество ионов серебра, то есть происходит очистка воды серебром, и чудесные свойства реки — это закономерность, а не чудо.
В настоящее время не является тайной, что вода, настоянная на серебре, не только очищена от болезнетворных бактерий и грибков, но и имеет антисептические свойства. Чтобы уберечься от 59 штаммов патогенных кишечных бактерий, в домашних условиях достаточно пользоваться серебряной посудой, что и делали когда-то дворяне. Такие столовые приборы не всем по карману, но существует традиция дарить новорожденному серебряную ложечку. Профилактика заболеваний и лечение серебряной водой не имеют побочных эффектов.
Такие столовые приборы не всем по карману, но существует традиция дарить новорожденному серебряную ложечку. Профилактика заболеваний и лечение серебряной водой не имеют побочных эффектов.
Способы получения ионизированной воды
Для приготовления серебряной воды в домашних условиях нужно наполнить чистую емкость водой, лучше из колодца или скважины, и поместить туда серебряное изделие. Или, наоборот, налить воду в серебряную емкость. Проба металла не имеет значения, просто при более низкой пробе насыщение воды будет проходить дольше.
Насыщение воды ионами происходит на протяжении нескольких дней и зависит от объема воды, а также площади поверхности серебра. Внимание: солнечный свет способствует выпадению серебра в осадок, поэтому сосуд должен быть непрозрачным. При таком способе тяжело получить воду с большой концентрацией ионов, но можно значительно улучшить качество и провести очищение воды.
Обязательно следует обратить внимание на то, не покрыто ли серебряное изделие напылением из другого металла. Это практикуют для декоративных украшений, ведь обработанный металл не чернеет, но тем самым сводят на нет полезные свойства металла.
Это практикуют для декоративных украшений, ведь обработанный металл не чернеет, но тем самым сводят на нет полезные свойства металла.
Также в домашних условиях можно использовать ионатор — электрический прибор, принцип действия которого основан на методе электролиза. В емкость с водой погружают серебряный (анод) и стальной (катод) электроды, через которые пропускают электрический ток. В результате анод постепенно растворяется, а вода насыщается этим благородным металлом.
Умельцев, которые решат сделать ионатор своими руками, подстерегает серьезная опасность: примеси в серебре. Для анода необходимо брать абсолютно чистое серебро 999,9 пробы. Примеси, которые находятся в аноде (а это могут быть тяжелые металлы), также активно растворяются при электролизе. При этом они способны нанести организму не меньший вред, чем серебро — пользу. При использовании первого способа такого не происходит, потому что серебро выделяет ионы намного активнее, чем другие металлы.
Раствор серебряной воды нужной концентрации проще всего получить из готового концентрата раствора коллоидного серебра ( 35 мг/л), который продается в специальной светонепроницаемой посуде. Такие растворы производят в промышленных условиях с использованием чистого серебра. А в домашних условиях достаточно кухонной утвари, чтобы получить нужный раствор.
Применение раствора различной концентрации
Серебряная вода наиболее ценна тем, что не приносит вреда организму человека, при условии применения раствора правильной концентрации. При этом ее антисептические свойства превосходят раствор хлора в 5 раз!
Если концентрация ионов серебра в воде составляет 35-50 мкг/литр, то эта вода называется питьевой. Ее разрешено использовать в быту: пить, готовить пищу. Употреблением такой воды можно осуществлять профилактику ряда заболеваний желудочно-кишечного тракта, добавлять ее в лечебные отвары, готовить настойки. А домашние заготовки, в которые добавлена серебряная вода, порадуют лучшей сохранностью.
А домашние заготовки, в которые добавлена серебряная вода, порадуют лучшей сохранностью.
Когда концентрация ионов составляет 10 000 мкг/литр, это концентрат. Его используют как наружное средство для промывания ран, при лечении кожных или стоматологических заболеваний, для ингаляций при бронхитах и воспалении легких. Но лечение серебряной водой нужно проводить под контролем врачей, ведь серебро, как и другие металлы, способно накапливаться в организме человека и приносить не пользу, а вред.
как мы приручили серебро. Слово о бактерицидах для воды / Хабр
— Серебро полезно! Вот моя любимая ложка! И святая вода, которая хранится год!
— Окститесь, серебро — тяжелый металл. Как насчет любимой свинцовой ложки?
Два противоречащих убеждения одновременно верны. Разбираемся, как с этим жить не только долго, но и качественно.
Разбираемся, как с этим жить не только долго, но и качественно.
Серебро, как и золото, с древних времен использовалось в качестве бактерицида. Но не потому, что это отлично работает, а потому, что других вариантов до момента открытия Флемингом пенициллина просто не было. Кидать в стакан серебряную ложку в надежде обезвредить бактерии — эффективно примерно так же, как стучать по ним молотком.
Серебро, действительно, металл вредный. Его предельно допустимая концентрация (ПДК) в воде еще до недавнего времени была такой же как у свинца, а именно 0,05 мг/л. Напомним, речь о миллионных долях грамма. На вкус и цвет это определить невозможно. Сейчас требования СанПин по свинцу жестче и рамки дозволенного останавливаются на 0,03 мг/л.
Серебро и золото в ионной, а не металлической форме (!), — ксенобиотики, то есть яды для живых клеток.
Яды такие же как и свинец, ртуть или мышьяк. При постоянном употреблении даже в концентрациях ниже ПДК, тяжелые металлы накапливаются в организме и включают обратный отсчет хроническому отравлению. Но разве не это же свойство помогает нам защищаться от опасных заболеваний?
Но разве не это же свойство помогает нам защищаться от опасных заболеваний?
Ведь яд — бактерицид, а бактерицид — это хорошо. Так все-таки ДА или НЕТ?
Главная беда большинства бактерицидов, которые имеет смысл использовать для очистки воды, в том, что они не компетентны в вопросе «Кого атакуем?». Им все равно: что палочка Коха, что здоровая клетка вашей печени.
Помогая, не навреди
Необходимо разделить понятия бактерицидности и бактериостатичности для фильтров. Фильтр, который является бактерицидным, способен уничтожить всё живое, что в него попадает, независимо от концентрации. Таких фильтров бытового назначения практически не существует. Как правило — это специальные изделия для использования в тяжелых условиях, когда речь идет о выживании.
Бактериостатичность — способность предотвращать размножение бактерий внутри фильтра, ведь он не должен являться благоприятной средой для размножения микроорганизмов, и на “выходе” бактерий должно быть не больше, чем на “входе”. Для обеспечения этой задачи “социально” приемлемый бактерицид все-таки должен присутствовать в фильтре.
Для обеспечения этой задачи “социально” приемлемый бактерицид все-таки должен присутствовать в фильтре.
Выбираем из двух зол
Бактерициды последних поколений умеют действовать избирательно и нейтрализовать конкретные штаммы. Однако узкого спектра для наших целей недостаточно, состав воды в отдельно взятом кране нам неизвестен. Это как оказаться на промышленной ловле тунца со снаряжением на щуку.
С точки зрения медицины, серебро в ионной форме — не самый эффективный бактерицид, зато с широким спектром действия и не вызывающий острых отравлений у человека. Серебро встраивается в молекулу фермента клетки, заменяя собой ионы других металлов (например кобальта). Фермент перестает работать, а сама бактерия или человеческая клетка (что для серебра одно и то же) теряет способность размножаться и питаться, погибая от голода или одиночества.
Так серебро опасно, бесполезно или полезно?
Основной способ обеспечения бактериостатичности фильтра во всем мире — серебрение активированного угля. Небольшое количество угля, пропитанного концентратом соли серебра, смешивают с обычным активированным углем. Серебро восстанавливается из соли и в виде мельчайших кристаллов металла “застревает” в угольных порах. Однако металлическое серебро малоэффективно и, чтобы достичь нужного эффекта, приходится использовать его больше.
Небольшое количество угля, пропитанного концентратом соли серебра, смешивают с обычным активированным углем. Серебро восстанавливается из соли и в виде мельчайших кристаллов металла “застревает” в угольных порах. Однако металлическое серебро малоэффективно и, чтобы достичь нужного эффекта, приходится использовать его больше.
В ряде европейских стран, включая Германию, запрещено использование серебра в стационарных фильтрах. Под давлением водопроводной сети смыв может происходить спонтанно, с риском превышения ПДК. Для кувшинных водоочистителей серебро допустимо, если не превышается содержание до 0,05 мг на литр очищенной воды.
В отличие от металлического серебра, ионы этого металла гораздо эффективнее в качестве бактерицида. Но и удержать в фильтре серебро в таком виде намного сложнее. Оно либо взаимодействует с углем, превращаясь в металл, либо норовит смыться в стакан. А это уже угроза здоровью.
Для решения задачи трансформации активности серебра во благо, то есть в активную и безопасную форму, понадобится новая вводная.
Less is more
Интересные горизонты по решению озвученной проблемы открываются, когда ионная форма металла принудительно “сажается” на ионит. В нашем случае это Аквален-2, хелатное ионообменное волокно, селективно связывающее тяжелые металлы, в том числе и серебро. Так, с одной стороны они остаются в активной ионной форме, а с другой не смываются с волокна в воду.
Вернее будет сказать: мы не “серебрим” уголь, мы “серебрим” Аквален-2.
Почему это безопасно?
- Концентрация серебра внутри фильтра требуется невысокая;
- Когда активное вещество, в нашем случае ионы серебра, не находятся в растворе, а связаны на поверхности ионита, то и антибактериальная активность проявляется локально. Фильтр защищен от цветения, при этом вода, обработанная связанным серебром, не обладает бактерицидным действием, а значит — безопасна для организма.
Почему это эффективно?
- Активное серебро взаимодействует со средой с поверхности, на которой закреплено.
 Чем больше поверхность — тем масштабнее процесс. Одной из особенностей волокна является огромная площадь взаимодействия. Подробнее о том, какую роль Аквален выполняет в традиционной смеси из активированного угля и ионообменной смолы мы рассказываем в этом видео:
Чем больше поверхность — тем масштабнее процесс. Одной из особенностей волокна является огромная площадь взаимодействия. Подробнее о том, какую роль Аквален выполняет в традиционной смеси из активированного угля и ионообменной смолы мы рассказываем в этом видео:
Поэтому смело размешивайте чай серебряной ложкой. Самая большая неприятность, которая таится в этом действии, — опасность обжечься, ведь серебро, помимо прочего, обладает непревзойденной теплопроводностью. А вот пить “серебряную воду” или держать в графине с водой серебряную монету не стоит: первое вредно, а второе бессмысленно.
Теперь проба на серебре не является обязательной
Серебро! Что мы о нем знаем? И почему с июня 2020 года мы можем не увидеть клейма пробирной палаты? Является ли это нарушением закона?
Это металл белого цвета, практически не изменяющийся под действием кислорода при комнатной температуре, однако из-за наличия в воздухе сероводорода со временем покрывается темным налетом сульфида серебра. Обозначался алхимиками средневековья знаком луны. Это самый светлый металл с интенсивным блеском.
Обозначался алхимиками средневековья знаком луны. Это самый светлый металл с интенсивным блеском.
Использовать серебро люди стали давно, за несколько тысячелетий до нашей эры. В Древнем Египте своих месторождений серебра не было, его туда привозили из Малой Азии. В начале Медного века египтяне называли его «белым золотом» и ценили выше самого золота. Уже с древности люди стали использовать серебро для изготовления украшений. Из него делали броши, кольца, им отделывали парадное оружие, украшали предметы домашнего обихода.
С давних времен серебро добывают только посредством горных выработок. В древности были известны нубийские и эфиопские серебряные рудники. В Средние века самые известные серебряные рудники находились в Саксонии и Словакии. Ныне значительную часть серебра добывают в Северной Америке, Мексике, Канаде, Перу, Австралии, Испании, России.
Серебро хорошо полируется, имеет высокую отражательную способность. Оно обладает хорошей ковкостью, поэтому ему можно придать любую форму — все зависит от фантазии ювелира. Серебро устойчиво в воде, не растворяется в азотной и горячей концентрированной серной кислоте. Вот только со временем оно тускнеет и теряет свой блеск.
Серебро устойчиво в воде, не растворяется в азотной и горячей концентрированной серной кислоте. Вот только со временем оно тускнеет и теряет свой блеск.
В природе встречается в серебряных и свинцовых жилах. Добывается с давних пор только посредством горных выработок.
Серебро легче и, главное, гораздо дешевле золота. Чтобы повысить твердость и прочность серебра, его используют в сплавах с другими металлами.
С древности известно, что серебро обладает антимикробным действием. Состоятельные воины в походах хранили воду в серебряных сосудах. Знать предпочитала пользоваться посудой из серебра.
У некоторых народов серебро использовалось для предохранения детей от болезней. Для этого детям надевали на шею серебряные обручи.
Серебро относится к драгоценным металлам. И до 23 июня 2020 года ставить пробу на изделиях из серебра было обязательным. Если производитель не клеймил свой товар, то его могли оштрафовать и лишить разрешения на ювелирную деятельность.
Но теперь закон изменился. И клеймение украшений из серебра производителями осуществляется на добровольной основе. Более полно можно прочитать на отраслевом сайте «Ювелирное дело».
Пробы России на украшениях из серебра
Как очистить воду и сделать её лечебной? Онлайн с профессором Ивановым | Онлайн
Иванов Александр Александрович 12:11 14/12/2012
При кипячении воды определенное количество солей из нее выпадает (образование накипи), в частности ионы магния, кальция необходимы для полноценного функционирования. Если мы кипятим воду, то часть этих ионов выпадает в осадок, и мы их не получаем. В этом плане кипяченая вода может быть существенно обеднена, но с другой стороны, если воду не кипятить, то надо быть гарантированным от того, чтобы не заразиться от этой воды, чтобы она не была переносчиком холеры, например. Современная водопроводная вода иногда нам не гарантирует того, что она не будет заражена микроорганизмами, поскольку во многих городах очень старые водопроводные сети, бывают случаи, когда туда проникают фекальные загрязнения, как показатель – кишечная палочка, поэтому, конечно, рекомендовать пить такую воду сырой не стоит. Но если эта вода из хорошего горного источника, чистая родниковая вода, то пить ее лучше некипяченой, она вкуснее. При кипячении воды из нее выделяются газы, растворенный кислород, а с другой стороны, при кипячении водопроводной воды часть хлора удаляется, остается только связанная хлорорганика.
Но если эта вода из хорошего горного источника, чистая родниковая вода, то пить ее лучше некипяченой, она вкуснее. При кипячении воды из нее выделяются газы, растворенный кислород, а с другой стороны, при кипячении водопроводной воды часть хлора удаляется, остается только связанная хлорорганика.
AIF.RU Ведущий конференций 12:13 14/12/2012
А что Вы скажите по поводу отстаивания водопроводной воды? Насколько это действенный способ очищения воды?
Иванов Александр Александрович 12:13 14/12/2012
Есть такой пример. Если мы берем холодную артезианскую воду из известковых слоев, то она очень жесткая, в ней очень много кальция. Когда эта вода стоит, даже при комнатной температуре, эта соль выпадает, она садится на стенки. У нее накипь образуется без кипячения. Таким способом мы можем удалить некоторое количество солей, несколько смягчить воду. Рассчитывать на то, что что-то выпадет и будет самоочищение воды, не следует. Тяжелые металлы тоже имеют соли, которые достаточно хорошо растворимы, сами по себе они не выпадут. При отстаивании водопроводной воды хлор и хлорорганика способна иллюминироваться в атмосферу. Перед поливом растений воде надо отстояться. Перед тем, как заливать воду в аквариум, ей тоже надо дать отстояться. Жизнь показывает, что когда вода отстоялась, она может кое-что вредное потерять.
Тяжелые металлы тоже имеют соли, которые достаточно хорошо растворимы, сами по себе они не выпадут. При отстаивании водопроводной воды хлор и хлорорганика способна иллюминироваться в атмосферу. Перед поливом растений воде надо отстояться. Перед тем, как заливать воду в аквариум, ей тоже надо дать отстояться. Жизнь показывает, что когда вода отстоялась, она может кое-что вредное потерять.
Продукт растворимости
Растворимость
Товар
Продукт растворимости
Выражение
Хлорид серебра настолько нерастворим в воде (0,002 г/л), что
насыщенный раствор содержит только около 1,3 x 10 -5
молей AgCl на литр воды.
| Н 2 О | ||||
| AgCl( с ) | Ag + ( водный ) | + | Класс – ( водный ) |
Строгое соблюдение правил записи константы равновесия
выражения для этой реакции дает следующий результат.
(Вода не включена в выражение константы равновесия
потому что он не потребляется и не образуется в этой реакции,
хотя это жизненно важный компонент системы.)
Термины [Ag + ] и [Cl – ] представляют собой
концентрации ионов Ag + и Cl – в
молей на литр, когда этот раствор находится в равновесии. Третий
термин [AgCl] является
более неоднозначно. Это не представляет собой концентрацию AgCl
растворяется в воде, потому что мы предполагаем, что AgCl диссоциирует на
Ионы Ag + и ионы Cl – при растворении в
вода.Он не может отображать количество твердого AgCl в системе.
потому что на равновесие не влияет количество избытка
твердое вещество добавлено в систему. Термин [AgCl] должен быть переведен
буквально как количество молей AgCl в литре
твердый AgCl.
Концентрацию твердого AgCl можно рассчитать по его
плотность и молярная масса AgCl.
Однако это количество является константой. Количество молей на
Количество молей на
литр в твердом AgCl в начале реакции такой же, как
это когда реакция достигает равновесия.
Поскольку член [AgCl] является константой, которая не влияет на
равновесия, она встроена в константу равновесия для
Реакция.
[Ag + ][Cl – ] = К с
х [AgCl]
Это уравнение предполагает, что произведение
равновесные концентрации Ag + и Cl –
ионов в этом растворе равна константе.Поскольку эта постоянная
пропорциональна растворимости соли, она называется растворимостью
константа равновесия продукта для реакции или K sp .
K sp = [Ag + ][Cl – ]
Выражение для соли K sp
произведение концентраций ионов, при этом каждый
концентрацию, возведенную в степень, равную коэффициенту
ион в сбалансированном уравнении равновесия растворимости.
Связь между
К сп И
Растворимость соли
K sp называется произведением растворимости
потому что это буквально произведение растворимости
ионов в молях на литр. Произведение растворимости соли может
поэтому рассчитывают по его растворимости или наоборот.
Фотопленки основаны на чувствительности AgBr к
светлый. Когда свет попадает на кристалл AgBr, небольшая часть
Ионы Ag + восстанавливаются до металлического серебра. Остаток от
Ионы Ag + в этих кристаллах восстанавливаются до металлического серебра.
когда пленка проявлена. Кристаллы AgBr, не поглощающие
Затем свет удаляют с пленки, чтобы «исправить»
изображение.
Пример: Рассчитаем растворимость AgBr в воде в
граммов на литр, чтобы увидеть, можно ли удалить AgBr простым
промывка пленки.
Начнем со сбалансированного уравнения равновесия.
| Н 2 О | ||||
| AgBr( с ) | Ag + ( водный ) | + | Бр – ( водный ) |
Затем мы пишем выражение произведения растворимости для этого
реакция.
K sp = [Ag + ][Br – ]
= 5,0 х 10 -13
Одно уравнение не может быть решено с двумя неизвестными
концентрации ионов Ag + и Br – . Мы можем
Однако сгенерируйте второе уравнение, отметив, что одно Ag +
ион высвобождается на каждый ион Br – . Потому что нет
другого источника любого иона в этом растворе, концентрации
этих ионов в равновесии должно быть одинаковым.
[Аг + ] = [Бр – ]
Подставляя это уравнение в K sp
выражение дает следующий результат.
[Ag + ] 2 = 5,0 x 10 -13
Извлечение квадратного корня из обеих частей этого уравнения дает
равновесные концентрации Ag + и Br –
ионы.
[Ag + ] = [Br – ] = 7.1 x 10 -7 M
Как только мы узнаем, сколько молей AgBr растворяется в литре
воды, мы можем рассчитать растворимость в граммах на литр.
Растворимость AgBr в воде составляет всего
0,00013 грамма на литр. Поэтому нецелесообразно пытаться
смойте водой неэкспонированный AgBr с фотопленки.
Расчет произведения растворимости для солей 1:1, таких как AgBr
относительно просты в исполнении. Для продления такого
расчеты к соединениям с более сложными формулами нам нужно
понять связь между растворимостью соли и
концентрации его ионов в равновесии. Мы будем использовать
Мы будем использовать
символ C s для описания количества
соль, растворяющаяся в воде.
| Практическая задача 2: Несколько Нажмите здесь, чтобы проверить свой ответ |
Методы, использованные в предыдущих практических задачах,
справедливо и для солей, содержащих больше положительных ионов, чем
отрицательные ионы.
Распространенные заблуждения
О расчете произведения растворимости
Давайте сосредоточимся на одном шаге практической задачи 4.Мы начали с выражения произведения растворимости для Ag 2 S.
K sp = [Ag + ] 2 [S 2- ]
Затем мы подставили связь между
концентрация этих ионов и растворимость соли в
это уравнение.
[2 C с ] 2 [ C с ]
= 6,3 х 10 -50
Когда они видят это впервые, ученики часто спрашивают:
«Почему вы удвоили концентрацию ионов Ag + и
потом выровнять? Вы не считаете этот срок дважды?”
Этот вопрос возникает из-за путаницы с символами, используемыми в
расчет.Помните, что символ C s
в этом уравнении обозначает растворимость Ag 2 S в
моль на литр. Так как мы получаем два иона Ag + на каждый Ag 2 S
Так как мы получаем два иона Ag + на каждый Ag 2 S
формульная единица, растворяющаяся в воде, ион Ag +
равновесная концентрация в два раза превышает растворимость соли,
или 2 C с . Квадрат Ag +
член концентрации ионов, потому что константа равновесия
выражение для этой реакции пропорционально произведению
концентрации трех продуктов реакции.
K sp = [Ag + ][Ag + ][S 2- ]
Просто удобнее записать это уравнение в
конденсированная форма.
K sp = [Ag + ] 2 [S 2- ]
Еще одна распространенная ошибка при расчете произведения растворимости
происходит, когда учащихся просят написать уравнение, которое
описывает зависимость между концентрациями Ag +
и S 2- в насыщенном растворе Ag 2 S. Слишком просто посмотреть на формулу этого соединения Ag 2 Песок
Слишком просто посмотреть на формулу этого соединения Ag 2 Песок
затем напишите следующее уравнение.
[S 2- ] = 2 [Ag + ]
Это кажется разумным некоторым, кто утверждает, что существует дважды
столько ионов Ag + , сколько ионов S 2- в
сложный. Но уравнение неверное. Потому что два Ag +
на каждый ион S 2- приходится вдвое больше
много ионов серебра в виде сульфид-ионов в этом растворе.Это решение
правильно описывается следующим уравнением.
[Аг + ] = 2 [С 2- ]
Как не совершить эту ошибку? После того, как вы напишете
уравнение, которое, по вашему мнению, описывает отношение между
концентрации ионов, попробуйте, чтобы увидеть, работает ли это. Предполагать
ровно столько, сколько Ag 2 S растворено в воде, чтобы получить два S 2-
ионы. Сколько ионов Ag + вы получите? Четыре. если ты
если ты
получить правильный ответ при подстановке этого конкретного примера
в ваше уравнение, оно должно быть записано правильно.
Использование K sp
Как мера растворимости соли
Значение K a для кислоты
пропорционально силе кислоты.
Если мы найдем следующие значения K a в
таблицы, можно сразу сделать вывод, что муравьиная кислота является
более сильная кислота, чем уксусная.
| Муравьиная кислота (HCO 2 H): | К a = 1,8 х 10 -4 | |
| Уксусная кислота (CH 3 CO 2 H): | К a = 1,8 х 10 -5 |
То же самое можно сказать и о значениях K b .
Следующие константы равновесия ионизации основания подразумевают, что
метиламин является более сильным основанием, чем аммиак.
| Метиламин (CH 3 NH 2 ): | К б = 4,8 х 10 -4 | |
| Аммиак (NH 3 ): | К б = 1.8 х 10 -5 |
К сожалению, нет простого способа
предсказать относительную растворимость солей по их K sp s
если соли дают разное количество положительных и отрицательных
ионов при их растворении в воде.
Роль Иона
Продукт (Q sp ) В
Расчет растворимости
Рассмотрим насыщенный раствор AgCl в воде.
| Н 2 О | ||||
| AgCl( с ) | Ag + ( водный ) | + | Класс – ( водный ) |
Поскольку AgCl представляет собой соль 1:1, концентрации Ag +
и Cl – ионов в этом растворе равны.
| Насыщенный раствор AgCl в воде: |
[Ag + ] = [Cl – ]
Представьте, что произойдет, если несколько кристаллов твердого AgNO 3
добавляют к этому насыщенному раствору AgCl в воде. В соответствии
по правилам растворимости серебро
нитрат – растворимая соль. Поэтому он растворяется и диссоциирует
в ионы Ag + и NO 3 – . Как
Как
В результате имеется два источника иона Ag + в этом
решение.
| AgNO 3 ( с ) | Ag + ( водный) | + | НЕТ 3 – ( aq ) | |
| Н 2 О | ||||
| AgCl( с ) | Ag + ( водный ) | + | Класс – ( водный ) |
Добавление AgNO 3 к насыщенному раствору AgCl поэтому
увеличивает концентрацию ионов Ag + . Когда это
Когда это
происходит, раствор больше не находится в равновесии, потому что
произведение концентраций Ag + и Cl –
ионов слишком велико. Говоря более формально, мы можем утверждать, что ион
продукт ( Q sp )
для решения больше, чем произведение растворимости ( K sp )
для AgCl.
Q sp = (Ag + )(Cl – )
> К сп
Произведение ионов буквально является произведением концентраций
ионов в любой момент времени.Когда он равен
Произведение растворимости соли означает, что система находится в равновесии.
Реакция в конце концов возвращается к равновесию после
избыточные ионы осаждаются из раствора в виде твердого AgCl. Когда
равновесие восстанавливается, однако концентрации
Ионы Ag + и Cl – не будут одинаковыми. Так как
в этом растворе два источника иона Ag + ,
в равновесии будет больше ионов Ag + , чем Cl –
ионов:
| Насыщенный раствор AgCl, к которому AgNO 3 добавлено: |
[Ag + ] > [Кл – ]
Теперь представьте, что произойдет, если добавить несколько кристаллов NaCl.
к насыщенному раствору AgCl в воде.Есть два источника
хлорид-иона в этом растворе.
| Н 2 О | ||||
| NaCl( с ) | Na + ( водный ) | + | Класс – ( водный ) | |
| Н 2 О | ||||
| AgCl( с ) | Ag + ( водный ) | + | Класс – ( водный ) |
И снова ионное произведение больше, чем растворимость
продукт.
Q sp = (Ag + )(Cl – )
> К сп
На этот раз, когда реакция вернется к равновесию,
в растворе будет больше иона Cl-, чем иона Ag + .
| Насыщенный раствор AgCl, к которому добавлен NaCl добавлено: |
[Ag + ] < [Cl – ]
На рисунке ниже показана небольшая часть возможных
комбинации ионов Ag + и Cl –
концентрации в водном растворе.Любая точка кривой
линия на этом графике соответствует системе, находящейся в равновесии,
потому что продукт ионов Ag + и Cl –
концентрации для этих растворов равны K sp
для AgCl.
Точка A представляет собой раствор в равновесии, который может
можно получить путем растворения двух источников ионов Ag + , таких как
как AgNO 3 и AgCl в
вода. Точка B представляет собой насыщенный раствор AgCl в
Точка B представляет собой насыщенный раствор AgCl в
чистая вода, в которой [Ag + ] и [Cl – ]
условия равны. Пункт C описывает решение на
равновесие, которое было приготовлено путем растворения двух источников Cl –
ионов в воде, таких как NaCl и AgCl.
Любая точка, выходящая за пределы сплошной линии на приведенном выше рисунке.
представляет раствор, который не находится в равновесии. Любая точка ниже
сплошная линия (например, точка D ) представляет решение для
ионное произведение меньше произведения растворимости.
Если к раствору в точке D добавить больше AgCl, он
растворился бы.
| If Q sp < K sp : | AgCl( с ) Ag + ( водный раствор ) + Cl – ( водный раствор ) |
Точки над сплошной линией (например, точка E )
представляют растворы, для которых ионное произведение больше, чем
произведение растворимости.
Решение, описанное пунктом E , в конечном итоге придет
к равновесию после осаждения достаточного количества твердого AgCl.
| If Q sp > K sp : | Ag + ( водный раствор ) + Cl – ( водный раствор ) AgCl( с ) |
Как проверить наличие ионов хлорида в растворах для обработки железа с помощью нитрата серебра – Примечания Канадского института охраны природы (CCI) 4/5
Наука, стоящая за тестом ионов хлорида
Реакция нитрата серебра с ионами хлора
Когда соль, такая как хлорид натрия (NaCl), растворяется в воде, ионы, составляющие соль, диспергируются в растворе, но только до определенного предела (называемого растворимостью).Если мы попытаемся получить раствор, в котором этот предел превышен, ионы объединятся, образуя твердую соль. Твердое вещество, образовавшееся таким образом, называется осадком. Ключом к тесту в этой процедуре является низкая растворимость хлорида серебра в воде.
Твердое вещество, образовавшееся таким образом, называется осадком. Ключом к тесту в этой процедуре является низкая растворимость хлорида серебра в воде.
Большинство солей хлора хорошо растворимы в воде (Weast 1974). Хлорид натрия, например, имеет растворимость 357 г/л при 0°C, что соответствует концентрации ионов хлора 220 000 частей на миллион. Хлорид серебра, с другой стороны, является одной из немногих хлористых солей с низкой растворимостью: 0.89 мг/л при 10°C или концентрация ионов хлорида 0,22 ppm.
При добавлении раствора, содержащего ионы серебра (Ag + ), к раствору, содержащему ионы хлорида (Cl – ), образуется белый осадок хлорида серебра (AgCl), если только концентрация ионов хлорида не будет очень низкой. Реакция записывается как:
Cl – (водный раствор) + Ag + (водный раствор) → AgCl (белое твердое вещество)
Чем выше начальные концентрации ионов серебра и хлора, тем больше образуется осадка.
Определение частей на миллион (ppm)
Концентрации ионов хлорида часто указываются в частях на миллион (частей на миллион). Части на миллион — это единица концентрации, определяемая как масса растворенного вещества (добавляемого иона или соединения), деленная на массу раствора (после добавления иона или соединения), а затем умноженная на один миллион (10 6 ). ). Распространенным предположением для разбавленных водных растворов является то, что добавленные ионы не изменяют плотность воды, поэтому раствор имеет ту же плотность, что и чистая вода при комнатной температуре (примерно 1 г/мл) (Skoog et al.2014, с. 72). С учетом этого предположения определение ppm упрощается до:
Обратите внимание, что растворенным веществом является ион хлорида. Это означает, что раствор ионов хлорида с концентрацией 1 ppm содержит 1 миллиграмм (мг) ионов хлорида на литр (л) раствора.
При приготовлении 100 мл (0,1 л) раствора А (3000 частей на миллион) по этой методике отмеряется 0,49 г хлорида натрия. Хлорид натрия содержит 39,3 % натрия и 60,7 % хлорида по весу, как определено по атомному весу натрия (22.99 г/моль) и хлор (35,45 г/моль). Это означает, что при растворении хлорида натрия в растворе содержится 0,30 г (300 мг) ионов хлора и 0,19 г ионов натрия. Таким образом, концентрация ионов хлора в частях на миллион составляет 300 мг, деленных на 0,1 л, что равно 3000 частей на миллион (а не 4900 частей на миллион).
Хлорид натрия содержит 39,3 % натрия и 60,7 % хлорида по весу, как определено по атомному весу натрия (22.99 г/моль) и хлор (35,45 г/моль). Это означает, что при растворении хлорида натрия в растворе содержится 0,30 г (300 мг) ионов хлора и 0,19 г ионов натрия. Таким образом, концентрация ионов хлора в частях на миллион составляет 300 мг, деленных на 0,1 л, что равно 3000 частей на миллион (а не 4900 частей на миллион).
Чтобы получить представление о масштабе частей на миллион, посчитайте, сколько хлорида натрия содержится в 10 мл раствора с 10 ppm ионов хлорида. В этом объеме содержится 0,1 мг ионов хлора, а 0.065 мг ионов натрия или 0,165 мг хлорида натрия слишком мало, чтобы их можно было взвесить на лабораторных весах. Эта масса соответствует кубу хлорида натрия со стороной 0,42 мм, что примерно равно размеру крупинки соли.
Почему растворы образцов подкисляются
Растворы подкисляют разбавленной азотной кислотой, чтобы предотвратить осаждение некоторых солей серебра, кроме хлорида серебра, при добавлении нитрата серебра. В нейтральных растворах могут образовываться фосфат или карбонат серебра, если присутствует достаточно ионов фосфата или карбоната (Bassett et al.1978). Если испытуемый раствор имеет pH выше примерно 8, ионы серебра из нитрата серебра реагируют с ионами гидроксила (OH –) с образованием гидроксида серебра (AgOH) или оксида серебра (Ag 2 O). Реакция с ионами гидроксила:
В нейтральных растворах могут образовываться фосфат или карбонат серебра, если присутствует достаточно ионов фосфата или карбоната (Bassett et al.1978). Если испытуемый раствор имеет pH выше примерно 8, ионы серебра из нитрата серебра реагируют с ионами гидроксила (OH –) с образованием гидроксида серебра (AgOH) или оксида серебра (Ag 2 O). Реакция с ионами гидроксила:
AgNO 3 + OH – → AgOH (светло-коричневый)
, затем
2AgOH → H 2 O + Ag 2 O (темно-коричневый или черный)
На рис. 3 показано, что происходит, когда нитрат серебра добавляется к щелочному раствору, содержащему около 200 частей на миллион ионов хлорида.Этот образец был взят из ванны для обработки 1% (масса/объем) гидроксида натрия для археологического железа.
© Правительство Канады, Канадский институт охраны природы. CCI 120260-0413
Рис. 3. Оксид серебра выпадает в осадок в щелочном растворе примерно через 20 секунд после добавления двух капель 2% (масса/объем) нитрата серебра в щелочной раствор, содержащий 1% (масса/объем) гидроксида натрия и хлорида. концентрация ионов около 200 ppm.
концентрация ионов около 200 ppm.
На видео показано появление осадка гидроксида, оксида и хлорида серебра в пробирке в течение 20 секунд после добавления нитрата серебра.
Источники солей в объектах
Предметы, извлеченные из среды захоронения, загрязнены материалом из этой среды. Сюда часто входят различные соли, особенно если объекты извлечены из моря. Преобладающими ионами в морской воде (Weast 1974) являются ионы хлорида (Cl – , 19 000 частей на миллион) и ионы натрия (Na + , 10 600 частей на миллион), но также присутствуют ионы магния (Mg 2+ , 1270 частей на миллион). серы (в основном в виде сульфат-ионов SO 4 2-, 880 м.д.), кальция (Ca 2+ , 400 м.д.), калия (К + , 380 м.д.) и различных других ионов с концентрациями ниже 100 частей на миллион.
Эти ионы или соли этих ионов могут повредить объекты, если их не удалить. Ионы хлорида особенно вредны для металлических предметов, особенно железа.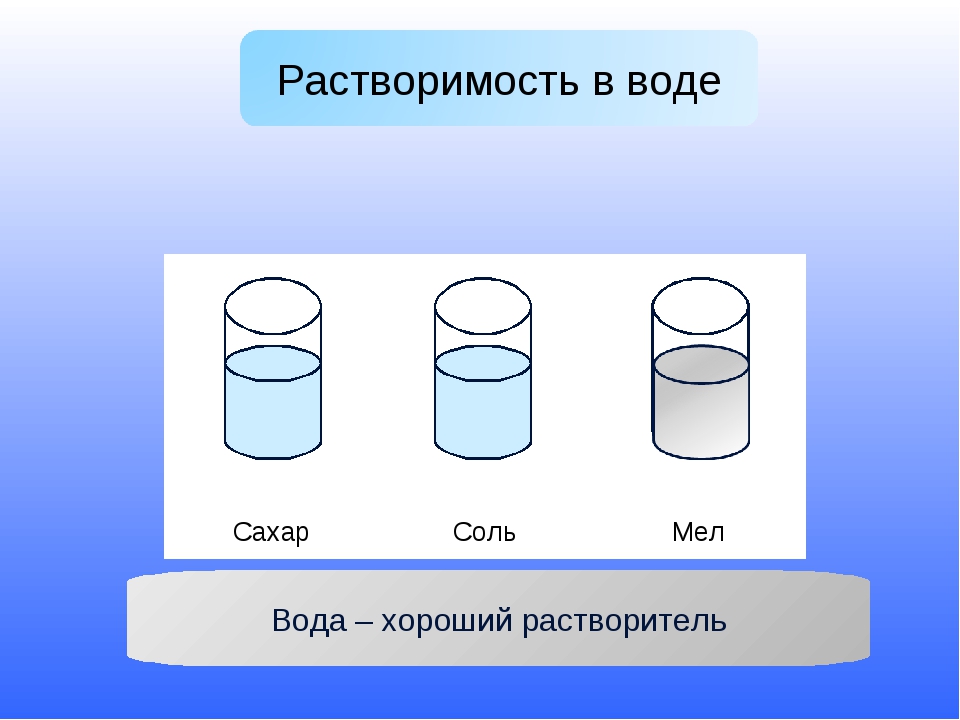 При коррозии железа оно покрывается слоем оксидов и гидроксидов железа. Этот слой обеспечивает некоторую защиту от дальнейшей коррозии. Однако ионы хлорида мешают слою, значительно увеличивая скорость коррозии (Selwyn et al. 1999).
При коррозии железа оно покрывается слоем оксидов и гидроксидов железа. Этот слой обеспечивает некоторую защиту от дальнейшей коррозии. Однако ионы хлорида мешают слою, значительно увеличивая скорость коррозии (Selwyn et al. 1999).
Другими объектами, которые повреждаются солями, являются пористые материалы, такие как керамика (Odegaard et al.2011). Повреждение возникает, когда соли превращаются из ионов, растворенных в растворе, в твердые кристаллы при испарении воды. Некоторые соли (в частности, сульфат натрия) претерпевают такое сильное расширение при кристаллизации, что наносят значительный ущерб окружающему материалу, если кристаллизация происходит в пористой структуре (Waller 1992).
Каталожные номера
Бассет, Дж., Р.К. Денни, Г.Х. Джеффри и Дж. Мендхэм. Учебник Фогеля по количественному анализу неорганических веществ , 4-е изд.Харлоу, Великобритания: Longman Group, 1978.
.
Лаговски, Дж.Дж. и К.Х. Сорум. Введение в качественный полумикроанализ , 8-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2005.
Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2005.
.
Одегаард, Н., С. Кэрролл и В.С. Зиммт. Тесты характеристик материалов для предметов искусства и археологии , 2-е изд. Лондон, Великобритания: Archetype Publications, 2005.
.
Одегаард, Н., П. Хилл, Б. Сантарелли и В. Зиммт. «Обнаружение и идентификация солей в процессе опреснения с помощью точечной контрольной бумаги. WAAC (Западная ассоциация сохранения произведений искусства) Информационный бюллетень 33 (2011 г.), стр. 14–17.
Плендерлейт, Х.Дж. и А.Е.А. Вернер. Сохранение древностей и произведений искусства , 2-е изд. Лондон, Великобритания: Издательство Оксфордского университета, 1971, с. 201.
Риммер М., Д. Уоткинсон и К. Ван. «Эффективность извлечения хлорида из археологических железных объектов с использованием деоксигенированных щелочных растворов». Исследования в области охраны природы 57 (2012), стр.29–41.
Риммер М. , Д. Уоткинсон и К. Ван. «Влияние опреснения хлоридом на скорость коррозии археологического железа». Исследования в области охраны природы 58 (2013), стр. 326–337.
, Д. Уоткинсон и К. Ван. «Влияние опреснения хлоридом на скорость коррозии археологического железа». Исследования в области охраны природы 58 (2013), стр. 326–337.
Riss, D. Тестирование на хлориды нитратом серебра (формат PDF). Сохраните О грамм 6/3. Вашингтон, округ Колумбия: Служба национальных парков, 1993.
.
Семчак, С.М. «Сравнение тестов на хлориды». Исследования в области охраны природы 22 (1977), стр.40–41.
Selwyn, L. Анализ концентрации ионов хлорида в водных растворах методом потенциометрического титрования . Отчет об исследованиях Канадского института охраны природы № 2. Оттава, Онтарио:
Канадский институт охраны природы, 2001 г.
Селвин, Л. «Обзор археологического железа: проблема коррозии, ключевые факторы, влияющие на обработку, и пробелы в современных знаниях». (формат PDF) В Дж. Эштон и Д. Халлам, ред., Metal 2004: Proceedings of the International Conference on Metals Conservation . Канберра, Австралия: Национальный музей Австралии, 2004 г., стр. 294–306.
Канберра, Австралия: Национальный музей Австралии, 2004 г., стр. 294–306.
Селвин, Л. С., П. Дж. Сируа и В. Аргиропулос. «Коррозия раскопанного археологического железа с подробностями о плаче и акаганеите». Исследования в области охраны природы 44 (1999), стр. 217–232.
Скуг, Д.А., Д.М. Уэст, Ф.Дж. Холлер и С.Р. Присесть. Основы аналитической химии , 9-е изд. Бельмонт, Калифорния: Брукс/Коул, 2014.
.
Уоллер, Р. «Чувствительные к температуре и влажности минералогические и петрологические образцы».«В FM Howie, ed., Уход и сохранение геологического материала: минералы, горные породы, метеориты и лунные находки . Оксфорд, Великобритания: Butterworth-Heinemann, 1992, стр. 25–50.
Ван, К., С. Дав, Ф. Ширман и М. Смирниоу. «Оценка методов определения концентрации ионов хлорида и эффективности опреснения с использованием растворов гидроксида натрия и щелочных сульфитов». Консерватор 31 (2008), стр. 67–74.
67–74.
Запад, Р.С., изд. Справочник по химии и физике , 54-е изд. Кливленд, Огайо: CRC Press, 1974.
.
Автор Линдси Селвин
Également publié во французской версии.
© Правительство Канады, Канадский институт охраны природы, 2016 г.
ISSN 1928-1455
Формирование серебряного зеркала на поверхности стекла
Краткое описание:
Две бесцветные жидкости наливают в флорентийскую колбу вместимостью 500 мл, затем колбу закрывают пробкой и взбалтывают.В течение нескольких минут внутренняя часть колбы темнеет и постепенно становится зеркальной, как украшение рождественской елки.
Цель/Задача:
Реакцией, используемой в этой демонстрации, является реакция Толлена, которая используется в качественном органическом анализе для идентификации альдегидов. Металлическое серебро образуется при восстановлении нитрата серебра альдегидом.
Объяснение эксперимента:
Реакция Толлена обычно проводится в небольшой пробирке. Чтобы повысить эффективность этой демонстрации, флорентийская колба зеркально отражена. Зеркало образуется, когда на внутреннюю поверхность колбы осаждается тонкая пленка металлического серебра. Когда альдегид соединяется с аммиачным комплексом серебра в основном водном растворе, альдегид медленно восстанавливает комплекс до металлического серебра. Когда поверхность стекла чистая и влажная, серебристый металл прилипает к стеклу, образуя поверхность с высокой отражающей способностью.
Чтобы повысить эффективность этой демонстрации, флорентийская колба зеркально отражена. Зеркало образуется, когда на внутреннюю поверхность колбы осаждается тонкая пленка металлического серебра. Когда альдегид соединяется с аммиачным комплексом серебра в основном водном растворе, альдегид медленно восстанавливает комплекс до металлического серебра. Когда поверхность стекла чистая и влажная, серебристый металл прилипает к стеклу, образуя поверхность с высокой отражающей способностью.
Реакция, происходящая в этой демонстрации:
CH 2 OH (CHOH) 4 CHO + 2 [AG (NH 3 ) 2 ] + + 3 OH – → 2 AG + CH 2 OH (CHOH) 4 COO – + 4 NH 3 + 2 H 2 O
Альдегидная функциональная группа (-CHO) декстрозы окисляется до кислоты (-COO –).Серебро(I) в ионе диаминсеребра(I) восстанавливается до металлического серебра. Металлическое серебро осаждается на стенках реакционного сосуда в виде «зеркала». Другие альдегиды, такие как бензальдегид, также могут быть использованы для производства серебряного зеркала. В этой демонстрации используется декстроза, поскольку она растворима в воде. Более однородное зеркало получается с водорастворимым альдегидом.
Другие альдегиды, такие как бензальдегид, также могут быть использованы для производства серебряного зеркала. В этой демонстрации используется декстроза, поскольку она растворима в воде. Более однородное зеркало получается с водорастворимым альдегидом.
Декстроза представляет собой сахар, т.е. растворимый углевод. Углеводы имеют молекулярную формулу вида C x (h3O) n .Для декстрозы x=6 и n=6. Обычный столовый сахар — это сахароза, углевод, где x=12 и n=11. Углеводы содержат либо альдегидную группу, либо кетоновую группу. Те, которые содержат альдегидную группу, дают положительный результат теста Толлена, т. е. восстанавливают [Ag(NH 3 ) 2 + ] в щелочном растворе до металлического серебра. По этой причине их называют редуцирующими сахарами. Декстроза является восстанавливающим сахаром, а сахароза — нет.
Поскольку этот процесс покрытия колбы серебром выполняется без внешней электрохимической цепи, он называется химическим осаждением. Чаще всего используется для получения металлического покрытия на поверхности, не проводящей электричество.
Чаще всего используется для получения металлического покрытия на поверхности, не проводящей электричество.
Подготовка материалов:
30 мл 0,10 М нитрата серебра, AgNO 3 (Для приготовления 100 мл раствора растворите 1,7 г AgNO 3 в 60 мл дистиллированной воды и разбавьте полученный раствор до 100 мл.)
ок. 3 мл концентрированного (15 М) водного раствора аммиака, NH 3 (из капельницы.)
15 мл 0.80 М гидроксид натрия, NaOH (Для приготовления 100 мл раствора растворите 3,2 г NaOH в 60 мл дистиллированной воды и разбавьте полученный раствор до 100 мл.
ок. 3 мл концентрированной (16 М) азотной кислоты, HNO 3 (из капельницы)
10 мл 0,5 М декстрозы, C 6 H 12 O 6 (Для приготовления 100 мл раствора растворите 9 г декстрозы в 60 мл дистиллированной воды и разбавьте полученный раствор до 100 мл.
Горячая вода для наполнения фляги Флоренции.
Стакан на 100 мл
Стержень для перемешивания
Флорентийская колба на 500 или 1000 мл.
Эта смесь должна быть приготовлена не более чем за один час до использования из-за потенциальной опасности. Налейте 30 мл 0,10 М AgNO 3 в химический стакан на 100 мл. При перемешивании раствора добавляйте по каплям 15 М NH 3 до тех пор, пока не растворится первоначально образовавшийся коричневый осадок. Добавьте к этой смеси 15 мл 0,80 М NaOH. Если снова образуется осадок, добавьте по каплям 15 М NH 3 , пока он не растворится.
Налейте 3 мл 0f 16 М HNO 3 в колбу Флоренса и закройте ее пробкой. Взболтайте кислоту, чтобы увлажнить всю внутреннюю поверхность колбы. Вылейте кислоту из колбы и смойте ее в канализацию водой. Промойте колбу и закройте ее пробкой.
В течение десяти минут после демонстрации наполните колбу горячей водой, чтобы нагреть ее.
Презентация:
Вылейте воду из фляги. Налейте 10 мл 0,5 М декстрозы в колбу.Добавьте содержимое стакана и закройте колбу пробкой. Непрерывно вращайте колбу, чтобы вся ее поверхность покрылась тонким слоем жидкости. Примерно через минуту колба начнет темнеть, так как на ее внутренней поверхности образуется пленка металлического серебра. Продолжайте вращать колбу, пока вся внутренняя часть колбы не покроется пленкой серебра, и колба не станет похожа на зеркало. Вылейте жидкость из колбы и смойте ее в канализацию водой.
Налейте 10 мл 0,5 М декстрозы в колбу.Добавьте содержимое стакана и закройте колбу пробкой. Непрерывно вращайте колбу, чтобы вся ее поверхность покрылась тонким слоем жидкости. Примерно через минуту колба начнет темнеть, так как на ее внутренней поверхности образуется пленка металлического серебра. Продолжайте вращать колбу, пока вся внутренняя часть колбы не покроется пленкой серебра, и колба не станет похожа на зеркало. Вылейте жидкость из колбы и смойте ее в канализацию водой.
Опасности:
Если смеси водного раствора нитрата серебра, аммиака и гидроксида натрия нагревают или оставляют на несколько часов, может образоваться взрывоопасный осадок (нитрид серебра).Поэтому смесь должна быть свежеприготовленной для каждой демонстрации. Кроме того, смесь, используемая для посеребрения колбы, должна быть смыта водой в канализацию сразу же после ее использования.
Концентрированная азотная кислота является одновременно сильной кислотой и сильным окислителем. Контакт с кожей может привести к сильным ожогам. Пары раздражают органы дыхания, глаза и другие слизистые оболочки – работать с концентрированной азотной кислотой следует только в хорошо проветриваемом помещении.
Контакт с кожей может привести к сильным ожогам. Пары раздражают органы дыхания, глаза и другие слизистые оболочки – работать с концентрированной азотной кислотой следует только в хорошо проветриваемом помещении.
Растворы гидроксида натрия могут вызвать серьезные ожоги глаз, кожи и слизистых оболочек.Нитрат серебра также вызывает раздражение и окрашивает кожу — эти пятна можно отбелить, промыв водным раствором тиосульфата натрия (Na 2 S 2 O 3 ), а затем водой. При приеме внутрь нитрат серебра может быть токсичным.
Концентрированный аммиак может раздражать кожу, а его пары вредны для глаз и слизистых оболочек.
Утилизация:
Раствор, использованный для серебрения колбы, и любые неиспользованные растворы следует смыть водой в канализацию.
После демонстрации серебро можно удалить из колбы, растворив его в 50 мл 1 М азотной кислоты, после чего колбу можно использовать повторно. Нитрат серебра может быть выделен из раствора кислоты выпариванием кислоты.
Видео:
Общая концепция:
Тип реакции:
Основной номер:
- Шахашири Б.З. (1992) Химические демонстрации – Справочник для учителей химии, том.4, стр. 240-243.
Теги:
Нитрат серебра – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Авторы и авторы
Нитрат серебра, AgNO 3 , является наименее дорогой солью серебра и относительно устойчив к свету.Легко растворяется в воде (2150 г/л при 20°С). Поскольку нитрат можно легко заменить другими лигандами, AgNO 3 является универсальной отправной точкой для синтеза других соединений серебра.
Нитрат серебра можно получить растворением серебра в азотной кислоте:
3 Ag + 4 HNO 3 3 AgNO 3 + NO + 2 H 2 O
Когда лист меди помещают в раствор нитрата серебра, нитрат серебра реагирует с медью с образованием волосовидных кристаллов металлического серебра и голубого раствора нитрата меди:
2 AgNO 3 + Cu Cu(NO 3 ) 2 + 2 Ag
AgNO 3 реагирует с растворами галогенид-ионов с образованием осадка AgX (X = Cl, Br, I), которые используются в фотопленках.
При нагревании нитрат серебра разлагается на металлическое серебро, кислород и оксид азота:
2 AgNO 3 2 Ag + O 2 + 2 NO 2
Соли серебра обладают антимикробными свойствами и обычно используются для дезинфекции питьевая вода. При контакте разбавленного нитрата серебра с кожей кожа через короткое время становится коричневой/черной из-за элементарного серебра, которое вводится в кожу в соответствии со следующей реакцией:
AgNO 3 + H (из кожи) Ag + HNO 3
Концентрированные растворы AgNO 3 вызывают ожоги из-за той же реакции.
Авторы и авторство
Растворимость нитрата серебра | Солт-Лейк-Металлз
Растворимость нитрата серебра в воде
| Температура | грамм нитрата серебра , растворенного на литр | граммов растворенных ионов серебра на литр |
|---|---|---|
| 0°C (32°F) | 1220 г Нитрат серебра | 774 г Ионы серебра |
| 10°C (50°F) | 1700 г нитрата серебра | 1,079 г Ионы серебра |
| 20°C (68°F) | 2220 г Нитрат серебра | 1,409 г Ионы серебра |
| 25°C (77°F) | 2570 г Нитрат серебра | 1632 г Ионы серебра |
| 30°C (86°F) | 3000 г нитрата серебра | 1,905 г Ионы серебра |
| 40°C (104°F) | 3760 г Нитрат серебра | 2,387 г Ионы серебра |
| 50°C (122°F) | 4550 г Нитрат серебра | 2,889 г Ионы серебра |
| 60°C (140°F) | 5250 г Нитрат серебра | 3,333 г Ионы серебра |
| 80°C (176°F) | 6690 г Нитрат серебра | 4248 г Ионы серебра |
| 100°C (212°F) | 9520 г Нитрат серебра | 6045 г Ионы серебра |
| 120°C (248°F) | 19000 г Нитрат серебра | 12 064 г ионов серебра |
Максимальная растворимость нитрата серебра в воде
1000 г нитрата серебра – Растворяется в 76. 1 грамм воды – при 248°F
1 грамм воды – при 248°F
и имеет общий объем 356,26 мл
Растворимость нитрата серебра в других материалах
Нитрат серебра плохо растворим в концентрированной азотной кислоте:
1000 граммов концентрированной HNO3 (~70%) растворяют 2 грамма AgNO3
Нитрат серебра немного лучше растворим в разбавленной азотной кислоте:
1000 г 2HNO3, 3 ч 30 мин растворяет 33,3 г AgNO3 при 20°C (68°F) (212°F)
Нитрат серебра слабо растворим в спиртах:
1000 г абсолютного метилового спирта растворяет 37.2 грамма AgNO3 при 20°C (68°F)
1000 грамм абсолютного этилового спирта растворяет 31,0 грамм AgNO3 при 20°C (68°F)
1000 грамм 95% этиловый спирт растворяет 73 грамма AgNO3 при 50°C (122°F) )
1000 г 60% этилового спирта растворяют 581 г AgNO3 при 50°C (122°F)
1000 г 40% этилового спирта растворяют 983 г AgNO3 при 50°C (122°F) граммов AgNO3 при 50°C (122°F)
Нитрат серебра слабо растворим в Ацетоне:
1000 грамм Ацетон растворяется 3. 5 г AgNO3 при 14°C (57°F)
5 г AgNO3 при 14°C (57°F)
1000 г Ацетон растворяет 4,4 г AgNO3 при 18°C (64°F)
ПРИМЕЧАНИЯ ДЛЯ ЛАБОРАТОРИИ: нитрат серебра и азотная кислота
НЕПРАВИЛЬНАЯ формула для нитрата серебра + азотная кислота:
Почти во всех учебниках по химии и на тысячах веб-сайтов приводится следующая формула:
правильный формула для серебра нитрата + азотная кислота:
4AG + 61624 3 → 4agno 3 + NO + NO 2 + 3H 2 o
Влияние концентрации хлорида на эффективность обеззараживания воды серебросодержащими композитами на основе наноцеллюлозы
Pradeep, T.& Аншуп. Наночастицы благородных металлов для очистки воды: критический обзор. Тонкие твердые пленки 517 , 6441–6478 (2009).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google Scholar
Chen, L. & Peng, X. Нановолоконная мембрана из целлюлозы, украшенная наночастицами серебра, обладает хорошей антибактериальной способностью и высокой водопроницаемостью. Заяв. Матер. Сегодня 9 , 130–135 (2017).
Артикул
Google Scholar
Лин, С. и др. . Композитные шарики из наночастиц серебра и альгината для дезинфекции питьевой воды в точках потребления. Вода Res. 47 , 3959–3965 (2013).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Гарсия Пенья, Л. В. и др. . Гибридные наночастицы хитозана и серебра, ферментативно внедренные в пробковый фильтрующий материал для обеззараживания воды. Индивидуальный инж. хим. Рез. 56 , 3599–3606 (2017).
Артикул
КАС
Google Scholar
Ли, К. и др. . Антимикробные наноматериалы для дезинфекции воды и микробного контроля: возможные применения и последствия. Вода Res. 42 , 4591–4602 (2008 г.).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Лю, Х., Тан, С. и Лю, К.Новый метод очистки воды в точках использования с помощью текстильного материала с антимикробным наносеребром. J. Water Health 12 , 670–677 (2014).
ПабМед
Статья
ПабМед Центральный
Google Scholar
Черноусова С. и Эппл М. Серебро как антибактериальное средство: ион, наночастица и металл. Анжю. Хеми – Междунар. Эд. 52 , 1636–1653 (2013).
Google Scholar
Добиас, Дж.и Бернье-Латмани, Р. Высвобождение серебра из наночастиц серебра в природных водах. Окружающая среда. науч. Технол. 47 , 4140–4146 (2013).
Окружающая среда. науч. Технол. 47 , 4140–4146 (2013).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Фабрега, Дж., Фосетт, С. Р., Реншоу, Дж. К. и Лид, Дж. Р. Влияние наночастиц серебра на рост бактерий: влияние рН, концентрации и органического вещества. Окружающая среда. науч. Технол. 43 , 7285–7290 (2009 г.).
Чжан С., Ху З. и Дэн Б. Наночастицы серебра в водной среде: физико-химическое поведение и антимикробные механизмы. Вода Res. 88 , 403–427 (2016).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Данкович, Т. А., Левин, Дж. С., Потгитер, Н., Диллингем, Р. и Смит, Дж. А. Инактивация бактерий из загрязненных ручьев в Лимпопо, Южная Африка, с помощью бумажных фильтров с наночастицами серебра или меди. Окружающая среда. науч. Вода Res. Технол. 2 , 85–96 (2016).
Окружающая среда. науч. Вода Res. Технол. 2 , 85–96 (2016).
КАС
Статья
Google Scholar
Эдайе, Б., Краузе, К. и Смит, Дж. А. Пористая керамическая таблетка с серебряными нанопластинками для недорогой очистки воды в месте использования. Окружающая среда. науч. Технол. 48 , 13901–13908 (2014).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Вентилятор, М., Gong, L., Huang, Y., Wang, D. & Gong, Z. Простое приготовление хитозановых криогелей, украшенных наночастицами серебра, для дезинфекции воды в месте использования. науч. Общая окружающая среда. 613–614 , 1317–1323 (2018).
ОБЪЯВЛЕНИЕ
пабмед
Статья
КАС
ПабМед Центральный
Google Scholar
Данкович, Т. А. и Грей, Д. Г. Бактерицидная бумага, пропитанная наночастицами серебра, для обработки воды в точках потребления. Окружающая среда. науч. Технол. 45 , 1992–1998 (2011).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Kahler, DM, Koermer, NT, Reichl, AR, Samie, A. & Smith, JA Эксплуатация и приемка новых керамических кубов, импрегнированных серебром, для очистки питьевой воды на двух полевых объектах: провинция Лимпопо, Южная Африка и Додома Регион, Танзания. Вода (Швейцария) , 8 , (2016).
Oyanedel-Craver, V.A. & Smith, J.A. Устойчивый керамический фильтр, пропитанный коллоидным серебром, для очистки воды в месте использования. Окружающая среда. науч. Технол. 42 , 927–933 (2008).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Райнер, Дж. и др. . Лабораторное исследование влияния применения серебра на эффективность удаления бактерий из фильтрующего материала для использования в керамических фильтрах для воды местного производства для очистки питьевой воды в домашних условиях. ACS Sustain. хим. англ. 1 , 737–745 (2013).
КАС
Статья
Google Scholar
Лоо, С. Л. и др. . Суперабсорбирующие криогели, украшенные наночастицами серебра, как новая технология дезинфекции воды в точках потребления. Окружающая среда. науч. Технол. 47 , 9363–9371 (2013).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Санкар, М.U. и др. . Армированные биополимером синтетические гранулированные нанокомпозиты для доступной очистки воды в точках использования. Проц. Натл. акад. науч. 110 , 8459–8464 (2013).
Натл. акад. науч. 110 , 8459–8464 (2013).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Мун, Р. Дж., Мартини, А., Нэрн, Дж., Симонсен, Дж. и Янгблад, Дж. Обзор наноматериалов целлюлозы: структура, свойства и нанокомпозиты. Обзоры химического общества , 40 , (2011).
Chaker, A. & Boufi, S. Катионная нанофибриллярная целлюлоза с высокими антибактериальными свойствами. Углевод. Полим. 131 , 224–232 (2015).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Литтунен, К. и др. . Синтез катионизированной нанофибриллированной целлюлозы и ее антимикробные свойства. евро. Полим. J. 75 , 116–124 (2016).
КАС
Статья
Google Scholar
Чжан В., Сяо Б. и Фанг Т. Химическая трансформация наночастиц серебра в водной среде: механизм, морфология и токсичность. Хемосфера 191 , 324–334 (2018).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Гуо З. и др. . Всегда ли наночастицы серебра токсичны в присутствии анионов окружающей среды? Хемосфера 171 , 318–323 (2017).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Левард, К. и др. . Влияние хлорида на скорость растворения наночастиц серебра и токсичность по отношению к E. coli . Окружающая среда. науч. Технол. 47 , 5738–5745 (2013).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Стабрила, Л. М., Джонстон, К. А., Миллстоун, Дж. Э. и Гилбертсон, Л. М. Серия новых исследователей: дело не только в ионах: поддержка вклада конкретных частиц в антимикробную активность наночастиц серебра. Окружающая среда. науч. Нано 5 , 2047–2068 (2018).
КАС
Статья
Google Scholar
Сю, З.М., Чжан, К. Б., Пуппала, Х. Л., Колвин, В. Л. и Альварес, П. Дж. Дж. Незначительная антибактериальная активность наночастиц серебра в отношении частиц. Нано Летт. 12 , 4271–4275 (2012).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Пал, С., Так, Ю. К. и Сонг, Дж. М. Зависит ли антибактериальная активность наночастиц серебра от формы наночастицы? Исследование грамотрицательной бактерии Escherichia coli . J. Biol. хим. 290 , 1712–1720 (2015).
Артикул
КАС
Google Scholar
Лонг, Ю. М. и др. . Поверхностный лиганд контролирует высвобождение ионов серебра из наносеребра и его антибактериальную активность в отношении Escherichia coli . Междунар. J. Nanomedicine 12 , 3193–3206 (2017).
КАС
пабмед
ПабМед Центральный
Статья
Google Scholar
Чой О. и др. . Ингибирующее действие наночастиц серебра, ионов серебра и коллоидов хлорида серебра на рост микробов. Вода Res. 42 , 3066–3074 (2008).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Edberg, S.C., Rice, E.W., Karlin, R.J. & Allen, M.J. Escherichia coli : лучший биологический индикатор питьевой воды для охраны здоровья населения. J. Appl. микробиол. 88 , 106С–116С (2000 г.).
J. Appl. микробиол. 88 , 106С–116С (2000 г.).
Артикул
Google Scholar
Правина, С. М., Хан, Л. С., Тан, Л. Т. Л. и Арис, А. З. Получение и характеристика наночастиц серебра, нанесенных на целлюлозную бумагу: оценка их потенциала в качестве антибактериального фильтра для воды. Дж. Экспл. Наноски. 11 , 1307–1319 (2016).
КАС
Статья
Google Scholar
Бисвас, П.& Bandyopadhyaya, R. Дезинфекция воды с использованием активированного угля, импрегнированного наночастицами серебра: уничтожение клеток Escherichia coli в периодической и непрерывной работе насадочной колонки в течение длительного времени. Вода Res. 100 , 105–115 (2016).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Le Ouay, B. & Stellacci, F. Антибактериальная активность наночастиц серебра: понимание науки о поверхности. Nano Today 10 , 339–354 (2015).
Артикул
КАС
Google Scholar
Чемберс, Б. А. и др. . Влияние хлорида и ионной силы на физическую морфологию, растворение и бактериальную токсичность наночастиц серебра. Окружающая среда. науч. Технол. 48 , 761–769 (2014).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Веферс, К.& Misra, C. Оксиды и гидроксиды алюминия. Технический документ Alcoa № 19. Квасцы . Ко Ам. 92 (1987).
Шен, Л., Ху, К., Сакка, Ю. и Хуанг, К. Изучение фазового превращения глинозема методом осаждения. J. Phys. Д. Заявл. Физ . 45 , (2012).
Ли, В.-Р. и др. . Антибактериальное действие наночастиц серебра на Staphylococcus aureus . BioMetals 24 , 135–141 (2011).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Амато, Э. и др. . Синтез, характеристика и антибактериальная активность против грамположительных и грамотрицательных бактерий наночастиц серебра с биомиметическим покрытием. Ленгмюр 27 , 9165–9173 (2011).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Грейлих, К. и др. . В этом же диапазоне концентраций проявляется токсическое действие ионов серебра и наночастиц серебра по отношению к бактериям и клеткам человека. RSC Adv. 2 , 6981–6987 (2012).
КАС
Статья
Google Scholar
Doody, M.A., Wang, D., Bais, H.P. & Jin, Y. Дифференциальная антимикробная активность наночастиц серебра в отношении бактерий Bacillus subtilis и Escherichia coli , а также токсичность для сельскохозяйственных растений Zea mays и полезных B.subtilis инокулированный Z. mays. J. Рез. наночастиц. 18 , 1–19 (2016).
КАС
Статья
Google Scholar
Юнг В.К. и др. . Антибактериальная активность и механизм действия ионов серебра в Staphylococcus aureus и Escherichia coli . Заяв. Окружающая среда. микробиол. 74 , 2171–2178 (2008).
КАС
пабмед
ПабМед Центральный
Статья
Google Scholar
Рупарелия, Дж.П., Чаттерджи А.К., Дуттагупта С.П. и Мукерджи С. Специфичность штамма в антимикробной активности наночастиц серебра и меди. Акта Биоматер. 4 , 707–716 (2008).
4 , 707–716 (2008).
КАС
пабмед
Статья
Google Scholar
Marambio-Jones, C. & Hoek, E. M. V. Обзор антибактериальных эффектов серебряных наноматериалов и потенциальных последствий для здоровья человека и окружающей среды. Дж.Рез. наночастиц. 12 , 1531–1551 (2010).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google Scholar
Gross, A., Stangl, F., Hoenes, K., Sift, M. & Hessling, M. Улучшенная дезинфекция питьевой воды с помощью УФ-светодиодов для Escherichia coli и Bacillus subtilis с использованием кварцевых трубок в качестве световод. Вода (Швейцария) 7 , 4605–4621 (2015).
КАС
Google Scholar
Ван Эльзас, Дж.Д., Семенов А.В., Коста Р. и Треворс Дж.Т. Выживание Escherichia coli в окружающей среде: фундаментальные аспекты и аспекты общественного здравоохранения. ISME J. 5 , 173–183 (2011).
ISME J. 5 , 173–183 (2011).
ПабМед
Статья
ПабМед Центральный
Google Scholar
Юн, К.Ю., Хун Бён, Дж., Пак, Дж.Х. и Хван, Дж. Константы чувствительности Escherichia coli и Bacillus subtilis к наночастицам серебра и меди. науч. Общая окружающая среда. 373 , 572–575 (2007).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Гангадхаран, Д. и др. . Полимерные микросферы, содержащие наночастицы серебра, как бактерицидное средство для обеззараживания воды. Вода Res. 44 , 5481–5487 (2010).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Всемирная организация здравоохранения.Руководство по качеству питьевой воды. 4 -е издание (2011 г.).
4 -е издание (2011 г.).
Sondi, I. & Salopek-Sondi, B. Наночастицы серебра в качестве антимикробного агента: тематическое исследование E. coli в качестве модели грамотрицательных бактерий. J. Коллоидный интерфейс Sci. 275 , 177–182 (2004).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Джонстон, К.А. и др. . Влияние химии бульона на высвобождение ионов серебра, химический состав поверхности и бактериальную цитотоксичность наночастиц серебра. Окружающая среда. науч. Нано 5 , 304–312 (2018).
КАС
Статья
Google Scholar
Рамалингам, Б., Хан, М. М. Р., Мондал, Б., Мандал, А. Б. и Дас, С. К. Легкий синтез наночастиц серебра, декорированных магнитно-хитозановой микросферой, для эффективного удаления красителей и микробных загрязнений. ACS Sustain. хим. англ. 3 , 2291–2302 (2015).
ACS Sustain. хим. англ. 3 , 2291–2302 (2015).
КАС
Статья
Google Scholar
Билефельдт, А. Р., Ковальски, К. и Саммерс, Р. С. Эффективность бактериальной очистки керамических фильтров для воды в точках использования. Вода Res. 43 , 3559–3565 (2009).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Правина С.M., Karuppiah, K. & Than, LTL. Потенциал целлюлозной бумаги, покрытой наночастицами серебра: благоприятный вариант для аварийного фильтра питьевой воды. Целлюлоза 25 , 2647–2658 (2018).
КАС
Статья
Google Scholar
Куанг, Д. В. и др. . Эффективная дезинфекция воды с использованием наночастиц серебра, содержащих гранулы кремнезема. Заяв. Серф. науч. 266 , 280–287 (2013).
науч. 266 , 280–287 (2013).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google Scholar
Ван дер Лаан, Х. и др. . Эффективность удаления бактерий и вирусов керамическим горшковым фильтром с различным применением серебра в долгосрочном эксперименте. Вода Res. 51 , 47–54 (2014).
ПабМед
Статья
КАС
ПабМед Центральный
Google Scholar
Яннаш, Х.W. Оценки скорости роста бактерий в природных водах. J. Бактериол. 99 , 156–160 (1969).
КАС
пабмед
ПабМед Центральный
Google Scholar
Левард, К. и др. . Сульфидирование наночастиц серебра: природное противоядие от их токсичности. Окружающая среда. науч. Технол. 47 , 13440–13448 (2013).
ОБЪЯВЛЕНИЕ
КАС
пабмед
ПабМед Центральный
Статья
Google Scholar
Сути, Дж.R. и др. . Антимикробное серебро: беспрецедентный анионный эффект. науч. Реп ., 11 , (2014).
Пинто, Р. Дж. Б. и др. . Антибактериальная активность нанокомпозитов серебра и бактериальных или растительных целлюлозных волокон. Акта Биоматер. 5 , 2279–2289 (2009).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Оби, К.Л., Потгитер, Н., Бессонг, П.О. и Матсаунг, Г. Объем потенциальных бактериальных возбудителей диареи и микробная оценка качества источников речной воды в сельских общинах венда в Южной Африке. Науки о воде. Технол. 47 , 59–64 (2003).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Гондикас А. П. и др. . Цистеин-индуцированные модификации наноматериалов с нулевой валентностью серебра: последствия для химии поверхности частиц, агрегации, растворения и образования серебра. Окружающая среда. науч. Технол. 46 , 7037–7045 (2012).
Окружающая среда. науч. Технол. 46 , 7037–7045 (2012).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Лоо, С. Л., Кранц, В. Б., Ху, X., Фейн, А. Г. и Лим, Т. Т. Влияние химии растворов на свойства и бактерицидную активность наночастиц серебра, нанесенных на сверхабсорбирующие криогели. J. Коллоидный интерфейс Sci. 461 , 104–113 (2016).
ОБЪЯВЛЕНИЕ
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Агентство по охране окружающей среды США. Издание 2012 г. Стандартов питьевой воды и рекомендаций по охране здоровья (2012 г.).
Kallio, P. T. & Bailey, J. E. Внутриклеточная экспрессия гемоглобина Vitreoscilla (VHb) повышает секрецию общего белка и улучшает выработку альфа-амилазы и нейтральной протеазы в Bacillus subtilis . Биотехнолог. прог. 12 , 31–39 (1996).
Биотехнолог. прог. 12 , 31–39 (1996).
КАС
пабмед
Статья
ПабМед Центральный
Google Scholar
Растворимость золота
Золото легко растворяется в царской водке или в любой другой смеси, образующей образующийся хлор, среди таких смесей есть растворы:
- нитраты, хлориды и сульфаты — например, бисульфат натрия, нитрат натрия и поваренная соль;
- хлориды и некоторые сульфаты — e.г., сульфат железа;
- соляная кислота и хлорат калия;
- хлорная известь и кислоты или соли, такие как бикарбонат соды.
Действие происходит намного быстрее, если применяется тепло или если золото сплавлено с одним из неблагородных металлов, чем если оно чистое. Присутствие серебра в золоте замедляет процесс, на металле образуется накипь из нерастворимого хлорида серебра, и в конечном итоге действие может быть полностью остановлено, если процент присутствующего серебра велик. Золото также растворяется жидкостями, содержащими хлор и бром, но действие их гораздо медленнее, чем у царской водки; и подвержены тем же трудностям, если присутствует серебро; тепло способствует растворению. Йод растворяет золото только тогда, когда оно находится в зачаточном состоянии, или если его нагреть с золотом и водой в запаянной пробирке до 50°. Металлическое золото растворяется в горячей крепкой серной кислоте, особенно если добавить немного азотной кислоты (осажденный металл растворяется легче всего), образуя желтую жидкость, которая при разбавлении водой дает металл в виде фиолетового или коричневого порошка.Раствор также покрывается блестящей пленкой восстановленного металла при воздействии влажного воздуха. При добавлении соляной кислоты или хлорида металла образуется хлорид золота, не осаждаемый водой. Золото также подвергается атаке, когда используется в качестве положительного полюса батареи при электролизе сильной серной кислоты, но немедленно снова восстанавливается выделяющимся водородом.
Золото также растворяется жидкостями, содержащими хлор и бром, но действие их гораздо медленнее, чем у царской водки; и подвержены тем же трудностям, если присутствует серебро; тепло способствует растворению. Йод растворяет золото только тогда, когда оно находится в зачаточном состоянии, или если его нагреть с золотом и водой в запаянной пробирке до 50°. Металлическое золото растворяется в горячей крепкой серной кислоте, особенно если добавить немного азотной кислоты (осажденный металл растворяется легче всего), образуя желтую жидкость, которая при разбавлении водой дает металл в виде фиолетового или коричневого порошка.Раствор также покрывается блестящей пленкой восстановленного металла при воздействии влажного воздуха. При добавлении соляной кислоты или хлорида металла образуется хлорид золота, не осаждаемый водой. Золото также подвергается атаке, когда используется в качестве положительного полюса батареи при электролизе сильной серной кислоты, но немедленно снова восстанавливается выделяющимся водородом.
Легко разлагающиеся металлические перхлориды, пербромиды и периодиды способны растворять золото, низшие хлориды и т. д.образованных неблагородных металлов и произведенного хлорида золота и т. д. Хорошо действуют высшие хлориды и бромиды марганца и кобальта (Co2Cl6 и т. д.), а горячий крепкий водный раствор бромида железа или хлорида железа также легко растворяет золото. Иодистое железо разлагается золотом в обычных условиях с образованием йодистого железа. Некоторые другие галоидные соединения атакуют золото только в присутствии эфира, и в этом случае даже сама иодистоводородная кислота разлагается с образованием йодистого золота.В качестве растворителей золота упоминаются также селеновая и йодистая кислоты, а действие смеси азотной и азотистой кислот описано в другом месте. Щелочные сульфиды медленно атакуют золото на холоде и быстрее при нагревании, образуя сульфид золота, который впоследствии растворяется. Дитте это отрицает. Золото также растворимо в гипосульфитах кальция, натрия, калия и магния.
Спринг показал, что золото растворяется в соляной кислоте при нагревании с ней до 150° в закрытой трубке, затем восстанавливается выделяющимся водородом и откладывается в виде микроскопических кристаллов на стенке трубки.К. Лоссен указал в 1895 г., что при электролизе раствора бромида калия образующийся щелочной раствор, содержащий гипобромит и бромат калия, способен растворять золото. Золото растворяется водными растворами простых цианидов и некоторыми двойными цианидами, такими как сульфоцианиды и ферроцианиды, которые действуют очень медленно, кроме как в присутствии окислителей и при помощи тепла.
Как приготовить чистое золото
Самое чистое золото требуется для использования в качестве эталонов или контрольных образцов при анализе золотых слитков.Следующий метод его приготовления был принят Робертсом-Остином при изготовлении пробной пластины, с помощью которой проверяются имперские золотые монеты. Золотые пробки из самого чистого золота, которое только можно получить, растворяют в азотной кислоте, удаляют избыток кислоты и добавляют спирт и хлористый калий для осаждения следов платины. Затем хлорид золота растворяют в дистиллированной воде в пропорции около половины унции металла на один галлон, и раствор выдерживают в течение трех недель.По истечении этого времени весь выпавший в осадок хлорид серебра осядет на дно, и надосадочную жидкость удаляют стеклянным сифоном. Затем время от времени добавляют кристаллы щавелевой кислоты, и жидкость осторожно нагревают до тех пор, пока она не станет бесцветной, когда осаждение завершится, точка достигается через три или четыре дня, если используются десятигаллонные сосуды. Полученное таким образом губчатое и чешуйчатое золото многократно промывают соляной кислотой, дистиллированной водой, аммиаком и снова дистиллированной водой до тех пор, пока не будет получена реакция на серебро или хлор, после чего его плавят в глиняном тигле с бисульфатом калия и бурой. , и заливают в каменную форму.Отсутствие осторожности в любой из операций приведет к золоту, содержащему одну или две части примеси на десять тысяч.
Затем хлорид золота растворяют в дистиллированной воде в пропорции около половины унции металла на один галлон, и раствор выдерживают в течение трех недель.По истечении этого времени весь выпавший в осадок хлорид серебра осядет на дно, и надосадочную жидкость удаляют стеклянным сифоном. Затем время от времени добавляют кристаллы щавелевой кислоты, и жидкость осторожно нагревают до тех пор, пока она не станет бесцветной, когда осаждение завершится, точка достигается через три или четыре дня, если используются десятигаллонные сосуды. Полученное таким образом губчатое и чешуйчатое золото многократно промывают соляной кислотой, дистиллированной водой, аммиаком и снова дистиллированной водой до тех пор, пока не будет получена реакция на серебро или хлор, после чего его плавят в глиняном тигле с бисульфатом калия и бурой. , и заливают в каменную форму.Отсутствие осторожности в любой из операций приведет к золоту, содержащему одну или две части примеси на десять тысяч.
В отношении вышеупомянутого метода можно отметить, что тщательно очищенный сернистый кислый газ является более удобным осадителем, чем щавелевая кислота, и может быть заменен на нее без каких-либо вредных последствий, так как любые посторонние металлы, которые могут присутствовать, находятся в таких малых количествах. количествах, при которых их сульфиты, даже если бы они образовались, оставались бы растворенными. Следует добавить, что, согласно недавним исследованиям Кольрауша, Роуза и Холлемана, хлорид серебра растворяется в 600 000—700 000 частей чистой воды при обычной температуре.Отсюда следует, что в условиях, заданных Робертсом-Остеном, раствор содержит по крайней мере 0,3—0,4 части серебра на 1000 частей золота, причем на практике это соотношение, несомненно, выше вследствие большей растворимости хлорида серебра в растворах других хлоридов, чем в чистой воде. Не может быть сомнения в том, что часть этого серебра осаждается вместе с золотом и что путем повторного растворения и повторного осаждения получается более чистый продукт. пятую часть указанного выше количества, добавляя к раствору небольшое количество бромистоводородной кислоты, причем бромид серебра растворяется гораздо хуже, чем хлорид серебра.Другая дополнительная мера предосторожности заключается в удалении газов, поглощаемых золотом в процессе плавления, путем нагревания его до красноты в вакууме.
количествах, при которых их сульфиты, даже если бы они образовались, оставались бы растворенными. Следует добавить, что, согласно недавним исследованиям Кольрауша, Роуза и Холлемана, хлорид серебра растворяется в 600 000—700 000 частей чистой воды при обычной температуре.Отсюда следует, что в условиях, заданных Робертсом-Остеном, раствор содержит по крайней мере 0,3—0,4 части серебра на 1000 частей золота, причем на практике это соотношение, несомненно, выше вследствие большей растворимости хлорида серебра в растворах других хлоридов, чем в чистой воде. Не может быть сомнения в том, что часть этого серебра осаждается вместе с золотом и что путем повторного растворения и повторного осаждения получается более чистый продукт. пятую часть указанного выше количества, добавляя к раствору небольшое количество бромистоводородной кислоты, причем бромид серебра растворяется гораздо хуже, чем хлорид серебра.Другая дополнительная мера предосторожности заключается в удалении газов, поглощаемых золотом в процессе плавления, путем нагревания его до красноты в вакууме.
Растворимость золота
Золото легко растворяется в царской водке или в любой другой смеси, образующей выделяющийся хлор, среди таких смесей растворы (1) нитратов, хлоридов и кислых сульфатов, например, бисульфат соды, нитрат соды и поваренная соль; (2) хлориды и некоторые сульфаты, например, сульфат железа; (3) соляная кислота и нитраты, пероксиды, такие как перманганат или хлораты; (4) отбеливающий порошок и кислоты или соли, такие как бикарбонат соды.Вообще говоря, почти любой хлорид, бромид или йодид растворяет золото в присутствии окислителя. Действие происходит намного быстрее, если применяется тепло или если золото сплавлено с одним из неблагородных металлов. Присутствие серебра в золоте замедляет процесс, на металле образуется накипь из нерастворимого хлорида серебра, и в конечном итоге действие может быть полностью остановлено, если процент присутствующего серебра велик. Золото растворяется также в жидкостях, содержащих хлор и бром, или в смеси, образующей бром. Действие гораздо медленнее, чем у царской водки, и с теми же трудностями, если присутствует серебро; тепло способствует растворению. Йод растворяет золото только тогда, когда оно находится в зачаточном состоянии, или если оно растворено в йодидах, эфире или спирте. Металлическое золото не растворяется в сильной серной кислоте, если не добавить немного азотной кислоты , при этом образуется желтая жидкость, которая при разбавлении водой осаждает металл в виде фиолетового или коричневого порошка. Смесь азотной и серной кислот является более быстрым растворителем золота, чем одна азотная кислота.
Действие гораздо медленнее, чем у царской водки, и с теми же трудностями, если присутствует серебро; тепло способствует растворению. Йод растворяет золото только тогда, когда оно находится в зачаточном состоянии, или если оно растворено в йодидах, эфире или спирте. Металлическое золото не растворяется в сильной серной кислоте, если не добавить немного азотной кислоты , при этом образуется желтая жидкость, которая при разбавлении водой осаждает металл в виде фиолетового или коричневого порошка. Смесь азотной и серной кислот является более быстрым растворителем золота, чем одна азотная кислота.
Согласно Никлсу, легко разлагающиеся металлические перхлориды, пербромиды и периодиды способны растворять золото, низшие хлориды и т. д. образующихся неблагородных металлов, а также образующийся хлорид золота и т. д. Однако некоторые из этих так называемых персолей часто рассматривают просто как растворы хлора, брома или йода в протосолях. Кипящий концентрированный раствор хлорного железа легко растворяет золото.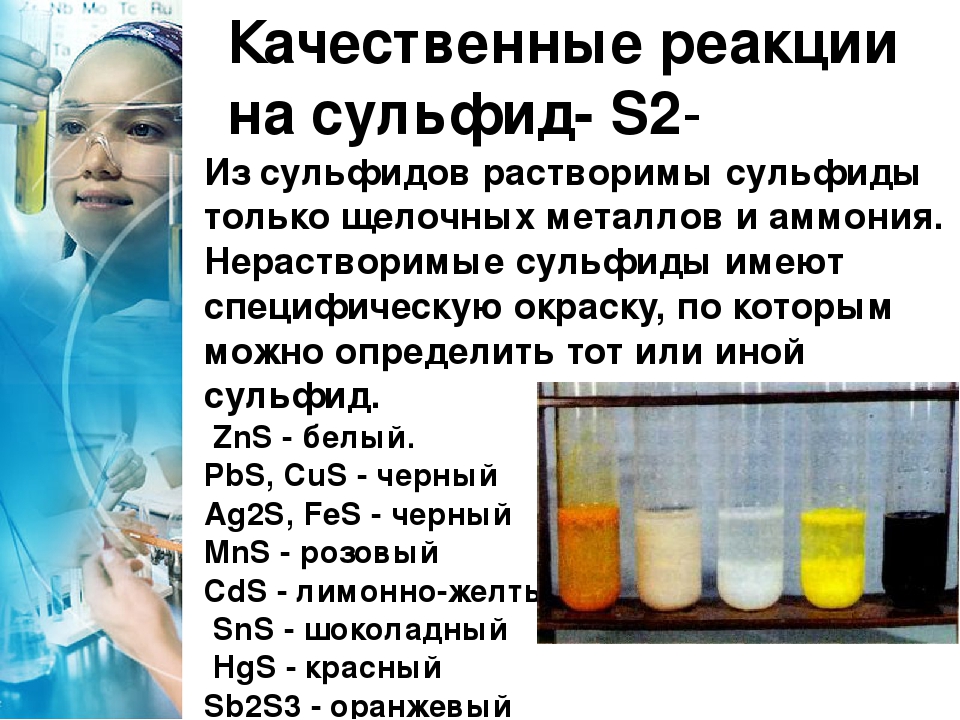 Некоторые другие галоидные соединения атакуют золото только в присутствии эфира, и в этом случае даже иодистоводородная кислота оказывает небольшое влияние.Чистая горячая селеновая кислота растворяет золото с образованием селената золота (Митчерлих, также Виктор Ленхер). В качестве растворителя золота упоминалась и йодноватая кислота, но действие ее очень слабое, гораздо меньшее, например, действия концентрированной соляной кислоты в аналогичных условиях. Смесь йодной и серной кислот растворяет золото при нагревании до 300° (Прат, также Виктор Ленхер). Действие смеси азотной и азотистой кислот описано в главе xx. Щелочные сульфиды медленно атакуют золото на холоде и быстрее при нагревании, образуя сульфид золота, который впоследствии растворяется.Золото также растворимо в тиосульфатах (гипосульфитах) кальция, натрия, калия и магния в присутствии окислителя.
Некоторые другие галоидные соединения атакуют золото только в присутствии эфира, и в этом случае даже иодистоводородная кислота оказывает небольшое влияние.Чистая горячая селеновая кислота растворяет золото с образованием селената золота (Митчерлих, также Виктор Ленхер). В качестве растворителя золота упоминалась и йодноватая кислота, но действие ее очень слабое, гораздо меньшее, например, действия концентрированной соляной кислоты в аналогичных условиях. Смесь йодной и серной кислот растворяет золото при нагревании до 300° (Прат, также Виктор Ленхер). Действие смеси азотной и азотистой кислот описано в главе xx. Щелочные сульфиды медленно атакуют золото на холоде и быстрее при нагревании, образуя сульфид золота, который впоследствии растворяется.Золото также растворимо в тиосульфатах (гипосульфитах) кальция, натрия, калия и магния в присутствии окислителя.
Спринг показал, что золото растворяется в соляной кислоте при нагревании с ней до 150° в закрытой трубке, затем восстанавливается выделяющимся водородом и откладывается в виде микроскопических кристаллов на стенке трубки. Автор обнаружил, что кипящая концентрированная соляная кислота растворяет золото и поддерживает его в растворе. Виктор Ленхер показал, что в присутствии серной кислоты многие окисляющие вещества, такие как теллуровая кислота, двуокись марганца, двуокись свинца, красный свинец, триокись хрома и окись никеля, вызывают переход золота в раствор.В некоторых случаях серную кислоту можно заменить фосфорной кислотой. При использовании золота в качестве анода золото окисляется, а если электролитом является сильная серная кислота, фосфорная кислота или едкий натр или поташ, часть оксида растворяется. К. Лоссен указал в 1895 г., что при электролизе раствора бромида калия образующийся щелочной раствор, содержащий гипобромит и бромат калия, способен растворять золото. Золото растворяется водными растворами простых цианидов в присутствии окислителя.Сульфоцианиды, ферроцианиды и некоторые другие двойные цианиды также растворяют золото, но действие их очень медленное даже в присутствии окислителей, если растворы не нагревать.
Автор обнаружил, что кипящая концентрированная соляная кислота растворяет золото и поддерживает его в растворе. Виктор Ленхер показал, что в присутствии серной кислоты многие окисляющие вещества, такие как теллуровая кислота, двуокись марганца, двуокись свинца, красный свинец, триокись хрома и окись никеля, вызывают переход золота в раствор.В некоторых случаях серную кислоту можно заменить фосфорной кислотой. При использовании золота в качестве анода золото окисляется, а если электролитом является сильная серная кислота, фосфорная кислота или едкий натр или поташ, часть оксида растворяется. К. Лоссен указал в 1895 г., что при электролизе раствора бромида калия образующийся щелочной раствор, содержащий гипобромит и бромат калия, способен растворять золото. Золото растворяется водными растворами простых цианидов в присутствии окислителя.Сульфоцианиды, ферроцианиды и некоторые другие двойные цианиды также растворяют золото, но действие их очень медленное даже в присутствии окислителей, если растворы не нагревать.
Таблица на с. 12 дана относительная скорость растворения золота рядом растворителей. Золото, использованное в каждом случае, состояло из одного «корнета» из «разделенного» золота, весом около половины грамма и состоящего из золота 99,93%, серебра 0,07%. Корнеты предлагают большую поверхность для атаки, так как состоят из губчатого золота, а те, что использовались, не отличались по физическому состоянию.Они были приготовлены по методике, описанной в разделе «Опробование слитков». Растворы были в избытке, но перемешивание или встряхивание не использовались.
Аллотропные формы золота
Мало что известно об аллотропных формах золота. О заметном влиянии следов других металлов на свойства золота уже говорилось; из этого, а также из вариаций цвета и других свойств можно сделать вывод о существовании нескольких аллотропных модификаций золота. В сплавах, содержащих заметные количества других металлов, признаки аллотропии встречаются не так часто.Однако калиевый сплав, содержащий 10% золота, при воздействии воды оставляет черный мелкодисперсный золотой порошок, и есть основания полагать, что он соединяется с водой с образованием гидрата.
Вильм утверждает, что если золото растворить в разбавленной амальгаме натрия под водой, водная жидкость становится темно-фиолетовой, а при подкислении ее соляной кислотой получается черный осадок чистого золота. Черное золото отличается от обычных модификаций своей чрезвычайной легкостью; кроме того, он растворим в щелочных растворах и не амальгамируется ни с ртутью, ни с амальгамой натрия.При нагревании дает обычную модификацию в виде фиолетово-красного порошка. Эта форма золота, по словам Вильма, напоминает черный осадок, получаемый при разложении некоторых сплавов алюминия и золота соляной кислотой.
Золотые амальгамы
Ртуть быстро растворяет золото при обычных температурах, образуя жидкие, пастообразные или твердые амальгамы, в зависимости от пропорций присутствующих металлов и их чистоты. Кусочек золота, натертый ртутью, тотчас же проникает в нее и становится чрезвычайно хрупким.Пластичность не всегда восстанавливается при удалении ртути перегонкой, часто индуцируется кристаллическая структура. Некоторые формы осажденного золота плохо поглощаются ртутью, частицы которой имеют тенденцию плавать на поверхности последней. Амальгама, содержащая 90% ртути, жидкая, 87,5% — пастообразная, 85% — кристаллизуется в желтовато-белые легкоплавкие призмы. При растворении осажденного золота в нагретой до 120° ртути и последующем охлаждении массы выделяются белые кристаллические пластинки, имеющие состав, соответствующий формуле AuHg4.Амальгамы с меньшим содержанием ртути могут быть получены различными способами путем нагревания золота и ртути до различных температур, вплоть до слабого красного каления, и воздействия на изделия азотной кислотой. Золотая амальгама легко растворяется в избытке ртути, образуя жидкую массу, от которой ее можно частично отделить процеживанием через замшу, когда белая пастообразная амальгама, содержащая около 33% золота, остается, а просачивающаяся через нее ртуть содержит некоторое количество золота. , величина которой зависит от температуры, но не от приложенного давления.
Некоторые формы осажденного золота плохо поглощаются ртутью, частицы которой имеют тенденцию плавать на поверхности последней. Амальгама, содержащая 90% ртути, жидкая, 87,5% — пастообразная, 85% — кристаллизуется в желтовато-белые легкоплавкие призмы. При растворении осажденного золота в нагретой до 120° ртути и последующем охлаждении массы выделяются белые кристаллические пластинки, имеющие состав, соответствующий формуле AuHg4.Амальгамы с меньшим содержанием ртути могут быть получены различными способами путем нагревания золота и ртути до различных температур, вплоть до слабого красного каления, и воздействия на изделия азотной кислотой. Золотая амальгама легко растворяется в избытке ртути, образуя жидкую массу, от которой ее можно частично отделить процеживанием через замшу, когда белая пастообразная амальгама, содержащая около 33% золота, остается, а просачивающаяся через нее ртуть содержит некоторое количество золота. , величина которой зависит от температуры, но не от приложенного давления.
 Чем больше поверхность — тем масштабнее процесс. Одной из особенностей волокна является огромная площадь взаимодействия. Подробнее о том, какую роль Аквален выполняет в традиционной смеси из активированного угля и ионообменной смолы мы рассказываем в этом видео:
Чем больше поверхность — тем масштабнее процесс. Одной из особенностей волокна является огромная площадь взаимодействия. Подробнее о том, какую роль Аквален выполняет в традиционной смеси из активированного угля и ионообменной смолы мы рассказываем в этом видео: