Через сколько амоксициллин выходит из организма
Совместимость Амоксициллина с алкоголем: действие на человека и последствия приема
Амоксициллин #8212; препарат, который обладает бактерицидным и антибактериальным эффектами.
Это антибиотик, относящийся к пенициллиновой группе.
Эффект от препарата достаточно быстр даже при серьезных заболеваниях.
Его можно принимать внутрь, а вот сочетать лекарство с алкоголем не рекомендуется.
Взаимодействие препарата со спиртным
Последствия совмещения препарата с алкоголем следующие:
Выше уже упоминалось о том, что Амоксициллин вызывает затруднения в дыхании. Алкоголь тоже воздействует на дыхание. Усиленное воздействие на дыхательный центр головного мозга может привести не только к серьезным дыхательным нарушениям, но и к смерти.
Когда разрешается принимать алкоголь после антибиотика
Воздействие антибиотика начинается уже через 2 часа после того, как препарат прошел процесс всасывания. Действие продолжается до 8-9 часов.
На следующие сутки Амоксициллин уже не будет воздействовать на организм. Однако врачи запрещают принимать спиртное минимум неделю после курса лечения.
Ведь все лечение не обходится единоразовым принятием антибиотика. Это продолжается долгое время. Спиртное лишь усугубит все лечение и болезнь может вернуться обратно.
Конечно, больной сам вправе решать, пить алкоголь во время лечения Амоксициллином или нет. Практически все больные, которые принимали Амоксициллин, оставляют положительные отзывы.
Антибиотик действует быстро и направлен на лечение почти всех главных органов. Он способен бороться со следующими заболеваниями:
- Дыхательная система: гнойная ангина, абсцесс легких, поражение бронхов, отит, синуситы.
- Пищеварительный тракт: перитонит, острые инфекции кишечника, холецистит.
- Мочеполовая система: пиелонефрит, гонорея, гнойные заболевания.
- Нарывы на мягких тканях, сепсис.

Естественно, есть и негативные отзывы, но все они из-за того, что препарат имеет не самые приятные побочные эффекты. С принятием алкоголя, как уже известно, они лишь усугубляются. Лечение становится бессмысленным.
Совместимы или нет антибиотики и алкоголь, смотрите интересную информацию в следующем видео:
Видите неточности, неполную или неверную информацию? Знаете, как сделать статью лучше?
Хотите предложить для публикации фотографии по теме?
Пожалуйста, помогите нам сделать сайт лучше! Оставьте сообщение и свои контакты в комментариях – мы свяжемся с Вами и вместе сделаем публикацию лучше!
Совместимость Амоксициллина с алкоголем: действие на человека и последствия приема
Амоксициллин #8212; препарат, который обладает бактерицидным и антибактериальным эффектами.
Это антибиотик, относящийся к пенициллиновой группе.
Эффект от препарата достаточно быстр даже при серьезных заболеваниях.
Его можно принимать внутрь, а вот сочетать лекарство с алкоголем не рекомендуется.
Взаимодействие препарата со спиртным
Последствия совмещения препарата с алкоголем следующие:
Выше уже упоминалось о том, что Амоксициллин вызывает затруднения в дыхании. Алкоголь тоже воздействует на дыхание. Усиленное воздействие на дыхательный центр головного мозга может привести не только к серьезным дыхательным нарушениям, но и к смерти.
Когда разрешается принимать алкоголь после антибиотика
Воздействие антибиотика начинается уже через 2 часа после того, как препарат прошел процесс всасывания. Действие продолжается до 8-9 часов.
На следующие сутки Амоксициллин уже не будет воздействовать на организм. Однако врачи запрещают принимать спиртное минимум неделю после курса лечения.
Ведь все лечение не обходится единоразовым принятием антибиотика. Это продолжается долгое время. Спиртное лишь усугубит все лечение и болезнь может вернуться обратно.
Конечно, больной сам вправе решать, пить алкоголь во время лечения Амоксициллином или нет. Практически все больные, которые принимали Амоксициллин, оставляют положительные отзывы.
Практически все больные, которые принимали Амоксициллин, оставляют положительные отзывы.
Антибиотик действует быстро и направлен на лечение почти всех главных органов. Он способен бороться со следующими заболеваниями:
- Дыхательная система: гнойная ангина, абсцесс легких, поражение бронхов, отит, синуситы.
- Пищеварительный тракт: перитонит, острые инфекции кишечника, холецистит.
- Мочеполовая система: пиелонефрит, гонорея, гнойные заболевания.
- Нарывы на мягких тканях, сепсис.
Естественно, есть и негативные отзывы, но все они из-за того, что препарат имеет не самые приятные побочные эффекты. С принятием алкоголя, как уже известно, они лишь усугубляются. Лечение становится бессмысленным.
Совместимы или нет антибиотики и алкоголь, смотрите интересную информацию в следующем видео:
Видите неточности, неполную или неверную информацию? Знаете, как сделать статью лучше?
Хотите предложить для публикации фотографии по теме?
Пожалуйста, помогите нам сделать сайт лучше! Оставьте сообщение и свои контакты в комментариях – мы свяжемся с Вами и вместе сделаем публикацию лучше!
Амоксициллин инструкция
Содержание
Общая характеристика
Действующее вещество: амоксициллин, (2S,5R,6R) -6 – [ [ (2R) -2 – амино -2- (4 – гидроксифенил) ацетил ] амино ] -3,3 – диметил -7- оксо -4 – тиа -1 – азабицикло [ 3.2.0 ] гептан -2 – карбоновой кислоты ;
1 капсула содержит амоксициллина три гидрата 0,587 г в пересчете на амоксициллин 0,5 г.
Основные физико-химические свойства : твердые капсулы с крышечкой красного цвета и корпусом желтого цвета. Содержимое капсулы – порошок белого или почти белого цвета.
Лекарственная форма
Фармакотерапевтическая группа
– инфекции верхних дыхательных путей, в том числе уха, горла и носа: острый средний отит, острый синусит и бактериальных фарингит;
– инфекции нижних дыхательных путей: острое обострение хронического бронхита, пневмония;
– инфекции почек и урогенитального тракта: цистит, пиелонефрит;
– инфекции ЖКТ: возможна необходимость применения комбинированной терапии, если инфекции вызваны анаэробными микроорганизмами;
Противопоказания
Дозы зависят от чувствительности микро организмов и тяжести заболевания.
Взрослые и подростки (масса тела 40 кг):
обычные дозы – от 750 мг до 3 г амоксициллина в день, разделенные на три приема.
Краткий курс лечения:
Неосложненные инфекции мочевого тракта рекомендуются две дозы по 3 г в день с интервалами между дозами 10-12 часов.
Лечение высокими дозами: рекомендовано максимально 6 г в день, распределенная на два приема.
Дозы по 3 г дважды в день рекомендованы для лечения тяжелых или рецидивирующих инфекций дыхательных путей.
Дозы для предотвращения эндокардита:
Для предотвращения эндокардита больным, для которых не предусмотрена общая анестезия, за час до хирургического вмешательства дают 3 г амоксициллина, через 16 часов, по необходимости , дают еще 3 ч.
Для младенцев и детей рекомендуется пероральнi суспензии , содержащие амоксициллин.
Дозирование при нарушении функции почек:
Клиренс креатинина 10 – 30 мл / мин. Максимальная доза амоксициллина – 500 мг дважды в день.
Клиренс креатинина 10 мл / мин. Максимальная доза амоксицилiну – 500 мг в день.
Дети (масса тела 40 кг):
Клиренс креатинина 10 – 30 мл/мин – 15 мг/кг массы тела дважды в день.
Клиренс креатинина 10 мл/мин – 15 мг/кг массы тела один раз в день.
В целом лечение следует продолжать от 2 до 3 дней после исчезновения симптомов. Для полного исчезновения инфекции, вызванной бета – гемолитическими стрептококками, рекомендуется продолжительность лечения не менее 10 дней .
Побочные реакции
Со стороны крови: обратимая лейкопения (включая тяжелую нейтропению или агранулоцитоз), обратимая тромбоцитопения и гемолитическая анемия.
Со стороны иммунной системы: тяжелые аллергические реакции, в том числе ангионевротический отек, анафилаксия, сывороточная болезнь и гиперреактивный васкулит. При наличии реакции гиперчувствительности лечение следует прекратить.
Со стороны нервной системы: гiперкинезия, головокружение и судороги. Судороги могут возникнуть у больных с нарушением почечной функции или при получении высокой дозы.
Судороги могут возникнуть у больных с нарушением почечной функции или при получении высокой дозы.
Со стороны пищеварительной системы: диарея, тошнота, рвота, очень редко – ассоциированный антибиотический колит (в том числе псевдомембранозный и геморрагической колиты).
Со стороны печени: гепатит, холестатическая желтуха, умеренная повышение активности печеночных ферментов.
Другие осложнения: длительное и повторное применение препарата может привести к суперинфекции и колонизации резистентных микроорганизмов, например, орального или вагинального кандидоза.
У детей описано изменение цвета зубов. Предотвратить изменение цвета зубов может надлежащая гигиена полости рта.
Передозировка
Применение в период беременности или кормления грудью
Особенности применения
Больных, страдающих тяжелыми желудочно – кишечными расстройствами с диареей и рвотой, не следует лечить амоксициллином в капсулах из-за риска пониженного всасывания. В этих случаях рекомендуется парентеральное лечение амоксициллином.
Амоксициллин следует применять с осторожностью больным с аллергическими диатезами и астмой.
У больных с нарушением функции почек выведение амоксициллина задерживается, в зависимости от степени нарушения, может возникнуть необходимость в уменьшении суточной дозы.
Длительное применение амоксициллина может иногда приводить к избыточному росту некоторых нечувствительных микроорганизмов. Поэтому следует тщательно наблюдать за больными из-за возможности возникновения суперинфекции.
Наличие высокой концентрации амоксицилина в моче может привести к осаждению продуктов распада в мочевых катетерах. Поэтому в интервалах катетеры следует визуально проверять.
При высоких дозах амоксициллина рекомендуется поддерживать адекватный прием жидкости и мочеиспускания для минимизации возможности амоксициллиновой кристаллурии.
Способность влиять на управление автотранспортом
Взаимодействие с другими лекарственными средствами
Подобно к другим антибиотикам широкого спектра, амоксициллин может снижать эффективность контрацептивов, о чем следует предупредить больных.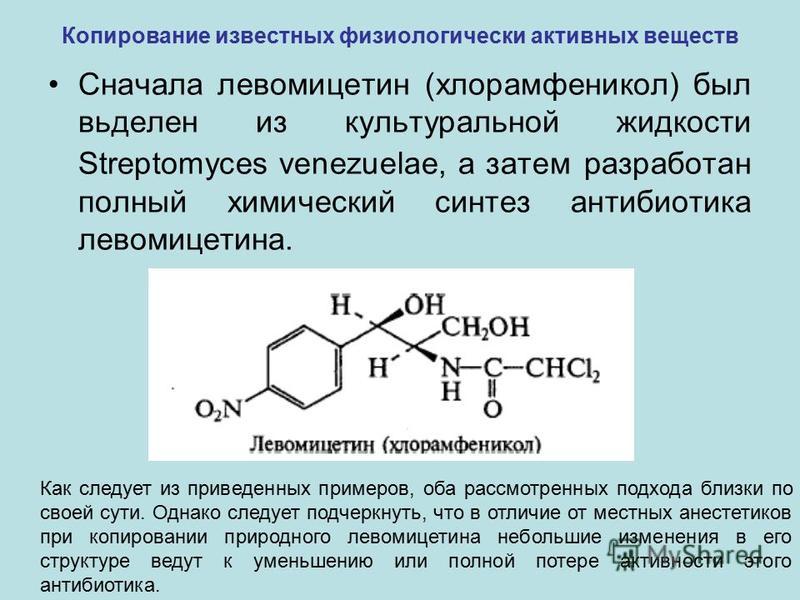
Одновременное введение аллопуринола во время лечения амоксициллином может повысить вероятность аллергических кожных реакций.
Иногда описывают продолжение протромбинового времени у больных, получающих амоксициллин. При одновременном назначении антикоагулянтов следует вести соответствующий мониторинг.
Возможно повышение всасывания дигоксина при одновременном применении с амоксициллином. Возможна противодействие антибактериального действия амоксициллина при одновременном применении макролидов, тетрациклинов, сульфамидов или хлорамфеникола.
Пробенецид снижает выведение амоксициллина почечными канальцами.
Одновременное применение с амоксициллином может привести к повышенной концентрации амоксициллина в крови.
Фармакодинамика
Амоксициллин – это аминопенициллин, который оказывает антибактериальное действие из-за торможения синтеза клеточных оболочки бактерий.
Клиническая эффективность бета-лактама зависит от времени, в течение которого концентрация препарата в крови превышает МПК (минимальную ингибирующее концентрацию) для конкретного микроорганизма.
Бактерии могут быть резистентными к амоксициллину благодаря:
– выработке бета-лактамазы, которая гидролизирует аминопенициллины;
– изменения белков, связывающих пенициллины;
– непроникаемости бактерий для препарата;
– насосам, которые выводят препарат.
В одном организме могут сосуществовать один или несколько из этих механизмов, приводя к вариабельной и непредсказуемой перекрестной резистентности к другим бета-лактамов и к АНТИБАКТЕРИАЛЬНЫМ средств других классов.
Действующие точки. Действующие точки МПК для чувствительных микроорганизмов варьируют в зависимости от вида: S – чувствительный, R – резистентный.
Энтеробактерии считаются чувствительными, если концентрация амоксициллина для ингибирования S составляет 8 мг/л.
М. саtarrhalis (отрицательные по β-лактамазе) S 0,25 мг / л, R 0,5 мг / л,
H. influenzae (отрицательные по β – лактамазе) S 1 мг/л, R 45 мг/л,
influenzae (отрицательные по β – лактамазе) S 1 мг/л, R 45 мг/л,
S. рneumoniae S 0,5 мг/л, R мг/л.
Обычно чувствительные виды
Граммпозитивные аэробы – Enterococcus faecalis, Streptococcus agalactide, Streptococcus pyogenes.
Граммнегативные аэробы – Neisseria meningitidis.
анаэробы: Clostridium perftringens, Peptostreptococci.
Виды, приобретенная резистентность к которым может быть угрожающая пациента.
Аэробные: Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus viridans, Esherichia coli, Нaemophilus influenzae, Нaemophilus parainfluenzae, Klebsiella spp., Moraxella catarrhalis, Proteus mirabilis, Proteus spp., Proteus vulgaris, Providencia spp.
анаэробы: Bacteroides spp., Fusobacterium spp.
Организмы, для которых свойственна резистентность:
Acinebacter spp., Citrobacter spp., Enterobacter spp., Pseudomonas spp., Serrata spp.
Chlamidia, Mycoplasma, Ricketsia.
Фармакокинетика
Распределение. Связывание амоксициллина с белками составляет около 17%. Амоксициллин может проникать в воспаленные мозговые оболочки и в спинномозговую жидкость. Амоксициллин проходит сквозь плаценту, небольшой процент выводится в грудное молоко.
Срок годности
Условия хранения
Категория продажи
Производитель
ЗАО Лекхим – Харьков .
Местоположение. Украина, 61115, г. Харьков, ул. 17-го Партсъезда, 36.
Источник:
http://doctornebolit.ru/vse-ob-antibiotikah/cherez-skolko-amoksicillin-vyhodit-iz-organizma.html
Как долго амоксициллин выводится из организма
Как проявляется передозировка Амоксициллином?
Амоксициллин – эффективный препарат, используемый для лечения инфекционных заболеваний. Он имеет ряд противопоказаний и побочных эффектов.
При нарушении назначенной схемы приема, возникает вероятность появления симптомов передозировки. У взрослых отравление развивается при употреблении в сутки более 6 грамм Амоксициллина.
У детей максимальная доза рассчитывается индивидуально, в зависимости от веса. При превышении нормы возникает передозировка.
Амоксициллин: передозировка, симптомы, через сколько проявляются, период полувыведения
Передозировка Амоксициллином опасна для человеческого организма. Первые симптомы отравления проявляются через час после приема препарата. У человека снижается работоспособность и ухудшается самочувствие. К характерным признакам отравления относят:
- тошноту и рвоту;
- болезненность в области живота;
- головные боли;
- повышение температуры тела;
- аллергическую реакцию.
Внешне распознать отравление Амоксициллином достаточно просто. Кожные покровы становятся бледными, увеличивается потоотделение.
В некоторых случаях на коже образуются покраснения или сыпь. Наблюдаются скачки артериального давления и повышение температуры тела.
У детей передозировка характеризуется кожными высыпаниями. При продолжительном приеме Амоксициллина развивается отек Квинке.
Отравление Амоксициллином касается всех систем жизнеобеспечения. Нарушается функция кровеносной системы. Чаще всего это выражается в появлении анемии. Затрагивается деятельность печени и почек. Излишки лекарственного средства застаиваются в органах, провоцируя развитие уремии и желтухи. Особенно опасна интоксикация для людей, страдающих хроническими заболеваниями печени и почек.
Справка. Во время приема Амоксициллина в моче будет определяться ошибочное количество глюкозы. Чтобы получить наиболее достоверный результат, рекомендуется использовать глюкозоксидантный способ обнаружения глюкозы.
Как справиться с отравлением?
При отравлении Амоксициллином человеку требуется незамедлительная помощь. В домашних условиях устраняются симптомы интоксикации. С этой целью производятся следующие действия:
Фото 1. Упаковка активированного угля в форме таблеток дозировкой 250 мг. В пачке 100 штук.
Упаковка активированного угля в форме таблеток дозировкой 250 мг. В пачке 100 штук.
Положительное влияние на процесс выздоровления оказывает употребление большого количества жидкости и пищи, богатой жирами. Желательно включать в рацион молоко, желейные десерты, кисели и компоты. От тяжелой пищи на начальной стадии лечения следует отказаться.
Внимание! Одновременный прием Амоксициллина с антикоагулянтами вызывает нарушения свертываемости крови. В этом случае показана регулярная сдача коагулограммы.
Последствия
Ранняя диагностика отравления позволит избежать серьезных последствий. Если вовремя не принять меры по устранению симптомов интоксикации, увеличивается вероятность летального исхода. При передозировке Амоксициллином страдают:
Фото 2. Отёк Квинке у мужчины. В некоторых случаях может стать причиной удушья.
Важно! Чтобы лечение туберкулеза было продуктивным, необходимо выполнять назначенные врачом рекомендации.
Период выведения из организма, чем выводится, через какое время пропадают симптомы передозировки
При своевременном обращении к врачу, симптомы передозировки исчезают уже через 1—2 дня. Последствия острой интоксикации вылечить сложнее. Продолжительность терапии в каждом случае индивидуальна. Она зависит от того, какие патологии вызвала передозировка.
Полезное видео
Посмотрите видео, в котором подробно описывается препарат Амоксициллин, его основные свойства: показания, противопоказания, побочные действия, максимальная дозировка.
- игорь — Особенности лечения Амоксициллином: сколько дней принимать антибиотик, чтобы победить болезнь? 5
- Ирина — Инструкция по применению Канамицина: как не ошибиться с дозировкой 4
- Петя — Инструкция по применению Канамицина: как не ошибиться с дозировкой 4
- Гена — Антибиотик Амикацин: инструкция по применению, противопоказания и побочные эффекты 3
- Василий — Инструкция по применению Амикацина: как разводить уколы 6
Интернет-журнал о туберкулёзе, болезнях лёгких, анализах, диагностике, лекарствах и другой важной информации об этом.
Как проявляется передозировка Амоксициллином?
Амоксициллин – эффективный препарат, используемый для лечения инфекционных заболеваний. Он имеет ряд противопоказаний и побочных эффектов.
При нарушении назначенной схемы приема, возникает вероятность появления симптомов передозировки. У взрослых отравление развивается при употреблении в сутки более 6 грамм Амоксициллина.
У детей максимальная доза рассчитывается индивидуально, в зависимости от веса. При превышении нормы возникает передозировка.
Амоксициллин: передозировка, симптомы, через сколько проявляются, период полувыведения
Передозировка Амоксициллином опасна для человеческого организма. Первые симптомы отравления проявляются через час после приема препарата. У человека снижается работоспособность и ухудшается самочувствие. К характерным признакам отравления относят:
- тошноту и рвоту;
- болезненность в области живота;
- головные боли;
- повышение температуры тела;
- аллергическую реакцию.
Внешне распознать отравление Амоксициллином достаточно просто. Кожные покровы становятся бледными, увеличивается потоотделение.
В некоторых случаях на коже образуются покраснения или сыпь. Наблюдаются скачки артериального давления и повышение температуры тела.
У детей передозировка характеризуется кожными высыпаниями. При продолжительном приеме Амоксициллина развивается отек Квинке.
Отравление Амоксициллином касается всех систем жизнеобеспечения. Нарушается функция кровеносной системы. Чаще всего это выражается в появлении анемии. Затрагивается деятельность печени и почек. Излишки лекарственного средства застаиваются в органах, провоцируя развитие уремии и желтухи. Особенно опасна интоксикация для людей, страдающих хроническими заболеваниями печени и почек.
Справка. Во время приема Амоксициллина в моче будет определяться ошибочное количество глюкозы. Чтобы получить наиболее достоверный результат, рекомендуется использовать глюкозоксидантный способ обнаружения глюкозы.
Во время приема Амоксициллина в моче будет определяться ошибочное количество глюкозы. Чтобы получить наиболее достоверный результат, рекомендуется использовать глюкозоксидантный способ обнаружения глюкозы.
Как справиться с отравлением?
При отравлении Амоксициллином человеку требуется незамедлительная помощь. В домашних условиях устраняются симптомы интоксикации. С этой целью производятся следующие действия:
Фото 1. Упаковка активированного угля в форме таблеток дозировкой 250 мг. В пачке 100 штук.
Положительное влияние на процесс выздоровления оказывает употребление большого количества жидкости и пищи, богатой жирами. Желательно включать в рацион молоко, желейные десерты, кисели и компоты. От тяжелой пищи на начальной стадии лечения следует отказаться.
Внимание! Одновременный прием Амоксициллина с антикоагулянтами вызывает нарушения свертываемости крови. В этом случае показана регулярная сдача коагулограммы.
Последствия
Ранняя диагностика отравления позволит избежать серьезных последствий. Если вовремя не принять меры по устранению симптомов интоксикации, увеличивается вероятность летального исхода. При передозировке Амоксициллином страдают:
Фото 2. Отёк Квинке у мужчины. В некоторых случаях может стать причиной удушья.
Важно! Чтобы лечение туберкулеза было продуктивным, необходимо выполнять назначенные врачом рекомендации.
Период выведения из организма, чем выводится, через какое время пропадают симптомы передозировки
При своевременном обращении к врачу, симптомы передозировки исчезают уже через 1—2 дня. Последствия острой интоксикации вылечить сложнее. Продолжительность терапии в каждом случае индивидуальна. Она зависит от того, какие патологии вызвала передозировка.
Полезное видео
Посмотрите видео, в котором подробно описывается препарат Амоксициллин, его основные свойства: показания, противопоказания, побочные действия, максимальная дозировка.
- игорь — Особенности лечения Амоксициллином: сколько дней принимать антибиотик, чтобы победить болезнь? 5
- Ирина — Инструкция по применению Канамицина: как не ошибиться с дозировкой 4
- Петя — Инструкция по применению Канамицина: как не ошибиться с дозировкой 4
- Гена — Антибиотик Амикацин: инструкция по применению, противопоказания и побочные эффекты 3
- Василий — Инструкция по применению Амикацина: как разводить уколы 6
Интернет-журнал о туберкулёзе, болезнях лёгких, анализах, диагностике, лекарствах и другой важной информации об этом.
Амоксициллин и алкоголь
Кратко о препарате
Амоксициллин назначается при состояниях, которые требуют быстрого реагирования, когда промедление может стоить человеку жизни.
Алкоголь и Амоксициллин: последствия
Особенность всех антибактериальных препаратов в том, что они создают дополнительную нагрузку на печень. Она как орган фильтрации защищает организм, перерабатывает вредные и опасные вещества. А их в лекарствах содержится немало.
- Ускоряет выведение антибиотика из организма, что снижает воздействие лекарства на микроорганизмы-возбудители заболевания.
- Провоцирует возникновение дисбактериоза, который, в свою очередь, препятствует всасыванию Амоксициллина в системе пищеварения.
Алкогольные напитки отрицательно влияют на деятельность мозга, потому что ухудшают его снабжение кислородом. Человек может это ощутить головокружением, тошнотой.
Врачи подчеркивают: чем старше человек, чем больше у него хронических недугов и патологий, тем опаснее совмещать прием Амоксициллина с горячительными напитками.
Что касается вопроса о том, когда после окончания лечения можно употреблять спиртное, то врачи рекомендуют это делать не раньше, чем через неделю. Соблюдение рекомендации поможет избежать повторного проявления болезни.
Лечение Амоксициллином дает хорошие результаты, если точно и строго следовать назначенной врачом схеме приема лекарства и не употреблять горячительные напитки. Это же совершенно несложно!
Это же совершенно несложно!
Заметили ошибку? Пожалуйста, выделите текст с ошибкой и нажмите Ctrl+Enter, чтобы сообщить об этом редакции.
Нередко можно услышать «рецепт» для поднятия артериального давления посредством употребления алкоголя. Так ли это.
Пресловутый «зеленый змий» – серьезный противник. Он способен превратить здоровых людей в инвалидов, разрушить нашу жизнь или.
Вы хотите бросить курить, но не знаете, как правильно это сделать или с чего начать? А, может, вы уже пробовали отказаться от.
Одной из наиболее частых зависимостей в настоящее время считается алкоголизм. Реакция на спиртные напитки всегда индивидуальна.
Копирование материалов только с указанием ссылки на ресурс.
Источник:
http://slovovracha.ru/sovety-vrachej/kak-dolgo-amoksicillin-vyvoditsja-iz-organizma.html
Лечим печень
Лечение, симптомы, препараты
Сколько выводится амоксициллин из организма
Как проявляется передозировка Амоксициллином?
Амоксициллин – эффективный препарат, используемый для лечения инфекционных заболеваний. Он имеет ряд противопоказаний и побочных эффектов.
При нарушении назначенной схемы приема, возникает вероятность появления симптомов передозировки. У взрослых отравление развивается при употреблении в сутки более 6 грамм Амоксициллина.
У детей максимальная доза рассчитывается индивидуально, в зависимости от веса. При превышении нормы возникает передозировка.
Амоксициллин: передозировка, симптомы, через сколько проявляются, период полувыведения
Передозировка Амоксициллином опасна для человеческого организма. Первые симптомы отравления проявляются через час после приема препарата. У человека снижается работоспособность и ухудшается самочувствие. К характерным признакам отравления относят:
- тошноту и рвоту;
- болезненность в области живота;
- головные боли;
- повышение температуры тела;
- аллергическую реакцию.

Внешне распознать отравление Амоксициллином достаточно просто. Кожные покровы становятся бледными, увеличивается потоотделение.
В некоторых случаях на коже образуются покраснения или сыпь. Наблюдаются скачки артериального давления и повышение температуры тела.
У детей передозировка характеризуется кожными высыпаниями. При продолжительном приеме Амоксициллина развивается отек Квинке.
Отравление Амоксициллином касается всех систем жизнеобеспечения. Нарушается функция кровеносной системы. Чаще всего это выражается в появлении анемии. Затрагивается деятельность печени и почек. Излишки лекарственного средства застаиваются в органах, провоцируя развитие уремии и желтухи. Особенно опасна интоксикация для людей, страдающих хроническими заболеваниями печени и почек.
Справка. Во время приема Амоксициллина в моче будет определяться ошибочное количество глюкозы. Чтобы получить наиболее достоверный результат, рекомендуется использовать глюкозоксидантный способ обнаружения глюкозы.
Как справиться с отравлением?
При отравлении Амоксициллином человеку требуется незамедлительная помощь. В домашних условиях устраняются симптомы интоксикации. С этой целью производятся следующие действия:
Фото 1. Упаковка активированного угля в форме таблеток дозировкой 250 мг. В пачке 100 штук.
Положительное влияние на процесс выздоровления оказывает употребление большого количества жидкости и пищи, богатой жирами. Желательно включать в рацион молоко, желейные десерты, кисели и компоты. От тяжелой пищи на начальной стадии лечения следует отказаться.
Внимание! Одновременный прием Амоксициллина с антикоагулянтами вызывает нарушения свертываемости крови. В этом случае показана регулярная сдача коагулограммы.
Последствия
Ранняя диагностика отравления позволит избежать серьезных последствий. Если вовремя не принять меры по устранению симптомов интоксикации, увеличивается вероятность летального исхода. При передозировке Амоксициллином страдают:
При передозировке Амоксициллином страдают:
Фото 2. Отёк Квинке у мужчины. В некоторых случаях может стать причиной удушья.
Важно! Чтобы лечение туберкулеза было продуктивным, необходимо выполнять назначенные врачом рекомендации.
Период выведения из организма, чем выводится, через какое время пропадают симптомы передозировки
При своевременном обращении к врачу, симптомы передозировки исчезают уже через 1—2 дня. Последствия острой интоксикации вылечить сложнее. Продолжительность терапии в каждом случае индивидуальна. Она зависит от того, какие патологии вызвала передозировка.
Полезное видео
Посмотрите видео, в котором подробно описывается препарат Амоксициллин, его основные свойства: показания, противопоказания, побочные действия, максимальная дозировка.
- игорь — Особенности лечения Амоксициллином: сколько дней принимать антибиотик, чтобы победить болезнь? 5
- Ирина — Инструкция по применению Канамицина: как не ошибиться с дозировкой 4
- Петя — Инструкция по применению Канамицина: как не ошибиться с дозировкой 4
- Гена — Антибиотик Амикацин: инструкция по применению, противопоказания и побочные эффекты 3
- Василий — Инструкция по применению Амикацина: как разводить уколы 6
Интернет-журнал о туберкулёзе, болезнях лёгких, анализах, диагностике, лекарствах и другой важной информации об этом.
Как проявляется передозировка Амоксициллином?
Амоксициллин – эффективный препарат, используемый для лечения инфекционных заболеваний. Он имеет ряд противопоказаний и побочных эффектов.
При нарушении назначенной схемы приема, возникает вероятность появления симптомов передозировки. У взрослых отравление развивается при употреблении в сутки более 6 грамм Амоксициллина.
У детей максимальная доза рассчитывается индивидуально, в зависимости от веса. При превышении нормы возникает передозировка.
Амоксициллин: передозировка, симптомы, через сколько проявляются, период полувыведения
Передозировка Амоксициллином опасна для человеческого организма. Первые симптомы отравления проявляются через час после приема препарата. У человека снижается работоспособность и ухудшается самочувствие. К характерным признакам отравления относят:
- тошноту и рвоту;
- болезненность в области живота;
- головные боли;
- повышение температуры тела;
- аллергическую реакцию.
Внешне распознать отравление Амоксициллином достаточно просто. Кожные покровы становятся бледными, увеличивается потоотделение.
В некоторых случаях на коже образуются покраснения или сыпь. Наблюдаются скачки артериального давления и повышение температуры тела.
У детей передозировка характеризуется кожными высыпаниями. При продолжительном приеме Амоксициллина развивается отек Квинке.
Отравление Амоксициллином касается всех систем жизнеобеспечения. Нарушается функция кровеносной системы. Чаще всего это выражается в появлении анемии. Затрагивается деятельность печени и почек. Излишки лекарственного средства застаиваются в органах, провоцируя развитие уремии и желтухи. Особенно опасна интоксикация для людей, страдающих хроническими заболеваниями печени и почек.
Справка. Во время приема Амоксициллина в моче будет определяться ошибочное количество глюкозы. Чтобы получить наиболее достоверный результат, рекомендуется использовать глюкозоксидантный способ обнаружения глюкозы.
Как справиться с отравлением?
При отравлении Амоксициллином человеку требуется незамедлительная помощь. В домашних условиях устраняются симптомы интоксикации. С этой целью производятся следующие действия:
Фото 1. Упаковка активированного угля в форме таблеток дозировкой 250 мг. В пачке 100 штук.
Положительное влияние на процесс выздоровления оказывает употребление большого количества жидкости и пищи, богатой жирами. Желательно включать в рацион молоко, желейные десерты, кисели и компоты. От тяжелой пищи на начальной стадии лечения следует отказаться.
Желательно включать в рацион молоко, желейные десерты, кисели и компоты. От тяжелой пищи на начальной стадии лечения следует отказаться.
Внимание! Одновременный прием Амоксициллина с антикоагулянтами вызывает нарушения свертываемости крови. В этом случае показана регулярная сдача коагулограммы.
Последствия
Ранняя диагностика отравления позволит избежать серьезных последствий. Если вовремя не принять меры по устранению симптомов интоксикации, увеличивается вероятность летального исхода. При передозировке Амоксициллином страдают:
Фото 2. Отёк Квинке у мужчины. В некоторых случаях может стать причиной удушья.
Важно! Чтобы лечение туберкулеза было продуктивным, необходимо выполнять назначенные врачом рекомендации.
Период выведения из организма, чем выводится, через какое время пропадают симптомы передозировки
При своевременном обращении к врачу, симптомы передозировки исчезают уже через 1—2 дня. Последствия острой интоксикации вылечить сложнее. Продолжительность терапии в каждом случае индивидуальна. Она зависит от того, какие патологии вызвала передозировка.
Полезное видео
Посмотрите видео, в котором подробно описывается препарат Амоксициллин, его основные свойства: показания, противопоказания, побочные действия, максимальная дозировка.
- игорь — Особенности лечения Амоксициллином: сколько дней принимать антибиотик, чтобы победить болезнь? 5
- Ирина — Инструкция по применению Канамицина: как не ошибиться с дозировкой 4
- Петя — Инструкция по применению Канамицина: как не ошибиться с дозировкой 4
- Гена — Антибиотик Амикацин: инструкция по применению, противопоказания и побочные эффекты 3
- Василий — Инструкция по применению Амикацина: как разводить уколы 6
Интернет-журнал о туберкулёзе, болезнях лёгких, анализах, диагностике, лекарствах и другой важной информации об этом.
Амоксициллин и алкоголь
Кратко о препарате
Амоксициллин назначается при состояниях, которые требуют быстрого реагирования, когда промедление может стоить человеку жизни.
Алкоголь и Амоксициллин: последствия
Особенность всех антибактериальных препаратов в том, что они создают дополнительную нагрузку на печень. Она как орган фильтрации защищает организм, перерабатывает вредные и опасные вещества. А их в лекарствах содержится немало.
- Ускоряет выведение антибиотика из организма, что снижает воздействие лекарства на микроорганизмы-возбудители заболевания.
- Провоцирует возникновение дисбактериоза, который, в свою очередь, препятствует всасыванию Амоксициллина в системе пищеварения.
Алкогольные напитки отрицательно влияют на деятельность мозга, потому что ухудшают его снабжение кислородом. Человек может это ощутить головокружением, тошнотой.
Врачи подчеркивают: чем старше человек, чем больше у него хронических недугов и патологий, тем опаснее совмещать прием Амоксициллина с горячительными напитками.
Что касается вопроса о том, когда после окончания лечения можно употреблять спиртное, то врачи рекомендуют это делать не раньше, чем через неделю. Соблюдение рекомендации поможет избежать повторного проявления болезни.
Лечение Амоксициллином дает хорошие результаты, если точно и строго следовать назначенной врачом схеме приема лекарства и не употреблять горячительные напитки. Это же совершенно несложно!
Заметили ошибку? Пожалуйста, выделите текст с ошибкой и нажмите Ctrl+Enter, чтобы сообщить об этом редакции.
Нередко можно услышать «рецепт» для поднятия артериального давления посредством употребления алкоголя. Так ли это.
Пресловутый «зеленый змий» – серьезный противник. Он способен превратить здоровых людей в инвалидов, разрушить нашу жизнь или.
Вы хотите бросить курить, но не знаете, как правильно это сделать или с чего начать? А, может, вы уже пробовали отказаться от.
Одной из наиболее частых зависимостей в настоящее время считается алкоголизм. Реакция на спиртные напитки всегда индивидуальна.
Копирование материалов только с указанием ссылки на ресурс.
Источник:
http://gepasoft.ru/skolko-vyvoditsja-amoksicillin-iz-organizma/
Нет рецепта — нет проблем? Чем опасно самолечение антибиотиками :: Здоровье :: РБК Стиль
© Joshua Coleman/Unsplash
Автор
Ульяна Смирнова
03 июня 2019
Pink рассказывает о том, почему нельзя заниматься самолечением и принимать антибиотики без предварительной консультации с врачом.
Антибиотики предназначены для борьбы с опасными бактериальными инфекциями. Несмотря на это, многие до сих пор используют их, чтобы избавиться от кашля, простуды и гриппа. В этом случае антибиотики наносят лишь вред и без того ослабленному организму. Опросы показывают: почти половина россиян не знает об основной функции антибиотиков и принимает их без консультации с врачом. Рассказываем о том, почему не стоит этого делать.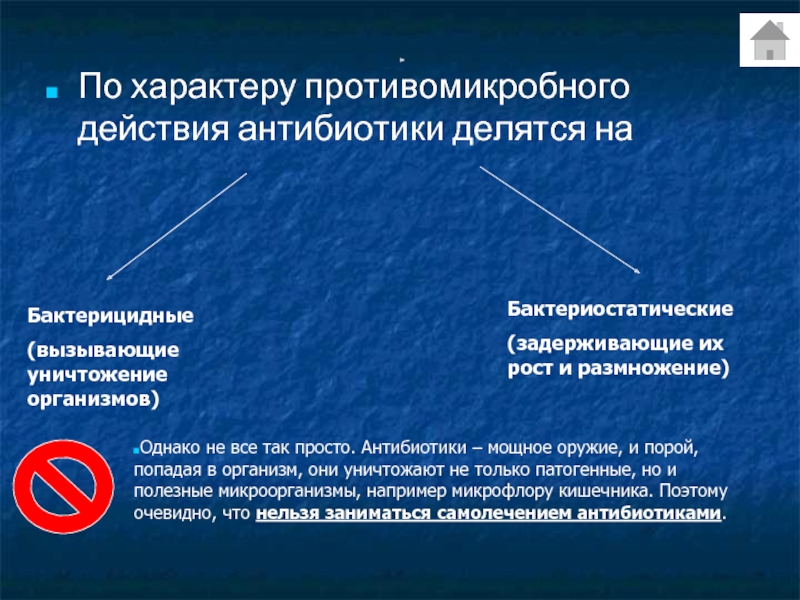
Легкодоступные антибиотики
В странах Западной Европы и США купить антибиотики без консультации со специалистом нельзя. Их назначают только при наличии строгих показаний и продают исключительно по рецепту врача. В России, несмотря на действующий запрет, даже сильные противомикробные препараты можно приобрести практически в любой аптеке. Хотя такая практика незаконна, контролировать ее очень сложно. По данным опросов, антибиотики хранятся в аптечке у 41% россиян, а треть населения страны активно практикует самолечение.
Прием антибиотиков связан со множеством нюансов, которые необходимо учитывать. Именно поэтому так важно обращаться к специалисту. Даже если доктор уже назначал вам антибиотики, не стоит принимать тот же препарат при аналогичных симптомах в следующий раз. Скорее всего, вам потребуется новое лекарство и другая доза. Не зная наверняка, какой возбудитель стал причиной плохого самочувствия, принимать антибиотики нельзя. Самолечение и бесконтрольное использование таких лекарств может спровоцировать различные осложнения.
Если у вас остались таблетки из прошлой упаковки, утилизируйте их вместе с мусором. Не смывайте антибиотики в раковину или унитаз — это вредно для окружающей среды. В США ненужные лекарства сдают в специальные пункты приема. В России подобная практика отсутствует. Специалисты советуют извлечь таблетки из блистеров, измельчить до состояния порошка и смешать с землей или наполнителем для кошачьего туалета. Перед утилизацией поместите смесь в стеклянную банку и плотно закройте крышкой.
© Tbel Abuseridze/Unsplash
Антибиотики не панацея. Бактерии учатся защищаться
Не спешите пить антибиотики при первых признаках недомогания. Согласно опросам, 46% россиян уверены, что антибиотики убивают вирусы так же хорошо, как и бактерии. Их используют для лечения заложенности носа, кашля, бронхита, простуды и гриппа. Это распространенное заблуждение. В действительности антибиотики не приносят пользы в борьбе с вирусами, их действие направлено только на бактерии. Врач определит, действительно ли вам нужны антибиотики. Если нет, он порекомендует противовирусное лечение: много питья, покой и витамины, поддерживающие организм.
Их используют для лечения заложенности носа, кашля, бронхита, простуды и гриппа. Это распространенное заблуждение. В действительности антибиотики не приносят пользы в борьбе с вирусами, их действие направлено только на бактерии. Врач определит, действительно ли вам нужны антибиотики. Если нет, он порекомендует противовирусное лечение: много питья, покой и витамины, поддерживающие организм.
Главная опасность антибиотикотерапии — бактериальная резистентность. Так называют устойчивость микроорганизмов к антибиотикам. Бактерии быстро приспосабливаются к неблагоприятным условиям и вырабатывают новые свойства, которые защищают их от лекарств. Другими словами, антибиотик может не подействовать тогда, когда будет действительно необходим. Более того, некоторые бактерии могут передавать ген устойчивости собратьям. В результате болезнь становится опаснее, лечение — дороже, а организм тратит больше времени на восстановление.
Было подсчитано, что антибиотики увеличили продолжительность человеческой жизни в среднем на 20 лет. Сегодня медицинские ассоциации активно борются с безответственным приемом противомикробных лекарств. Мы не производим нужное количество новых антибиотиков, а имеющиеся используем нерационально, считают представители ВОЗ. В результате уже сейчас не всегда удается победить инфекции с помощью антибиотиков, которые раньше помогали. По оценкам английских экспертов, из-за устойчивых бактерий в Европе ежегодно умирают около 25 тыс. человек.
© Lucas Vasques/Unsplash
Что не убивает бактерии, делает их сильнее
Микроорганизмы, которые не боятся антибиотиков, появляются в том числе из-за неправильного приема лекарств. Это еще одна причина, по которой нужно обращаться к врачу. Он определит длительность лечения, подберет подходящую суточную дозу и подробно расскажет о схеме приема препарата. Чтобы антибиотик работал правильно, нужно соблюдать все рекомендации врача. Некоторые препараты пьют всегда в одно и то же время, другие — до, после или во время еды. Принимайте антибиотики по часам, чтобы поддерживать необходимую концентрацию препарата в крови.
Чтобы антибиотик работал правильно, нужно соблюдать все рекомендации врача. Некоторые препараты пьют всегда в одно и то же время, другие — до, после или во время еды. Принимайте антибиотики по часам, чтобы поддерживать необходимую концентрацию препарата в крови.
Очень важно не прерывать курс лечения, даже если появились улучшения. Симптомы болезни могут пройти, но это не значит, что бактерии уничтожены. Если принимать антибиотики в течение слишком короткого времени или в недостаточных дозах, оставшиеся микробы могут привести к возобновлению болезни. При этом они будут менее восприимчивы к антибиотику, а ген устойчивости перейдет к следующему поколению микробов. Таким образом, человек станет переносчиком бактерий «с иммунитетом», которые могут передаваться при тесном контакте.
Неприятные побочные эффекты
Выбор правильного антибиотика зависит не только от диагноза, но и от ваших индивидуальных противопоказаний. Важная задача доктора — наблюдение за возможными побочными реакциями. Например, некоторые антибиотики в 10–15% случаев дают осложнения на печень. Кроме того, они убивают не только болезнетворные микробы, но и полезные бактерии. Поэтому их прием иногда сопровождается аллергией, тошнотой, расстройством кишечника и желудка. Опытный врач подберет оптимальный препарат, который поможет устранить неприятные симптомы и избежать осложнений.
Противомикробные препараты могут взаимодействовать с другими лекарствами, поэтому очень важно заранее предупредить врача об их приеме. Например, одни антибиотики снижают лечебный эффект препаратов, которые разжижают кровь или нормализуют кислотность желудка, другие — ослабляют действие контрацептивов. Кроме того, на время приема антибактериальных препаратов рекомендуется отказаться от фруктовых соков, молочных продуктов, сладкой газировки и алкоголя. Входящие в их состав вещества снижают всасывание и ослабляют действие антибиотиков.
© Simone Van Der Koelen/Unsplash
Если врач не прав
Антибиотики — дефицитный ресурс. Несмотря на это, сами врачи иногда злоупотребляют их назначением. Четверть всех антибиотиков прописывают необоснованно, уверены американские исследователи. Чаще всего это происходит из-за давления со стороны пациентов, которые просят лекарство «посильнее». В некоторых случаях медики назначают сильнодействующие препараты для «перестраховки». Обязательно уточните у доктора, с какой целью и для лечения какого заболевания он назначил вам антибиотики. Приобретайте лекарства только в надежных местах. По оценке ВОЗ, антибиотики считаются самыми популярными препаратами для подделок.
Несмотря на это, сами врачи иногда злоупотребляют их назначением. Четверть всех антибиотиков прописывают необоснованно, уверены американские исследователи. Чаще всего это происходит из-за давления со стороны пациентов, которые просят лекарство «посильнее». В некоторых случаях медики назначают сильнодействующие препараты для «перестраховки». Обязательно уточните у доктора, с какой целью и для лечения какого заболевания он назначил вам антибиотики. Приобретайте лекарства только в надежных местах. По оценке ВОЗ, антибиотики считаются самыми популярными препаратами для подделок.
чего опасаться – новости и статьи в регионе Нижегородская область – АптекаМос
25 ноября 2015
Злоупотребление антибиотиками может оказать как вредное, так и бесполезное действие, если пациент не будет принимать их строго по указанию лечащего доктора. Это главное правило, о котором должен помнить пациент, чтобы ускорить выздоровление и избежать побочных эффектов.
Что это за лекарство?
Антибиотиками называют лекарственные препараты, способные избавить от различных видов микробов (бактерицидные антибиотики), а также прерывающие их размножение (бактериостатические антибиотики).
Своим появлением они обязаны британскому бактериологу Александру Флемингу, который выделил пенициллин из плесневелых грибов Penicillium notatum в 1928 году. Благодаря открытию пенициллина появилась возможность победить многие заболевания, которые ранее не поддавались лечению. Небольшая доза обычного пенициллина в течение суток снижала высокую температуру и возвращала человеку жизнь. Но шло время, и дозировка антибиотиков увеличилась во много раз, что в результате сильно повлияло на исход лечения.
Антибиотикорезистентность
Появление и применение антибиотиков не прошло бесследно для микроорганизмов, которые пройдя естественный отбор, научились приспосабливаться к лекарственным препаратам.
Это явление стали называть антибиотикорезистентностью – сопротивляемость микробов по отношению к антибиотикам.
В наши дни проблема антибиотикорезистентности стала основной в области применения антибиотиков, поскольку их использование привело к появлению устойчивых микробов, более агрессивных и опасных, не поддающихся лечению.
В связи с этим химики и фармацевты не стоят на месте, а создают новые формы антибиотиков, чтобы быть во всеоружии против возбудителей инфекционных заболеваний. Сегодня на помощь врачам приходят:
- Антибиотики с избирательным действием на определенные штаммы микробов.
- Средства короткого и пролонгированного действия.
- Препараты с накопительным эффектом в определенных органах.
- Лекарства местного и общего действия.
Современные антибиотики призваны бороться с инфекцией, но, если применять их не по назначению, способны причинить огромный вред здоровью из-за побочных действий.
Разрабатывается новое поколение антибиотиков, способное не только подавлять бактерии, но и защищать иммунитет. Прием подобных препаратов не требует дополнительного применения антигистаминных (противоаллергенных), противогрибковых средств и пробиотиков, учитывая, что соблюдается режим правильного питания и точное следование врачебным рекомендациям.
В чем вред
Бесспорно при осложненных формах того или иного заболевания, когда без антибиотика не обойтись, необходим курс, но строго по предписанию врача. Однако, если можно этого избежать, лучше не подвергать свой организм их воздействию.
Антибиотики, полученные из плесени, могут уничтожить огромное количество бактерий. Среди них и множество полезных, например, палочки коли (E. coli), которые несут ответственность за полноценное существование и функционирование всего организма.
Палочки коли способны нейтрализовать кислород, который скапливается в просвете толстой кишки и подавляет жизнедеятельность бифидо- и лакто-бактерий. Благодаря палочкам коли, вырабатываются витамины группы В. Эти полезные бактерии помогают обмену холина, холестерина и билирубина, положительно воздействуют на процесс всасывания микроэлементов (кальция и железа).
Благодаря палочкам коли, вырабатываются витамины группы В. Эти полезные бактерии помогают обмену холина, холестерина и билирубина, положительно воздействуют на процесс всасывания микроэлементов (кальция и железа).
Антибиотики уничтожают полностью эти жизненно важные бактерии, провоцируя дисбактериоз и ослабляя иммунную систему. Сбои в работе кишечника и подорванный иммунитет являются главными причинами снижения деятельности почти всех систем в организме.
- Видимый негативный след отражается, в первую очередь, на состоянии кожи, волос и ногтей.
- Антибиотик – по своей сути гриб, бессистемный прием которого приводит к образованию в организме кандидоза (грибок, вызывающий молочницу).
- Антибиотики создают дополнительную нагрузку на печень, которой приходится работать в усиленном режиме и очищать кровь от медикаментов и продуктов распада гибнущих бактерий.
- Антибиотики не следует употреблять совместно с адсорбентами (Маалокс, активированный уголь, Альмагель). Последние заметно снижают эффективность воздействия антибиотиков.
- Препараты, разжижающие кровь, несовместимы с антибиотиками, поскольку повышается риск возникновения кровотечений.
- Прием нескольких антибиотиков также наносит сильный вред, поэтому такая терапия возможна исключительно под контролем врача.
Рекомендация: выждав 2 часа после приема антибиотиков, следует принять лекарственные препараты бифидо-бактерий и лакто-бактерий. Этот шаг даст организму возможность сохранить здоровую микрофлору и избежать дисбактериоза.
Важно – антибиотики и алкоголь:
- Совместный прием антибиотиков и алкоголя также наносит существенный удар по печени, параллельно ослабляя необходимое воздействие препарата и отравляя печень токсинами.
- Спиртные напитки в сочетании с препаратами, содержащими метронидазол и тетрациклин, часто являются виновниками тошноты и рвоты.
Антибиотики: можно и нельзя
Практически во всех случаях лечение антибиотиками назначает врач. Исключение – это удаленность от цивилизации и отсутствие квалифицированной медицинской помощи, но в этом случае нужно быть готовым к возможным осложнениям.
Исключение – это удаленность от цивилизации и отсутствие квалифицированной медицинской помощи, но в этом случае нужно быть готовым к возможным осложнениям.
Итак, антибиотикотерапия показана:
- Для лечения бактериальных заболеваний, например, при типичной пневмонии, ангине, цистите, пиелонефрите, мастите, гнойных заболеваниях кожи.
- Для профилактики бактериальных инфекций в редких случаях: после оперативных вмешательств, травм, осложненных родов, при вирусных заболеваниях у ослабленных больных, при химиотерапии в онкологии и т.д.
Эффективность антибактериального лечения зависит от правильности выбора препарата и дозы.
Внимание!
- Не рекомендуется принимать препарат, если после начала приема в течение 2-3 суток не наступило улучшения. Об этом необходимо сообщить врачу для замены антибиотика.
- Запрещается самостоятельное прекращение приема лекарства. Это грозит развитием осложнений и переходом заболевания в хроническую форму.
- При ухудшении состояния, появлении кожной сыпи, отечности, диареи и других негативных реакций срочно сообщить врачу.
- Поставить доктора в известность, если тот же самый препарат применялся 3-4 месяца назад.
- Не использовать антибиотики по истечении срока годности.
- Сопутствующие лекарства при назначении антибиотика может порекомендовать только лечащий врач.
Не рекомендуется принимать антибиотики без назначения врача при:
- Вирусных заболеваниях (ОРВИ, ОРЗ и гриппе): они не оказывают на них действия.
- При расстройствах кишечника.
- Для снижения температуры.
- Во время беременности и кормления грудью: многие препараты токсичны в этот период.
Распространенные заблуждения
- Препараты следует принимать не менее 7-10 дней. В каждом конкретном случае дозировку и продолжительность приема подбирает доктор.

- Если препарат уже помог, то поможет снова. Данное утверждение верно тогда, когда патогенный микроорганизм еще чувствителен к антибиотику, поскольку бактерии умеют приспосабливаться. Таким образом, при похожих симптомах болезни один тот же препарат может столкнуться с абсолютно разными возбудителями. В результате пользы от лечения не будет.
Источник: Лупанина Ольга, журналист
Чрезмерное использование антибиотиков: к чему это может привести
К сожалению, часто антибиотики используются чрезмерно, не по назначению не только больными при самолечении, но и — увы — врачами. Наверное, вам приходилось сталкиваться с назначением антибиотиков при симптомах простуды, гриппа и ОРЗ.
Между тем, использование антибиотиков не поможет при вирусной инфекции, их действие направлено на бактерии. Симптомы вирусных и бактериальных инфекций частично пересекаются, поэтому диагностика может быть затруднена. Считается, что некоторые отиты, тяжелые синуситы, ангина, воспаления мочевого тракта, раневые и кожные воспаления взывают бактерии, а вирусы ответственны за простуды, грипп, большую часть отитов, острые респираторные заболевания, бронхиты, вирусный гастроэнтерит, называемый в обиходе желудочным или кишечным гриппом.
Если часто использовать антибиотики не по назначению, они становятся неэффективными, потому что с течением времени бактерии, присутствующие в организме, мутируют, и развивается резистентный, т.е. устойчивый к воздействию антибиотика штамм. То же самое происходит при неправильном использовании препарата, когда пациент не доводит курс до конца, почувствовав улучшение на второй-третий день приема. Антибиотик очистил организм от инфекции не полностью, и оставшиеся бактерии мутируют вышеописанным образом. Человек становится носителем такой резистентной инфекции, распространяет ее, но заболевшим не помогают антибиотики первого поколения, и риск осложнений или даже летального исхода повышается. Ирония ситуации заключается в том, что будучи революционным прорывом в борьбе с инфекциями, антибиотики становятся творцами новых инфекций, для которых требуются новые, еще более сильные антибиотики. Такой замкнутый круг предвидел Александр Флеминг, открывший в 1928 году первый антибиотик — пенициллин. В своих лекциях он неоднократно предостерегал от применения этих сильных лекарственных препаратов без точно установленного диагноза.
Ирония ситуации заключается в том, что будучи революционным прорывом в борьбе с инфекциями, антибиотики становятся творцами новых инфекций, для которых требуются новые, еще более сильные антибиотики. Такой замкнутый круг предвидел Александр Флеминг, открывший в 1928 году первый антибиотик — пенициллин. В своих лекциях он неоднократно предостерегал от применения этих сильных лекарственных препаратов без точно установленного диагноза.
Однако развитие штаммов бактерий с высокой устойчивостью — не единственное неприятное последствие чрезмерного применения антибиотиков. Другим весьма распространенным осложнением антибиотикотерапии является дисбактериоз. Антибиотики широкого спектра действия (амоксициллин, доксициклин, левомицетин и др.) очень эффективны против целого ряда инфекций, но они убивают и полезную микрофлору кишечника, от которой зависит работа нашего желудочно-кишечного тракта, наш иммунитет и все обменные процессы нашего организма. Не случайно в современной медицинской литературе кишечник называют вторым мозгом: его роль в функционировании всех органов и систем, включая центральную нервную, трудно переоценить. И это еще одна серьезная причина не назначать антибиотики без диагноза, определенно указывающего на их абсолютную необходимость.
Первые симптомы дисбактериоза — это диарея или запор (нередко перемежающиеся), избыток газообразования в кишечнике и вздутие живота. В отсутствии полезной флоры в кишечнике развиваются патогенные бактерии и дрожжи, вызывающие гнилостные и бродильные процессы. При этом у больного начинается тяга к сладкому и мучному, потому что патогены требуют пищи, а питаются они сахарами и крахмалами. Постепенно появляются и другие симптомы, настолько серьезные, что кишечные проблемы кажутся на их фоне мелкими неприятностями. Нередко пациент обращается к невропатологу, жалуясь на хроническую усталость, мигрени, депрессии, не связывая их со своими кишечными расстройствами. Его иммунная система ослаблена, он страдает от частых простуд, против которых ему опять же, весьма вероятно, пропишут антибиотики. Вот мы и оказались в очередном порочном круге.
Вот мы и оказались в очередном порочном круге.
Но и это еще не все.
Вот совсем свежие новости. Доктор Мартин Блэйзер, профессор микробиологии Медицинского Центра Лангон Нью-Йоркского Университета, в своей статье, опубликованной в августовском номере журнала Nature выдвигает неожиданную гипотезу. Он считает, что изменение микрофлоры человеческого организма в результате чрезмерного использования антибиотиков влечет за собой не только аллергии, синдром раздраженного кишечника, астму и гастроэзофагеальный рефлюкс, но и является причиной ожирения. Но самое главное, по его мнению, не все микроорганизмы, которые мы привыкли рассматривать как патогены, являются исключительно болезнетворными агентами.
Кишечник человека — это среда обитания миллиардов бактерий, но многое ли нам известно об этой скрытой от нас экосистеме?
Возьмем Хелибактер пилори, известный возбудитель хронического гастрита, язвы, а возможно и рака желудка. Многие врачи, обнаружив эти бактерии в желудочно-кишечном тракте больного, тут же прописывают антибиотики, даже если в данный момент пациент не жалуется на симптомы этих заболеваний. Доктор Блейзер считает, что если Хелибактер живет в организме человека десятки тысяч лет, то для такого симбиоза должны быть серьезные причины. Его лаборатория провела целый ряд исследований, из которых следует, что после избавления от бактерий Хелибактер желудок ведет себя совершенно иначе.
После еды уровень грелина, гормона голода, секретируемого желудком, должен упасть. На удивление, у пациентов, избавившихся от Хелибактер, уровень грелина в крови после принятия пищи оставался стабильным и, таким образом, подавал мозгу сигнал продолжать есть. Более того, мыши в эксперименте Блейзера после доз антибиотиков, сравнимых с теми, что дают детям при отитах и ангинах (которые вполне достаточны для того, чтобы убить все Хелибактер пилори не у одного пациента), дали прибавку в весе даже без изменения диеты. И в самом деле, фермеры давно начали давать антибиотики скоту, разводимому на мясо, именно потому, что заметили, что они способствуют прибавке веса без увеличения потребления калорий.
Результаты экспериментов Блейзера увязываются с теми фактами, которые выявили Питер Турнбау, генетик из Гарвардского университета и доктор Джеффри Гордон, гастроэнтеролог из Вашингтонского Университета. Они обнаружили, что соотношения различных видов бактерий в кишечниках как мышей, так и людей, страдающих от ожирения, значительно отличались от соответствующих показателей контрольной группы, соответственно мышей и людей с нормальной массой тела. Изменение баланса различных бактерий в микрофлоре кишечника в результате использования антибиотиков, по мнению исследователей, повышает для пациента риск ожирения.
Эпидемиолог из Нью-Йоркского Университета Ю Чен установил обратную корреляцию между наличием Хелибактер пилори в желудочно-кишечном тракте и такими заболеваниями, как астма, сенная лихорадка, кожные аллергические реакции. Уничтожение этих бактерий повышает риск развития таких заболеваний, как гастральный рефлюкс, который и сам по себе связан с астмой и эзофагитом.
Доктор Барри Маршалл, профессор клинической биологии в Университете Западной Австралии в Перте, получивший в 2005 году Нобелевскую премию по медицине за открытие бактерий Хелибактер пилори и их роли в развитии гастрита и язвенной болезни отреагировал на новости вполне спокойно. «Я пока что никого не убил, давая своим пациентам антибиотики против Хелибактер пилори, зато известно немало случаев, когда в отсутствие антибиотиков Хелибактер убивали людей», — сказал он. При этом он согласился с тем, что в развитых странах антибиотики используются чрезмерно и даже предположил, что в будущем детоксифицированный штамм Хелибактер пилори можно будет использовать для лечения пациентов от астмы и от ожирения.
Работа Мартина Блейзера признана исключительно важной Национальным Институтом здоровья США, который выделил ему грант на продолжение исследований роли симбиоза человеческого организма с различными микроорганизмами. Результаты этого исследования могут совершить новую революцию в медицине.
- Ну а пока что попробуем сформулировать несколько правил использования антибиотиков.
- Прежде всего, не прописывайте антибиотик себе и своим близким сами на основании того, что кому-то из знакомых это лекарство помогло в аналогичной ситуации. Похожие симптомы могут иметь место при различных инфекциях, и только врач правильно подберет соответствующий препарат.
- Обязательно попросите врача сообщить вам ваш диагноз. Поинтересуйтесь, возможно ли подтвердить его с помощью анализов или других исследований, и в случае положительного ответа, постарайтесь пройти эти исследования.
- Если врач прописывает антибиотик, спросите, насколько важно начать прием немедленно, нельзя ли подождать и посмотреть, справляется ли ваш организм с инфекцией самостоятельно. Разумеется, есть случаи, в которых промедление может вызвать серьезные осложнения, порой, связанные с риском для жизни, и антибиотикотерапия является абсолютно необходимой мерой.
- Если вы страдаете аллергиями или иными хроническими заболеваниями, не забудьте сообщить об этом врачу. Подбирая антибиотик, врач должен также знать и о тех лекарствах, которые вы принимаете регулярно, например, гипотензивные или противосудорожные препараты, что бы учесть взаимодействие принимаемых одновременно лекарственных средств.
- Если после последнего принятого вами курса антибиотиков прошло не больше года, сообщите врачу об этом, назовите антибиотик, который вы принимали, а также от чего именно он был прописан. Нередко антибиотики прописывает стоматолог, далеко не всегда интересуясь тем, что и с какой целью вы принимали до этого.
- Всегда доводите курс до конца. Традиционный курс антибиотиков длится 7 – 10 дней. Не так давно появилась практика однократного — трехкратного применение высоких доз. В любом случае нужно строго соблюдать дозировку и длительность курса, указанные врачом.В западной популярной медицинской литературе содержится рекомендация выбрасывать в мусорное ведро оставшиеся от курса таблетки, чтобы ни у вас, ни у других членов семьи не возникло искушение воспользоваться ими в будущем без указания врача. Вполне разумный совет, и выполнить его легко, если лекарство оплачено государством или страховой компанией. Увы, нам чаще всего приходится платить из своего кармана, препараты отнюдь не дешевы, а эластичность бюджета у большинства из нас оставляет желать лучшего. Поэтому просто имейте в виду, что принимать это лекарство в будущем по собственному почину без указания врача не стоит, что возвращает нас к первому правилу.
Если вы приняли курс антибиотиков, то стоит позаботиться о том, чтобы восстановить полезную флору кишечника с помощью биопрепаратов (пробиотиков). Попросите своего врача подобрать вам пробиотик и назначить курс.
Следуя этим рекомендациям, вы не только сохраните здоровье себе и своим близким, но и поможете предотвратить появление новых инфекций, устойчивых к лекарственным препаратам.
Источниками этой статьи послужили следующие материалы:
Steven Dowshen, MD “Antibiotic Overuse”.
Kate Murphy, “The Hypothesis: Overuse of antibiotics increases the risk of obesity”. October 31, 2011 http://www.nytimes.com/2011/11/01/health/scientist-examines-possible-link-between-antibiotics-and-obesity.html?_r=1
Dr. David Dowson “Dysbiosis”.
Бактериофаги
БАКТЕРИОФАГИ КАК АЛЬТЕРНАТИВА АНТИБИОТИКАМ В ЛЕЧЕНИИ ИНФЕКЦИЙ
Бактериофаги — вирусы бактерий, естественные микроорганизмы, которые, размножаясь внутри бактериальной клетки, ведут к ее быстрой гибели.
Из истории открытия
В 1896 году английский бактериолог Э. Ханкин, исследуя антибактериальное действие воды индийских рек, пришел к выводу о существовании агента, проходящего через бактериальные фильтры и вызывающего лизис холерных вибрионов. Российский микробиолог Н. Ф. Гамалея в 1897 году наблюдал лизис бацилл сибирской язвы. Однако первой научной публикацией о фагах стала статья английского микробиолога Ф. Туорта, в которой он в 1915 году описал инфекционное поражение стафилококков, значительно изменявшее морфологию колоний. В 1917 году канадский бактериолог Ф. Д’Эрелль независимо от Туорта сообщил об открытии вируса, «пожирающего» бактерии — бактериофага.
Интересный факт: при нанесении бактериофага на влажные слизистые он за 20 минут очищает их от определенного вида бактерий, например от стафилококка. Так быстро не работает ни один антибиотик.
Действие бактериофагов отличается от действия антибиотиков:
- Для определенного вида бактерий существует свой определенный бактериофаг. Но стоит отметить, что не ко всем бактериям есть бактериофаги (это основной недостаток этих препаратов). Для решения вопроса, какую терапию выбрать для лечения инфекции, врач должен сначала взять материал для посева на флору с точным определением вида возбудителя и только после получения анализа на чувствительность микроорганизма к бактериофагам выбрать препарат.
- Бактериофаги не действуют на нормофлору (нормальные бактерии), поэтому лечение бактериофагами экологично и не требует коррекции нормофлоры.
- Бактериофаги не влияют на организм человека, поскольку не способны проникнуть в клетки человека. Поэтому бактериофаги не токсичны и не вызывают побочных эффектов.
- После уничтожения патогена элиминируются (самовыводятся) из организма.
- Бактериофаги просты в применении: большинство их производится в жидком виде. Доступно наружное орошение при местном применении, полоскании, в виде микроклизм при кишечных инфекциях. Но действуют бактериофаги только местно, то есть именно там, где вы их применяете при полоскании, орошении и закапывании. В отличие от антибиотиков, которые при приеме внутрь распределяются по организму и действуют во всех органах и тканях.
- Бактериофаги стимулируют местный иммунитет, так как частицы уничтоженных бактерий побуждают иммунную систему к выработке специфических антител. Из-за этого свойства бактериофаги являются препаратом выбора в лечении бактерионосительства (например, стафилококконосительства) и хронических форм бактериальных инфекций.
- Сочетаются с другими препаратами, в том числе с антибиотиками. Их совместное применение ведет к быстрому выздоровлению от бактериальной инфекции.
- По совокупности описанных свойств бактериофаги применимы как основной препарат для лечения бактериальных инфекций у беременных, детей с рождения и людей пожилого возраста, а также в тех случаях, когда имеется полирезистентность микроорганизма к антибиотикам.
В лаборатории KDL предлагается 2 варианта посевов на флору с определением чувствительности выделенной культуры микроорганизма к препаратам бактериофагов и разным наборам антибиотиков в зависимости от ситуации пациента (выбирает врач), например:
Посев на микрофлору отделяемого урогенитального тракта женщины с определением чувствительности к основному спектру антибиотиков и бактериофагам, в т.ч. Кандида
Посев на микрофлору отделяемого урогенитального тракта женщины с определением чувствительности к расширенному спектру антибиотиков и бактериофагам, в т.ч. Кандида
Какие инфекции можно лечить бактериофагами:
- кожные, ожоговые и раневые инфекции;
- инфекции ЛОР органов;
- инфекции урогенитального тракта;
- отдельные инфекции желудочно-кишечного тракта.
Возбудителями этих инфекций могут быть такие бактерии, как золотистый стафилококк, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, стрептококки.
В Новосибирском научном центре технологии персонализированного лечения бактериофагами в большой коллекции бактериофагов есть уникальные штаммы, способные бороться с недавно появившимися и уже получившими широкое распространение возбудителями больничных инфекций, такими как грамотрицательные бактерии Acinetobacter baumanii, Stenotrophomonas maltophilia и др.
Последние годы ознаменовались широкими исследованиями бактериофагов из-за нарастающей проблемы антибиотикорезистентности микроорганизмов, которые находят всё новые применения не только в терапии и профилактике, но и в биотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
Поделиться статьей:
Остались вопросы?
Самолечение – опасно для жизни и здоровья!
Без назначения врача, нельзя пить лекарственные препараты, выписываемые по рецепту!
Как повысить ответственность за свое здоровье?
Помните, что только врач может назначать антибактериальные препараты!
Как «работают» антибиотики?
По механизму своего действия антибактериальные препараты делятся на две огромные группы: антибиотики бактерицидные и антибиотики бактериостатические. Бактерицидные убивают микроб, а бактериостатические нарушают цикл его развития, препятствуя дальнейшему размножению микроба.
В каких случаях без антибиотиков не обойтись, а в каких они бесполезны?
Не обойтись без антибактериальных препаратов в случаях бактериальной инфекции. Существует две основные группы инфекций: вирусные и бактериальные. (Есть еще и другие варианты – грибковые, протозойные инфекции и т.д.). При вирусных инфекциях антибиотики не показаны, при бактериальных инфекциях – обязательны. Например, грипп – это вирусная инфекция, и назначение антибиотиков при гриппе не показано. А острый тонзиллит (ангина) – бактериальная инфекция, и назначение антибиотика обязательно. Следует отметить, что основная масса инфекций у нас все-таки вирусные. Но, несмотря на это, по статистике на постсоветском пространстве излишнее назначение антибиотиков составляет примерно 60%, во всем мире – около 40%.
Как отличить вирус от бактерии?
Это задача врача. Антибиотик нужно принимать только тогда, когда есть четко доказанная бактериальная инфекция: либо клинически, например, врач видит гнойный отит, острый тонзиллит, и когда антибиотик принимается сразу и безоговорочно, либо есть лабораторные подтверждения: изменения в общем анализе крови, определенные показатели в биохимическом анализе крови, высев микроба из бактериального очага, а также эпидемиологические показания.
Чем опасен бесконтрольный прием антибиотиков?
Опасен не только бесконтрольный, но и неправильный прием антибиотиков. Бесконтрольный прием – это самостоятельное назначение антибактериальной терапии, без консультации врача. Неправильный прием – то есть неправильный по дозировке, кратности приема и длительности курса.
Как бесконтрольный, так и неправильный приемы чреваты одними и теми же последствиями: выработкой устойчивых форм. С течением времени бактерии приспосабливаются к условиям окружающей среды и к применяемым антибактериальным препаратам. В результате неправильного приема антибиотиков бактерии не разрушаются полностью, и со временем у них вырабатываются определенные ферменты, которые разрушают антибиотик.
Важно понимать: если доза препарата меньше необходимой, то он не поможет. Если кратность приема меньше необходимой, то он не поможет. Если длительность курса меньше необходимой, то он не поможет. Назначили принимать препараты семь дней, значит семь дней, а не три и не шесть. Антибиотик должен окончательно исполнить свою роль, в противном случае выжившие бактерии постепенно формируют механизмы устойчивости, и в один прекрасный день антибактериальные препараты перестанут на них действовать.
Чем это чревато? Тем, что на сегодняшний день очень серьезно стоит вопрос о том, что в ближайшие пару десятков лет мы можем остаться без «работающих» антибиотиков.
Бытует мнение, что минимальный курс приема антибиотиков составляет пять дней, так ли это?
На этот вопрос нельзя дать однозначного ответа, потому что существуют разные группы антибактериальных препаратов. Есть препараты, которые вводятся один раз в месяц, есть препараты, которые нужно принимать три, четырнадцать, двадцать один день. Все индивидуально, и назначение делает врач.
Влияют ли антибактериальные препараты на желудочно-кишечный тракт и нужно ли с этим бороться?
Подобные страхи появились тогда, когда в широкое распространение попали полусинтетические пенициллины в таблетированных формах, и их стали принимать все подряд при любых заболеваниях. Эти препараты действительно вызывали нарушения кишечной микрофлоры, дисбиотические процессы, микозы (грибковые поражения).
Сегодня при неосложненной бактериальной инфекции, при не очень длительном курсе приема (не более 10 суток) у детей старше года, как правило, не бывает ярко выраженных дисбиотических явлений.
Важно знать, что одновременно с антибиотиками выживают только лактобактерии, поэтому если при антибактериальной терапии развились симптомы дисбиоза, то правильным будет сначала завершить курс лечения и только потом пропить курс комплексных биопрепаратов.
В некоторых ситуациях, например, при приеме макролидных антибиотиков, наличие поноса вообще не говорит о наличии дисбиоза, так как сама химическая формула макролидных антибиотиков действует как слабительное. В таких ситуациях дисбиотические симптомы исчезают вместе с окончанием курса лечения.
Может ли антибиотик действовать симптоматически?
Антибиотик не действует на симптомы. Он делает только одно, убивает бактерии (если они есть). Он не снижает температуру, не воздействует на кашель, не уменьшает интоксикацию, не устраняет головную боль. Если бактерий нет, то антибиотик ничем не поможет.
Можно ли пить антибиотики для профилактики болезней?
Антибиотик не имеет профилактического эффекта. Более того, если как осложнение гриппа возникает бронхит или пневмония, а вы начали принимать антибиотик «на всякий случай» еще до того, как это осложнение началось, то процесс все равно разовьется, но микробы, которые его вызвали, будут уже нечувствительны к данному антибиотику.
Правила приема лекарств:
- Избегайте бесконтрольного приема серьезных препаратов (таких как антибиотики, гормональные препараты), а также биологически активных добавок и фитопрепаратов (особенно многокомпонентных).
- При применении рецептурных и безрецептурных препаратов внимательно читайте инструкцию и убедитесь, что вы не превышаете рекомендованную дозу.
- По возможности применяйте препарат коротким курсом. При длительном приеме препарата (более 10 дней) сдайте сдайте биохимический анализ крови.
- Составьте и всегда храните список всех рецептурных и безрецептурных препаратов, которые вы принимаете, включая травы, витамины и пищевые добавки. Всегда берите этот список с собой на каждый прием врача.
- Если препараты вам прописали разные врачи, попросите их перед назначением посмотреть, не совпадают ли их компоненты с составом принимаемых вами лекарств, иначе существует риск передозировки или изменения воздействия лекарственных средств на организм.
- Если вы страдаете заболеванием печени или почек, убедитесь, что, назначая вам новый препарат, ваш врач знает об этом. Желательно также проконсультироваться с гепатологом, нефрологом и гастроэнтерологом.
- Избегайте одновременного приема лекарств с алкоголем.
Чем запить таблетку?
Можно
Вода – самая подходящая жидкость для приема лекарств. Лучше, чтобы она была комнатной температуры, отфильтрованной или прокипяченной.
Минералка – допускается при приеме нестероидных противовоспалительных препаратов, аспирина, анальгина и других средств, раздражающих слизистую желудка. Правда, минеральная вода в этом случае должна быть щелочной.
Молоко – в некоторых случаях даже рекомендуется для запивания лекарств. Например, препараты калия и жирорастворимые витамины. Однако противоязвенные препараты, сердечные лекарства, препараты железа, ферменты и некоторые антибиотики запивать молоком нельзя.
Компоты и кисели – можно рекомендовать пациентам с гастритом и язвой: кисель обволакивает стенки желудка. Однако лечебное действие препарата тоже снижается. Запивать пилюлю компотом нежелательно – фруктовые кислоты могут изменять фармакологический эффект лекарств.
Нельзя
Соки – неподходящая жидкость для запивания лекарств. Особенно грейпфрутовый сок. В сочетании с сердечными, противоаллергическими, противовирусными средствами, а также антидепрессантами и антибиотиками он может вызвать тяжелые осложнения.
Чай – содержит танин – активное вещество, влияющее на скорость всасывания лекарств. Не рекомендуется запивать чаем таблетки «от сердца» и «от желудка», антибиотики.
Кофе – тонизирует и обладает сильным мочегонным эффектом. Если запить им лекарство, то можно вывести препарат из организма слишком быстро или же усилить его действие (такое возможно например, с болеутоляющими).
Алкоголь – категорически несовместим с лекарствами. Особенно опасно его сочетание с антидепрессантами, антибиотиками, анальгетиками и жаропонижающими.
Лечение антибиотиками детей: насколько это безобидно?
Сегодня в общественном сознании существует множество точек зрения, причем нередко взаимоисключающих друг друга, о том, что же такое антибиотики, когда и как их надо применять, и насколько они опасны для человека. При ответе на эти вопросы достаточно популярны две крайности. По одним утверждениям, антибиотики — это «вредная химия», они угнетают иммунитет, вызывают дисбактериоз — нарушения в соотношении микроорганизмов в кишечнике, поэтому принимать их нельзя, а бороться с инфекциями организм человека должен своими силами. Другая категория участников дискуссии — сторонники антибиотиков, не очень утруждая себя теоретизированием, в домашней аптечке держат 2–3 различных антибиотика, принимают их сами и «назначают» родственникам при первом же чихе.
Насколько оправданы обе позиции? Предположение о том, что истина лежит где-то посередине между крайними точками зрения, вполне разумно, но нуждается в некоторой конкретизации, поэтому поговорим об антибиотиках подробно.
О том, что человек живет в мире бактерий, стало известно давно. Многие микроорганизмы оказывают благотворное влияние на жизнедеятельность людей, но они же могут и нанести вред, особенно те, которые способны проникать внутрь организма. Сильный удар по болезнетворным бактериям способны нанести антибиотики.
Чтобы понять принцип действия антибиотиков, сначала надо увидеть механизм возникновения инфекционных заболеваний в человеческом организме, поэтому начнем разговор с вызывающих их микроорганизмов. Все инфекционные болезни вызываются микроорганизмами, существенно различающимися по выраженности своих болезнетворных свойств. Одни из них способны преодолевать защитные силы организма человека и вызывать крайне тяжелые, и даже смертельные, заболевания (возбудители чумы, менингитов и др.), с другими организм легко справляется без посторонней помощи (например, возбудители простудных заболеваний). В зависимости от внутренней организации микроорганизмы делят на группы: бактерии, грибки, вирусы и простейшие (амебы, лямблии и другие).
Антибиотики — это и есть противомикробные (антибактериальные) средства. На вирусы, простейших они не оказывают лечебного воздействия, на грибки воздействуют частично (и далеко не все виды из антибактериальных препаратов). Итак, антибиотиками врачи лечат воспаления, которые вызывают бактерии.
Если малыш переносит инфекцию мочеполовой системы, заболеет бронхитом или, хуже того, пневмонией, врач, вероятнее всего, назначит ему антибиотики. О том, зачем нужны эти лекарства, как быстро они расправляются с болезнью, и как стоит к ним относиться, пойдет речь в нашей статье.
По логике событий, после определения показаний для назначения антибактериальной терапии следует этап выбора препаратов. В настоящее время для медицинского применения в России разрешено около 50 различных антибактериальных препаратов. Вполне очевидно, что выбор правильного препарата для лечения отдельных заболеваний требует значительных профессиональных знаний:
- во-первых, о спектре действия каждого препарата;
- во-вторых, о наиболее вероятных возбудителях отдельных инфекционных болезней.
Но есть общие положения, которые необходимо знать и врачам, и родителям маленьких пациентов.
Что бы ни происходило с малышом, не давайте ему антибиотики без консультации с врачом-педиатром. Почему это так важно?
Речь пойдет о возможности развития нежелательных явлений после приема лекарства и об ограничениях или запрете на прием отдельных препаратов. Сразу же необходимо оговориться, что все запреты относительны, так как в критических ситуациях, при наличии реальной угрозы жизни, врач может назначить даже запрещенный для детей препарат.
Во-первых, начинать лечение нужно только после того, как будет поставлен точный диагноз болезни: дело в том, что антибиотики — это сложные, не универсальные и небезобидные лекарства. Кроме того, каждое средство действует только на те микробы, которые к нему чувствительны, именно поэтому выбором препарата должен заниматься врач. В противном случае болезнь может затянуться или неправильно подобранный антибиотик «затушует» ее признаки, и доктору будет трудно понять, с чем он имеет дело.
Во-вторых, врач должен установить, в каких дозах и как долго стоит принимать лекарство. Если, например, курс лечение прекратится раньше времени, возбудители болезни получат «передышку» и перестанут воспринимать препарат. В результате все придется начинать сначала.
В-третьих, существует проблема побочных реакций, которые вызывают некоторые антибиотики. В отношении новых препаратов, как правило, действуют ограничения на применение их у новорожденных детей и детей в возрасте до 2-6 месяцев. Подобные ограничения объясняются отсутствием опыта применения новых препаратов у детей младших возрастных групп и риском развития нежелательных эффектов, связанных с особенностями возрастной физиологии. В инструкциях к лекарствам в таких ситуациях просто указывают, что данных о безопасности препарата для детей младших возрастных групп нет. Врач должен самостоятельно оценить соотношение пользы и вероятного вреда при назначении препарата. В остальных случаях (не связанных с ранним детским возрастом) — к наиболее частым нежелательным явлениям относятся аллергические реакции (от сыпи на коже до анафилактического шока, и, в серьезных случаях, даже отек Квинке, во время которого возникает опасность удушья). Если с малышом произошло нечто подобное, позаботьтесь о том, чтобы он пил как можно больше жидкости (тогда лекарство быстрее выйдет из организма), дайте ему активированный уголь (или смекту) и антигистаминное средство — тавегил, супрастин, эриус, кларитин или зиртек и т. д. После включите виновный в происходящем антибиотик в «черный список» и больше никогда не давайте его малышу. Подобные реакции наиболее характерны для препаратов группы пенициллинов, на препараты других групп они возникают крайне редко. Иногда родители говорят, что у ребенка аллергия «на все». При тщательном анализе каждой конкретной ситуации практически всегда оказывается, что это не так. К наиболее серьезным нежелательным явлениям относятся специфические поражения органов и систем, развивающиеся под воздействием отдельных лекарств. Несмотря на то, что современные препараты на стадии разработки проходят крайне жесткий контроль, иногда способность вызывать такие поражения может выявиться только через несколько лет после начала применения препаратов. Именно поэтому к разрешенным для применения у детей младших возрастных групп (и беременных женщин) относятся только хорошо изученные в течение многих лет препараты.
В-четвертых, прием антибиотиков может закончиться нарушением микрофлоры кишечника. Дело в том, что, попав в желудочно-кишечный тракт, антибиотики «атакуют» и нормальную флору: бифидобактерии, лактобактерии и кишечную палочку, что в результате приводит к разным проблемам, например, дисбактериозу, расстройству стула и молочнице. Именно поэтому во время лечения антибиотиками и после него врачи рекомендуют маленьким пациентам биологические препараты, которые восстанавливают микрофлору кишечника. А после того, как он перестанет принимать антибиотики, — рекомендуют продолжать прием биологических препаратов (примадофилюс, бифидумбактерин, линекс, аципол и др.), которые защитят его от дисбактериоза.
Говоря об антибактериальной терапии, много споров, разногласий и вопросов возникает также на счет антибиотикорезистентности (устойчивости бактерий к антибиотикам).
Как формируется устойчивость микроорганизмов к антибиотикам?
Все живое, в том числе и бактерии быстро приспосабливаются к неблагоприятным условиям внешней среды. Выработка устойчивости к антибиотикам — один из наиболее ярких примеров такого приспособления. Можно утверждать, что рано или поздно любой вид бактерий сможет выработать устойчивость к любому антибактериальному препарату. Выработка устойчивости происходит тем быстрее, чем в большем объеме применяется данное вещество. По мере того, как бактерии вырабатывают устойчивость к антибиотикам, человечество вынуждено изобретать все новые препараты. Поэтому можно предположить, что если сегодня мы будем бесконтрольно назначать антибактериальные препараты всем детям, то завтра внуков нам лечить будет просто нечем. В ходе этой гонки в обществе возникают конфликты интересов. Общество, в целом, заинтересовано в сокращении затрат на антибактериальную терапию и соблюдении баланса между стоимостью и эффективностью лечения. Для достижения этой цели необходимо ограничить применение антибиотиков строгими показаниями, что позволит избежать излишних затрат на разработку и изготовление новых препаратов. Производители же антибиотиков наоборот заинтересованы в увеличении объема продаж (за счет расширения показаний), что неизбежно приведет к более быстрому распространению устойчивости микроорганизмов к лекарствам и, как следствие, необходимости разработки все новых и новых препаратов. К сожалению, массовое и неконтролируемое применение антибиотиков уже привело к широкому распространению устойчивости микроорганизмов к ним.
Поэтому для выбора препарата врачу необходимо знать, не только каким возбудителем вызвана инфекция, но и то, к какому препарату этот возбудитель чувствителен. Казалось бы, что эта проблема легко решается при проведении лабораторных исследований. Но, увы, при применении современных методов исследований ответ может быть получен лишь через 2-3 (а то и 5) суток. В большинстве случаев, лечение необходимо назначить в более быстрые сроки, для предотвращения возникновения возможных осложнений воспалительного процесса. Вследствие этого в реальной жизни антибиотики назначают эмпирически, т. е. на основании имеющегося практического опыта. Но даже самый блестящий врач не может самостоятельно накопить опыт по применению всех возможных антибиотиков и уверенно сказать, что препарат, А лучше чем препарат Б. К тому же необходимо учитывать насколько широко в конкретном географическом регионе среди бактерий распространена устойчивость к конкретному препарату. Врачу неизбежно приходится опираться на результаты специальных исследований, их критический анализ, мировой и национальный опыт, а также на рекомендации по стандартам лечения, разработанные экспертами.
Беглого взгляда на особенности антибактериальной терапии в приведенных выше примерах достаточно для выделения основных принципов антибактериальной терапии:
- быстрое назначение наиболее эффективных препаратов в тех случаях, когда их эффект доказан;
- максимальное сокращение применения антибиотиков во всех других случаях.
Итак, антибиотики, конечно же, могут вызывать вполне определенные нежелательные реакции. Но вдобавок к их истинным грехам иногда приходится слышать и явно незаслуженные обвинения. Достаточно часто не только в научно-популярных, но и в специальных статьях как о чем-то совершенно очевидном говорят о способности антибиотиков угнетать иммунитет. Подобные утверждения абсолютно ничем не подтверждены. Многочисленными исследованиями однозначно установлено, что ни один из разрешенных к применению в медицинской практике антибиотиков при использовании в лечебных дозах не угнетает систему иммунитета. Следующая крайне болезненная проблема: влияние антибиотиков на кишечную микрофлору и дисбактериоз. Здесь стоит сказать несколько слов по вопросу, выходящему за рамки темы настоящей статьи. Более или менее постоянный состав кишечной микрофлоры у ребенка формируется в течение первых 6-12 месяцев жизни, а иногда и дольше, в зависимости от вида вскармливания. В течение этого периода функция желудочно-кишечного тракта характеризуется нестабильностью и частыми нарушениями (боли, вздутия живота, понос), а видовой и количественный состав кишечной микрофлоры — более или менее выраженными отклонениями от средних значений. В самом общем виде описанные изменения состава микрофлоры называют дисбактериозом.
Однако до настоящего времени нет убедительных обоснований того, какие именно изменения в составе кишечной микрофлоры следует считать патологическими. Используемые критерии нормы и патологии являются сегодня произвольными, а необычайный общественный интерес к проблеме дисбактериоза не имеет под собой серьезных оснований. На фоне приема антибиотиков состав кишечной микрофлоры неизбежно меняется, более того, во время приема наиболее мощных антибактериальных средств (препаратов группы цефалоспоринов III — IV поколений, карбапенемов — имипенема или меропинема) на короткий срок можно даже стерилизовать кишечник. Наверное, это можно назвать дисбактериозом, но имеет ли это практическое значение? Если ребенка ничего не беспокоит, то абсолютно никакого. Если же у ребенка на фоне приема антибиотиков развился понос, то необходимо сопоставить тяжесть основного заболевания и потребность в антибактериальной терапии с выраженностью желудочно-кишечного расстройства. Придется либо терпеть и окончить курс лечения, либо отменить антибиотик до окончания поноса. После отмены антибактериального препарата практически всегда функция кишечника быстро нормализуется, но у самых маленьких детей процесс восстановления может затянуться. Основным методом коррекции должна быть оптимизация питания, возможен прием биопрепаратов, содержащих «полезные» лакто- и бифидобактерии (об этом уже упоминалось в статье, чуть выше), но ни в коем случае не следует пытаться исправить ситуацию назначением новых антибиотиков.
С концепцией дисбактериоза связано и представление о неизбежной активизации роста грибов, живущих в кишечнике и потенциально способных вызывать инфекционные заболевания при приеме антибиотиков. Например, на слизистой оболочке половых органов или на небных миндалинах может появиться легко снимающийся рыхлый налет, похожий на творог, при этом самочувствие человека ухудшается. Поэтому им необходимо иногда назначать профилактические курсы противогрибковых препаратов.
Подводя итог, хотелось бы сказать, что бояться надо не антибиотиков, а последствий их бездумного и неправильного применения. Антибиотик, назначенный грамотным врачом — это целенаправленное оружие против конкретной причины заболевания. В фармакологии мало подобных групп лекарств, которые так эффективно и быстро борются с болезнью.
Будьте здоровы!
Обзор антимикробной терапии | Безграничная микробиология
Происхождение противомикробных препаратов
Эпоха противомикробных препаратов начинается, когда Пастер и Жубер открывают, что один тип бактерий может предотвратить рост другого.
Цели обучения
Напомнить техническое определение антибиотиков
Основные выводы
Ключевые моменты
- Антибиотики – это только те вещества, которые производятся одним микроорганизмом, которые убивают или предотвращают рост другого микроорганизма.
- В современном обиходе термин «антибиотик» используется для обозначения практически любого лекарства, которое пытается избавить ваш организм от бактериальной инфекции.
- Открытие противомикробных препаратов, таких как пенициллин и тетрациклин, проложило путь к улучшению здоровья миллионов людей во всем мире.
Ключевые термины
- противомикробное средство : Средство, уничтожающее микробы, подавляющее их рост или предотвращающее или противодействующее их патогенному действию.
- пенициллин : любой из группы антибиотиков широкого спектра действия, полученных из плесневых грибов Penicillium или синтезированных; они имеют бета-лактамную структуру; большинство из них активны в отношении грамположительных бактерий и используются при лечении различных инфекций и заболеваний.
История противомикробных препаратов начинается с наблюдений Пастера и Коха, которые обнаружили, что один тип бактерий может препятствовать росту другого. В то время они не знали, что причина того, что одна бактерия не может расти, заключалась в том, что другая бактерия вырабатывала антибиотик. Технически антибиотики – это только те вещества, которые производятся одним микроорганизмом, которые убивают или предотвращают рост другого микроорганизма.
Александр Флеминг : В 1928 году Александр Флеминг наблюдал антибиотик против бактерий, вызываемый грибком рода Penicillium, и предположил, что этот эффект опосредован антибактериальным соединением, пенициллином, и что его антибактериальные свойства могут быть использованы для химиотерапии.
Открытие Александром Флемингом таких противомикробных препаратов, как пенициллин и тетрациклин, проложило путь к улучшению здоровья миллионов людей во всем мире. До того, как в начале 1940-х годов пенициллин стал эффективным лекарством, не существовало настоящего лекарства от гонореи, ангины или пневмонии. Пациентам с инфицированными ранами часто приходилось удалять раненую конечность, или им грозила смерть от инфекции. Теперь большинство этих инфекций можно легко вылечить коротким курсом противомикробных препаратов.
Термин «антибиотик» впервые был использован в 1942 году Селманом Ваксманом и его сотрудниками в журнальных статьях для описания любого вещества, продуцируемого микроорганизмом, которое антагонистично росту других микроорганизмов в высоком разведении.Это определение исключало вещества, которые убивают бактерии, но не производятся микроорганизмами (например, желудочный сок и перекись водорода). Также исключены синтетические антибактериальные соединения, такие как сульфаниламиды. Многие антибактериальные соединения представляют собой относительно небольшие молекулы с молекулярной массой менее 2000 атомных единиц массы. С развитием медицинской химии большинство современных антибактериальных средств химически представляют собой полусинтетические модификации различных природных соединений.
Открытие антибиотиков
Наблюдения за антибиотиками между микроорганизмами привели к открытию естественных антибактериальных средств, продуцируемых микроорганизмами.
Цели обучения
Опишите понятие «антибиоз» и вклад различных ученых, открывших его.
Основные выводы
Ключевые моменты
- До начала 20 века лечение инфекций основывалось в основном на медицинском фольклоре.
- Луи Пастер заметил: «Если бы мы могли вмешаться в антагонизм, наблюдаемый между некоторыми бактериями, это, возможно, возложило бы самые большие надежды на терапию».
- Термин «антибиоз», означающий «против жизни», был введен французским бактериологом Вюйлеменом как описательное название явления, проявляемого этими ранними антибактериальными препаратами.
Ключевые термины
- микроорганизм : микроорганизм (от греческого: μ, mikrós, «маленький» и ὀ, организм – s, «организм»; также пишется микроорганизм, микроорганизм или микроорганизм) или микроб – это микроскопический организм, который включает либо одиночная клетка (одноклеточная), либо скопления клеток, либо многоклеточные относительно сложные организмы.
- химиотерапия : любое химическое лечение, предназначенное для лечения болезненного состояния.
- инфекция : неконтролируемый рост вредных микроорганизмов в организме хозяина.
До начала 20 -го века методы лечения инфекций основывались в основном на медицинском фольклоре. Смеси с антимикробными свойствами, которые использовались для лечения инфекций, были описаны более 2000 лет назад. Многие древние культуры, в том числе древние египтяне и древние греки, использовали специально подобранные плесневые и растительные материалы и экстракты для лечения инфекций.Более поздние лабораторные наблюдения антибиотиков между микроорганизмами привели к открытию естественных антибактериальных средств, продуцируемых микроорганизмами.
Луи Пастер заметил: «Если бы мы могли вмешаться в антагонизм, наблюдаемый между некоторыми бактериями, это, возможно, возложило бы самые большие надежды на терапию». Термин «антибиотик», означающий «против жизни», был введен французским бактериологом Вюйлеменом как описательное название явления, проявляемого этими ранними антибактериальными препаратами.Впервые антибиотик был описан в 1877 году у бактерий, когда Луи Пастер и Роберт Кох обнаружили, что воздушно-капельная палочка может подавлять рост Bacillus anthracis. Эти препараты были позже переименованы в антибиотики американским микробиологом Селманом Ваксманом в 1942 году.
Луи Пастер : Луи Пастер был французским микробиологом и химиком, наиболее известным своими экспериментами, подтверждающими теорию микробов о болезни, и своими вакцинами, в первую очередь первой вакциной против бешенства.
Джон Тиндалл впервые описал антагонистическую активность грибов против бактерий в Англии в 1875 году. Химиотерапия синтетическими антибиотиками как наука и разработка антибактериальных препаратов началась в Германии с Полом Эрлихом в конце 1880-х годов. Эрлих отметил, что одни красители окрашивают клетки человека, животных или бактерий, а другие – нет. Затем он предложил идею создания химических веществ, которые действовали бы как селективное лекарство, которое могло бы связываться с бактериями и убивать их, не причиняя вреда человеческому хозяину.Проведя скрининг сотен красителей против различных организмов, он обнаружил лечебно-полезный препарат, синтетический антибактериальный сальварсан, который теперь называется арсфенамин. В 1895 году Винченцо Тиберио, врач Неаполитанского университета, обнаружил, что плесень (Penicillium) в колодце с водой обладает антибактериальным действием. После того, как это первоначальное химиотерапевтическое соединение оказалось эффективным, другие исследователи продолжили аналогичные исследования, но только в 1928 году Александр Флеминг обнаружил антибиотик против бактерий, вызываемый грибами рода Penicillium.Флеминг постулировал, что эффект был опосредован антибактериальным соединением под названием пенициллин, и что его антибактериальные свойства могут быть использованы для химиотерапии. Первоначально он охарактеризовал некоторые из его биологических свойств, но не стал заниматься его дальнейшим развитием.
Антибиотики и избирательная токсичность
Антибиотики способны избирательно воздействовать на определенные типы бактерий, не нанося вреда инфицированному хозяину.
Цели обучения
Опишите избирательную токсичность
Основные выводы
Ключевые моменты
- Их механизм действия, химическая структура или спектр действия – это способы классификации антибиотиков.
- Антибиотики широкого спектра действия воздействуют на широкий спектр бактерий, в то время как антибиотики узкого спектра действия способны воздействовать на определенные типы.
- Антибиотики должны пройти процесс скрининга, в ходе которого они выделяются, культивируются, а затем тестируются на производство диффундирующих продуктов, подавляющих рост определенных тест-организмов.
- Из-за потенциальных побочных эффектов антибиотики также необходимо проверять на их избирательную токсичность.
Ключевые термины
- антибактериальный : Лекарственное средство, убивающее или подавляющее бактерии.
- бактерицидный : Средство, убивающее бактерии.
- бактериостатический : Препарат, предотвращающий рост и размножение бактерий, но не обязательно убивающий их. Когда его удаляют из окружающей среды, бактерии снова начинают расти.
Избирательная токсичность антибиотиков
Химиотерапия синтетическими антибиотиками как наука и разработка антибактериальных средств началась в Германии с Полом Эрлихом в конце 1880-х годов. Эрлих отметил, что одни красители окрашивают клетки человека, животных или бактерий, а другие – нет.Затем он предложил идею создания химических веществ, которые действовали бы как селективное лекарство, которое могло бы связываться с бактериями и убивать их, не причиняя вреда человеческому хозяину. Проведя скрининг сотен красителей против различных организмов, он обнаружил лечебно-полезный препарат, синтетический антибактериальный сальварсан, который теперь называется арсфенамин.
Антибиотики обычно классифицируются на основе их механизма действия, химической структуры или спектра действия. Более конкретно, антибиотики узкого спектра действия нацелены на определенные типы бактерий, такие как грамотрицательные или грамположительные бактерии, тогда как антибиотики широкого спектра действия влияют на широкий спектр бактерий.После 40-летнего перерыва в открытии новых классов антибактериальных соединений в клиническую практику были введены три новых класса антибактериальных антибиотиков: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид).
Бактериальные культуры : При производстве антибактериальных средств микроорганизмы необходимо изолировать, культивировать и тестировать на ингибирование роста организмов-мишеней и на их избирательную токсичность.
Некоторые антибактериальные препараты вызывают ряд побочных эффектов.Побочные эффекты варьируются от легких до очень серьезных в зависимости от используемых антибиотиков, целевых микробных организмов и конкретного пациента. Профили безопасности новых лекарств часто не так хорошо установлены, как для тех, которые давно используются. Побочные эффекты варьируются от лихорадки и тошноты до серьезных аллергических реакций, включая фотодерматит и анафилаксию. Общие побочные эффекты включают диарею, возникающую в результате нарушения видового состава кишечной флоры, что приводит, например, к чрезмерному росту патогенных бактерий, таких как Clostridium difficile .Антибактериальные препараты также могут влиять на флору влагалища и могут привести к чрезмерному росту дрожжевых грибов рода Candida в вульвовагинальной области. Дополнительные побочные эффекты могут возникать в результате взаимодействия с другими лекарствами, например, повышенный риск повреждения сухожилий при введении хинолонового антибиотика с системным кортикостероидом.
Производство антибактериальных средств
Несмотря на широкий спектр известных антибиотиков, менее 1% противомикробных агентов имеют медицинскую или коммерческую ценность.Например, в то время как пенициллин имеет высокий терапевтический индекс, поскольку он обычно не влияет на клетки человека, для многих антибиотиков это не так. Другие антибиотики просто не имеют преимуществ перед уже применяемыми или не имеют другого практического применения. Полезные антибиотики часто обнаруживаются в процессе скрининга. Для проведения такого скрининга изоляты многих различных микроорганизмов культивируются, а затем тестируются на получение диффундирующих продуктов, которые подавляют рост тестируемых организмов. Большинство антибиотиков, выявленных при таком скрининге, уже известны, и поэтому их нельзя принимать во внимание.Остальные должны быть проверены на их избирательную токсичность и терапевтическую активность, а лучшие кандидаты могут быть исследованы и, возможно, модифицированы. Более современная версия этого подхода – программа рационального проектирования. Это включает в себя скрининг, направленный на поиск новых натуральных продуктов, которые ингибируют конкретную мишень, например фермент, обнаруживаемый только в целевом патогене, а не тесты, демонстрирующие общее ингибирование культуры.
Спектр антимикробной активности
Спектр антибиотиков может быть широким или узким.
Цели обучения
Сравните антибиотики узкого и широкого спектра действия
Основные выводы
Ключевые моменты
- Антибиотики широкого спектра действия действуют против более широкой группы бактерий.
- Антибиотики узкого спектра нацелены на специфические бактерии, такие как грамположительные или грамотрицательные.
- Три новых класса антибактериальных антибиотиков введены в клиническое использование: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид).
Ключевые термины
- Окрашивание по Граму : метод дифференциации видов бактерий на две большие группы (грамположительные и грамотрицательные).
- Антибиотик узкого спектра действия : Тип антибиотика, который нацелен на определенные типы грамположительных или грамотрицательных бактерий.
- антибиотик широкого спектра действия : Тип антибиотика, который может поражать широкий спектр бактерий.
Спектр бактерий, на которые воздействует антибиотик, можно разделить на узкий и широкий спектр.Антибиотики узкого спектра действия действуют против ограниченной группы бактерий, грамположительных или грамотрицательных, например фузидат натрия действует только против стафилококковых бактерий. Широкий спектр действия – антибиотики действуют против грамположительных и грамотрицательных бактерий, например амоксициллина.
Окрашивание по Граму (или метод Грама; это метод разделения видов бактерий на две большие группы (грамположительные и грамотрицательные). Он основан на химических и физических свойствах их клеточных стенок.В первую очередь, он обнаруживает пептидогликан, который присутствует в толстом слое у грамположительных бактерий. Грамположительный результат дает пурпурный / синий цвет, а грамотрицательный – розовый / красный цвет. Окрашивание по Граму почти всегда является первым шагом в идентификации бактериального организма и является окрашиванием по умолчанию, выполняемым лабораториями над образцом, когда не указывается конкретная культура. Хотя окрашивание по Граму является ценным диагностическим инструментом как в клинических, так и в исследовательских целях, не все бактерии могут быть окончательно классифицированы с помощью этого метода, таким образом, образуя группы грамм-переменных и грамм-неопределенных групп.
Окраска по Граму : Это микроскопическое изображение окрашивания по Граму смешанных грамположительных кокков ( Staphylococcus aureus , фиолетовый) и грамотрицательных бацилл ( Escherichia coli , красный).
Антибиотик широкого спектра действия действует как против грамположительных, так и грамотрицательных бактерий, в отличие от антибиотика узкого спектра действия, который эффективен против определенных семейств бактерий. Примером широко применяемого антибиотика широкого спектра действия является ампициллин.Антибиотики широкого спектра действия должным образом используются в следующих медицинских ситуациях: эмпирически (т. Е. На основе опыта практикующего врача), до формальной идентификации бактерий-возбудителей и когда существует широкий спектр возможных заболеваний и потенциально серьезное заболевание. результат, если лечение откладывается. Это происходит, например, при менингите, когда пациент может смертельно заболеть в течение нескольких часов, если не начать лечение антибиотиками широкого спектра действия. Антибиотики широкого спектра действия также используются для лекарственно-устойчивых бактерий, которые не реагируют на другие антибиотики более узкого спектра действия, а также в случае суперинфекций, когда существует несколько типов бактерий, вызывающих заболевание, что требует применения либо антибиотика широкого спектра действия, либо комбинированной антибиотикотерапии. .
После 40-летнего перерыва в открытии новых классов антибактериальных соединений в клиническое использование были введены три новых класса антибактериальных антибиотиков: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид). .
Классификация антибиотиков
Бактерицидные антибиотики убивают бактерии; бактериостатические антибиотики замедляют их рост или размножение.
Цели обучения
Сравните два класса антибиотиков: бактерицидные и бактериостатические антибиотики
Основные выводы
Ключевые моменты
- Бактерицидные антитела подавляют синтез клеточной стенки.
- Бактериостатические антибиотики ограничивают рост бактерий, препятствуя производству бактериального белка, репликации ДНК или другим аспектам метаболизма бактериальных клеток.
- Бактериостатические антибиотики должны работать вместе с иммунной системой, чтобы удалить микроорганизмы из организма.
Ключевые термины
- бактерицидный : Средство, убивающее бактерии.
- бактериостатический : Препарат, предотвращающий рост и размножение бактерий, но не обязательно убивающий их.Когда его удаляют из окружающей среды, бактерии снова начинают расти.
Антибиотики можно разделить на два класса по механизму действия. Бактерицидные антибиотики убивают бактерии; бактериостатические антибиотики подавляют их рост или размножение.
Одним из способов уничтожения бактерий бактерицидными антителами является подавление синтеза клеточной стенки. Примеры включают бета-лактамные антибиотики (производные пенициллина (пенамы), цефалоспорины (цефемы), монобактамы и карбапенемы) и ванкомицин.Другие способы, которыми бактерицидные антибиотики убивают бактерии, включают ингибирование бактериальных ферментов или трансляцию белка. Другие бактерицидные агенты включают даптомицин, фторхинолоны, метронидазол, нитрофурантоин, ко-тримоксазол и телитромицин. Аминогликозидные антибиотики обычно считаются бактерицидными, хотя они могут оказывать бактериостатическое действие на некоторые организмы. МБК (минимальная бактерицидная концентрация) – это минимальная концентрация лекарственного средства, которая может убить 99,99% населения.
Механизм ингибирования пенициллина : Пенициллин и большинство других β-лактамных антибиотиков действуют путем ингибирования пенициллин-связывающих белков, которые обычно катализируют сшивание стенок бактериальных клеток.
Бактериостатические антибиотики ограничивают рост бактерий, препятствуя производству бактериального белка, репликации ДНК или другим аспектам метаболизма бактериальных клеток. В эту группу входят: тетрациклины, сульфаниламиды, спектиномицин, триметоприм, хлорамфеникол, макролиды и линкозамиды. Они должны работать вместе с иммунной системой, чтобы удалить микроорганизмы из организма. Однако не всегда существует четкое различие между ними и бактерицидными антибиотиками. Некоторые бактериостатические агенты в высоких концентрациях также обладают бактерицидным действием.МИК (минимальная ингибирующая концентрация) – это минимальная концентрация лекарственного средства, которая может подавлять рост микроорганизма.
Структура тетрациклина : Тетрациклиновые антибиотики являются ингибиторами синтеза белка, ингибируя связывание аминоацил-тРНК с комплексом мРНК-рибосома. Они делают это главным образом за счет связывания с 30S субъединицей рибосомы в комплексе трансляции мРНК.
Дальнейшая категоризация основана на их целевой специфичности. Антибактериальные антибиотики «узкого спектра» нацелены на определенные типы бактерий, такие как грамотрицательные или грамположительные бактерии, тогда как антибиотики широкого спектра действия воздействуют на широкий спектр бактерий, обычно как грамположительные, так и грамотрицательные клетки.После 40-летнего перерыва в открытии новых классов антибактериальных соединений в клиническую практику были введены три новых класса антибактериальных антибиотиков: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид).
Aminoglycosides: A Practical Review – American Family Physician
UIS S. GONZALEZ III, PHARM.D., И JEANNE P. SPENCER, M.D., Мемориальный медицинский центр Conemaugh, Джонстаун, Пенсильвания
Am Fam Physician. 15 ноября 1998; 58 (8): 1811-1820.
Связанная редакционная
Аминогликозиды – сильнодействующие бактерицидные антибиотики, которые действуют путем создания трещин на внешней мембране бактериальной клетки. Они особенно активны против аэробных грамотрицательных бактерий и действуют синергетически против определенных грамположительных организмов. Гентамицин является наиболее часто используемым аминогликозидом, но амикацин может быть особенно эффективным против резистентных организмов.Аминогликозиды используются при лечении тяжелых инфекций брюшной полости и мочевыводящих путей, а также бактериемии и эндокардита. Они также используются для профилактики, особенно против эндокардита. Сопротивление встречается редко, но его частота увеличивается. Избегание длительного использования, уменьшения объема и одновременного приема других потенциально нефротоксичных агентов снижает риск токсичности. Однократное ежедневное введение аминогликозидов возможно из-за их быстрого уничтожения, зависящего от концентрации, и постантибиотического эффекта, а также имеет потенциал для снижения токсичности.Однократное ежедневное введение аминогликозидов оказалось безопасным, эффективным и экономичным. В определенных клинических ситуациях, таких как пациенты с эндокардитом или педиатрические пациенты, обычно все же рекомендуется традиционное многократное дозирование.
Первый аминогликозид, стрептомицин, был выделен из Streptomyces griseus в 1943 году. Неомицин, выделенный из Streptomyces fradiae, обладал большей активностью, чем стрептомицин, против аэробных грамотрицательных бактерий, но из-за его огромной токсичности не мог безопасно использоваться системно.Гентамицин, выделенный из Micromonospora в 1963 году, стал прорывом в лечении грамотрицательных бациллярных инфекций, в том числе вызванных синегнойной палочкой. Впоследствии были разработаны и другие аминогликозиды, в том числе амикацин (амикин), нетилмицин (нетромицин) и тобрамицин (небцин), которые в настоящее время доступны для системного применения в Соединенных Штатах.1
Цель данной статьи – предоставить семейным врачам возможность обзор аминогликозидов и их роли в лечении инфекционных заболеваний.Несмотря на появление новых, менее токсичных противомикробных средств, аминогликозиды продолжают играть полезную роль в лечении серьезных энтерококковых и грамотрицательных бактериальных инфекций.
Фармакология
Традиционно считалось, что антибактериальные свойства аминогликозидов являются результатом ингибирования синтеза бактериального белка за счет необратимого связывания с 30S бактериальной рибосомой. Это объяснение, однако, не учитывает сильные бактерицидные свойства этих агентов, поскольку другие антибиотики, подавляющие синтез белков (например, тетрациклин), не обладают бактерицидным действием.Недавние экспериментальные исследования показывают, что первоначальным местом действия является внешняя бактериальная мембрана. Катионные молекулы антибиотика создают трещины на внешней клеточной мембране, что приводит к утечке внутриклеточного содержимого и усилению поглощения антибиотика. Это быстрое действие на наружную мембрану, вероятно, объясняет большую часть бактерицидной активности. 2 Энергия необходима для поглощения аминогликозида бактериальной клеткой. У анаэробов меньше энергии для этого поглощения, поэтому аминогликозиды менее активны в отношении анаэробов.
Аминогликозиды плохо всасываются из желудочно-кишечного тракта. После парентерального введения аминогликозиды преимущественно распределяются во внеклеточной жидкости. Таким образом, наличие болезненных состояний или ятрогенных ситуаций, которые изменяют баланс жидкости, может потребовать изменения дозировки. При парентеральном применении адекватные концентрации лекарства обычно обнаруживаются в костях, синовиальной жидкости и перитонеальной жидкости. Проникновение через биологические мембраны слабое из-за полярной структуры препарата, а внутриклеточные концентрации обычно низкие, за исключением проксимального почечного канальца.Эндотрахеальное введение приводит к более высоким уровням в бронхах по сравнению с системным введением, но различия в клинических исходах не были последовательными.
После парентерального введения аминогликозида субтерапевтические концентрации обычно обнаруживаются в спинномозговой жидкости, стекловидном теле, предстательной железе и головном мозге.3,4 Аминогликозиды быстро выводятся за счет клубочковой фильтрации, в результате чего период полувыведения из плазмы колеблется от двух часов до пациенту с «нормальной» функцией почек от 30 до 60 часов у пациентов с функциональной анефрией.5 Период полувыведения аминогликозидов в коре почек составляет приблизительно 100 часов, поэтому повторное дозирование может привести к накоплению в почках и токсичности.
Клиническое применение
Аминогликозиды проявляют бактерицидное убивающее действие в зависимости от концентрации и активны против широкого спектра аэробных грамотрицательных бактерий. Они также активны в отношении стафилококков и некоторых микобактерий. Аминогликозиды эффективны даже при большом количестве бактериального инокулята, и в ходе лечения редко развивается резистентность.Эти сильнодействующие противомикробные препараты используются в качестве профилактики и лечения в различных клинических ситуациях5 (Таблица 1).
Просмотреть / распечатать таблицу
ТАБЛИЦА 1
Общие клинические применения аминогликозидов *
Серьезная, опасная для жизни грамотрицательная инфекция | |
Осложненная инфекция кожи, костей или мягких тканей 05 | |
Осложненная инфекция мочевыводящих путей | |
Септицемия | |
Перитонит и другие тяжелые внутрибрюшные инфекции | |
Тяжелая тазовая болезнь | |
Неонатальный сепсис | |
Глазные инфекции (местно) | |
Внешний отит (местный) | |
Осложненная инфекция кожи, костей или мягких тканей | |
Осложненная инфекция мочевыводящих путей | |
Септицемия | 905 |
Тяжелые воспалительные заболевания органов малого таза | |
Эндокардит | |
Mycobacterium инфекция | |
Наружный отит (местный) |
Гентамицин – это аминогликозид, который используется наиболее часто из-за его низкой стоимости и надежной активности против грамотрицательных аэробов.Однако местные образцы резистентности должны влиять на выбор терапии. Как правило, гентамицин, тобрамицин и амикацин используются в аналогичных обстоятельствах, часто взаимозаменяемо.4
Тобрамицин может быть аминогликозидом выбора для применения против P. aeruginosa, поскольку он показал большую активность in vitro. Тем не менее, клиническое значение этой активности было поставлено под сомнение1. Амикацин особенно эффективен при использовании против бактерий, устойчивых к другим аминогликозидам, поскольку его химическая структура делает его менее чувствительным к инактивирующим ферментам.4 В зависимости от местной структуры резистентности амикацин может быть предпочтительным агентом при серьезных внутрибольничных инфекциях, вызванных грамотрицательными бациллами. В таблице 2 указана стоимость различных антибиотиков, используемых для лечения грамотрицательных инфекций.
Просмотреть / распечатать таблицу
ТАБЛИЦА 2
Сравнение стоимости антибиотиков, используемых для лечения грамотрицательных инфекций
| Лекарство | Внутривенный режим | Стоимость * | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Amikacin (Amikacin) Amikacin | 1 г ежедневно | 65 $.00 | |||||||||||||||
Азтреонам (Azactam) | 1 г каждые 8 часов | 49,00 | |||||||||||||||
2 г каждые 8 часов | 658 ) | 1 г каждые 8 часов | 44,00 | ||||||||||||||
2 г каждые 8 часов | 86,50 | ||||||||||||||||
цефтриаксон 4 ( ) ежедневно | 72.50 | ||||||||||||||||
Цефотаксим (Клафоран) † | 1 г каждые 8 часов | 33,50 | |||||||||||||||
Ципрофлоксацин (Ципро) |
Стоимость 90 |
Стоимость Сравнение антибиотиков, используемых для лечения грамотрицательных инфекций
| Лекарство | Внутривенный режим | Стоимость * | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Амикацин (амикин) | $ ежедневно00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Азтреонам (Azactam) | 1 г каждые 8 часов | 49,00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2 г каждые 8 часов | 658 ) | 1 г каждые 8 часов | 44,00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2 г каждые 8 часов | 86,50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
цефтриаксон 4 ( ) ежедневно | 72.50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Цефотаксим (Клафоран) † | 1 г каждые 8 часов | 33,50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ципрофлоксацин (Ципро) |
Лекарственная устойчивость Наибольшая устойчивость к аминогликозидам вызвана инактивацией бактерий внутриклеточными ферментами. Из-за структурных различий амикацин не инактивируется обычными ферментами, инактивирующими гентамицин и тобрамицин. Следовательно, большая часть грамотрицательных аэробов, устойчивых к гентамицину и тобрамицину, чувствительна к амикацину.Кроме того, при более частом применении амикацина наблюдалась более низкая частота резистентности по сравнению с повышенным использованием гентамицина и тобрамицина5. P. aeruginosa может проявлять адаптивную резистентность к аминогликозидам. Это происходит, когда ранее восприимчивые группы населения становятся менее восприимчивыми к антибиотику в результате снижения внутриклеточных концентраций антибиотика. Это снижение может привести к колонизации, медленному клиническому ответу или отказу от антибиотика, несмотря на чувствительность при тестировании in vitro.6 Аминогликозиды часто сочетаются с бета-лактамными препаратами при лечении инфекции Staphylococcus aureus. Эта комбинация усиливает бактерицидную активность, тогда как монотерапия аминогликозидами может позволить устойчивым стафилококкам сохраняться во время терапии и вызывать клинический рецидив после отмены антибиотика.1 Инфекционный эндокардит, вызванный энтерококками с высоким уровнем устойчивости к аминогликозидам, становится все более распространенным. Все энтерококки обладают низкой устойчивостью к аминогликозидам из-за их анаэробного метаболизма.При лечении бактериального эндокардита бета-лактамный препарат также синергетически используется для облегчения проникновения аминогликозидов в клетку. Когда возникает резистентность высокого уровня, это обычно происходит из-за производства бактериями инактивирующих ферментов. Из-за увеличения частоты этой резистентности все энтерококки должны быть проверены на чувствительность к антибиотикам7. Как и все антибиотики, резистентность к аминогликозидам становится все более распространенной. Повторное использование аминогликозидов, особенно когда используется только один тип, приводит к увеличению числа случаев резистентности.8 Тем не менее, устойчивость к аминогликозидам требует длительных периодов воздействия или очень большого количества инокулятов организмов и встречается реже, чем к другим агентам, таким как цефалоспорины третьего поколения, которые также эффективны против грамотрицательных организмов.1 Лекарственные взаимодействия и побочные эффекты ЭффектыПоскольку организм не метаболизирует аминогликозиды, активность аминогликозидов не изменяется за счет индукции или ингибирования метаболических ферментов, таких как ферменты в системе цитохрома P450.Некоторые лекарства могут повышать риск почечной токсичности при использовании аминогликозидов (таблица 3). Просмотреть / распечатать таблицу ТАБЛИЦА 3 Факторы риска, предрасполагающие к нефротоксичности аминогликозидов
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


