Мальтофер инструкция по применению: показания, противопоказания, побочное действие – описание Maltofer р-р д/в/м введения 50 мг/1 мл: амп. 2 мл 5 шт. (19044)
Препарат вводят в/м.
Перед первым введением терапевтической дозы необходимо провести в/м тест: взрослым вводят от 1/4 до 1/2 дозы препарата (от 25 до 50 мг железа (0.5-1 мл)), детям с 4 месяцев – половину суточной дозы. При отсутствии побочных реакций в течение 15 мин после введения можно вводить оставшуюся часть начальной дозы препарата.
Во время инъекции необходимо обеспечить наличие средств для оказания неотложной помощи при развитии анафилактического шока.
Доза препарата рассчитывается индивидуально и адаптируется в соответствии с общим дефицитом железа по следующей формуле:
Общий дефицит железа (мг) = масса тела (кг) × (нормальный уровень Нb – уровень Нb больного) (г/л) × 0.24* + железо запасов (мг)
При массе тела менее 35 кг: нормальный Нb = 130 г/л, что соответствует депонированному железу = 15 мг/кг массы тела
При массе тела более 35 кг: нормальный уровень Нb = 150 г/л, что соответствует депонированному железу = 500 мг
* Фактор 0. 24 = 0.0034×0.07×1000 (содержание железа в гемоглобине = 0.34%/объем крови =7% от массы тела/фактор 1000 = перевод из г в мг)
24 = 0.0034×0.07×1000 (содержание железа в гемоглобине = 0.34%/объем крови =7% от массы тела/фактор 1000 = перевод из г в мг)
Общее количество ампул для введения = общий дефицит железа (мг)/100 мг.
| Масса тела (кг) | Общее количество ампул для введения | |||
| Нb 60 г/л | Нb 75 г/л | Нb 90 г/л | Нb 105 г/л | |
| 5 | 1.5 | 1.5 | 1.5 | 1 |
| 10 | 3 | 3 | 2.5 | 2 |
| 15 | 5 | 4.5 | 3.5 | 3 |
| 20 | 6.5 | 5.5 | 5 | 4 |
| 25 | 8 | 7 | 6 | 5.5 |
| 30 | 9.5 | 8.5 | 7.5 | 6.5 |
| 35 | 12.5 | 11.5 | 10 | 9 |
| 40 | 13.5 | 12 | 11 | 9.5 |
| 45 | 15 | 13 | 11. 5 5 | 10 |
| 50 | 16 | 14 | 12 | 10.5 |
| 55 | 17 | 15 | 13 | 11 |
| 60 | 18 | 16 | 13.5 | 11.5 |
| 65 | 19 | 16.5 | 14.5 | 12 |
| 70 | 20 | 17.5 | 15 | 12.5 |
| 75 | 21 | 18.5 | 16 | 13 |
| 80 | 22.5 | 19.5 | 16.5 | 13.5 |
| 85 | 23.5 | 20.5 | 17 | 14 |
| 90 | 24.5 | 21.5 | 18 | 14.5 |
Если необходимая доза превышает максимальную суточную дозу, то введение препарата должно быть дробным.
Взрослым назначают по 1 ампуле ежедневно (2.0 мл = 100 мг железа).
Для детей с 4 месяцев доза определяется в зависимости от массы тела.
Максимально допустимые суточные дозы:
| Дети с массой тела до 6 кг | 1/4 ампулы (0. 5 мл = 25 мг железа) 5 мл = 25 мг железа) |
| Дети с массой тела от 5 до 10 кг | 1/2 ампулы (1.0 мл = 50 мг железа) |
| Дети с массой тела от 10 до 45 кг | 1 ампула (2.0 мл = 100 мг железа) |
| Взрослые | 2 ампулы (4.0 мл = 200 мг железа) |
Если терапевтический ответ со стороны гематологических параметров отсутствует через 1-2 недели (например, увеличение уровня Нb примерно на 0.1 г/дл в день), то первоначальный диагноз следует пересмотреть. Общая доза препарата на курс лечения не должна превышать рассчитанное количество ампул.
Техника проведения инъекции
Техника инъекции имеет решающее значение. В результате неправильного введения препарата могут возникнуть болевые ощущения и окрашивание кожи в месте инъекции. Описанная ниже методика вентро-ягодичной инъекции рекомендована вместо общепринятой (в верхний наружный квадрант большой ягодичной мышцы).
Длина иглы должна быть не менее 5-6 см. Просвет иглы не должен быть широким. Для детей, а также для взрослых с небольшой массой тела, иглы должны быть короче и тоньше.
Для детей, а также для взрослых с небольшой массой тела, иглы должны быть короче и тоньше.
Инструменты дезинфицируются обычным методом.
В соответствии с рекомендациями Hochstetter, место инъекции определяется следующим образом: по линии позвоночного столба на уровне, соответствующем пояснично-подвздошному сочленению, зафиксировать точку А. Если больной лежит на правом боку, то следует расположить средний палец левой руки в точке А. Отставить указательный палец от среднего так, чтобы он находился под линией подвздошного гребня в точке B.
Треугольник, располагающийся между проксимальными фалангами, средним и указательным пальцами является местом инъекции.
Прежде чем ввести иглу, следует сдвинуть кожу примерно на 2 см для того, чтобы хорошо закрыть канал прокола после извлечения иглы. Это предотвращает проникновение введенного раствора в подкожные ткани и окрашивание кожи.
Расположить иглу вертикально по отношению к поверхности кожи, под большим углом к точке подвздошного сочленения, чем к точке бедренного сустава.
После инъекции медленно извлечь иглу и прижимать пальцем участок кожи, прилегающий к месту инъекции, примерно в течение 5 мин.
После инъекции пациенту необходимо подвигаться.
Популярные препараты повышают риск анемии и пневмонии
У популярных лекарств от изжоги обнаружились новые опасные побочные эффекты: как показали последние исследования, они мешают усвоению железа и способствуют развитию пневмонии у пожилых людей.
Изжога – ощущение жжения и даже боли за грудиной – появляется, когда кислое содержимое желудка забрасывается в пищевод. Врачи называют это состояние гастроэзофагеальным рефлюксом. Для борьбы с ним широко применяются средства из категории ингибиторов протонной помпы (ИПП). Эти препараты (омепразол, лансопразол, пантопразол и другие) подавляют синтез соляной кислоты в желудке. Их назначают миллионам людей по всему миру. Ещё больше народу покупает эти таблетки без всяких рецептов: во многих странах, в том числе в России, они находятся в свободной продаже.
Международная команда учёных, в которую вошли специалисты из Австралии и Нидерландов, провела исследование с участием 50 тыс. человек, принимавших ИПП на протяжении года. В итоге выяснилось, что у таких пациентов образовался дефицит железа в организме. По мнению исследователей, такое происходит из-за недостаточного количества кислоты, которая способствует усвоению этого микроэлемента.
Авторы изыскания предупреждают, что длительный приём лекарств от изжоги чреват развитием железодефицитной анемии, от которой страдают свыше 2 млрд человек во всём мире. Железо является важнейшим компонентом гемоглобина в крови. При его недостатке уровень гемоглобина снижается, что приводит к ухудшению самочувствия: появляются головокружение, «звёзды» в глазах, мигрени, учащённое сердцебиение, так называемый синдром беспокойных ног.
В свою очередь, британские учёные из Эксетерского университета заявили, что подобные препараты повышают риск смертельно опасного воспаления лёгких у пожилых людей. Такие выводы были получены при анализе историй болезни более 150 тыс. человек старше 60 лет, половина из которых принимали ИПП не менее года. По словам медиков, они способствуют развитию пневмонии, нейтрализуя желудочную кислоту, которая действует как эффективный барьер против инфекции. «Наше исследование в очередной раз подтверждает, что препараты для устранения изжоги не так безопасны, как считалось ранее, хотя они всё ещё остаются очень полезным классом лекарств для определённых групп пациентов», – говорит профессор Дэвид Мельцер.
Такие выводы были получены при анализе историй болезни более 150 тыс. человек старше 60 лет, половина из которых принимали ИПП не менее года. По словам медиков, они способствуют развитию пневмонии, нейтрализуя желудочную кислоту, которая действует как эффективный барьер против инфекции. «Наше исследование в очередной раз подтверждает, что препараты для устранения изжоги не так безопасны, как считалось ранее, хотя они всё ещё остаются очень полезным классом лекарств для определённых групп пациентов», – говорит профессор Дэвид Мельцер.
При этом исследователи подчёркивают, что люди не должны отказываться от назначенных им ИПП без консультации с лечащим врачом. Самостоятельное прекращение приёма может быть опасным, так как у некоторых пациентов эти лекарства предотвращают желудочные кровотечения.
Добавим, что ранее учёные уже связывали частое употребление популярных средств от изжоги с целым рядом серьёзных заболеваний (включая рак желудка, инфаркты, почечную недостаточность, депрессию и старческое слабоумие), а также с сокращением количества сперматозоидов у мужчин. По данным некоторых экспертов, до 85% людей, сидящих на этих таблетках, на самом деле в них не нуждаются.
По данным некоторых экспертов, до 85% людей, сидящих на этих таблетках, на самом деле в них не нуждаются.
Наталья Стукова, врач гастроэнтеролог-диетолог, кандидат медицинских наук, эксперт проекта «Культура здоровья»:
– Дискомфорт после еды, чувство жжения, вкус кислоты или горечи во рту – это все симптомы повышенной кислотности желудка, или изжоги. Сегодня нас призывают принимать препараты для устранения неприятных ощущений. Но зачем доводить до приёма лекарственных средств, если можно избежать изжоги вовсе? Главной причиной этих ощущений является неправильное питание: сократите количество шоколада, мятных леденцов и алкоголя в своём рационе. Не затягивайте живот облегающей одеждой и тугими поясами, дайте своему желудку работать спокойно, вне стресса и давления. Отдыхайте после еды, но не лёжа. Лучше этот час сидя почитать или составить список задач.
Допинг и марихуана как лекарства | Научные открытия и технические новинки из Германии | DW
Наверное, большинство наших слушателей, как и многие миллионы людей во всём мире, внимательно следили за ходом соревнований на 28-х летних Олимпийских играх в Афинах. К сожалению, нынешняя Олимпиада, как и все предыдущие, тоже не обошлась без допинговых скандалов. Эта проблема актуальна для любых спортивных соревнований, а уж для таких масштабных и престижных, как Олимпийские игры, – и подавно. Многие эксперты полагают, что состязания спортсменов постепенно вырождаются в состязания медиков и фармакологов – тех, которые разрабатывают новые стимуляторы, и тех, которые изобретают способы их обнаружения. Судя по всему, подобные опасения отнюдь не беспочвенны: чтобы в этом убедиться, достаточно взглянуть на сообщения информационных агентств. Только с момента официального открытия в Афинах олимпийской деревни до начала Игр как таковых, то есть ещё в ходе тренировок, в применении допинга были уличены 9 спортсменов. Ещё 12 атлетов Международный олимпийский комитет дисквалифицировал во время соревнований. Однако эксперты убеждены, что это – лишь верхушка айсберга: злоупотребляют допингом десятки и сотни атлетов, целые команды, а попадаются единицы.
К сожалению, нынешняя Олимпиада, как и все предыдущие, тоже не обошлась без допинговых скандалов. Эта проблема актуальна для любых спортивных соревнований, а уж для таких масштабных и престижных, как Олимпийские игры, – и подавно. Многие эксперты полагают, что состязания спортсменов постепенно вырождаются в состязания медиков и фармакологов – тех, которые разрабатывают новые стимуляторы, и тех, которые изобретают способы их обнаружения. Судя по всему, подобные опасения отнюдь не беспочвенны: чтобы в этом убедиться, достаточно взглянуть на сообщения информационных агентств. Только с момента официального открытия в Афинах олимпийской деревни до начала Игр как таковых, то есть ещё в ходе тренировок, в применении допинга были уличены 9 спортсменов. Ещё 12 атлетов Международный олимпийский комитет дисквалифицировал во время соревнований. Однако эксперты убеждены, что это – лишь верхушка айсберга: злоупотребляют допингом десятки и сотни атлетов, целые команды, а попадаются единицы.
Стоит ли говорить о том, что допинг не только дискредитирует, превращает в абсурд саму идею честного спортивного единоборства, но и подрывает здоровье спортсменов, калечит их – вплоть до случаев со смертельным исходом. Но это – тема отдельного разговора. А в нашем сегодняшнем выпуске журнала речь пойдёт, да простится мне такое выражение, о пользе допинговых средств, то есть о том, как те же самые препараты, с которыми отчаянно борются допинг-контролёры, помогают медикам лечить больных. В этом смысле весьма показательна история с гормоном эритропоэтином.
Но это – тема отдельного разговора. А в нашем сегодняшнем выпуске журнала речь пойдёт, да простится мне такое выражение, о пользе допинговых средств, то есть о том, как те же самые препараты, с которыми отчаянно борются допинг-контролёры, помогают медикам лечить больных. В этом смысле весьма показательна история с гормоном эритропоэтином.
Как известно, один из двух основных видов клеток крови – это красные кровяные тельца, или эритроциты. Их функция состоит, прежде всего, в переносе кислорода от лёгких к мышцам и прочим тканям и в транспортировке углекислого газа в обратном направлении. Этот процесс реализуется благодаря наличию в эритроцитах особого вещества – гемоглобина. Гемоглобин представляет собой соединение железосодержащего пигмента гема с белком глобином. Именно гемоглобин обладает уникальным свойством – обратимо соединяться с кислородом при прохождении крови через лёгкие и освобождаться от него при достижении кровью других тканей организма. Срок жизни циркулирующих красных кровяных клеток составляет в среднем 120 дней. У здорового человека в нормальном состоянии отмирание старых и образование новых эритроцитов сбалансировано. Однако в условиях кислородного голодания – например, высоко в горах, – организм включает пока ещё не до конца исследованный биохимический механизм, который заставляет определённые клетки в почках вырабатывать особый гормон – эритропоэтин. Этот гормон увеличивает скорость эритропоэза, то есть процесса образования эритроцитов из специальных кроветворных клеток костного мозга. Обычно эритроидная дифференцировка этих стволовых клеток и созревание эритроцита занимает около 12-ти суток.
У здорового человека в нормальном состоянии отмирание старых и образование новых эритроцитов сбалансировано. Однако в условиях кислородного голодания – например, высоко в горах, – организм включает пока ещё не до конца исследованный биохимический механизм, который заставляет определённые клетки в почках вырабатывать особый гормон – эритропоэтин. Этот гормон увеличивает скорость эритропоэза, то есть процесса образования эритроцитов из специальных кроветворных клеток костного мозга. Обычно эритроидная дифференцировка этих стволовых клеток и созревание эритроцита занимает около 12-ти суток.
О том, что снижение содержания кислорода в крови, вызванное подъёмом в горы, влияет на кроветворную деятельность организма, медики знали уже в 19-м веке. В 1906-м году была выдвинута гипотеза о существовании гормона эритропоэтина, но выделить его из мочи удалось лишь в 1977-м году. В 1984-м году, используя методы генной инженерии, учёные впервые смогли искусственно синтезировать эритропоэтин. Он представляет собой сложное белково-углеводное соединение – так называемый гликопротеин – и состоит из 166-ти аминокислот и 4-х сахаридов. Получают этот гормон посредством внедрения соответствующего человеческого гена в культуру клеток млекопитающих лабораторных животных – например, хомяков. С 1989-го года эритропоэтин впервые начал робко применяться в медицине и тогда же – но гораздо более решительно – в спорте в качестве допинга.
Получают этот гормон посредством внедрения соответствующего человеческого гена в культуру клеток млекопитающих лабораторных животных – например, хомяков. С 1989-го года эритропоэтин впервые начал робко применяться в медицине и тогда же – но гораздо более решительно – в спорте в качестве допинга.
То, что повышенное содержание эритроцитов в крови способствует росту выносливости спортсменов, известно давно. На этом основана классическая тренировка в горах: на протяжении двух-трёх недель атлета подвергают кислородному голоданию, в результате чего его организм начинает усиленно производить эритроциты. Однако обустройство тренировочного лагеря в высокогорье – дело долгое и дорогостоящее. Поэтому уже в начале 50-х годов начались опыты с переливанием спортсмену его собственной крови. Типичная схема выглядела примерно так: за месяц или два до начала соревнований у спортсмена брали с небольшим интервалом 2 порции крови по 400 миллилитров и замораживали их. Организм постепенно компенсировал кровопотерю, а за день-два до старта атлету вливали обратно его собственную ранее изъятую кровь. В результате уровень эритроцитов в организме оказывался искусственно повышенным. В условиях эксперимента такой трюк обеспечивал рост спортивных результатов на 10 процентов – особенно в тех видах спорта, которые требуют большой выносливости. Впрочем, применялся этот метод и на практике – например, некоторыми американскими велогонщиками на летней Олимпиаде 1984-го года в Лос-Анджелесе. Международный олимпийский комитет счёл такое переливание крови допингом и запретил его, хотя никаких методов, которые позволили бы уличить спортсмена в нарушении этого запрета, как не было тогда, так и нет до сих пор. Однако после того как был искусственно синтезирован гормон эритропоэтин, необходимость в сложных, дорогих и рискованных манипуляциях с кровью отпала. Лабораторные исследования показали, что инъекции этого гормона здоровым мужчинам на протяжении 6-ти недель дают такой же рост выносливости, как и описанный выше метод переливания крови. Правда, в 1990-м году МОК внёс и эритропоэтин в список запрещённых препаратов, но тестов, позволяющих обнаружить этот допинг, опять же предложено не было.
В результате уровень эритроцитов в организме оказывался искусственно повышенным. В условиях эксперимента такой трюк обеспечивал рост спортивных результатов на 10 процентов – особенно в тех видах спорта, которые требуют большой выносливости. Впрочем, применялся этот метод и на практике – например, некоторыми американскими велогонщиками на летней Олимпиаде 1984-го года в Лос-Анджелесе. Международный олимпийский комитет счёл такое переливание крови допингом и запретил его, хотя никаких методов, которые позволили бы уличить спортсмена в нарушении этого запрета, как не было тогда, так и нет до сих пор. Однако после того как был искусственно синтезирован гормон эритропоэтин, необходимость в сложных, дорогих и рискованных манипуляциях с кровью отпала. Лабораторные исследования показали, что инъекции этого гормона здоровым мужчинам на протяжении 6-ти недель дают такой же рост выносливости, как и описанный выше метод переливания крови. Правда, в 1990-м году МОК внёс и эритропоэтин в список запрещённых препаратов, но тестов, позволяющих обнаружить этот допинг, опять же предложено не было. А просто измерять концентрацию эритропоэтина в крови совершенно бессмысленно ввиду весьма значительных естественных колебаний этого показателя у одного и того же спортсмена, индивидуальных различий между спортсменами, а также быстрого распада гормона. Поэтому эритропоэтин стал применяться очень широко. Массовое распространение этого допинга привело, в частности, к тому, что самая престижная международная велогонка «Тур де Франс» в 1998-м году обернулась грандиозным, беспрецедентным скандалом, который сопровождался обысками, арестами спортсменов и тренеров, дисквалификациями, забастовками и так далее. Впрочем, и на следующий год, на велогонке «Жиро д’Италия», скандал, пусть и не такой громкий, повторился.
А просто измерять концентрацию эритропоэтина в крови совершенно бессмысленно ввиду весьма значительных естественных колебаний этого показателя у одного и того же спортсмена, индивидуальных различий между спортсменами, а также быстрого распада гормона. Поэтому эритропоэтин стал применяться очень широко. Массовое распространение этого допинга привело, в частности, к тому, что самая престижная международная велогонка «Тур де Франс» в 1998-м году обернулась грандиозным, беспрецедентным скандалом, который сопровождался обысками, арестами спортсменов и тренеров, дисквалификациями, забастовками и так далее. Впрочем, и на следующий год, на велогонке «Жиро д’Италия», скандал, пусть и не такой громкий, повторился.
Официально проверять на эритропоэтин спортсменов впервые начали лишь 4 года назад, на Олимпиаде в Сиднее, причём сразу двумя разными тестами – один на основе анализа мочи, другой – на основе анализа крови. В обоих тестах используется тот факт, что хотя искусственно синтезированный эритропоэтин по своей пептидной структуре идентичен натуральному, в углеводной составляющей небольшое отличие всё же существует и может быть обнаружено. Кроме того, федерации некоторых видов спорта сами ввели ограничения на концентрацию гемоглобина в крови спортсмена или на уровень гематокрита – так называется отношение суммарного объёма эритроцитов к объёму плазмы крови, в которой они содержатся. Спортсмены с показателем более 50-ти процентов и спортсменки с показателем более 47-ми процентов просто не допускаются к соревнованиям.
Кроме того, федерации некоторых видов спорта сами ввели ограничения на концентрацию гемоглобина в крови спортсмена или на уровень гематокрита – так называется отношение суммарного объёма эритроцитов к объёму плазмы крови, в которой они содержатся. Спортсмены с показателем более 50-ти процентов и спортсменки с показателем более 47-ми процентов просто не допускаются к соревнованиям.
В общем, вполне понятно, почему в сознании подавляющего большинства людей эритропоэтин прочно ассоциируется с запрещёнными препаратами и допинговыми скандалами. Между тем, как я уже упомянул, этот гормон используется и в медицине – главным образом, при терапии заболеваний, сопровождающихся анемией, то есть уменьшением количества эритроцитов и гемоглобина в крови пациента. Сюда относятся СПИД, онкологические заболевания, послеоперационные состояния и, прежде всего, хроническая почечная недостаточность. Здесь эритропоэтин давно признан обязательным компонентом длительной заместительной терапии. Однако совсем недавно немецкие медики обнаружили новые, весьма многообещающие свойства этого гормона. Профессор Герман Халлер (Hermann Haller), заведующий отделением нефрологии Высшей медицинской школы в Ганновере, говорит:
Профессор Герман Халлер (Hermann Haller), заведующий отделением нефрологии Высшей медицинской школы в Ганновере, говорит:
На основании имеющихся в нашем распоряжении экспериментальных данных, а также результатов первых клинических испытаний на людях, мы можем утверждать, что открыли новые свойства этого гормона – эритропоэтина. И мы полагаем, что в медицинском отношении они ничуть не менее важны, чем уже известные его свойства. Для пациентов, страдающих сердечно-сосудистыми заболеваниями, эритропоэтин, судя по всему, является если и не панацеей, то, во всяком случае, препаратом, оказывающим мощное защитное и терапевтическое действие.
Ясно, что на основе этих ранее неизвестных свойств эритропоэтина учёные постараются разработать новые концепции лечения некоторых категорий пациентов. Профессор Халлер поясняет, в каком направлении планируется вести эти исследования:
Что касается защиты и регенерации органов, то в последние годы мы узнали много нового о стволовых клетках. Согласно господствующему сегодня представлению, эти так называемые адультные стволовые клетки, содержащиеся в костном мозге всякого взрослого человека, могут с потоком крови устремиться к повреждённому органу и принять активное участие в его регенерации, то есть в восстановлении тканей. Так вот, нам удалось теперь обнаружить, что эритропоэтин оказывает воздействие на эти самые адультные стволовые клетки, раньше это не было известно. Выяснилось, что у пациентов, принимающих этот гормон, во-первых, увеличивается количество циркулирующих стволовых клеток, а во-вторых, способность к дифференцировке самих этих клеток повышается, они более эффективно регенерируют повреждённые ткани. Мы наблюдали это у пациентов, страдающих почечной недостаточностью в сочетании с сердечно-сосудистыми заболеваниями.
Согласно господствующему сегодня представлению, эти так называемые адультные стволовые клетки, содержащиеся в костном мозге всякого взрослого человека, могут с потоком крови устремиться к повреждённому органу и принять активное участие в его регенерации, то есть в восстановлении тканей. Так вот, нам удалось теперь обнаружить, что эритропоэтин оказывает воздействие на эти самые адультные стволовые клетки, раньше это не было известно. Выяснилось, что у пациентов, принимающих этот гормон, во-первых, увеличивается количество циркулирующих стволовых клеток, а во-вторых, способность к дифференцировке самих этих клеток повышается, они более эффективно регенерируют повреждённые ткани. Мы наблюдали это у пациентов, страдающих почечной недостаточностью в сочетании с сердечно-сосудистыми заболеваниями.
Второе важное открытие состоит в том, что это терапевтическое воздействие эритропоэтина на стволовые клетки имеет место уже при очень низких его концентрациях, то есть таких, при которых хорошо всем известное свойство этого гормона – влиять на эритроциты – ещё не проявляется. Иными словами, мы обнаружили, что эритропоэтин воздействует на стволовые клетки, не вызывая при этом каких-либо побочных реакций.
Иными словами, мы обнаружили, что эритропоэтин воздействует на стволовые клетки, не вызывая при этом каких-либо побочных реакций.
Это не только важный, но и в значительной мере неожиданный результат, поскольку совсем недавно специалисты Немецкого центра онкологических исследований в Гейдельберге особо указывали на побочные действия эритропоэтина. По их данным, терапия на базе этого гормона скорее снижает продолжительность жизни раковых больных, чем увеличивает её. Чем же объясняется столь существенное расхождение в результатах исследований? Профессор Халлер поясняет:
Речь идёт о совершенно иных дозировках и о совершенно иных медицинских показаниях. Там исходили из того, что пациенту пойдёт на пользу увеличение количества эритроцитов в крови, и соответственно давали ему такие дозы гормона, которые стимулируют эритропоэз. Мы же работаем с гораздо более низкими дозировками. В этом и состоит главная ценность нашего открытия – иначе побочных воздействий на процесс образования красных кровяных телец было бы не избежать.
Гормональная терапия без побочных реакций – что и говорить, звучит почти неправдоподобно. Однако профессор Халлер настроен более чем оптимистически:
Здесь открываются, конечно, весьма широкие перспективы. То, о чём я рассказал, подтверждено не только экспериментами, но и в ходе первых клинических испытаний на людях. В опытах на животных нам удалось низкими дозировками эритропоэтина остановить развитие хронической почечной недостаточности. Параллельно группа американских учёных провела аналогичное исследование в отношении инфаркта миокарда – также на животных – и показала, что низкие дозировки эритропоэтина примерно вдвое уменьшают объём тканей, поражённых инфарктом. Возможно, тут имеются и какие-то другие защитные механизмы, не связанные с воздействием на стволовые клетки, но так или иначе, мы уверены, что у этого гормона – большое будущее в клинической медицине.
Между тем, врачи обнаруживают полезные для пациентов свойства не только у допинговых средств. Всё более широкое применение в лечении больных находят сегодня и наркотики. Наглядным примером тут может служить марихуана, получаемая из листьев и соцветий индийской конопли (Cannabis sativa, Cannabis indica). Послушайте репортаж, подготовленный Марией Никкель:
Наглядным примером тут может служить марихуана, получаемая из листьев и соцветий индийской конопли (Cannabis sativa, Cannabis indica). Послушайте репортаж, подготовленный Марией Никкель:
Первые упоминания о медицинском использовании индийской конопли датируются 6-м веком до рождества Христова. В Западной Европе она стала применяться в начале 19-го века как средство против эпилепсии, невралгии тройничного нерва, усталости и бессонницы. Однако в середине 20-го века марихуана была практически повсеместно признана наркотиком – со всеми вытекающими отсюда последствиями. С тех пор даже научные исследования, в которых фигурировала бы индийская конопля, стали почти невозможными, – сетует Андреас Циммер (Andreas Zimmer), сотрудник Института молекулярной нейробиологии Боннского университета:
Это объясняется преимущественно политическими причинами. Поскольку этой субстанцией злоупотребляют и поскольку она, возможно, вызывает зависимость, её за последние 50-60 лет почти не использовали в медицине.
Впрочем, некоторые пациенты, рискуя крупными неприятностями, с ведома и молчаливого согласия врачей всё же продолжали принимать марихуану в терапевтических целях. А в последние лет 10 каннабис переживает своего рода ренессанс. Используется, прежде всего, способность марихуаны вызывать расслабление мышц и повышать аппетит. К числу болезней, в терапии которых применяется марихуана, относятся рассеянный склероз, различные формы рака и СПИД. Андреас Циммер поясняет:
Многие больные СПИДом страдают потерей аппетита, практически перестают принимать пищу и быстро теряют в весе. Между тем, любой, кто хоть раз попробовал марихуану, может подтвердить, что она вызывает зверский аппетит. Поэтому многие из таких больных СПИДом используют это свойство конопли, просто курят травку, и начинают больше есть, и набирают вес, и чувствуют себя лучше.
Кроме того, марихуана используется и как болеутоляющее средство, – говорит Андреас Циммер:
Препараты на основе конопли имеют весьма широкий спектр применения. В частности, это растение содержит ряд ценных субстанций, способных эффективно подавлять боль. Речь идёт, прежде всего, о так называемых невропатических болях, которыми страдают пациенты с нарушениями нервной системы. Как правило, такие боли носят хронический характер и плохо поддаются стандартной медикаментозной терапии. В этих случаях марихуана зарекомендовала себя очень хорошо.
В частности, это растение содержит ряд ценных субстанций, способных эффективно подавлять боль. Речь идёт, прежде всего, о так называемых невропатических болях, которыми страдают пациенты с нарушениями нервной системы. Как правило, такие боли носят хронический характер и плохо поддаются стандартной медикаментозной терапии. В этих случаях марихуана зарекомендовала себя очень хорошо.
Успешно применяются каннабиоиды и в психиатрии – в частности, для терапии реактивно-депрессивных состояний. Профессор Георг Юккель (Georg Juckel) из отделения нейробиологии берлинской клиники «Шарите» говорит:
У нас в психиатрии каннабис играет определённую роль в области терапии шизофрении, сопровождающейся маниями и галлюцинациями. Результаты проведённых в последние годы исследований дают основания полагать, что в мозге человека имеются рецепторы, реагирующие именно на субстанции типа каннабиоидов. Между тем, в терапии шизофрении очень важной задачей является редукция так называемой негативной симптоматики – апатии, подавленности пациентов. Похоже, что тут психоактивные компоненты марихуаны действительно могут вызвать улучшение состояния больных.
Похоже, что тут психоактивные компоненты марихуаны действительно могут вызвать улучшение состояния больных.
Естественно, возникает вопрос: а не приведёт ли такая терапия к наркотической зависимости? Андреас Циммер считает такой риск минимальным:
Исходящая от конопли угроза развития зависимости, судя по всему, ничтожна. Не вызывает никаких сомнений, что привыкание к марихуане гораздо слабее, чем к алкоголю или к табаку. Я убеждён, что этой опасностью можно смело пренебречь.
Того же мнения придерживается и профессор Юккель:
Если речь идёт о тяжелобольных пациентах – раковых больных или больных СПИДом, – вероятность возникновения какой-либо формы психической зависимости очень мала. Кстати, у таких пациентов и опиаты практически никогда не вызывают зависимости. Поэтому я считаю, что в этих случаях применение марихуаны оправдано – оно улучшает самочувствие больных, делает их жизнь в этой стадии болезни более терпимой.
Это был репортаж, подготовленный Марией Никкель. Понятно, впрочем, что жёсткие нормативно-правовые ограничения, касающиеся марихуаны, затрагивают и медицину. В Европе растительные препараты из конопли легально продаются только в аптеках Голландии. В США лишь в штате Калифорния разрешено возделывание индийской конопли на специальных фермах, где пациенты – по рецепту врача – могут потреблять её непосредственно на месте, причём не курить, а вдыхать с помощью специального «ингалятора». Так что говорить о широком распространении марихуаны в медицине всё же пока рано.
Понятно, впрочем, что жёсткие нормативно-правовые ограничения, касающиеся марихуаны, затрагивают и медицину. В Европе растительные препараты из конопли легально продаются только в аптеках Голландии. В США лишь в штате Калифорния разрешено возделывание индийской конопли на специальных фермах, где пациенты – по рецепту врача – могут потреблять её непосредственно на месте, причём не курить, а вдыхать с помощью специального «ингалятора». Так что говорить о широком распространении марихуаны в медицине всё же пока рано.
Апластическая анемия | Фонд «Подари жизнь»
Суть болезни
Апластической анемией (АА) называют заболевание, при котором костный мозг больного перестает производить достаточные количества всех основных видов клеток крови – эритроцитов, лейкоцитов и тромбоцитов. Отсюда и название болезни: она сочетает в себе анемию (недостаточное число эритроцитов, низкий уровень гемоглобина) и аплазию кроветворения (угнетение выработки всех клеток крови).
Частота встречаемости, факторы риска
Апластическая анемия – редкая болезнь: ее частота составляет порядка 2-6 случаев на миллион жителей в год. АА может возникнуть как у детей, так и у взрослых; считается, что пики заболеваемости наблюдаются в молодом возрасте (15-30 лет) и затем в пожилом (свыше 60 лет). Мужчины и женщины заболевают одинаково часто.
В подавляющем большинстве случаев причина заболевания неизвестна – в этом случае говорят об идиопатической АА. Но иногда развитие болезни связано с некоторыми врожденными патологиями или с внешними факторами: использованием определенных лекарств (хинин, хлорамфеникол и др.), работой с токсичными веществами (гербициды, инсектициды, некоторые растворители, включая бензол), облучением или перенесенными инфекциями (инфицирование вирусами гепатитов, вирусом Эпштейна-Барр, ВИЧ; возможно, также цитомегаловирусом).
Считается, что идиопатическая АА обычно имеет аутоиммунную природу, то есть возникает тогда, когда иммунная система организма по какой-то причине начинает бороться против его собственных клеток костного мозга.
Признаки и симптомы
Проявления апластической анемии связаны с панцитопенией – дефицитом всех разновидностей клеток крови.
- Недостаток эритроцитов – бледность, слабость, одышка, учащенное сердцебиение, головокружения, головные боли.
- Недостаток тромбоцитов – кровотечения, в том числе из носа и десен; появление синяков и петехий (мелких подкожных кровоизлияний).
- Недостаток лейкоцитов – слабая сопротивляемость инфекциям. Могут возникнуть инфекционные заболевания, плохо поддающиеся терапии или часто повторяющиеся.
Апластическая анемия бывает разной степени тяжести: различают легкую, средней тяжести, тяжелую и сверхтяжелую формы АА.
Диагностика
Заподозрить АА можно при появлении у ребенка перечисленных жалоб и симптомов, а подтвердить – на основании результатов клинического анализа крови, где резко снижены количества эритроцитов, лейкоцитов и тромбоцитов. Производятся также другие клинические и лабораторные исследования, но окончательный диагноз ставится только по результатам анализа образца костного мозга, полученного с помощью пункции и трепанобиопсии. Исследование костного мозга необходимо для того, чтобы исключить другие возможные причины дефицита клеток крови, такие как лейкоз, миелодиспластические синдромы, миелофиброз и др.
Исследование костного мозга необходимо для того, чтобы исключить другие возможные причины дефицита клеток крови, такие как лейкоз, миелодиспластические синдромы, миелофиброз и др.
При апластической анемии исследование костного мозга указывает на аплазию или гипоплазию кроветворения – то есть костный мозг практически не производит клетки крови или же производит их, но существенно меньше нужного.
В ходе диагностических исследований необходимо также надежно отличать АА от врожденной анемии Фанкони, так как лечение этих болезней (включая протоколы трансплантации костного мозга) заметно различается. Для подтверждения или исключения анемии Фанкони могут использоваться специальные исследования (такие как ДЭБ-тест).
Лечение
Лечение тяжелой и сверхтяжелой АА должно быть начато сразу после постановки диагноза, так как состояние серьезного дефицита всех клеток крови опасно для жизни.
Если развитие АА вызвано определенной внешней причиной (лекарства, радиация), то в первую очередь надо убрать эту причину. Однако, как уже говорилось, какой-то внешний фактор развития болезни удается установить лишь в очень небольшом числе случаев.
Однако, как уже говорилось, какой-то внешний фактор развития болезни удается установить лишь в очень небольшом числе случаев.
Так как АА предположительно имеет аутоиммунную природу, то для ее лечения широко применяется иммуносупрессивная терапия – то есть терапия, которая направлена на подавление иммунной системы, «атакующей» клетки костного мозга. Обычно такая терапия включает в себя антитимоцитарный глобулин (АТГ) или антилимфоцитарный глобулин (АЛГ) в сочетании с циклоспорином; для профилактики побочных действий АТГ могут использоваться стероидные гормоны, такие как метилпреднизолон. Ответ на эту терапию, как правило, возникает медленно: в случае успеха костный мозг постепенно восстанавливается через несколько недель или месяцев после введения лекарств и начинает производить здоровые клетки.
Для проведения курса иммуносупрессивной терапии с АТГ или АЛГ обычно необходима госпитализация. Основные осложнения в ходе лечения – это инфекции и кровотечения. Если нет ответа на первый курс терапии, может быть проведен повторный курс. Иммуносупрессивная терапия эффективна приблизительно в 70% случаев. К сожалению, у части больных после нее возникают рецидивы болезни.
Иммуносупрессивная терапия эффективна приблизительно в 70% случаев. К сожалению, у части больных после нее возникают рецидивы болезни.
Аллогенная трансплантация костного мозга в случае успеха приводит к полному излечению. Трансплантация особенно предпочтительна в случаях, когда больной молод и у него есть полностью совместимый родственный донор (брат или сестра). В отсутствие родственного донора допустимо использование совместимого неродственного донора или наполовину совместимого родственного дона (гаплотрансплантация). Ранее считалось, что трансплантации от неродственных или частично совместимых доноров при АА являются очень рискованными, но сейчас их результаты существенно улучшились.
В ходе лечения АА нередко нужна интенсивная заместительная терапия компонентами крови (переливания донорских тромбоцитов, эритроцитов, в случае тяжелых инфекций – иногда и гранулоцитов). Однако если планируется трансплантация костного мозга, то нужно помнить, что множественные переливания перед трансплантацией повышают вероятность отторжения трансплантата.
Очень важны профилактика и лечение бактериальных, вирусных и грибковых инфекций, которые представляют большую опасность для больных АА. Для лечения применяют сочетания эффективных антибиотиков и противогрибковых препаратов, иногда на протяжении долгого времени.
В качестве дополнительной терапии используются также факторы роста – препараты, помогающие костному мозгу производить нужные клетки. Среди них можно назвать гранулоцитарный колониестимулирующий фактор (нейпоген, лейкостим, граноцит), который стимулирует выработку лейкоцитов, и эритропоэтин, стимулирующий выработку эритроцитов.
Отличные результаты при АА показывает также элтромбопаг (револейд): этот препарат стимулирует выработку тромбоцитов и в целом улучшает ответ на терапию, поэтому, например, в НМИЦ ДГОИ имени Дмитрия Рогачева он уже включен в новые протоколы лечения.
Прогноз
Без лечения больные тяжелыми формами апластической анемии погибают в течение нескольких месяцев. Однако при современном адекватном лечении прогноз довольно хороший.
Как уже говорилось, во многих случаях эффективна иммуносупрессивная терапия. Больные после такой терапии могут продолжительное время чувствовать себя хорошо, однако у некоторых из них возникает рецидив (возвращение) болезни. Для своевременного обнаружения рецидива необходимы регулярные проверки, в первую очередь анализы крови.
Трансплантация костного мозга как от родственных, так и неродственных доноров связана с определенными рисками, в первую очередь иммунных и инфекционных осложнений. Но в случае успеха трансплантации наступает полное излечение.
Анемия – Диагностика и лечение
Диагноз
Чтобы диагностировать анемию, ваш врач, скорее всего, спросит вас о вашем медицинском и семейном анамнезе, проведет медицинский осмотр и выполнит следующие тесты:
Общий анализ крови (CBC). A CBC используется для подсчета количества клеток крови в образце вашей крови.
 В случае анемии ваш врач будет интересоваться уровнями красных кровяных телец, содержащихся в вашей крови (гематокрит), и гемоглобином в вашей крови.
В случае анемии ваш врач будет интересоваться уровнями красных кровяных телец, содержащихся в вашей крови (гематокрит), и гемоглобином в вашей крови.Нормальные значения гематокрита у взрослых варьируются в зависимости от медицинской практики, но обычно составляют от 40% до 52% для мужчин и от 35% до 47% для женщин. Нормальные значения гемоглобина у взрослых обычно составляют от 14 до 18 граммов на децилитр для мужчин и от 12 до 16 граммов на децилитр для женщин.
- Тест для определения размера и формы эритроцитов. Некоторые из ваших эритроцитов также могут быть исследованы на предмет необычного размера, формы и цвета.
Дополнительные диагностические тесты
Если вам поставили диагноз анемии, ваш врач может назначить дополнительные тесты для определения причины.Иногда может потребоваться изучить образец костного мозга для диагностики анемии.
Лечение
Лечение анемии зависит от причины.
Железодефицитная анемия. Лечение этой формы анемии обычно включает прием препаратов железа и изменение диеты.
Если причиной дефицита железа является потеря крови – кроме менструации, – необходимо определить источник кровотечения и остановить кровотечение.Это может быть операция.
Витаминно-дефицитные анемии. Лечение дефицита фолиевой кислоты и витамина С включает в себя диетические добавки и увеличение количества этих питательных веществ в вашем рационе.
Если ваша пищеварительная система плохо усваивает витамин B-12 из пищи, которую вы едите, вам могут потребоваться инъекции витамина B-12. Сначала можно делать прививки через день. В конце концов, вам понадобятся прививки только раз в месяц, возможно, на всю жизнь, в зависимости от вашей ситуации.
- Анемия хронического заболевания. Для этого типа анемии нет специального лечения.
 Врачи сосредоточены на лечении основного заболевания. Если симптомы становятся серьезными, переливание крови или инъекции синтетического гормона, который обычно вырабатывается почками (эритропоэтин), могут помочь стимулировать выработку красных кровяных телец и снять усталость.
Врачи сосредоточены на лечении основного заболевания. Если симптомы становятся серьезными, переливание крови или инъекции синтетического гормона, который обычно вырабатывается почками (эритропоэтин), могут помочь стимулировать выработку красных кровяных телец и снять усталость. - Апластическая анемия. Лечение анемии может включать переливание крови для повышения уровня эритроцитов.Вам может потребоваться пересадка костного мозга, если ваш костный мозг не может производить здоровые клетки крови.
- Анемии, связанные с заболеванием костного мозга. Лечение этих различных заболеваний может включать медикаменты, химиотерапию или трансплантацию костного мозга.
Гемолитические анемии. Управление гемолитической анемией включает в себя отказ от подозрительных лекарств, лечение инфекций и прием лекарств, подавляющих вашу иммунную систему, которые могут атаковать ваши эритроциты.
В зависимости от причины или гемолитической анемии вас могут направить к кардиологу или сосудистому специалисту.

Серповидно-клеточная анемия. Лечение может включать кислород, болеутоляющие, а также пероральные и внутривенные жидкости для уменьшения боли и предотвращения осложнений. Врачи также могут порекомендовать переливание крови, добавки фолиевой кислоты и антибиотики.
Лекарство от рака под названием гидроксимочевина (Droxia, Hydrea, Siklos) также используется для лечения серповидноклеточной анемии.
- Талассемия. Большинство форм талассемии легкие и не требуют лечения. Более тяжелые формы талассемии обычно требуют переливания крови, приема добавок фолиевой кислоты, лекарств, удаления селезенки или трансплантации стволовых клеток крови и костного мозга.
Клинические испытания
Изучите исследования клиники Мэйо, в которых тестируются новые методы лечения, вмешательства и тесты как средства предотвращения, обнаружения, лечения или контроля этого состояния.
Подготовка к приему
Запишитесь на прием к лечащему врачу, если у вас продолжительная усталость или другие признаки или симптомы, которые вас беспокоят. Он или она может направить вас к врачу, который специализируется на лечении заболеваний крови (гематолог), сердца (кардиолог) или пищеварительной системы (гастроэнтеролог).
Вот некоторая информация, которая поможет вам подготовиться к встрече.
Что вы можете сделать
Перед приемом составьте список:
- Ваши симптомы и когда они начались
- Ключевая личная информация, включая серьезные стрессы, имплантированные медицинские устройства, воздействие токсинов или химикатов и недавние изменения в жизни
- Все лекарства, витамины и другие добавки, которые вы принимаете, включая дозы
- Вопросы к врачу
Основные вопросы, которые следует задать врачу при анемии:
- Какая наиболее вероятная причина моих симптомов?
- Есть ли другие возможные причины?
- Мне нужны тесты?
- Является ли моя анемия временной или продолжительной?
- Какие методы лечения доступны и какие вы рекомендуете?
- Какие побочные эффекты можно ожидать от лечения?
- У меня другие проблемы со здоровьем.
 Как мне лучше всего управлять ими вместе?
Как мне лучше всего управлять ими вместе? - Нужно ли мне ограничивать диету?
- Нужно ли мне добавлять продукты в свой рацион? Как часто мне нужно есть эти продукты?
- У вас есть брошюры или другие печатные материалы, которые я могу взять? Какие сайты вы рекомендуете?
Чего ожидать от врача
Ваш врач, скорее всего, задаст вам вопросы, например:
- Ваши симптомы приходят и уходят, или они постоянны?
- Насколько серьезны ваши симптомы?
- Кажется, что-нибудь улучшает ваши симптомы?
- Что может ухудшить ваши симптомы?
- Вы вегетарианец?
- Сколько порций фруктов и овощей вы обычно съедаете в день?
- Вы употребляете алкоголь? Если да, то как часто и сколько напитков вы обычно пьете?
- Вы курите?
- Вы в последнее время сдавали кровь более одного раза?
Лечение анемии в клинике Мэйо
Августа16, 2019
Показать ссылки
- Анемия.
 Национальный институт сердца, легких и крови. https://www.nhlbi.nih.gov/health-topics/iron-deficiency-anemia. Доступ 23 июля 2019 г.
Национальный институт сердца, легких и крови. https://www.nhlbi.nih.gov/health-topics/iron-deficiency-anemia. Доступ 23 июля 2019 г. - Анемия. Лабораторные тесты онлайн. https://labtestsonline.org/conditions/anemia. Доступ 23 июля 2019 г.
- Schrier SL. Подходите к взрослому пациенту с анемией. https://www.uptodate.com/contents/search. 23 июля 2019.
- Анемия. Американское общество гематологии.https://www.matology.org/Patients/Anemia/. Доступ 23 июля 2019 г.
- Ваш путеводитель по анемии. Национальный институт сердца, легких и крови. https://www.nhlbi.nih.gov/files/docs/public/blood/anemia-yg.pdf. Доступ 27 июля 2019 г.
- Morrow ES Jr. Allscripts EPSi. Клиника Мэйо, Рочестер, Миннесота, 22 июля 2019 г.
Эксперт объясняет, что делать, если лечение анемии не работает
Анемия или низкий уровень гемоглобина – одна из наиболее распространенных проблем, с которыми сталкиваются в первичной медико-санитарной помощи. Гемоглобин – это белок, содержащийся в красных кровяных тельцах (эритроцитах) и содержащий железо.
Гемоглобин – это белок, содержащийся в красных кровяных тельцах (эритроцитах) и содержащий железо.
Анемия может возникнуть в результате слишком малого количества нормальных эритроцитов, нормального количества клеток с низким уровнем гемоглобина в каждой клетке или генетически измененного гемоглобина.
Лечение анемии первой линии зависит от причины.
Нормальное количество клеток при низком клеточном гемоглобине означает, что у вас может не хватать железа, витамина B12 или фолиевой кислоты, которые необходимы вашему костному мозгу для выработки эритроцитов.
Низкий уровень железа также может быть следствием кровопотери, например, из-за месячных. Замена этих питательных веществ обычно легко устраняет анемию.
Слишком мало, но нормальных эритроцитов может возникнуть в результате приема лекарств, подавляющих выработку эритроцитов. Обычно помогает отмена или снижение дозы. Иногда причиной является хроническое заболевание, например сердечная недостаточность.
Эритроциты живут в крови около 120 дней, затем расщепляются, а гемоглобин перерабатывается. Если это происходит быстрее, чем образуются клетки, изучение мазка крови или костного мозга под микроскопом может стать следующим шагом для определения причины и лечения.
Лечение не работает, если симптомы не улучшаются. Усталость – частый симптом, иногда также может возникать одышка при легких упражнениях. Это связано с тем, что основная функция эритроцитов – переносить кислород из легких в другие части тела.
Недостаточно кислорода в тканях означает, что ваши мышцы могут слишком быстро уставать или ваше мышление может быть туманным. В тяжелых случаях ваше сердце может биться неправильно.
Последующие анализы крови – это первый шаг.Это может включать:
- общий анализ крови (CBC), который проверяет ваш уровень гемоглобина и количество эритроцитов
- последующие исследования железа, витамина 12 или фолиевой кислоты, если причина вашей анемии известна
- тест для поиска для увеличения производства эритроцитов, известного как количество ретикулоцитов, чтобы проверить, выполняет ли ваш костный мозг свою работу
- также можно заказать мазок периферической крови на предмет слишком быстрой рециркуляции клеток крови
- тест электрофореза гемоглобина для поиска генетические проблемы с белком гемоглобина
Иногда низкий уровень железа связан с кровопотерей в кишечнике, что не очевидно. Ваш врач может также захотеть проверить ваш стул на наличие микроскопических количеств крови, на случай, если у вас кровотечение и вы этого не знаете.
Ваш врач может также захотеть проверить ваш стул на наличие микроскопических количеств крови, на случай, если у вас кровотечение и вы этого не знаете.
Иногда люди не могут усваивать пероральное железо или витамины или не принимают достаточно постоянно, чтобы решить проблему.
Лекарства, отпускаемые по рецепту и без рецепта, также могут влиять на абсорбцию добавок. Также доступны внутривенные инъекции железа и витамина B12.
Следующим шагом будет полное обследование на предмет хронического заболевания.Это будет включать в себя специально разработанные для вас скрининговые тесты, если они еще не проводились.
Если анемия не проходит или вам больше 50 лет, можно порекомендовать эндоскопию для осмотра желудка или толстой кишки на предмет стойкой микроскопической кровопотери.
Если анемия становится тяжелой, может потребоваться переливание крови или направление к специалисту по крови, известному как гематолог.
Пероральные добавки с железом – это первая линия лечения анемии, наряду с диетой с высоким содержанием железа, которое содержится в темно-зеленых листовых овощах.
Однако запоры от добавок железа – обычное явление. Обязательно соблюдайте диету с высоким содержанием клетчатки.
Железосодержащие добавки могут лучше переноситься и одинаково эффективны, если их принимать только три раза в неделю.
Еда помогает при любой тошноте и способствует усвоению железа.
Если вам необходимо внутривенное введение железа, вы будете находиться под пристальным наблюдением, пока оно будет вводиться в случае аллергической реакции.
Основной риск нелеченной или недолеченной анемии – это недостаточное поступление кислорода в жизненно важные органы, такие как мозг, сердце или почки.Также существуют риски, связанные с беременностью.
Без надлежащего лечения некоторые пациенты чувствуют, что их мышление немного затуманено или они более забывчивы. Усталость – частая жалоба.
Симптомы тяжелой анемии включают одышку в покое, головокружение или боль в груди. Немедленно обратитесь к врачу, если вы испытываете эти симптомы, потому что они могут быть опасными для жизни.
Самая частая причина анемии – низкий уровень железа в организме и крови. Если это причина, то употребление в пищу продуктов, богатых железом, безусловно, может помочь.Однако железо лучше всего усваивается из пищи и лучше всего у молодых людей.
Антациды могут мешать усвоению железа, тогда как прием витамина С (аскорбиновая кислота) может помочь.
Также может помочь прием препаратов железа три раза в неделю. Если вы почувствуете тошноту или сильный запор при приеме добавок железа, попробуйте принимать препараты с более низким содержанием железа или в жидкой форме и принимать их во время еды.
В крайних или устойчивых случаях железо можно также вводить внутривенно.
Если анемия не связана с уровнем железа или витаминов, увеличение потребления железа не поможет, и это может привести к проблемам, связанным с избытком железа в организме.
Это зависит от тяжести и причины анемии.
Если причиной является низкий уровень железа, ваш врач проверит ваш общий анализ крови и исследования железа через месяц. Уровень железа должен вернуться к норме через 2–4 месяца приема добавок. Столько же нужно времени, чтобы полностью отреагировать на уровень витамина B12 и фолиевой кислоты.
Уровень железа должен вернуться к норме через 2–4 месяца приема добавок. Столько же нужно времени, чтобы полностью отреагировать на уровень витамина B12 и фолиевой кислоты.
В случае других причин анемии ваш поставщик, скорее всего, обсудит с вами следующие шаги для лечения и наблюдения.
Никакая подготовка не требуется для любого анализа крови, который может быть заказан.Если была заказана такая процедура, как эндоскопия, врач, выполняющий эту процедуру, даст вам подробные инструкции о том, как подготовиться.
Обычно лучше придерживаться того же поставщика медицинских услуг, с которым вы начали этот путь.
Если симптомы не исчезнут или лечение не помогает, врач может провести дополнительное обследование. Они также могут направить вас к специалисту, который поможет обнаружить и лечить первопричину анемии.
Др.Мередит Гудвин – сертифицированный врач семейной медицины, практикующий в Сакраменто, Калифорния. Она имеет обширный опыт в области семейной медицины полного спектра, включая посещения на дому, телемедицину, помощь ветеранам, защиту интересов пациентов и планирование ухода за жизнью. Она получила степень доктора медицины в Колледже врачей и хирургов Колумбийского университета в Нью-Йорке и закончила резидентуру по семейной медицине в Калифорнийском университете в Лос-Анджелесе. Она является членом Американской академии семейных врачей (FAAFP).
Она получила степень доктора медицины в Колледже врачей и хирургов Колумбийского университета в Нью-Йорке и закончила резидентуру по семейной медицине в Калифорнийском университете в Лос-Анджелесе. Она является членом Американской академии семейных врачей (FAAFP).
Симптомы, методы лечения, типы и причины
Мы включаем продукты, которые, по нашему мнению, полезны для наших читателей.Если вы покупаете по ссылкам на этой странице, мы можем заработать небольшую комиссию. Вот наш процесс.
Анемия возникает, когда количество эритроцитов, циркулирующих в организме, уменьшается. Это наиболее распространенное заболевание крови.
Согласно статье The Lancet от 2015 года, около одной трети населения мира страдает анемией.
Он часто развивается в результате других проблем со здоровьем, которые препятствуют выработке организмом здоровых эритроцитов (эритроцитов) или увеличивают скорость разрушения или потери этих клеток.
В этой статье мы объясняем типы, симптомы и причины анемии, а также доступные методы лечения.
Поделиться на Pinterest Человек с анемией может испытывать усталость, нерегулярное сердцебиение и боль в груди.
Самый частый симптом анемии – утомляемость. Другие общие симптомы включают:
- бледная кожа
- быстрое или нерегулярное сердцебиение
- одышка
- боль в груди
- головные боли
- головокружение
Люди с легкой анемией могут испытывать незначительные симптомы или их отсутствие.
Некоторые формы анемии вызывают специфические характерные симптомы, в том числе:
- Апластическая анемия: Это может вызвать лихорадку, частые инфекции и кожную сыпь.
- Анемия, вызванная недостаточностью фолиевой кислоты: Может вызывать раздражительность, диарею и гладкость языка.
- Гемолитическая анемия: Может вызывать желтуху, темную мочу, жар и боль в животе.
- Серповидно-клеточная анемия: Может вызывать болезненные отеки в ступнях и руках, а также вызывать усталость и желтуху.

Организм нуждается в эритроцитах, чтобы выжить. Они переносят гемоглобин, сложный белок, который прикрепляется к молекулам железа. Эти молекулы переносят кислород из легких во все остальные части тела.
Низкий уровень эритроцитов может вызывать различные состояния здоровья.
Существует множество типов анемии, у которых нет единственной причины. У некоторых людей бывает трудно определить причину низкого уровня эритроцитов.
Три основных причины анемии:
Кровопотеря
Железодефицитная анемия является наиболее распространенным типом анемии, и часто причиной является потеря крови.Нехватка железа в крови приводит к этой форме состояния, а низкий уровень железа часто возникает в результате кровопотери.
Когда организм теряет кровь, он забирает воду из тканей вне кровотока, чтобы кровеносные сосуды оставались наполненными. Эта дополнительная вода разбавляет кровь, снижая количество эритроцитов.
Кровопотеря может быть острой и быстрой или хронической. Некоторые причины быстрой кровопотери включают хирургическое вмешательство, роды и травмы.
Некоторые причины быстрой кровопотери включают хирургическое вмешательство, роды и травмы.
Хроническая кровопотеря чаще является причиной анемии.Это может быть следствием язвы желудка, рака или другого типа опухоли.
Другие причины анемии из-за кровопотери включают:
- желудочно-кишечные заболевания, такие как язвы, геморрой, рак или гастрит
- использование нестероидных противовоспалительных препаратов, таких как аспирин и ибупрофен
- обильные менструальные кровотечения
Снижение или повреждение эритроцитов
Костный мозг – это мягкая губчатая ткань в центре костей, которая играет важную роль в создании эритроцитов.Костный мозг производит стволовые клетки, которые превращаются в эритроциты, лейкоциты и тромбоциты.
Костный мозг может поражать ряд заболеваний, включая лейкоз. Это тип рака, который вызывает образование чрезмерных и аномальных лейкоцитов, нарушая производство эритроцитов.
Проблемы с костным мозгом могут вызвать анемию. Например, апластическая анемия возникает, когда в костном мозге мало или совсем нет стволовых клеток.
Например, апластическая анемия возникает, когда в костном мозге мало или совсем нет стволовых клеток.
В некоторых случаях анемия возникает, когда эритроциты не растут и не созревают, как обычно, как в случае талассемии – наследственной формы анемии.
Другие типы анемии, которые возникают из-за уменьшения или нарушения эритроцитов, включают:
Серповидно-клеточная анемия
Это приводит к тому, что эритроциты имеют форму полумесяца. Они могут разрушаться быстрее, чем здоровые эритроциты, или оседать в мелких кровеносных сосудах.
Эта блокада может снизить уровень кислорода и вызвать боль в более низком кровотоке.
Железодефицитная анемия
Это связано с тем, что организм производит слишком мало эритроцитов из-за недостатка железа в организме.
Железодефицитная анемия может развиться в результате:
- диеты с низким содержанием железа
- менструации
- частой сдачи крови
- тренировки на выносливость
- определенных пищеварительных состояний, таких как болезнь Крона
- лекарств, раздражающих кишечник подкладка, такая как ибупрофен
Витаминодефицитная анемия
Витамин B-12 и фолиевая кислота необходимы для производства эритроцитов. Если человек не потребляет достаточное количество витаминов, количество эритроцитов может быть низким.
Если человек не потребляет достаточное количество витаминов, количество эритроцитов может быть низким.
Некоторые примеры витаминно-дефицитной анемии включают мегалобластную анемию и злокачественную анемию.
Разрушение эритроцитов
Эти клетки обычно живут в кровотоке 120 дней, но организм может уничтожить или удалить их до того, как они завершат свой естественный жизненный цикл.
Одним из видов анемии, возникающей в результате разрушения эритроцитов, является аутоиммунная гемолитическая анемия. Это происходит, когда иммунная система принимает эритроциты за чужеродное вещество и атакует их.
Многие факторы могут вызвать чрезмерное разрушение эритроцитов, в том числе:
- инфекции
- определенные лекарства, включая некоторые антибиотики
- тяжелая гипертензия
- сосудистые трансплантаты и протезы сердечных клапанов
- токсины, продуцируемые прогрессирующими заболеваниями почек или печени
- аутоиммунная атака, вызванная гемолитической болезнью, например,
- яд змеи или паука
Существует целый ряд методов лечения анемии. Каждый из них направлен на увеличение количества эритроцитов, что, в свою очередь, увеличивает количество кислорода в крови.
Каждый из них направлен на увеличение количества эритроцитов, что, в свою очередь, увеличивает количество кислорода в крови.
Ниже мы описываем методы лечения нескольких типов анемии:
- Железодефицитная анемия: Добавки железа и диетические изменения могут помочь, и, при необходимости, врач определит и устранит причину чрезмерного кровотечения.
- Витаминно-дефицитная анемия: Лечение может включать пищевые добавки и инъекции витамина B-12.
- Талассемия: Лечение включает добавки фолиевой кислоты, хелатирование железа и, для некоторых людей, переливание крови и пересадку костного мозга.
- Анемия, вызванная хроническим заболеванием: Врач сосредоточит внимание на устранении основного заболевания.
- Апластическая анемия: Лечение включает переливание крови или пересадку костного мозга.
- Серповидно-клеточная анемия: Лечение обычно включает кислородную терапию, обезболивающие и внутривенное введение жидкости, но оно также может включать антибиотики, добавки фолиевой кислоты, переливание крови и лекарство от рака под названием гидроксимочевина.

- Гемолитическая анемия: В план лечения могут входить иммунодепрессанты, лечение инфекций и плазмаферез, фильтрующий кровь.
Добавки железа можно приобрести в Интернете.
Если причиной анемии является недостаток питательных веществ, может помочь употребление большего количества продуктов, богатых железом.
Следующие продукты содержат большое количество железа:
- обогащенные железом злаки и хлеб
- листовые зеленые овощи, такие как капуста, шпинат и кресс-салат
- бобовые и бобы
- коричневый рис
- белое или красное мясо
- орехи и семена
- рыба
- тофу
- яйца
- сухофрукты, включая абрикосы, изюм и чернослив
Анемия может возникать у людей любого возраста, пола и национальности.
Следующие факторы увеличивают риск развития той или иной формы состояния:
- преждевременные роды
- период от 6 месяцев до 2 лет
- менструация
- беременность и роды
- диета с низким содержанием витамины, минералы и железо
- , регулярный прием лекарств, вызывающих воспаление слизистой оболочки желудка, таких как ибупрофен
- , имеющий в семейном анамнезе наследственную анемию, такую как серповидноклеточная анемия или талассемия
- , имеющий кишечное расстройство, которое влияет на всасывание питательных веществ, такие как болезнь Крона
- потеря крови из-за операции или травмы, например
- хроническое заболевание, такое как СПИД, диабет, заболевание почек, рак, ревматоидный артрит, сердечная недостаточность или заболевание печени
Существуют различные Способы диагностики анемии, но наиболее распространенный способ включает анализ крови, называемый полным анализом крови (CBC).
При этом измеряется ряд компонентов, в том числе:
- уровней гематокрита, что включает сравнение объема эритроцитов с общим объемом крови
- уровней гемоглобина
- количество эритроцитов
Общий анализ крови может дать представление об общем объеме крови. здоровье. Это также может помочь врачу решить, следует ли проверить наличие основных заболеваний, таких как лейкемия или заболевание почек.
Если уровни эритроцитов, гемоглобина и гематокрита опускаются ниже нормального диапазона, у человека может быть какая-то форма анемии.
Тем не менее, уровни здорового человека могут выходить за пределы этого диапазона – общий анализ крови не дает окончательных результатов, но это полезная отправная точка.
Прогноз для человека с анемией зависит от причины. Иногда люди могут предотвратить или справиться с анемией, изменив только диету.
Другие виды анемии носят длительный характер, и некоторые из них могут быть опасными для жизни без лечения.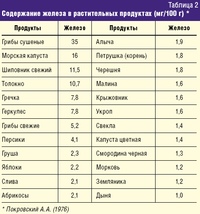
Если человек постоянно чувствует себя слабым и усталым, ему следует обратиться к врачу для обследования.
Анемия возникает, когда в организме циркулирует небольшое количество эритроцитов. Это снижает уровень кислорода в организме человека и может вызвать такие симптомы, как усталость, бледность кожи, боль в груди и одышка.
Существует более 400 видов анемии. Распространенными причинами являются потеря крови, снижение или нарушение производства эритроцитов и разрушение эритроцитов.
Самый распространенный тип – железодефицитная анемия. Иногда он развивается из-за недостатка питательных веществ в диете, болезни Крона или приема определенных лекарств.
Врач может использовать общий анализ крови для выявления анемии. Лечение варьируется в зависимости от типа, но может включать в себя добавки железа или витаминов, лекарства, переливание крови и трансплантацию костного мозга.
Однако для некоторых людей с анемией изменение рациона может решить проблему.
Общие сведения о гемолитической анемии, вызванной лекарственными средствами
Гемолитическая анемия описывает большую группу состояний, характеризующихся ускоренным разрушением эритроцитов. Средняя продолжительность жизни эритроцита составляет 120 дней.По истечении 120 дней эритроцит распадается, а его части перерабатываются, чтобы образовать новые. Когда ваши эритроциты разрушаются быстрее, это называется гемолизом.
Caiaimage / Мартин Барро / Creative RF / Getty Images
Гемолиз может быть вызван множеством разных причин. Некоторые формы, которые вы наследуете, например наследственный сфероцитоз и дефицит пируваткиназы. Другие вызваны разрушением эритроцитов вашей иммунной системой, например аутоиммунная гемолитическая анемия или гемолитическая болезнь новорожденных.При лекарственной гемолитической анемии существует несколько различных механизмов, вызывающих гемолиз при воздействии лекарств или токсинов.
Признаки и симптомы
Признаки и симптомы лекарственной гемолитической анемии аналогичны другим формам гемолитической анемии. Эти симптомы незначительно различаются в зависимости от того, разрушается ли эритроцит при циркуляции (внутрисосудистый гемолиз) или вне сосудистой системы (преимущественно в печени и селезенке). Ваши симптомы могут включать:
Эти симптомы незначительно различаются в зависимости от того, разрушается ли эритроцит при циркуляции (внутрисосудистый гемолиз) или вне сосудистой системы (преимущественно в печени и селезенке). Ваши симптомы могут включать:
- Желтуха, пожелтение кожи
- Темная (цвета чая или колы) моча
- Бледность, бледность кожи
- Утомляемость, утомляемость
- Головокружение
- Повышенное сердцебиение
- Одышка
- Спленомегалия, увеличенная селезенка
Диагностика
Диагностика лекарственной гемолитической анемии начинается, как и при большинстве форм анемии, с полного анализа крови (ОАК).На анемию указывает низкий гемоглобин и / или гематокрит. При гемолитической анемии производство красных кровяных телец ускоряется, что приводит к увеличению количества ретикулоцитов, незрелых красных кровяных телец. Этот тест обычно называют ретикулярным, и его можно регистрировать как процентное или абсолютное количество ретикулоцитов (ARC).
Чтобы диагностировать гемолитическую анемию, важно, чтобы кто-нибудь (ваш гематолог или патолог) посмотрел на ваши эритроциты под микроскопом. Этот тест называется мазком периферической крови.Красная кровь обычно выглядит круглой, как пончик под микроскопом, но когда красные кровяные тельца разрушаются преждевременно, они становятся фрагментированными или имеют форму сфер или шаров.
Некоторые лекарства вызывают иммунную гемолитическую анемию, аналогичную аутоиммунной гемолитической анемии. Если у вас это есть, тест, называемый прямым тестом на антиглобулин (DAT или Direct Coombs), будет положительным, указывая на то, что ваша иммунная система атакует и разрушает ваши эритроциты ненадлежащим образом. Поскольку красные кровяные тельца выделяют билирубин, пигмент, вызывающий желтуху, у вас может быть повышен уровень билирубина.В противном случае нет специальных тестов, чтобы определить, является ли ваше лекарство причиной гемолитической анемии. Как правило, диагноз подтверждается, если после прекращения приема лекарств состояние вашей анемии улучшается.
Причины
Есть несколько лекарств, связанных с лекарственной гемолитической анемией. Наиболее частые виновники:
- Цефалоспорины, распространенный антибиотик, включая цефтриаксон
- Пенициллины, в частности пиперациллин
- Диклофенак, нестероидное противовоспалительное средство
- Оксалиплатин, химиотерапевтический препарат
Связанное состояние – дефицит глюкозо-6-фосфатдегидрогеназы (G6PD).При этом типе анемии вам не хватает ключевого фермента (химического вещества) в красных кровяных тельцах. Если вы принимаете определенные лекарства, такие как сульфамидные антибиотики, ваши эритроциты могут гемолизироваться, вызывая анемию. Если у вас дефицит G6PD, вам важно знать, каких лекарств / продуктов следует избегать.
Варианты лечения
Варианты лечения зависят от степени тяжести вашей анемии. Во-первых, следует прекратить прием лекарств / токсинов, вызывающих гемолитическую анемию.При необходимости можно сделать переливание крови. Если гемолиз тяжелый, он может вызвать повреждение почек. К счастью, это, как правило, временное явление, которое улучшается после исчезновения гемолиза, но для этого может потребоваться диализ в течение определенного периода времени.
Если гемолиз тяжелый, он может вызвать повреждение почек. К счастью, это, как правило, временное явление, которое улучшается после исчезновения гемолиза, но для этого может потребоваться диализ в течение определенного периода времени.
Слово Verywell
Может показаться странным узнать, что лекарство, которое вы принимали от другого заболевания, вызвало вашу анемию. К счастью, отмена лекарственного препарата предотвратит ухудшение гемолиза. Важно обсудить со своим врачом, какое лекарство вызвало анемию, чтобы вы не использовали его в будущем.
Гемолитическая анемия, индуцированная ибупрофеном
Иммунная гемолитическая анемия, индуцированная лекарствами, является редким заболеванием, встречаемость которого составляет 1 на миллион населения. Мы сообщаем о случае 36-летней женщины, которая обратилась в отделение неотложной помощи с жалобами на одышку и темную мочу. При физикальном обследовании были выявлены бледные слизистые оболочки. Пациент сообщил, что использовал ибупрофен за несколько дней до обращения. Полный анализ крови, проведенный перед началом приема ибупрофена, показал нормальные значения тромбоцитов и гемоглобина.При поступлении у пациента были признаки гемолитической анемии с гемоглобином 4,9 г / дл, гематокритом 14,2%, лактатдегидрогеназой 435 МЕ / л и ретикулоцитозом 23,2%. Дальнейшие исследования исключили аутоиммунное заболевание, лимфому и лейкоз как этиологию новой гемолитической анемии пациента. Ибупрофен был немедленно прекращен с постепенным гематологическим выздоровлением в течение 3 дней.
Полный анализ крови, проведенный перед началом приема ибупрофена, показал нормальные значения тромбоцитов и гемоглобина.При поступлении у пациента были признаки гемолитической анемии с гемоглобином 4,9 г / дл, гематокритом 14,2%, лактатдегидрогеназой 435 МЕ / л и ретикулоцитозом 23,2%. Дальнейшие исследования исключили аутоиммунное заболевание, лимфому и лейкоз как этиологию новой гемолитической анемии пациента. Ибупрофен был немедленно прекращен с постепенным гематологическим выздоровлением в течение 3 дней.
1. Введение
Иммунная гемолитическая анемия, вызванная лекарствами (DIIHA), является серьезным заболеванием, которое может быть редким побочным эффектом обычно используемых безрецептурных лекарств.Заболеваемость DIIHA оценивается в 1 на миллион населения. Хотя не существует явных данных относительно частоты индуцированного ибупрофеном гемолиза, в различных сериях случаев было обнаружено, что НПВП влияют на менее чем 15% случаев; большинство случаев вызвано антибиотиками бета-лактамаз (например, цефалоспоринами и пенициллинами). Своевременное распознавание этого состояния вместе с прекращением приема возбудителя имеет первостепенное значение при лечении его потенциально смертельных осложнений [1–3].
Своевременное распознавание этого состояния вместе с прекращением приема возбудителя имеет первостепенное значение при лечении его потенциально смертельных осложнений [1–3].
2.Описание клинического случая
36-летняя здоровая женщина европеоидной расы поступила в отделение неотложной помощи с жалобами на одышку продолжительностью один день. Единственным лекарством, которое она принимала, был ибупрофен, который она начала принимать дважды в день за неделю до обращения при головных болях напряжения. У пациента выявлена регулярная синусовая тахикардия 127 ударов в минуту. Последующее физикальное обследование показало вздутие яремных вен и бледность слизистых оболочек без желтухи, лимфаденопатии или органегалии.Очевидного источника кровотечения выявлено не было.
При первоначальном обследовании у нее была обнаружена тяжелая анемия с гемоглобином 4,9 (нормальный диапазон 12–15 г / дл), гематокритом 14,2 (нормальный диапазон 36–47%), MCV 98,8 (нормальный диапазон 80–100). fL) и RDW 24,6 (нормальный диапазон 11–14,5%). Было начато обследование при анемии, оно было значимым для повышения лактатдегидрогеназы (ЛДГ) 435 (нормальный диапазон 135–214 МЕ / л), ретикулоцитоза 23,2 (нормальный диапазон 0,5–2,8%) и пониженного гаптоглобина <6 (нормальный диапазон 36–195). мг / дл).Анализ кала на скрытую кровь отрицательный. Тип и скрининг были положительными на антитела, а прямой тест на антиглобулин (DAT) был реактивным с антителами против IgG и C3. Элюирование теста Кумбса также оказалось положительным. Биохимические тесты, за исключением билирубина 2,7 (нормальный диапазон 0,0–1,0 мг / дл), без особенностей. Мазок периферической крови пациента показал обилие сфероцитов и полихромазию (рис. 1). Никаких отклонений среди лейкоцитов и тромбоцитов обнаружено не было. Антинуклеарные антитела (дцДНК, хроматин, рибосомный P, SS / A, SS / B, Sm, SmRNP, RNP, Scl 70, Jo 1 и Centromere B), ревматоидный фактор (RF) и компьютерная томография грудной клетки, брюшной полости и таза все были отрицательными в рамках обследования на аутоиммунную гемолитическую анемию.
fL) и RDW 24,6 (нормальный диапазон 11–14,5%). Было начато обследование при анемии, оно было значимым для повышения лактатдегидрогеназы (ЛДГ) 435 (нормальный диапазон 135–214 МЕ / л), ретикулоцитоза 23,2 (нормальный диапазон 0,5–2,8%) и пониженного гаптоглобина <6 (нормальный диапазон 36–195). мг / дл).Анализ кала на скрытую кровь отрицательный. Тип и скрининг были положительными на антитела, а прямой тест на антиглобулин (DAT) был реактивным с антителами против IgG и C3. Элюирование теста Кумбса также оказалось положительным. Биохимические тесты, за исключением билирубина 2,7 (нормальный диапазон 0,0–1,0 мг / дл), без особенностей. Мазок периферической крови пациента показал обилие сфероцитов и полихромазию (рис. 1). Никаких отклонений среди лейкоцитов и тромбоцитов обнаружено не было. Антинуклеарные антитела (дцДНК, хроматин, рибосомный P, SS / A, SS / B, Sm, SmRNP, RNP, Scl 70, Jo 1 и Centromere B), ревматоидный фактор (RF) и компьютерная томография грудной клетки, брюшной полости и таза все были отрицательными в рамках обследования на аутоиммунную гемолитическую анемию.
Пациенту перелили три единицы эритроцитов (PRBC), после чего ее гемоглобин увеличился с 4,9 до 6,9 г / дл. Ибупрофен был отменен сразу же после поступления, и была начата поддерживающая доза преднизона наряду с агрессивной гидратационной терапией. Она хорошо отреагировала на вышеупомянутые меры, и ее выздоровление прошло без осложнений. Через несколько недель пациентка была обследована, гематологические показатели полностью выздоровели.
3. Обсуждение
Иммунная гемолитическая анемия, вызванная лекарственными средствами (DIIHA), является редким заболеванием, которым страдает примерно 1 человек на миллион населения.Для сравнения: лекарственная тромбоцитопения и нейтропения имеют частоту 10–18 случаев на миллион и 2–15 случаев на миллион соответственно [4, 5]. DIIHA можно дополнительно классифицировать, разделив лекарство на наличие или отсутствие антител к лекарству: лекарственно-зависимый (DDAB) и лекарственно-независимый (DIAB). DDAB проявляет активность только в присутствии препарата; DIAB проявляет активность в отсутствие лекарственного средства [6]. Большинство случаев DIIHA вызвано DDAB. Обычно прямой тест на антиген (DAT), также известный как прямой тест Кумбса, используется для диагностики DIIHA [6].В этом тесте отмытые эритроциты смешивают с антисывороткой или моноклональными антителами, приготовленными против IgG и третьего компонента комплемента C3d [7]. Он является положительным почти во всех случаях DIIHA, хотя иногда можно наблюдать некоторые редкие случаи отрицательного DAT [2]. Если DAT положительный, необходимо провести тест на элюцию для характеристики антител. В случае элюции DDAB тест отрицательный, так как препарат не тестируется in vitro. DIIHA реже опосредуется DIAB, что почти идентично теплой аутоиммунной гемолитической анемии (WAIHA).В этом случае и DAT, и элюция положительны. Единственный способ отличить DIAB от WAIHA – это остановить возбудителя и наблюдать гематологический ответ [6]. Обычно для достижения гематологической ремиссии требуется несколько недель, в то время как серологическая ремиссия (когда тест Комбса становится отрицательным) может занять несколько месяцев [2].
Большинство случаев DIIHA вызвано DDAB. Обычно прямой тест на антиген (DAT), также известный как прямой тест Кумбса, используется для диагностики DIIHA [6].В этом тесте отмытые эритроциты смешивают с антисывороткой или моноклональными антителами, приготовленными против IgG и третьего компонента комплемента C3d [7]. Он является положительным почти во всех случаях DIIHA, хотя иногда можно наблюдать некоторые редкие случаи отрицательного DAT [2]. Если DAT положительный, необходимо провести тест на элюцию для характеристики антител. В случае элюции DDAB тест отрицательный, так как препарат не тестируется in vitro. DIIHA реже опосредуется DIAB, что почти идентично теплой аутоиммунной гемолитической анемии (WAIHA).В этом случае и DAT, и элюция положительны. Единственный способ отличить DIAB от WAIHA – это остановить возбудителя и наблюдать гематологический ответ [6]. Обычно для достижения гематологической ремиссии требуется несколько недель, в то время как серологическая ремиссия (когда тест Комбса становится отрицательным) может занять несколько месяцев [2]. Лечение DDAB – это прекращение приема препарата, вызывающего нарушение. В случае ДИАБ, помимо отмены лекарственного препарата, следует также добавить стероиды [6].
Лечение DDAB – это прекращение приема препарата, вызывающего нарушение. В случае ДИАБ, помимо отмены лекарственного препарата, следует также добавить стероиды [6].
Основные диагностические объекты, которые следует учитывать при дифференциальной диагностике лекарственной иммунной гемолитической анемии (DIIHA), включают различные причины теплой аутоиммунной гемолитической анемии (WAIHA), поскольку они характеризуются антителами IgG, которые реагируют с антигенами красных кровяных телец температура тела.Основными причинами WAIHA являются идиопатический WAIHA, аутоиммунные заболевания и заболевания соединительной ткани (особенно системная красная волчанка, склеродермия, дерматомиозит, язвенный колит и ревматоидный артрит), лимфома, хронический лимфолейкоз и предшествующая трансплантация органов [8–13]. DIIHA чаще всего путают с идиопатическим WAIHA, который встречается чаще [2]. Тест на элюцию может быть полезен для дифференциации DIIHA от WAIHA. В случае WAIHA оба теста DAT и элюирование положительны. В редких случаях DDAB и почти во всех случаях DIAB тест на элюцию также может быть положительным.В этом случае единственный способ подтвердить диагноз DIIHA – это документальное подтверждение полного гематологического и серологического выздоровления после прекращения приема лекарственного средства, вызывающего нарушение [6].
В редких случаях DDAB и почти во всех случаях DIAB тест на элюцию также может быть положительным.В этом случае единственный способ подтвердить диагноз DIIHA – это документальное подтверждение полного гематологического и серологического выздоровления после прекращения приема лекарственного средства, вызывающего нарушение [6].
В заключение, обычно используемые безрецептурные лекарства могут иметь редкие, но серьезные побочные эффекты. Из-за их редкости гемолитические реакции, вызванные лекарствами, менее изучены по сравнению с тромбоцитопенией и гранулоцитопенией, вызванными лекарствами. Своевременное распознавание возбудителя болезни нельзя недооценивать, поскольку невыполнение этого требования может привести к продолжению приема вызывающего нарушения лекарственного средства и ухудшению гемолитической анемии пациента.В дополнение к отмене препарата и мониторингу гематологического восстановления иногда также могут потребоваться стероиды.
Авторские права
Авторские права © 2013 Aram Barbaryan et al. Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Лечение анемии и радиационный онколог: оптимизация результатов для пациентов
Анемия – частое осложнение рака и связанного с ним лечения.Хотя ее возникновение хорошо задокументировано в условиях химиотерапии, распространенность и природа анемии в условиях лучевой онкологии не были должным образом охарактеризованы. Предварительные результаты текущего ретроспективного исследования в Медицинском центре Бет Исраэль в Нью-Йорке показывают, что анемия легкой и средней степени тяжести (т. Е. Уровень гемоглобина от 10 до 12 г / дл) является обычным явлением при обращении за лучевой терапией и увеличивается ее распространенность и тяжесть во время лечения. курс лучевого лечения. Симптомы анемии легкой или средней степени тяжести, особенно утомляемость, могут существенно ухудшить качество жизни больных раком. Кроме того, в обширной литературе документально подтверждена связь между низким уровнем гемоглобина и плохим контролем над локорегиональной опухолью и выживаемостью после лечебной лучевой терапии. Более активные усилия радиационных онкологов по документированию и лечению анемии у пациентов, проходящих лучевую терапию, могут дать возможность улучшить постлучевые исходы и самочувствие. [ONCOLOGY 15: 1486-1496, 2001]
Кроме того, в обширной литературе документально подтверждена связь между низким уровнем гемоглобина и плохим контролем над локорегиональной опухолью и выживаемостью после лечебной лучевой терапии. Более активные усилия радиационных онкологов по документированию и лечению анемии у пациентов, проходящих лучевую терапию, могут дать возможность улучшить постлучевые исходы и самочувствие. [ONCOLOGY 15: 1486-1496, 2001]
Основные достижения в технологии и методах лучевой онкологии улучшили нашу способность достигать местного контроля опухолей с уменьшением тканевых осложнений.Общие цели текущих исследований в области радиационной онкологии включают (1) дальнейшее повышение уровня контроля над локорегиональными опухолями, что может привести к повышению выживаемости; (2) оценка схем радиохимиотерапии, которые содержат цитотоксические агенты нового поколения, некоторые из которых обладают радиосенсибилизирующими свойствами, с целью улучшения местного контроля и снижения частоты отдаленных метастазов; и (3) поддержание или улучшение качества жизни пациента во время и после терапии.
«Анемия хронического заболевания»
Поддержание или улучшение функционального и психосоциального статуса больного раком особенно важно в эпоху агрессивных комбинированных методов лечения и стратегий лечения высокими дозами.Анемия, наиболее частое гематологическое отклонение в популяции раковых больных (включая пациентов, поступающих на лечение или проходящих лучевую терапию), связана с симптомами (например, усталостью, головокружением, одышкой), которые могут значительно ухудшить качество жизни. На момент постановки диагноза рака это состояние обычно классифицируется как «анемия хронического заболевания»; со временем оно может усугубляться прогрессированием основного заболевания, хирургической кровопотерей или последующей химиотерапией и / или лучевой терапией.
До недавнего времени онкологи обычно не лечили анемию легкой и средней степени тяжести, потому что она воспринималась как «клинически неважная» в контексте опасных для жизни осложнений, включая другие гематологические аномалии. Однако это восприятие онкологов-медиков меняется. Недавние исследования показывают, что коррекция анемии от легкой до умеренной у онкологических больных может улучшить энергетический уровень [1,2], что может оказать сильное влияние на функциональные возможности, чувство благополучия и, в конечном итоге, на желание продолжить химиотерапию.
Однако это восприятие онкологов-медиков меняется. Недавние исследования показывают, что коррекция анемии от легкой до умеренной у онкологических больных может улучшить энергетический уровень [1,2], что может оказать сильное влияние на функциональные возможности, чувство благополучия и, в конечном итоге, на желание продолжить химиотерапию.
Два опроса больных раком показали, что утомляемость широко распространена во время химиотерапии или химиолучевой терапии и связана со значительными неблагоприятными последствиями для физического и психосоциального функционирования [3,4]. В более позднем опросе большинство пациентов сообщили, что утомляемость была продолжительной и имела оказывает большее влияние на их повседневную жизнь, чем боль, тошнота и депрессия. [4]
Хотя многие факторы могут вызывать или усугублять утомляемость, связанную с раком, [5] анемия является одной из наиболее распространенных причин.Несколько исследований показывают, что больные раком с более высоким уровнем гемоглобина меньше утомляются и имеют более благоприятное представление о качестве своей жизни. [6-8] Усталость также является хорошо известным побочным эффектом фракционированной лучевой терапии, но ее причины недостаточно изучены. Распространенность утомляемости неуклонно возрастает в течение курса лучевой терапии, часто достигая пика через несколько недель. [9-12]
[6-8] Усталость также является хорошо известным побочным эффектом фракционированной лучевой терапии, но ее причины недостаточно изучены. Распространенность утомляемости неуклонно возрастает в течение курса лучевой терапии, часто достигая пика через несколько недель. [9-12]
В условиях радиационной онкологии переливание крови обычно проводится для коррекции «тяжелой» анемии (т. Е. Уровень гемоглобина <8 г. / dL или ярко выраженные симптомы), [13,14], и если нет противопоказаний, в таких случаях следует проводить переливание крови.Тем не менее, коррекция анемии от легкой до умеренной может иметь положительное влияние на качество жизни. [1,2,7] Более того, появляющиеся данные предполагают, что анемия перед лечением и низкий уровень гемоглобина во время лучевой терапии являются факторами риска для плохого локально-регионарного контроля и выживания.
Распространенность анемии в радиационной онкологии
Радиологи-онкологи часто «наследуют» анемию, развившуюся в результате хирургической кровопотери, миелотоксической химиотерапии и / или запущенного заболевания. Распространенность анемии среди пациентов, поступающих на лучевую терапию, недостаточно документирована, но, как правило, считается, что значительная часть этих пациентов действительно заболевает анемией.Недавний обзор литературы выявил относительно высокую частоту анемии легкой и средней степени тяжести у пациентов, получающих монотерапию или комбинированную химиотерапию по поводу немиелоидных злокачественных новообразований. [15] Подобная оценка в условиях радиационной онкологии недоступна.
Распространенность анемии среди пациентов, поступающих на лучевую терапию, недостаточно документирована, но, как правило, считается, что значительная часть этих пациентов действительно заболевает анемией.Недавний обзор литературы выявил относительно высокую частоту анемии легкой и средней степени тяжести у пациентов, получающих монотерапию или комбинированную химиотерапию по поводу немиелоидных злокачественных новообразований. [15] Подобная оценка в условиях радиационной онкологии недоступна.
Текущее ретроспективное исследование в Медицинском центре Бет Исраэль оценивает распространенность анемии (определяемой как гемоглобин <12 г / дл) непосредственно перед и во время лучевой терапии. [16] Мы проводим это исследование путем случайной выборки пациентов, получавших лучевую терапию с декабря 1996 года.По состоянию на июнь 1999 г., в общей сложности 574 пациента были подвержены оценке с относительно равномерным распределением рака простаты (16%), груди (14%), головы / шеи (12%), толстой / прямой кишки (11%), легкие / бронхи (11%) и шейка матки (9%). Общая распространенность анемии (гемоглобин <12 г / дл) при обращении за лучевой терапией составляла примерно 41% (28% и 54% мужчин и женщин соответственно). По завершении лучевой терапии у 43% мужчин и 63% женщин была анемия (общая распространенность 54%), которая обычно была легкой или средней степени тяжести (т. Е. Уровень гемоглобина от 10 до 12 г / дл).
Общая распространенность анемии (гемоглобин <12 г / дл) при обращении за лучевой терапией составляла примерно 41% (28% и 54% мужчин и женщин соответственно). По завершении лучевой терапии у 43% мужчин и 63% женщин была анемия (общая распространенность 54%), которая обычно была легкой или средней степени тяжести (т. Е. Уровень гемоглобина от 10 до 12 г / дл).
У подгруппы пациентов с раком шейки матки была самая высокая распространенность анемии на исходном уровне (75%) и после завершения лучевой терапии (79%), тогда как у пациентов с раком простаты была самая низкая распространенность анемии в обеих точках оценки ( 9% и 26% соответственно). Распространенность анемии значительно увеличилась во время лучевой терапии у пациентов с раком простаты и пациентов с колоректальным раком (от 44% до 63%), раком легких / бронхов (от 55% до 77%) или головы / шеи (от 34% до 57%).Во всех подгруппах опухолей низкий уровень гемоглобина обычно составлял от 10 до 12 г / дл.
Предварительные результаты этого исследования показывают, что анемия легкой и средней степени тяжести является распространенной проблемой в лучевой онкологии как при обращении, так и после завершения лучевой терапии. Похоже, что у большинства пациентов с лучевой онкологией с анемией (от 60% до 80%) уровень гемоглобина можно легко скорректировать (от 10 до 12 г / дл). Ожидается, что окончательная база данных пациентов будет насчитывать более 1000 пациентов. Насколько нам известно, это первое крупномасштабное исследование, разработанное для систематической характеристики распространенности и характера анемии в условиях радиационной онкологии.
Похоже, что у большинства пациентов с лучевой онкологией с анемией (от 60% до 80%) уровень гемоглобина можно легко скорректировать (от 10 до 12 г / дл). Ожидается, что окончательная база данных пациентов будет насчитывать более 1000 пациентов. Насколько нам известно, это первое крупномасштабное исследование, разработанное для систематической характеристики распространенности и характера анемии в условиях радиационной онкологии.
Значение анемии в радиационной онкологии
В последние годы все больше осознается способность анемии ухудшать качество жизни онкологических больных. Также, по-видимому, существует связь между анемией и низкими показателями контроля над заболеванием и выживаемости в условиях радиационной онкологии. Обширная литература предоставляет доказательства связи между низким уровнем гемоглобина и низким локально-региональным контролем / выживаемостью после лечебной лучевой терапии. Эта связь наиболее широко изучена у пациентов, получающих фракционированную лучевую терапию по поводу рака шейки матки [17–21] или рака головы и шеи. [22-26]
[22-26]
Предлагаемые механизмы
Регрессионные анализы неизменно показывают, что исходная анемия (определяемая по-разному) является независимым предиктором локорегионального контроля и общей выживаемости без болезни или общей выживаемости у этих пациентов. [17-26] Предполагаемое значение. Связующим звеном между низким уровнем гемоглобина и плохим локорегиональным контролем солидных опухолей является молекулярный кислород, хорошо известный радиосенсибилизатор (рис. 1). Многочисленные исследования выявили внутриопухолевую гипоксию как неблагоприятный прогностический фактор для локального контроля и выживаемости у пациентов, получающих радикальную лучевую терапию по поводу рака шейки матки или рака головы и шеи.[27,28] Кроме того, предрадиационная гипоксия была связана с повышенным риском отдаленных метастазов у пациентов, получающих лучевую терапию в сочетании с гипертермией по поводу сарком мягких тканей. [29]
Низкий уровень гемоглобина коррелировал с плохой внутриопухолевой оксигенацией. [30,31] Например, в недавнем исследовании Strauss et al., Исходный уровень гемоглобина <13 г / дл был связан с низким внутриопухолевым уровнем pO2 у пациентов, перенесших лучевая терапия при распространенном раке шейки матки.[31] Хотя предполагается, что низкий уровень гемоглобина усугубляет ранее существовавшее гипоксическое состояние солидных опухолей, эта взаимосвязь и ее значимость в клинических условиях остаются спорными. [26,31-33]
[30,31] Например, в недавнем исследовании Strauss et al., Исходный уровень гемоглобина <13 г / дл был связан с низким внутриопухолевым уровнем pO2 у пациентов, перенесших лучевая терапия при распространенном раке шейки матки.[31] Хотя предполагается, что низкий уровень гемоглобина усугубляет ранее существовавшее гипоксическое состояние солидных опухолей, эта взаимосвязь и ее значимость в клинических условиях остаются спорными. [26,31-33]
Значения гемоглобина
Интересно, что гемоглобин уровни от 12 до 14 г / дл использовались для стратификации пациентов в отдельных исследованиях рака шейки матки [34] и головы и шеи [22-26], что позволяет предположить, что значения гемоглобина находятся в этом диапазоне (а не пороговом уровне 10 г / дл) должны побудить к рассмотрению вмешательств, направленных на лечение анемии.В одном из последних опубликованных исследований влияния анемии на исход лучевой терапии участвовало около 600 пациентов с раком шейки матки [34]. В этом канадском исследовании средний недельный уровень гемоглобина в надир 12 г / дл или более во время лучевой терапии был связан со значительным повышением частоты локальных / отдаленных рецидивов заболевания и 5-летней выживаемости. [34]
В этом канадском исследовании средний недельный уровень гемоглобина в надир 12 г / дл или более во время лучевой терапии был связан со значительным повышением частоты локальных / отдаленных рецидивов заболевания и 5-летней выживаемости. [34]
Исследователи из онкологического центра Фокса Чейза обнаружили, что пациенты с карциномой голосовой щели T1 / 2 с уровнем гемоглобина перед лучевой терапией> 13 г / дл достигли более высоких показателей местного контроля и выживаемости в течение 2 лет (95% и 88% соответственно), чем пациенты с уровень гемоглобина ниже этого порога (66% и 46% соответственно).[23] Фактически, уровень гемоглобина был единственным фактором, который существенно влиял как на местный контроль, так и на выживаемость при регрессионном анализе. [23]
В недавнем исследовании, проведенном Группой радиационной терапии онкологии (RTOG), пациенты с плоскоклеточным раком головы / шеи стадии III / IV с низким уровнем гемоглобина (т.е. <14,5 г / дл для мужчин и <13 г / дл для женщин ) в начале курса лучевой терапии показали менее благоприятные показатели 5-летней локорегиональной недостаточности и выживаемости (68% и 22% соответственно) по сравнению с пациентами с более высоким уровнем гемоглобина (52% и 36% соответственно). [24]
[24]
Другие подгруппы
Растущие данные свидетельствуют о том, что анемия до лечения влияет на результаты лучевой терапии при других типах опухолей, включая немелкоклеточный рак легкого [35–38] простаты [39] и анальный рак [40]. ] Хотя это менее широко документировано, снижение уровня гемоглобина во время лучевой терапии также, по-видимому, отрицательно влияет на контроль и выживаемость местных заболеваний. [19,41-46]
Потенциальные стратегии преодоления гипоксии
Коррекция анемии и применение препаратов, направленных на гипоксию. методы лечения, такие как сенсибилизаторы гипоксических клеток, могут влиять на исход болезни в условиях радиационной онкологии.Ранняя коррекция анемии легкой и средней степени тяжести может рассматриваться как средство отсрочки развития и прогрессирования внутриопухолевой гипоксии. Комбинация вмешательств, направленных на анемию и гипоксию, является разумным соображением до начала курса лучевой терапии.
Сенсибилизаторы гипоксических клеток
Нацеливание на гипоксическую среду солидных опухолей – один из подходов к преодолению гипоксии в клинической практике. Сенсибилизаторы гипоксических клеток оказывают прямое действие на ДНК, вызывая цитотоксичность независимо от лучевой терапии.[47] Клинические испытания оценивали митомицин (мутамицин) в качестве дополнения к лучевой терапии у пациентов с раком головы и шеи, шейки матки и других локализаций. [47-53] Анализ объединенных данных двух рандомизированных исследований с аналогичным дизайном продемонстрировал что добавление митомицина к лучевой терапии у пациентов с раком головы и шеи приводит к статистически и клинически значимому улучшению локальной безрецидивной выживаемости (85% против 66% для одной лучевой терапии), локальной безрецидивной выживаемости (76% против 54% для только радиация), и выживаемость по конкретной причине через 5 лет (74% против 51% только для радиации).[47]
Сенсибилизаторы гипоксических клеток оказывают прямое действие на ДНК, вызывая цитотоксичность независимо от лучевой терапии.[47] Клинические испытания оценивали митомицин (мутамицин) в качестве дополнения к лучевой терапии у пациентов с раком головы и шеи, шейки матки и других локализаций. [47-53] Анализ объединенных данных двух рандомизированных исследований с аналогичным дизайном продемонстрировал что добавление митомицина к лучевой терапии у пациентов с раком головы и шеи приводит к статистически и клинически значимому улучшению локальной безрецидивной выживаемости (85% против 66% для одной лучевой терапии), локальной безрецидивной выживаемости (76% против 54% для только радиация), и выживаемость по конкретной причине через 5 лет (74% против 51% только для радиации).[47]
Совсем недавно было обнаружено, что уровень местного контроля и выживаемости у пациентов с раком головы и шеи наиболее благоприятен у тех, кто получал непрерывную гиперфракционированную ускоренную лучевую терапию по Вене (V-CHART) плюс митомицин (48% и 39%, соответственно) ) по сравнению с теми, кто получал только V-CHART (34% и 28% соответственно) или обычное фракционирование (31% и 27%, соответственно). [51,52]
[51,52]
Эритропоэтин
Переливание красных кровяных телец является несколько непопулярное вмешательство, направленное на борьбу с анемией, среди пациентов и медицинских работников, в основном из-за хорошо известных рисков (например, инфекций, острых / хронических реакций, иммуносупрессии) и неудобств, а также из-за продолжающегося дефицита кровоснабжения.[33,54] В качестве альтернативы рекомбинантный человеческий эритропоэтин (эпоэтин альфа, эпоген, прокрит) может быть использован для лечения анемии, связанной с химиотерапией, у пациентов с немиелоидными злокачественными новообразованиями.
В исследованиях фазы I / II эритропоэтин хорошо переносился и повышал уровень гемоглобина у пациентов с анемией до лучевой терапии – среднее повышение гемоглобина во время лучевой терапии составляло приблизительно 0,60 г / дл в неделю [13,55-58]. В большинстве этих исследований использовался эритропоэтин в дозе 150 Ед / кг три раза в неделю (начиная как минимум за 1 неделю до лучевой терапии) с дополнительным железом. Наш опыт в области радиационной онкологии показал, что нормальный гемоглобин обычно может быть достигнут в течение 2–3 недель после начала этой терапии у пациентов с легкой или умеренной предлучевой анемией. Эритропоэтин один раз в неделю может быть одинаково эффективным для повышения уровня гемоглобина и снижения потребности в переливании крови во время химиотерапии и химиолучевой терапии, как недавно было продемонстрировано в исследованиях на уровне сообществ. [59,60]
Наш опыт в области радиационной онкологии показал, что нормальный гемоглобин обычно может быть достигнут в течение 2–3 недель после начала этой терапии у пациентов с легкой или умеренной предлучевой анемией. Эритропоэтин один раз в неделю может быть одинаково эффективным для повышения уровня гемоглобина и снижения потребности в переливании крови во время химиотерапии и химиолучевой терапии, как недавно было продемонстрировано в исследованиях на уровне сообществ. [59,60]
Предварительные результаты более позднего исследования, ориентированного на пациентов. которые получали последовательное или сопутствующее химиолучевое лечение, показали, что среднее увеличение уровня гемоглобина за 16-недельный период лечения составило 2.0 г / дл (от 1,8 до 3,4 г / дл, в зависимости от компонента химиотерапии). [60] Полная нормализация уровня гемоглобина до начала лучевой терапии может не иметь решающего значения, пока пациенты проходят активное лечение от анемии. Гематопоэтические эффекты эритропоэтина во время лучевой терапии побудили исследовать его профилактическое применение перед назначением высокомиелотоксических режимов химиолучевой терапии для лечения немелкоклеточного рака легкого и головы и шеи. [61-63]
[61-63]
Влияние на локорегиональный контроль и Выживаемость – Прогностическое значение предрадиационной анемии у пациентов с раком головы, шеи и шейки матки предполагает, что повышение уровня гемоглобина до нормального диапазона может привести к увеличению выживаемости.Есть также убедительные доказательства того, что коррекция анемии эритропоэтином улучшает локорегиональный контроль опухоли и выживаемость после облучения или химиолучевой терапии при раке головы и шеи. [56,64,65]
В исследовании Glaser et al, 37 пациентов с исходным уровнем гемоглобина. <12,5 г / дл получали эритропоэтин три раза в неделю во время режима неоадъювантной химиолучевой терапии на основе фторурацила при плоскоклеточной карциноме полости рта. [64] Доля пациентов с остаточной болезнью на момент хирургической резекции была значительно ниже среди этих пациентов по сравнению с исторической контрольной группой, которая не получала эритропоэтин (32% против 73%, P =.001). [64] Более того, местные рецидивы были отмечены у 11% пациентов, получавших эритропоэтин, и у 30% пациентов контрольной группы после 17-месячного периода наблюдения ( P = 0,03) [64].
Последующее исследование Glaser et al показало, что двухлетний локорегиональный контроль и показатели выживаемости улучшились при применении эритропоэтина три раза в неделю у пациентов с анемией (уровень гемоглобина <14,5 г / дл) в начале химиолучевой терапии для полости рта и рак ротоглотки. [65] Частота 2-летнего локорегионального контроля составила 95% у пациентов с анемией, получавших эритропоэтин, 88% у пациентов без анемии до лечения и 72% у пациентов с анемией, которые не получали эритропоэтин во время химиолучевой терапии.[65] Общие показатели выживаемости, указанные для этих групп пациентов, составили 93%, 84% и 62% соответственно. [65]
В проспективном исследовании Юго-Западной онкологической группы (SWOG) оценивалось влияние эритропоэтина и перорального железа на общую выживаемость без прогрессирования заболевания и общую выживаемость 52 пациентов, получавших одновременно цисплатин (платинол) и облучение органов малого таза при раке шейки матки на стадиях IIB-IVA [66]. Средние уровни гемоглобина составляли 10,3 г / дл на исходном уровне и 12,0 г / дл по завершении 5-недельного курса химиолучевой терапии с постепенным увеличением в течение периода исследования.Целевой уровень гемоглобина 12,5 г / дл был достигнут 40% пациентов до получения 13-й фракции облучения. Среди пациентов с подтвержденным ответом на заболевание общий ответ на химиолучевую терапию составил 60%, со средним интервалом без прогрессирования 15 месяцев и средней продолжительностью выживания 23 месяца. Это исследование SWOG было прекращено досрочно из-за небольшого повышения уровня гемоглобина, отмеченного во время химиолучевой терапии.
Средние уровни гемоглобина составляли 10,3 г / дл на исходном уровне и 12,0 г / дл по завершении 5-недельного курса химиолучевой терапии с постепенным увеличением в течение периода исследования.Целевой уровень гемоглобина 12,5 г / дл был достигнут 40% пациентов до получения 13-й фракции облучения. Среди пациентов с подтвержденным ответом на заболевание общий ответ на химиолучевую терапию составил 60%, со средним интервалом без прогрессирования 15 месяцев и средней продолжительностью выживания 23 месяца. Это исследование SWOG было прекращено досрочно из-за небольшого повышения уровня гемоглобина, отмеченного во время химиолучевой терапии.
RTOG проводит рандомизированное исследование III фазы эритропоэтина в качестве дополнения к лучевой терапии у пациентов с раком головы и шеи.[67] Сравнительные данные о локорегиональном контроле и выживаемости ожидаются в ближайшее время и дадут дополнительную информацию о том, влияет ли коррекция анемии во время лучевой терапии на долгосрочные результаты.
Влияние на качество жизни – Два небольших радиационных исследования терапии эритропоэтином оценивали качество жизни пациентов с недельными интервалами и показали тенденцию к улучшению качества жизни. [55,58] Крупные исследования на уровне сообществ. эритропоэтина, вводимого три раза в неделю или один раз в неделю более чем 7500 пациентам с анемическим раком, проходящим химиотерапию или химиолучевую терапию, продемонстрировали сравнительно значительные положительные эффекты на самооценку энергетических уровней, способности выполнять повседневные действия и общего качества жизни.[1,2,59,60] Предварительные результаты другого исследования эритропоэтина, вводимого один раз в неделю в качестве дополнения к последовательным или одновременным режимам химиолучевой терапии, дополнительно подтверждают эти преимущества для качества жизни. [60]
Выводы
На основании данных Медицинского центра Бет Исраэль о распространенности анемии, уровни гемоглобина в диапазоне от 10 до 12 г / дл являются обычным явлением в условиях радиационной онкологии. Текущие исследования направлены на определение взаимосвязи между степенью и скоростью снижения гемоглобина и развитием утомляемости, а также влиянием анемии на другие показатели качества жизни у онкологической популяции.Такие стратегии, как сенсибилизаторы гипоксических клеток (митомицин) и терапия, направленная на анемию (эритропоэтин, переливание крови), являются разумным вмешательством для пациентов, планирующих пройти лучевую терапию. Лечение анемии легкой и средней степени может потенциально влиять как на ответ опухоли, так и на качество жизни пациента.
Текущие исследования направлены на определение взаимосвязи между степенью и скоростью снижения гемоглобина и развитием утомляемости, а также влиянием анемии на другие показатели качества жизни у онкологической популяции.Такие стратегии, как сенсибилизаторы гипоксических клеток (митомицин) и терапия, направленная на анемию (эритропоэтин, переливание крови), являются разумным вмешательством для пациентов, планирующих пройти лучевую терапию. Лечение анемии легкой и средней степени может потенциально влиять как на ответ опухоли, так и на качество жизни пациента.
Долгосрочные преимущества коррекции анемии во время лучевой или химиолучевой терапии еще не установлены. Однако взаимосвязь между пострадиационным локальным контролем и выживаемостью не всегда ясна, и любое увеличение выживаемости может фактически быть специфическим для болезни.Как онкологи-радиологи, мы должны уделять больше внимания диагностике и лечению анемии с целью улучшения исходов заболеваний и благополучия пациентов.
Благодарность: Д-р Харрисон получил грантовую поддержку от Ortho Biotech Products, LP
Ссылки:
1. Деметри Г.Д., Крис М., Уэйд Дж. И др. Для исследовательской группы Procrit: качество жизни. у пациентов с химиотерапией, получавших эпоэтин альфа, не зависит от реакции на заболевание или типа опухоли: результаты проспективного онкологического исследования в сообществе.J Clin Oncol 16: 3412-3425, 1998.
2. Гласпи Дж., Буковски Р., Штейнберг Д. и др. Для исследовательской группы Procrit: Влияние терапии эпоэтином альфа на клинические исходы у пациентов с немиелоидными злокачественными новообразованиями во время химиотерапии рака в онкологической практике. J Clin Oncol 15: 1218-1234, 1997.
3. Фогельзанг Н.Дж., Брейтбарт В., Селла Д. и др.: Восприятие пациентом, опекуном и онкологом усталости, связанной с раком: результаты трехкомпонентного оценочного опроса. Semin Hematol 34 (приложение 2): 4-12, 1997.
4. Курт Г.А., Брейтбарт В. , Селла Д.Ф. и др.: Влияние усталости, связанной с раком, на жизнь пациентов (аннотация 2214). Proc Am Soc Clin Oncol 18: 573a, 1999.
, Селла Д.Ф. и др.: Влияние усталости, связанной с раком, на жизнь пациентов (аннотация 2214). Proc Am Soc Clin Oncol 18: 573a, 1999.
5. Портеной Р.К., Итри Л.М.: Усталость, связанная с раком: Руководство по оценке и лечению. Онколог 4: 1-10, 1999.
6. Cella D: Шкала функциональной оценки терапии рака – анемия (FACT-An): новый инструмент для оценки результатов при онкологической анемии и утомляемости. Semin Hematol 34 (приложение 2): 13-19, 1997.
7. Cella D: Факторы, влияющие на качество жизни онкологических больных: анемия и усталость. Semin Oncol 25 (Suppl 7): 43-46, 1998.
8. Йеллен С.Б., Селла Д.Ф., Вебстер К. и др.: Измерение усталости и других связанных с анемией симптомов с помощью системы измерения функциональной оценки терапии рака (FACT). . J Pain Symptom Manage 13: 63-74, 1997.
9. Гринберг Д. Б., Савика Дж., Эйзенталь С. и др.: Синдром усталости из-за локализованного излучения. J Pain Symptom Manage 7: 38-45, 1992.
10. Haylock PJ, Hart LK: Усталость у пациентов, получающих локализованное облучение. Cancer Nurs 2: 461-467, 1979.
Cancer Nurs 2: 461-467, 1979.
11. King KB, Nail LM, Kreamer K и др.: Описание пациентами опыта получения лучевой терапии. Oncol Nurs Forum 12: 55-61, 1985.
12. Kobashi-Schoot JAM, Hanewald GJFP, Van Dam FSAM и др.: Оценка недомогания у онкологических больных, получавших лучевую терапию. Cancer Nurs 8: 306-313, 1985.
13. Lavey RS, Dempsey WH: Эритропоэтин увеличивает гемоглобин у онкологических больных во время лучевой терапии.Int J Radiat Oncol Biol Phys 27: 1147-1152, 1993.
14. Pedersen D, Søgaard H, Overgaard J и др.: Прогностическое значение факторов предварительного лечения у пациентов с местнораспространенным раком шейки матки, леченных лучевой терапией. один. Acta Oncologica 34: 787-795, 1995.
15. Groopman JE, Itri LM: Анемия, вызванная химиотерапией у взрослых: заболеваемость и лечение. J Natl Cancer Inst 91: 1616-1633, 1999.
16. Харрисон Л. Б., Шаша С., Шиаова Л. и др.: Распространенность анемии у онкологических больных, проходящих лучевую терапию (аннотация 1849). Proc Am Soc Clin Oncol 19: 471a, 2000.
Proc Am Soc Clin Oncol 19: 471a, 2000.
17. Hong J-H, Tsai C-S, Chang JT, et al: Прогностическое значение уровней SCC до и после лечения у пациентов с плоскоклеточным раком шейки матки, получавших лучевую терапию. Int J Radiat Oncol Biol Phys 41: 823-830, 1998.
18. Кагеи К., Ширато Х., Нисиока Т. и др.: Внутриполостное облучение с высокой мощностью дозы с использованием линейного расположения источников для плоскоклеточного рака II и III стадии. шейка матки. Радиотер Онкол 47: 207-213, 1998.
19. Logsdon MD, Eifel PJ: плоскоклеточный рак шейки матки FIGO IIIB: анализ прогностических факторов, подчеркивающих баланс между внешним пучком и внутриполостной лучевой терапией. Int J Radiat Oncol Biol Phys 43: 763-775, 1999.
20. Мундт А.Дж., Коннелл П.П., Кэмпбелл Т. и др.: Раса и клинический исход у пациентов с карциномой шейки матки, получавших лучевую терапию. Gynecol Oncol 71: 151-158, 1998
21. Такеши К., Кацуюки К., Йошиаки Т. и др.: Окончательная лучевая терапия в сочетании с брахитерапией с высокой мощностью дозы для рака шейки матки III стадии: ретроспективный анализ прогностических факторов, касающихся пациента характеристики и параметры лечения. Int J Radiat Oncol Biol Phys 41: 319-327, 1998.
Int J Radiat Oncol Biol Phys 41: 319-327, 1998.
22. Дубрей Б., Моссери В., Брунин Ф. и др.: Анемия связана с более низким локально-региональным контролем и выживаемостью после лучевой терапии рака головы и шеи: Перспективное исследование. Radiology 201: 553-558, 1996.
23. Фейн Д.А., Ли В.Р., Хэнлон А.Л. и др.: Уровень гемоглобина перед лечением влияет на местный контроль и выживаемость плоскоклеточного рака Т1-Т2 гортани. J Clin Oncol 13: 2077-2083, 1995.
24. Ли В. Р., Берки Б., Марсиаль В. и др.: Анемия связана со снижением выживаемости и увеличением локорегиональной недостаточности у пациентов с местнораспространенным раком головы и шеи: вторичный анализ RTOG 85-27.Int J Radiat Oncol Biol Phys 42: 1069-1075, 1998.
25. Штадлер П., Беккер А., Фельдманн Х. Дж. И др.: Влияние гипоксического субобъема на выживаемость пациентов с раком головы и шеи. Int J Radiat Oncol Biol Phys 44: 749-754, 1999.
26. Warde P, O’Sullivan B, Bristow RG, et al: T1 / T2 рак голосовой щели, управляемый дистанционной лучевой терапией: влияние гемоглобина до лечения на местное управление. Int J Radiat Oncol Biol Phys 41: 347-353, 1998.
Int J Radiat Oncol Biol Phys 41: 347-353, 1998.
27. Файлс А.В., Милошевич М., Вонг Р. и др.: Оксигенация предсказывает радиационный ответ и выживаемость у пациентов с раком шейки матки.Radiother Oncol 48: 149-156, 1998.
28. Штадлер П., Беккер А., Фельдманн Х. Дж. И др.: Влияние гипоксического субобъема на выживаемость пациентов с раком головы и шеи. Int J Radiat Oncol Biol Phys 44: 749-754, 1999.
29. Бризель Д.М., Скалли С.П., Харрельсон Дж. М. и др.: Оксигенация опухоли предсказывает вероятность отдаленных метастазов в саркоме мягких тканей человека. Cancer Res 56: 941-943, 1996.
30. Molls M, Stadler P, Becker A, et al.: Значение кислорода в радиационной онкологии: механизмы действия, корреляция с низким уровнем гемоглобина.Strahlenther Onkol 174: 13-16, 1998.
31. Strauss HG, Haensgen G, Becker A и др.: Прогностическое влияние изменений pO2 в опухолевой ткани во время ранней лучевой терапии при раке шейки матки: Улучшенный местный контроль в первично гипоксических опухолях с «реоксигенация» и влияние гемоглобина (аннотация 2168). Int J Radiat Oncol Biol Phys 45 (приложение): 364, 1999.
Int J Radiat Oncol Biol Phys 45 (приложение): 364, 1999.
32. Obralic N, Bilenjki D, Bilbija Z: Прогностическое значение параметров, связанных с анемией, у пациентов с карциномой шейки матки.Acta Oncologica 29: 199-201, 1990.
33. Rockwell S: Доставка кислорода: значение для биологии и терапии солидных опухолей. Oncol Res 9: 383-390, 1997.
34. Гроган М., Томас Г.М., Меламед I и др.: Важность уровней гемоглобина во время лучевой терапии рака шейки матки. Cancer 86: 1528-1536, 1999.
35. Takigawa N, Segawa Y, Okahara M и др.: Факторы прогноза для пациентов с распространенным немелкоклеточным раком легкого: одномерный и многомерный анализ, включая рекурсивное разделение и слияние.Lung Cancer 15: 67-77, 1996.
36. Cole CJ, Pollack A, Zagars GK и др.: Местный контроль мышечно-инвазивного рака мочевого пузыря: предоперационная лучевая терапия и цистэктомия по сравнению с одной цистэктомией. Int J Radiat Oncol Biol Phys 32: 331-340, 1995.
37. Hannisdal E, Fossà ¥ SD, Høst H: Анализы крови и прогноз при карциномах мочевого пузыря, леченных радикальной лучевой терапией. Radiother Oncol 27: 117-122, 1993.
Radiother Oncol 27: 117-122, 1993.
38. Поллак А., Загарс Г.К., Динни С.П. и др.: Предоперационная лучевая терапия при мышечно-инвазивной карциноме мочевого пузыря.Cancer 74: 2819-2827, 1994.
39. Данфи Е.П., Петерсен И.А., Кокс RS и др.: Влияние начальных уровней гемоглобина и артериального давления на результаты лучевой терапии рака простаты. Int J Radiat Oncol Biol Phys 16: 1173-1178, 1989.
40. Constantinou EC, Daly W., Fung CY и др.: Соображения по поводу временной дозы при лечении рака анального канала. Int J Radiat Oncol Biol Phys 39: 651-657, 1997.
41. Chatani M, Matayoshi Y, Masaki N и др.: Внутриполостное облучение с высокой мощностью дозы при раке шейки матки: побочный эффект продления лечения.Strahlenther Onkol 173: 379-384, 1997.
42. Гирински Т., Пейович-Ленфант М.Х., Бурхис Дж. И др.: Прогностическое значение концентраций гемоглобина и переливания крови при запущенной карциноме шейки матки, леченной лучевой терапией: Результаты ретроспективное исследование 386 пациентов.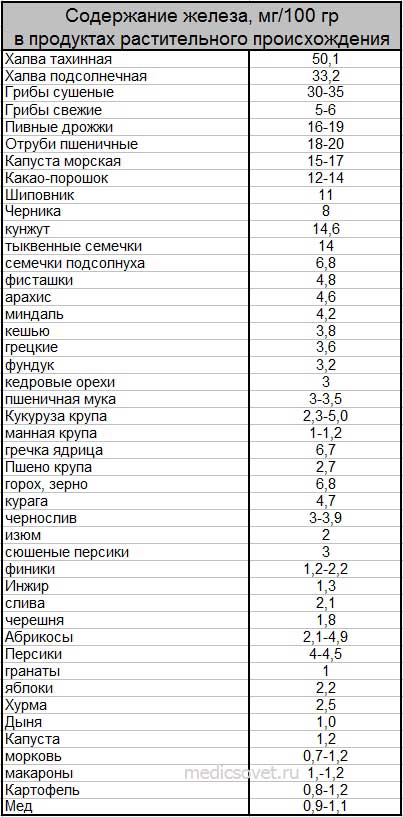 Int J Radiat Oncol Biol Phys 16: 37-42, 1989.
Int J Radiat Oncol Biol Phys 16: 37-42, 1989.
43. Rader JS, Haraf DJ, Halpern HJ и др.: Лучевая терапия в лечении рака шейки матки: опыт Чикагского университета / больницы Майкла Риза.J Surg Oncol 44: 157-165, 1990.
44. Skladowski K, Tarnawski R, Maciejewski B и др.: Клиническая радиобиология плоскоклеточной карциномы T1 голосовой щели. Int J Radiat Oncol Biol Phys 43: 101-106, 1999.
45. Tarnawski R, Skladowski K, Maciejewski B: Прогностическое значение концентрации гемоглобина в лучевой терапии рака надгортанной гортани. Int J Radiat Oncol Biol Phys 38: 1007-1011, 1997.
46. van Acht MJJ, Hermans J, Boks DES и др.: Прогностическое значение гемоглобина и снижение гемоглобина во время лучевой терапии при карциноме гортани.Radiother Oncol 23: 229-235, 1992.
47. Haffty BG, Son YH, Papac R, et al: Химиотерапия в качестве дополнения к радиации при лечении плоскоклеточного рака головы и шеи: результаты йельского митомицина рандомизированные испытания. J Clin Oncol 15: 268-276, 1997.
J Clin Oncol 15: 268-276, 1997.
48. Coia LR, Engstrom PF, Paul AR, et al: Долгосрочные результаты инфузионного 5-FU, митомицина-C и облучения как первичного лечения карциномы пищевода. Int J Radiat Oncol Biol Phys 20: 29-36, 1991.
49. Каммингс Б.Дж., Кин Т.Дж., О’Салливан Б. и др.: Эпидермоидный рак анального канала: лечение только радиацией или радиацией и 5-фторурацилом с и без митомицин С.Int J Radiat Oncol Biol Phys 21: 1115-1125, 1991.
50. Dobrowsky W: Митомицин С, 5-фторурацил и облучение при запущенном, местно-рецидивирующем раке прямой кишки. Br J Radiol 65: 143-147, 1992.
51. Dobrowsky W, Naudé J, Widder J и др.: Непрерывная гиперфракционированная ускоренная лучевая терапия с / без митомицина C при раке головы и шеи. Int J Radiat Oncol Biol Phys 42: 803-806, 1998.
52. Dobrowsky WH, Naudé J, Widder J, et al: Непрерывная гиперфракционированная ускоренная лучевая терапия и митомицин C при раке головы и шеи (аннотация 7).Int J Radiat Oncol Biol Phys 45 (добавлен): 148, 1999.
53. Сиванесаратнам В., Джаялакшми П.: адъювантная химиотерапия с помощью митомицина С после гистерэктомии Вертхайма при раке шейки матки стадии IB. Cancer 64: 798-800, 1989.
54. Генри Д.Х.: Изменение схем лечения при лечении анемии. Semin Oncol 19 (Suppl 8): 3-7, 1992.
55. Dusenbery KE, McGuire WA, Holt PJ, et al: Эритропоэтин увеличивает гемоглобин во время лучевой терапии рака шейки матки. Int J Radiat Oncol Biol Phys 29: 1079-1084, 1994.
56. Хенке М., Гуттенбергер Р., Барке А. и др.: Эритропоэтин для пациентов, проходящих лучевую терапию: пилотное исследование. Radiother Oncol 50: 185-190, 1999.
57. Суини П.Дж., Николае Д., Игнасио Л. и др.: Эффект подкожного рекомбинантного человеческого эритропоэтина у онкологических больных, получающих лучевую терапию: Заключительный отчет рандомизированной открытой фазы II испытание. Br J Cancer 77: 1996-2002, 1998.
58. Виджаякумар С., Роуч М. III, Вара В. и др.: Эффект подкожного рекомбинантного человеческого эритропоэтина у онкологических больных, получающих лучевую терапию: предварительные результаты рандомизированного открытого исследования, фаза II испытания. Int J Radiat Oncol Biol Phys 26: 721-729, 1993.
Int J Radiat Oncol Biol Phys 26: 721-729, 1993.
59. Gabrilove JL, Einhorn LH, Livingston RB, et al: Еженедельное дозирование эпоэтина альфа аналогично трехкратному еженедельному дозированию для увеличения гемоглобина и качество жизни (аннотация 2216). Proc Am Soc Clin Oncol 18: 574a, 1999.
60. Shasha D, George MJ, Harrison LB: Еженедельное введение эпоэтина альфа увеличивает гемоглобин и улучшает качество жизни больных раком с анемией, получающих лучевую терапию одновременно или последовательно с химиотерапия (аннотация 916).Blood 96 (часть IA): 434a, 2000.
61. Lavey RS: Опыт клинических испытаний с использованием эритропоэтина во время лучевой терапии. Strahlenther Onkol 174 (Suppl IV): 24-30, 1998.
62. Lee JS, Komaki R, Touroutoglou N, et al: Эритропоэтин (EPO) предотвращает анемию во время одновременной химиолучевой терапии (RT) для местнораспространенных неоперабельных неоперабельных заболеваний. мелкоклеточный рак легкого (НМРЛ) (аннотация 1780). Proc Am Soc Clin Oncol 17: 463a, 1998.
Proc Am Soc Clin Oncol 17: 463a, 1998.
63. Rosen FR, Brockstein BE, Haraf D, et al: Многоцентровое рандомизированное исследование фазы II 1-часовой инфузии паклитаксела (T), фторурацила (5-FU) и гидроксимочевины ( HU) с сопутствующей гиперфракционированной (BID) лучевой терапией (XRT) с эритропоэтином (EPO) или без него при распространенном раке полости рта, глотки и гортани: промежуточный анализ (аннотация 1519).Proc Am Soc Clin Oncol 18: 393a, 1999.
64. Glaser C, Millesi W., Gössweiner S, et al: R-HuErythropoietin увеличивает эффективность неоадъювантной радиохимиотерапии у пациентов с плоскоклеточным раком полости рта (аннотация 1532). Proc Am Soc Clin Oncol 17: 397a, 1998.
65. Glaser CM, Millesi W., Kornek GV и др.: Влияние уровня гемоглобина (HGB) и использование рекомбинантного эритропоэтина человека на ответ на неоадъювантную химиолучевую терапию, контроль опухолей, и выживаемость пациентов с плоскоклеточным раком полости рта или ротоглотки (SCCA) (аннотация 10). Int J Radiat Oncol Biol Phys 45 (Suppl): 149, 1999.
Int J Radiat Oncol Biol Phys 45 (Suppl): 149, 1999.
66. Lavey RS, Liu PY, Greer BE и др .: Рекомбинантный человеческий эритропоэтин (EPO) в качестве дополнения к параллельной лучевой терапии (RT) и цисплатин для Карцинома шейки матки IIb-IVa стадии: исследование Юго-Западной онкологической группы (аннотация 330). Radiother Oncol 56 (приложение 1): s92, 2000.
67. Machtay M: рандомизированное исследование фазы III лучевой терапии с эпоэтином альфа или без него у пациентов с анемией и плоскоклеточным раком головы и шеи.Протокол RTOG-9903, RTOG-DEV-1008. Доступно на: http://cancernet.nci.nih.gov.
Может ли гормональный контроль над рождаемостью облегчить анемию? Диагностика и лечение
Медицинская проверка проведена Софией Йен, доктором медицины, магистром здравоохранения – Автор редакции Pandia Health
Могут ли гормональные противозачаточные средства лечить анемию?
TL; DR: Да, противозачаточные таблетки, противозачаточные пластыри, противозачаточное кольцо, ВМС с гормоном, инъекции, имплант – все это может помочь в лечении анемии. Железодефицитная анемия – распространенное заболевание, степень тяжести которого может варьироваться от незначительного раздражения до тяжелого и опасного для жизни. Исследования показывают, что 20% женщин в США страдают анемией. Во всем мире 1/3 населения мира страдает анемией. Анемия – обычное явление, но излечимое.
Железодефицитная анемия – распространенное заболевание, степень тяжести которого может варьироваться от незначительного раздражения до тяжелого и опасного для жизни. Исследования показывают, что 20% женщин в США страдают анемией. Во всем мире 1/3 населения мира страдает анемией. Анемия – обычное явление, но излечимое.
Что такое анемия?
Красные кровяные тельца переносят кислород и другие питательные вещества во все части тела. Богатые кислородом красные кровяные тельца позволяют органам и другим системам организма функционировать. Чтобы красные кровяные тельца выполняли свою работу, им необходимо нормальное количество гемоглобина.Гемоглобин – это вещество в красных кровяных тельцах, которое позволяет им переносить кислород. Организм нуждается в достаточных запасах железа для производства гемоглобина. Когда в организме не хватает железа, он не может вырабатывать гемоглобин, а красные кровяные тельца не могут доставлять кислород к тканям и органам тела. Это состояние называется железодефицитной анемией.
Что вызывает железодефицитную анемию?
Железодефицитная анемия может быть вызвана различными заболеваниями, в том числе:
- Заболевания, препятствующие усвоению организмом железа с пищей, включая целиакию
- Беременность (из-за растущего плода, нуждающегося в железе для своей крови)
- Кровопотеря (обильные месячные, нарушения свертываемости крови)
- Недостаток железа в рационе (вегетарианцы, бедность)
Женщины с обильными менструациями и беременные женщины подвержены повышенному риску железодефицитной анемии.Растущий плод может использовать запасы железа у матери, но прием витаминов во время беременности может предотвратить анемию у беременных.
Желудочно-кишечные расстройства, которые приводят к медленной, хронической кровопотере, также могут повышать риск развития анемии – например, пептические язвы, грыжи пищеводного отверстия диафрагмы и колоректальный рак могут привести к недостаточным запасам железа.
Прием добавок железа и употребление в пищу продуктов, богатых железом: мясо (говядина, курица, индейка, ветчина, телятина), рыба (сардины, палтус, пикша, окунь, лосось, тунец), листовые зеленые овощи и продукты, обогащенные железом, могут увеличить запасы железа в организме.Вегетарианцы рискуют заболеть анемией, если они не получат достаточного количества обогащенных продуктов в своем рационе.
Железо в растениях, таких как чечевица, фасоль и шпинат, не является гемовым железом. Эта форма железа добавляется в продукты, обогащенные и обогащенные железом. К сожалению, наш организм менее эффективно поглощает негемовое железо.
Каковы симптомы железодефицитной анемии?
- Слабость, усталость, утомляемость
- Холодные руки и ноги
- Бледность
- Учащенное сердцебиение, боль в груди и одышка
- Головные боли
- Головокружение или легкомысленность
- Хрупкие ногти
- Тяга к непищевым веществам, например, лед или грязь (на языке медицины это называется Pica)
- Воспаленный или болезненный язык
Как диагностируется анемия?
При подозрении на анемию врач / поставщик медицинских услуг может назначить
- Общий анализ крови (CBC) для проверки количества эритроцитов
- Гематокрит для проверки процентного содержания эритроцитов в крови
- Уровень гемоглобина
- Уровень железа
- Ферритин для проверки запасов железа
- TIBC ( общая емкость связывания железа), чтобы узнать, какой процент ваших магазинов заполнен.
 Низкое число означает, что вы можете хранить больше, иначе ваши магазины не заполнены, и вам нужно больше железа.
Низкое число означает, что вы можете хранить больше, иначе ваши магазины не заполнены, и вам нужно больше железа. - Насыщение трансферрина показывает, сколько железа связано с сывороткой.
У взрослых женщин уровень гематокрита должен составлять от 35% до 47%. Уровень гемоглобина у здоровой взрослой женщины должен составлять от 14 до 18 граммов на децилитр крови.
Каковы осложнения анемии?
Легкая анемия обычно не вызывает серьезных осложнений, и во многих случаях люди с легкой анемией не испытывают никаких разрушительных симптомов.Однако легкая анемия может ухудшиться и привести к тяжелой недостаточности железа. Анемия средней и тяжелой степени может нарушить повседневную жизнь человека и привести к следующим проблемам со здоровьем, если ее не лечить:
- Проблемы с сердцем: Анемия может вызвать учащенное или нерегулярное сердцебиение, что может привести к увеличению сердца, инсульту, сердечному приступу или сердечной недостаточности.

- Осложнения при беременности: беременные женщины с дефицитом железа могут родить недоношенного ребенка или ребенка с низкой массой тела при рождении. Прием добавок железа во время беременности может предотвратить это осложнение.
- Задержка роста у детей: Младенцы и дети с анемией могут испытывать задержку роста и не достигать основных этапов в расписании.
Что можно сделать для лечения анемии?
Добавки железа и включение в рацион продуктов, богатых железом, могут вылечить анемию. В тяжелых случаях анемии может потребоваться переливание крови. Но если анемия вызвана хронической кровопотерей во время менструации, женщины могут использовать противозачаточные средства, чтобы либо предотвратить менструацию полностью, либо облегчить менструальный цикл.
Что могут сделать противозачаточные средства при анемии?
Около 14% женщин детородного возраста страдают от обильных и болезненных менструальных кровотечений. Это не только болезненное, разочаровывающее и дорогое заболевание, оно также подвергает женщин риску железодефицитной анемии.
Хотя многое можно сделать для лечения анемии после того, как она возникла, для женщин с риском анемии, как правило, лучше всего предотвращать причины этого состояния.Гормональные противозачаточные средства можно использовать для предотвращения менструации в течение некоторого времени, пока пациентка не сможет увеличить свои запасы железа. Или же гормональные противозачаточные средства могут облегчить менструальный цикл, чтобы женщина не испытала значительную потерю крови.
Гормональная ВМС, противозачаточные таблетки, пластырь, кольцо и инъекция могут использоваться для лечения или профилактики железодефицитной анемии у женщин в детородном возрасте. Однако медные ВМС могут затруднить менструальный цикл и не должны применяться у женщин с дефицитом железа.
Комбинированные гормональные противозачаточные таблетки, в которых используются как эстроген, так и прогестиновые гормоны, являются наиболее эффективными для предотвращения или облегчения менструации. Женщины старше 35 лет, курящие или имеющие в анамнезе тромбы, не должны использовать комбинированные противозачаточные средства. Но есть таблетки, содержащие только прогестин, которые можно использовать для лечения железодефицитной анемии у женщин с этими противопоказаниями.
Женщины старше 35 лет, курящие или имеющие в анамнезе тромбы, не должны использовать комбинированные противозачаточные средства. Но есть таблетки, содержащие только прогестин, которые можно использовать для лечения железодефицитной анемии у женщин с этими противопоказаниями.
Для женщин с тяжелой анемией в результате менструации (меноррагии), которые не могут использовать гормональные противозачаточные средства, им может потребоваться рассмотреть возможность расширения и выскабливания (D&C) в качестве временной меры, а для женщин, родивших детей: аблация / резекция эндометрия или гистерэктомия до лечить анемию.Миома может быть причиной обильного кровотечения, и ее нужно лечить хирургическим путем, если лекарства не могут остановить кровотечение.
У вас обильные менструальные периоды (меноррагия) и симптомы анемии?
Гормональные противозачаточные средства можно принимать непрерывно, чтобы месячные не повторялись.
Постоянный прием противозачаточных таблеток или НоваРинга может помочь вам увеличить запасы железа и избавиться от изнуряющих симптомов анемии.
 В случае анемии ваш врач будет интересоваться уровнями красных кровяных телец, содержащихся в вашей крови (гематокрит), и гемоглобином в вашей крови.
В случае анемии ваш врач будет интересоваться уровнями красных кровяных телец, содержащихся в вашей крови (гематокрит), и гемоглобином в вашей крови. Врачи сосредоточены на лечении основного заболевания. Если симптомы становятся серьезными, переливание крови или инъекции синтетического гормона, который обычно вырабатывается почками (эритропоэтин), могут помочь стимулировать выработку красных кровяных телец и снять усталость.
Врачи сосредоточены на лечении основного заболевания. Если симптомы становятся серьезными, переливание крови или инъекции синтетического гормона, который обычно вырабатывается почками (эритропоэтин), могут помочь стимулировать выработку красных кровяных телец и снять усталость.
 Как мне лучше всего управлять ими вместе?
Как мне лучше всего управлять ими вместе? Национальный институт сердца, легких и крови. https://www.nhlbi.nih.gov/health-topics/iron-deficiency-anemia. Доступ 23 июля 2019 г.
Национальный институт сердца, легких и крови. https://www.nhlbi.nih.gov/health-topics/iron-deficiency-anemia. Доступ 23 июля 2019 г.

 Низкое число означает, что вы можете хранить больше, иначе ваши магазины не заполнены, и вам нужно больше железа.
Низкое число означает, что вы можете хранить больше, иначе ваши магазины не заполнены, и вам нужно больше железа.