Питьевая сода – Справочник химика 21
Гидрокарбонат натрия (питьевая сода) может содержать примесь карбоната натрия. Определение содержания обоих веществ в пробе осуществляется по методу, основанному на том же принципе, что и определение щелочи и карбоната в смеси (см. предыдущую работу). [c.115]
Бикарбонат натрия ЫаНСОз (двууглекислый натрий, питьевая сода) — мелкий белый порошок. В воде значительно менее растворим, чем карбонат натрия. При нагревании водного раствора или сухой соли бикарбонат натрия разлагается согласно уравнению [c.438]
Напишите формулы карбонатов натрия, нашедших широкое применение, в виде 1) кальцинированной соды 2) кристаллической соды 3) питьевой соды. [c.161]
Гидрокарбонат натрия (питьевая сода) [c.145]
Напишите уравнения реакций, протекающих при нейтрализации кислот растворами соды и поташа. Для чего в тесто добавляют питьевую соду, погашенную уксусом [c.141]
Для чего в тесто добавляют питьевую соду, погашенную уксусом [c.141]
Карбонат натрия, или углекислый натрий, можно найти почти в каждом доме — это обыкновенная стиральная сода. Еще чаще на кухне можно увидеть бикарбонат натрия, или двууглекислый натрий.— это питьевая сода. [c.163]
Но насытить тесто двуокисью углерода можно и любым другим способом. Например, можно добавить в тесто двууглекислый натрий (питьевую соду) в смеси со слабой кислотой, например винной. Под действием винной или любой другой слабой кислоты к иону бикарбоната, который входит в состав двууглекислого натрия, снова присоединяется атом водорода, и образуется угольная кислота. Это происходит только тогда, когда смесь соды и кислоты добавляют в тесто они растворяются в содержащейся в нем воде, и при этом образуется угольная кислота. [c.170]
Для оказания первой медицинской помощи в лабораторных помещениях всегда должна быть аптечка, в которой находятся бинты, гигроскопическая вата, 3%-ный раствор иода, 2%-ный раствор борной кислоты, 2%-ный раствор уксусной кислоты, 3%-ный раствор бикарбоната натрия (питьевой соды), 5%-ный раствор перманганата калия, 2%-ный раствор таннина, медицинский коллодий и т. п. [c.14]
п. [c.14]
Опыт 2. Действие кипело к. Для формирования у учащихся умений правильно нагревать растворы рекомендуется при изучении растворимости газов в воде показывать следующий опыт. В небольшой стакан (рис. 3) налить 5 %-ный раствор питьевой соды и бросить туда немного лимонной кислоты до прекращения вскипания жидкости от очередной порции. Полученную газированную воду налить в узкую кювету и опустить в нее привязанную на проволоке капиллярную трубку с запаянным концом (можно использовать кусок изоляции от тонкого провода). Трубка вводится так, чтобы она была целиком видна. Откры- [c.157]
Вдыхание 3—5%-ной газовоздушной смеси, содержащей аммиак, промывание глаз, рта и носа раствором бикарбоната натрия (питьевая сода). Покой, вдыхание кислорода [c.17]
Место технического обслуживания электрокаров и электропогрузчиков должно быть обеспечено всем необходимым для безопасного выполнения работы, а также средствами первой помощи при химических ожогах электролитом (проточной водопроводной водой для смывания брызг кислоты или щелочи, 1 /о-ным раствором питьевой соды для нейтрализации кислоты и 3%-ным раствором борной кислоты для нейтрализации щелочи), средствами очистки (обдува) транспортных средств после перевозки пылящих ингредиентов и обеспыливания одежды водителей. [c.270]
[c.270]
Какова концентрация ионов Н+ следующих растворов а) лимонный сок б) слюна в) кровь г) раствор питьевой соды д) черный кофе Для расчета используйте данные таблицы 22. Укажите, какой из этих растворов кислый, какой — основной. [c.146]
При термических ожогах первой и второй степени хорошо помогают примочки из свежеприготовленных растворов питьевой соды (3%-ный) или перманганата калия (5%-ный), а также таннина (2%-ный). Лучшим средством для примочек является этиловый спирт (96%-ный), который оказывает одновременно и обеззараживающее и обезболивающее действие. [c.15]
Напишите уравнение реакции получения питьевой соды по аммиачно-хлоридному методу. Определите массу хлорида натрия и гидрокарбоната аммония, необходимые для получения 1 т гидрокарбоната натрия. [c.161]
Питьевая сода – ионное соединение, состоящее из ионов натрия и кислого карбонат-иона НСОз”. [c.71]
Категорически запрещается самим без врача прокалывать образовавшиеся пузыри, а также накладывать на обожженные места какие-либо мази, жиры, масла, присыпать рану питьевой содой и т. п. Основная цель первой доврачебной помощи при ожогах — предохранить рану от загрязнения и попадания в нее инфекции, создать условия, щадящие поврежденную поверхность, и уменьшить боль. После оказания первой помощи, особенно при ожогах второй и третьей степени, следует немедленно обратиться к врачу. [c.15]
п. Основная цель первой доврачебной помощи при ожогах — предохранить рану от загрязнения и попадания в нее инфекции, создать условия, щадящие поврежденную поверхность, и уменьшить боль. После оказания первой помощи, особенно при ожогах второй и третьей степени, следует немедленно обратиться к врачу. [c.15]
Определите процентную концентрацию водного раствора питьевой соды, если известно, что после нагревания его получили 10,6%-ный раствор карбоната натрия. Объем раствора при нагревании поддерживался псстоянным. [c.28]
У. Укажите реагенты, взаимодействующие с миндальной кислотой только по 1) СООН-группе, 2) ОН-группе спирта. а. Натрий металлический б. Питьевая сода в. Соляная кислота г. Щелочь [c.186]
При ожогах кислотами (азотной, серной, соляной, фосфорной) необходимо промыть место ожога большим количеством воды, а затем 5-процентным раствором питьевой соды. При ожоге плавиковой кислотой — длительное промывание проточной водой (пока побелевшая и коагулированная поверхность ожога не покроется краснотой), а затем следует приложить свежеприготовленную 20-процентную суспензию окиси магния в глицерине. К приходу врача рекомендуется приготовить ltt-процентный раствор сульфата магния и обеспечить возможность стерилизации инструментов кипячением. [c.120]
К приходу врача рекомендуется приготовить ltt-процентный раствор сульфата магния и обеспечить возможность стерилизации инструментов кипячением. [c.120]
Водопроводная вода Раствор питьевой соды Известковая вода На1патырный спирт Раствор NaOH (I моль/л) [c.145]
При химическом ожоге глаз необходимо обильно промыть глаза струей воды, а затем в случае ожога щелочами промыть 2-процентным раствором борной кислоты при ожоге кислотами — 3-процентным раствором питьевой соды. Нельзя тереть глаза. Для более удобной промывки глаз методом фонтанчика от обычного водопроводного крана полезно иметь наготове тонкую резиновую трубку с приспособлением для надевания на конец крана (рис. 70). Некоторые учителя (ГДР) рекомендуют промывать глаза молоком. При лучевом ожоге применяют холодные примочки на глаза из 0,5— 1,0-процентного раствора дикаина. [c.121]
МаНСО,— бикарбонат натрия ( питьевая сода ) [c.438]
Карбонат и гидрокарбонат натрия ( питьевая сода )—белые кристаллические вещества. [c.228]
[c.228]
Некоторые вещества, например аммиак (Nh4) и питьевая сода (бикарбонат натрия НаНСОз), не содержат ОН -ионов, но при растворении в воде образуют основные растворы из-за того, что они взаимодействуют с водой и эта реакция сопровождается образованием ОН -ионов Человеческая кровь имеет слабощелочные свойства именно из-за наличия в ней бикарбоната натрия. [c.66]
Мой желудок выдержал лишь до начала ноября, а потом я стал каждый вечер испытывать сильнейшие боли. Питьевая сода н молоко не помогали, и хотя Элизабет уверяла, что все это пустяки, я отправился в ледяную приемную врача на Тринити-стрит. После того, как я достаточно налюбовался веслами, украшавшими стену, он выставил меня, выписав рецепт на бутыль какой-то белой жидкости, которую нужно было принимать после еды. С ее помощью я продержался еще две недели, но когда бутыль опустела, я снова пошел к врачу, опасаясь, что у меня язеа. Однако сообщение о том, что желудочные боли по-прежнему мучают злополучного иностранца, не вызвало у него никакого сочувствия, и у меня в руках опять оказался новый рецепт на белую жидкость. [c.88]
[c.88]
Примеры кислых солей гидросульфат натрия НаНЗО,, дигидрофосфат калия ЫаН РО , гидрокарбонат натрия NaH Oз, который все знают как питьевую соду. [c.127]
Наибольшее практическое применение имеет гидрокарбонат натрия ЫаНСОз — питьевая сода, которая используется в медицине, пищевой промышленности, быту, в химических огнетушителях. [c.92]
Питьевая сода ЫаНСОз — труднорастворима в холодной воде, и ее отделяют фильтрованием. При прокаливании NaH Oa получают кальцинированную соду, вы- [c.312]
Для подтверждения закона постоянства состава учащийся выбрал два способа получения питьевой соды NaH O,. В первом опыте он получил вещество с атомным отношением 0,5 0,49 0,51 1,48, а во втором опыте образовалось вещество с iVfja = 0,274, Wh = 0,012, = 0,143 и Wq = 0,571. Подтвердился ли данный закон [c.18]
Выпадает осадок малорастворимой в этих условиях соли гидрокарбонат натрия NaH Oз (в быту-питьевая сода). Его подвергают термическому обезвоживанию кальцинирование) [c.166]
Его подвергают термическому обезвоживанию кальцинирование) [c.166]
Карбонаты и гидрокарбонаты. Наиболее важными в техническом отношении карбонатами являются сода Ыа СОд, питьевая сода NaH 02, поташ К2СО3, известняк СаСОд й некоторые другие. Обыкновенно содой называют технический продукт, содержащий от 96 до 99% НзаСОд. Название сода иногда употребляют также и по отношению к химически чистому соединению Na2 Oз. [c.471]
Гидрокарбонат натрия (двууглекислый натрий, или питьевая сода) NaH Og — белый кристаллический порошок плотностью 2,2. Он относительно трудно растворим в воде при 0° С в 100 г воды растворяется около 7 г, а при комнатной температуре — около 10 г NaH Og. [c.474]
В противоположность большинству карбонатов все бикарбонаты в воде растворимы. Наиболее важной кислой солью угольной кислоты является ЫаНСОз ( двууглекислая , или питьевая сода). Гидролиз ее при обычных условиях незначителен (реакция раствора на лакмус почти нейтральна). При нагревании он заметно увеличивается, а около 60 °С углекислый газ начинает частично выделяться из раствора. Сильными кислотами бикарбонаты разлагаются аналогично карбонатам. [c.494]
При нагревании он заметно увеличивается, а около 60 °С углекислый газ начинает частично выделяться из раствора. Сильными кислотами бикарбонаты разлагаются аналогично карбонатам. [c.494]
bicarbonate de sodium – Перевод на русский – примеры французский
На основании Вашего запроса эти примеры могут содержать грубую лексику.
На основании Вашего запроса эти примеры могут содержать разговорную лексику.
Qu’est-ce que c’est du bicarbonate de sodium ?
Je vais vous donner un peu de bicarbonate de sodium.
Si c’est une ATR, du bicarbonate de sodium pour l’acidité, et une chirurgie pour les calculs.
Если это ПКА, ей нужна только питьевая сода для кислоты и операция по удалению кальциноза.
Matières requises : les produits suivants sont nécessaires : Huile donneuse d’hydrogène comme le fuel lourd nº 2 ou les huiles Sun Par nº LW-104, LW-106 et LW-110; Carbonate, bicarbonate ou hydroxyde de métal alcalin ou alcalinoterreux, comme le bicarbonate de sodium.
Предусматриваются относительно небольшие энергозатраты ввиду невысоких температур, при которых протекает процесс КОР. Ь) щёлочь или карбонат, бикарбонат или гидроксид щёлочноземельного металла, например, бикарбонат натрия.
Il y a ici du bicarbonate de sodium, dans une mare de crachats séchés.
Du collyre, du bicarbonate de sodium, et des pellicules.
Mettez-le sous stéroïdes et bicarbonate de sodium.
Corticoïdes et bicarbonate de sodium en parentéral.
Les résidus comprennent une solution aqueuse de sels de sodium inorganiques comme le chlorure de sodium, le bicarbonate de sodium et le fluorure de sodium.
Остаточные продукты представляют собой водный раствор неорганических солей натрия, таких, как поваренная соль, гидрокарбонат натрия и фтористый натрий.
Dans ce cas, le sol est préalablement mélangé à du bicarbonate de sodium avant d’être introduit dans l’unité de désorption thermique.
Le bicarbonate de sodium a été utilisé pour soigner ça.
Ils ont par contre obtenu un mix mortel d’hématite et bicarbonate de sodium.
А вместо этого, получили смертельную дозу углекислого натрия и гематита.
Je vais lui faire une intraveineuse, prépares moi une ampoule de bicarbonate de sodium
сода — Викисловарь
Морфологические и синтаксические свойства
со́-да
Существительное, неодушевлённое, женский род, 1-е склонение (тип склонения 1a по классификации А. А. Зализняка).
Корень: -сод-; окончание: -а [Тихонов, 1996].
Произношение
- МФА: ед. ч. [ˈsodə], мн. ч. [ˈsodɨ]
Семантические свойства
Значение
- хим. натриевая соль угольной кислоты, карбонат натрия (Na2CO3) или кристаллогидрат этого вещества (Na2CO3*nH2O)◆ Отсутствует пример употребления (см. рекомендации).
- разг.
 то же, что пищевая сода; гидрокарбонат натрия (NaHCO3) ◆ Всякую зелень надо для сохранения её цвета опускать в солёный кипяток, с прибавлением чуть-чуть соды, и варить в эмалированной закрытой кастрюльке. Е. И. Молоховец, «Подарок молодым хозяйкам», 1875–1900 г. (цитата из Национального корпуса русского языка, см. Список литературы)
то же, что пищевая сода; гидрокарбонат натрия (NaHCO3) ◆ Всякую зелень надо для сохранения её цвета опускать в солёный кипяток, с прибавлением чуть-чуть соды, и варить в эмалированной закрытой кастрюльке. Е. И. Молоховец, «Подарок молодым хозяйкам», 1875–1900 г. (цитата из Национального корпуса русского языка, см. Список литературы)
Синонимы
- карбонат натрия
- гидрокарбонат натрия; питьевая сода; пищевая сода
Антонимы
- —
- —
Гиперонимы
- соль, вещество
- соль, вещество
Гипонимы
- —
- —
Родственные слова
| Ближайшее родство | |
Этимология
Происходит от лат. soda (нов.) «сода», далее из итал., предположительно восходит к арабск. … (suwwad).
Фразеологизмы и устойчивые сочетания
Перевод
Анаграммы
Библиография
Морфологические и синтаксические свойства
сода
Существительное, женский род.
Корень: —.
Произношение
Семантические свойства
Значение
- хим. сода (аналогично русскому слову) ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы
- ?
Антонимы
- —
Гиперонимы
- ?
Гипонимы
- ?
Родственные слова
| Ближайшее родство | |
Этимология
Происходит от лат. soda (нов.) «сода», далее из итал., предположительно восходит к арабск. … (suwwad).
Фразеологизмы и устойчивые сочетания
Морфологические и синтаксические свойства
сода
Существительное, женский род.
Корень: —.
Произношение
Семантические свойства
Значение
- хим. сода (аналогично русскому слову) ◆ Отсутствует пример употребления (см.
 рекомендации).
рекомендации).
Синонимы
- ?
Антонимы
- —
Гиперонимы
- ?
Гипонимы
- ?
Родственные слова
| Ближайшее родство | |
Этимология
Происходит от лат. soda (нов.) «сода», далее из итал., предположительно восходит к арабск. … (suwwad).
Фразеологизмы и устойчивые сочетания
Морфологические и синтаксические свойства
сода
Существительное, женский род.
Корень: —.
Произношение
Семантические свойства
Значение
- хим. сода (аналогично русскому слову) ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы
- ?
Антонимы
- —
Гиперонимы
- ?
Гипонимы
- ?
Родственные слова
| Ближайшее родство | |
Этимология
Происходит от лат. soda (нов.) «сода», далее из итал., предположительно восходит к арабск. … (suwwad).
soda (нов.) «сода», далее из итал., предположительно восходит к арабск. … (suwwad).
Фразеологизмы и устойчивые сочетания
Морфологические и синтаксические свойства
сода
Существительное, женский род.
Корень: —.
Произношение
Семантические свойства
Значение
- хим. сода (аналогично русскому слову) ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы
- ?
Антонимы
- —
Гиперонимы
- ?
Гипонимы
- ?
Родственные слова
| Ближайшее родство | |
Этимология
Происходит от лат. soda (нов.) «сода», далее из итал., предположительно восходит к арабск. … (suwwad).
Фразеологизмы и устойчивые сочетания
Морфологические и синтаксические свойства
сода
Существительное, женский род.
Корень: —.
Произношение
Семантические свойства
Значение
- хим. сода (аналогично русскому слову) ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы
- ?
Антонимы
- —
Гиперонимы
- ?
Гипонимы
- ?
Родственные слова
| Ближайшее родство | |
Этимология
Происходит от лат. soda (нов.) «сода», далее из итал., предположительно восходит к арабск. … (suwwad).
Фразеологизмы и устойчивые сочетания
Сода пищевая (натрий двууглекислый, бикарбонат натрия, гидрокарбонат натрия)
Производитель: Россия, Турция
Упаковка:
Мешки 25кг
Мешки 40кг
Дополнительная информация об отгрузке:
Соду пищевую (натрий двууглекислый, бикарбонат натрия, гидрокарбонат натрия) транспортируют всеми видами транспорта (кроме воздушного) в крытых транспортных средствах. Допускается транспортирование двууглекислого натрия автомобильным транспортом навалом с использованием специализированного транспорта (типа муковоза) или в специально изготовленных емкостях из нержавеющей стали. Специализированные мягкие контейнеры транспортируют по железной дороге открытым подвижным составом повагонными отправками без перевалок, с погрузкой и выгрузкой на подъездных путях грузоотправителя (грузополучателя). Соду пищевую хранят в закрытых складских помещениях. Заполненные специализированные мягкие контейнеры хранят как в крытых складских помещениях, так и на открытых площадках, в 2-3 яруса по высоте.
Допускается транспортирование двууглекислого натрия автомобильным транспортом навалом с использованием специализированного транспорта (типа муковоза) или в специально изготовленных емкостях из нержавеющей стали. Специализированные мягкие контейнеры транспортируют по железной дороге открытым подвижным составом повагонными отправками без перевалок, с погрузкой и выгрузкой на подъездных путях грузоотправителя (грузополучателя). Соду пищевую хранят в закрытых складских помещениях. Заполненные специализированные мягкие контейнеры хранят как в крытых складских помещениях, так и на открытых площадках, в 2-3 яруса по высоте.
Рекомендации:
Сода пищевая – кристаллический порошок тонкого помола, белого цвета, без запаха. Отличительной особенностью является мягкие щелочные свойства, не оказывающие вредного воздействия на животные и растительные ткани.
Температура кипения – 851° C, температура плавления – 270° C. Плотность – 2,159 г/см³.
Предназначается для химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии и розничной торговли.
Химическая формула: NaHCO3.
Технология производства :
Добывают соду сейчас промышленным аммиачным способом (способ Сольве).
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония Nh5HCO3:
Nh4 + CO2 + h3O + NaCl → NaHCO3 + Nh5Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20° C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140 – 160° C, при этом он переходит в карбонат натрия:
2NaHCO3 →(t) Na2CO3 + CO2↑ + h3O
Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции:
2Nh5Cl + Ca(OH)2 → CaCl2 + 2Nh4↑ + 2h3O возвращают в производственный цикл.
Аммонизация раствора необходима для введения в него углекислого газа, малорастворимого в насыщенном растворе. Выпавший в виде кристаллов бикарбонат натрия отфильтровывают от раствора, содержащего хлористый аммоний и непрореагировавший NaCl, и прокаливают (кальцинируют). При этом происходит образование кальцинированной соды.
При этом происходит образование кальцинированной соды.
Выделяющиеся при кальцинации газы, содержащие углекислоту СO2, используют для карбонизации. Таким образом, часть затраченной углекислоты регенерируется.
Необходимую для процесса углекислоту получают обжигом известняка или мела. Обожженную известь СаО гасят водой.
Гашеная известь Са(ОН)2 замешивается с водой. Образовавшееся известковое молоко используют для регенерации аммиака из раствора (фильтровой жидкости), полученного после отделения бикарбоната и содержащего хлористый аммоний.
Для производства соды используют раствор поваренной соли (рассол) концентрации около 310 г/л, полученный в естественных условиях подземным выщелачиванием залежей поваренной соли. В естественном рассоле, помимо NaCl, обычно содержатся соли кальция и магния. При аммонизации и карбонизации рассола в результате взаимодействия этих примесей с Nh4 и СО2 будут выпадать осадки, что приведет к загрязнению аппаратов, нарушению теплообмена и нормального хода процесса. Поэтому рассол предварительно очищают от примесей: осаждают их, добавив к рассолу строго определенное количество реактивов – суспензии соды в очищенном рассоле и известкового молока. Этот способ очистки называется содово-известковым. Выпавшие при этом осадки гидрата магния и карбоната кальция отделяют в отстойниках.
Поэтому рассол предварительно очищают от примесей: осаждают их, добавив к рассолу строго определенное количество реактивов – суспензии соды в очищенном рассоле и известкового молока. Этот способ очистки называется содово-известковым. Выпавшие при этом осадки гидрата магния и карбоната кальция отделяют в отстойниках.
Очищенный и осветленный рассол поваренной соли направляют в барботажную абсорбционную колонну. Верхняя часть колонны служит для промывки рассолом газа, отсасываемого вакуум-насосом из вакуум-фильтров, и газа из карбонизационных колонн. В этих газах содержится небольшое количество аммиака и углекислоты, которые целесообразно отмыть свежим рассолом и, таким образом, более полно использовать их в производстве. Нижняя часть колонны служит для насыщения рассола аммиаком, поступающим из дистилляционной колонны. Полученный аммиачно-соляной рассол далее направляют в барботажную карбонизационную колонну, где происходит основная реакция превращения исходного сырья в бикарбонат натрия. Необходимая для этой цели углекислота СO2 поступает из шахтной известково-обжигательной печи и печи кальцинации бикарбоната натрия и нагнетается снизу в колонну.
Необходимая для этой цели углекислота СO2 поступает из шахтной известково-обжигательной печи и печи кальцинации бикарбоната натрия и нагнетается снизу в колонну.
Карбонизация аммиачно-соляного рассола является важнейшей стадией производства соды. Образование бикарбоната натрия при карбонизации происходит в результате протекания в карбонизационной колонне сложных химических процессов. В верхней части колонны идет образование углекислого аммония из аммиака, содержащегося в рассоле, и углекислоты, подаваемой в колонну.
По мере прохождения рассола в колонне сверху вниз углекислый аммоний, реагируя с избытком углекислоты, поступающей снизу колонны, переходит в двууглекислый аммоний (бикарбонат аммония).
Примерно в середине верхней неохлаждаемой части колонны начинается реакция обменного разложения, сопровождающаяся выпадением кристаллов бикарбоната натрия и образованием в растворе хлористого аммония. В средней части колонны, где идет образование кристаллов бикарбоната натрия за счет экзотермичности реакции, температура рассола несколько повышается (до 60 – 65° C), однако охлаждать его не надо, так как такая температура способствует формированию более крупных хорошо фильтрующихся кристаллов бикарбоната натрия. Внизу колонны охлаждение необходимо для уменьшения растворимости бикарбоната натрия и увеличения его выхода. В зависимости от температуры, содержания NaCl в рассоле, степени насыщения его аммиаком и углекислотой и других факторов выход бикарбоната составляет 65-75%. Практически невозможно полное превращение поваренной соли в осадок бикарбоната натрия. В этом заключается один из существенных недостатков производства соды аммиачным методом.
Внизу колонны охлаждение необходимо для уменьшения растворимости бикарбоната натрия и увеличения его выхода. В зависимости от температуры, содержания NaCl в рассоле, степени насыщения его аммиаком и углекислотой и других факторов выход бикарбоната составляет 65-75%. Практически невозможно полное превращение поваренной соли в осадок бикарбоната натрия. В этом заключается один из существенных недостатков производства соды аммиачным методом.
Применение:
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Широко примененяется в:
– химической промышленности – для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
– легкой промышленности – в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож).
– текстильной промышленности (отделка шелковых и хлопчатобумажных тканей). Применение бикарбоната натрия в производстве резиновых изделий также обусловлено выделением CO2 при нагревании, способствующем приданию резине необходимой пористой структуры.
– пищевой промышленности – хлебопечении, производстве кондитерских изделий, приготовлении напитков.
– медицинской промышленности – для приготовления инъекционных растворов, противотуберкулезных препаратов и антибиотиков.
– металлургии – при осаждении редкоземельных металлов и флотации руд.
Упаковка и хранение:
Соду пищевую упаковывают в четырех-, пятислойные бумажные мешки, а также в специализированные мягкие контейнеры разового использования с полиэтиленовым вкладышем.
Гарантийный срок хранения продукта.
1 год со дня изготовления.
Качественные показатели:
Бикарбонат натрия представляет собой кристаллический порошок белого цвета со средним размером кристал лов 0,05 – 0,20 мм. Молекулярная масса соединения равна 84,01, плотность составляет 2200 кг/м³, насыпная плотность – 0,9 г/см³. Теплота растворения бикарбоната натрия исчисляется 205 кДж (48,8 ккал) на 1 кг NaHCO3, теплоемкость достигает 1,05 кДж/кг•К(0,249 ккал/кг•°С).
Гидракарбонат натрия термически малоустойчив и при нагревании разлагается с образованием твердого карбоната натрия и выделением диоксида углерода, а также воды в газовую фазу:
Сода 2NaHCO3(тв.) ↔ Na2CO3(тв.) + CO2(г.) + h3O(пар) – 126 кДж (- 30 ккал) Аналогично разлагаются и водные растворы бикарбоната натрия:
2NaHCO3(р.) ↔ Na2CO3(р.) + CO2(г.) + h3O(пар) – 20,6 кДж (- 4,9 ккал) Водный раствор бикарбоната натрия имеет слабо выраженный щелочной характер, в связи с чем на животные и растительные ткани он не действует. Растворимость гидрокарбоната натрия в воде невелика и с повышением температуры она несколько повышается: с 6,87 г на 100 г воды при 0° С до 19,17 г на 100 г воды при 80° С.
Растворимость гидрокарбоната натрия в воде невелика и с повышением температуры она несколько повышается: с 6,87 г на 100 г воды при 0° С до 19,17 г на 100 г воды при 80° С.
Вследствие небольшой растворимости плотность насыщенных водных растворов бикарбоната натрия сравнительно мало отличается от плотности чистой воды.
Температура кипения (разлагается): 851° C;
Температура плавления: 270° C;
Плотность: 2,159 г/см³;
Растворимость в воде, г/100 мл при 20° C: 9.
Функциональные свойства:
Химические свойства.
Гидрокарбонат натрия – кислая натриевая соль угольной кислоты. Молекулярная масса (по международным атомным массам 1971 г.) – 84,00.
Реакция с кислотами.
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
NaHCO3 + HCl → NaCl + h3CO3
h3CO3 → h3O + CO2↑
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
NaHCO3 + Ch4COOH → Ch4COONa + h3O + CO2↑
Сода хорошо растворяется в воде. Водный раствор питьевой соды имеет слабощелочную реакцию. Шипение соды – результат выделения углекислого газа CO2 в результате химических реакций.
Водный раствор питьевой соды имеет слабощелочную реакцию. Шипение соды – результат выделения углекислого газа CO2 в результате химических реакций.
Термическое разложение.
При температуре 60° C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200° C):
2NaHCO3 → Na2CO3 + h3O + CO2↑
При дальнейшем нагревании до 1000° C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Na2CO3 → Na2O + CO2.
Сода пищевая (гидрокарбонат натрия) в мешках по 50 кг (Россия
Бикарбонат натрия (пищевая сода, бикарбонат соды, гидрокарбонат натрия) представляет собой белый кристаллический порошок без запаха. Химическая формула NaHCO3. Распространенное название гидрокарбонат натрия NaHCO3 – неорганическое химическое соединение, которое находит широкое применение в пищевой промышленности, медицине, сельском хозяйстве и прочих отраслях. Пищевая сода находит много применений в пищевой промышленности и в быту.
Пищевая сода находит много применений в пищевой промышленности и в быту.
ПРИМЕНЕНИЕ
• Производство продуктов питания и напитков
• Основной ингредиент в разрыхлителях
• Готовый к употреблению торт и пастообразный компонент
• Ингредиент в замороженных дрожжевых продуктах
• средство для мытья фруктов
• Запах абсорбента
• Чистящее средство
Пищевая сода – это ингредиент корма для животных, предназначенный для производителей кормов и частных фермеров. Доступный в форме порошка и гранул (компактная сода).
ПРИМЕНЕНИЕ
• Регулятор кислотности; стабилизирует рН от 6,0 до 6,8
• Ингредиент в кормовых смесях и премиксах
• Улучшает эффективность кормления животных
Его кислотное нейтрализующее действие, потенциальное связывание с другими химическими веществами и чистящие свойства помогают фармацевтической соде найти широкое применение.
ПРИМЕНЕНИЕ
• Производство различных шипучих таблеток
• Ингредиент в лекарствах и пищевых добавках
• Производство зубной пасты
• Компонент избранных оздоровительных продуктов
Гидрокарбонат натрия, бикарбонат натрия доступен в нескольких фракциях зерна, от мелкозернистых до ультра крупнозернистых.
ПРИМЕНЕНИЕ
• Добавка в стиральные порошки
• Компонент в зарядах огнетушителя
• Производство бумаги
• Добыча нефти
• Кожевенная промышленность
• Средство для чистки фасадов зданий
Упаковка пищевой соды гидрокарбоната натрия: мешки по 25 кг, 50 кг, 650 кг, 1000 кг, 1300 кг., пачки по 500 гр для розничной продажи.
Подробнее о производстве пищевой соды здесь.
СОДА | Энциклопедия Кругосвет
СОДА – карбонат натрия Na2CO3, бесцветное кристаллическое вещество, очень гигроскопичное, плавящееся при 858° С и хорошо растворимое в воде. При охлаждении насыщенных водных растворов соды ниже 32–35° С из них выделяются кристаллы десятиводного карбоната натрия Na2CO3·10H2O – декагидрата карбоната натрия. Если упаривать водный раствор соды, то при температуре выше 113° С будет кристаллизоваться безводный карбонат натрия Na2CO3. Безводный карбонат натрия в технике и быту называют кальцинированной содой, а десятиводный – кристаллической содой. Есть еще гидрокарбонат натрия NaHCO3, более известный в быту и в медицине как питьевая, или пищевая, сода.
Есть еще гидрокарбонат натрия NaHCO3, более известный в быту и в медицине как питьевая, или пищевая, сода.
Сода была известна человеку примерно за полторы-две тысячи лет до нашей эры, а может быть и раньше. Ее добывали из содовых озер и извлекали из немногочисленных месторождений в виде минералов натрона Na2CO3·10H2O, термонатрита Na2CO3·H2O и троны Na2CO3·NaHCO3·2H2O.
Первые сведения о получении соды путем упаривания воды содовых озер относятся к 64 и приведены в сочинении римского врача Диоскорида Педания о лекарственных веществах. И ему, и алхимикам всех стран вплоть до 18 в. сода представлялась неким веществом, которое шипело с выделением какого-то газа при действии на него известных к тому времени кислот – уксусной CH3COOH и серной H2SO4.
Теперь известно, что шипение – это результат выделения газообразного диоксида углерода (углекислого газа) CO2 в результате реакций
Na2CO3 + 2 CH3COOH = Na(CH3COO) + CO2 + Н2О,
Na2CO3 + 2 H2SO4 = 2 NaHSO4 + CO2 + Н2О,
где образуются еще ацетат натрия Na(CH3COO) и гидросульфат натрия NaHSO4.
Во времена Диоскорида Педания о составе соды никто не имел понятия, ведь и диоксид углерода открыл голландский химик Ян ван Гельмонт (назвавший его «лесным газом»). только через шестьсот лет
Искусственную соду научились получать после долгих и мучительных поисков только в 18 в. Но сначала следовало определить состав этого вещества, выделив его в достаточно чистом виде. В 1736 французский химик, врач и ботаник Анри Луи Дюамель де Монсо, пользуясь водой содовых озер и применив метод перекристаллизации, впервые выделил чистую соду. Ему удалось установить, что сода содержит химический элемент «натр». Годом позже Дюамель и немецкий химик Андреас Сигизмунд Маргграф пришли к выводу, что сода Na2CO3 и поташ (карбонат калия K2CO3) – разные вещества, а не одно и то же, как считалось ранее.
Дюамель пытался получить соду, действуя уксусной кислотой CH3COOH на сульфат натрия Na2SO4. С точки зрения современного химика, это совершенно бессмысленно, но Дюамель не знал состава ни того, ни другого из взятых им исходных веществ. Ему было также неизвестно, что сильную кислоту (серную) нельзя вытеснить из солей слабой кислотой (уксусной). Тем не менее, Дюамель сделал интересное наблюдение: при нагревании смеси сульфата натрия с уксусной кислотой начали выделяться пары, которые загорелись от пламени свечи. Это была довольно летучая и горючая уксусная кислота…
Ему было также неизвестно, что сильную кислоту (серную) нельзя вытеснить из солей слабой кислотой (уксусной). Тем не менее, Дюамель сделал интересное наблюдение: при нагревании смеси сульфата натрия с уксусной кислотой начали выделяться пары, которые загорелись от пламени свечи. Это была довольно летучая и горючая уксусная кислота…
История знает немало других, иногда и опасных попыток получить соду. Так, Маргграф с этой целью смешивал нитрат натрия с углем, а потом нагревал смесь. Опыт завершился вспышкой смеси, которая обожгла ему лицо и руки. Маргграф не учел, что достаточно к смеси нитрата натрия (натриевой селитры) и угля добавить серу, как получится один из видов пороха.
Правда, при проведении реакции
4NaNO3 + 5C = 2Na2CO3 + 3CO2 + 2N2
удалось получить немного соды, но какой ценой!
Первый промышленный способ получения соды зародился в России. В 1764 российский химик, швед по происхождению академик Эрик Густав Лаксман сообщил, что соду можно получить спеканием природного сульфата натрия с древесным углем.
При этом протекает реакция:
2Na2SO4 + 3C + 2O2 = 2Na2CO3 + CO2 + 2SO2
Здесь помимо карбоната натрия Na2CO3 образуются два газообразныx вещества – диоксид углерода CO2 и диоксид серы SO2.
Поскольку природный сульфат натрия часто содержит примесь карбоната кальция CaCO3 (известняка), то этой реакции сопутствует вторая:
CaCO3 + C + Na2SO4 = Na2CO3 + 4CO + CaS,
где выделяется газообразный монооксид углерода СО и получается малорастворимый сульфид кальция CaS, который при обработке смеси водой отделяется от карбоната натрия. Последняя стадия процесса – выпаривание раствора, отфильтрованного от осадка, и кристаллизация карбоната натрия.
Лаксман осуществил получение соды по своему способу в 1784 на собственном стекольном заводе в Тальцинске недалеко от Иркутска. К сожалению, дальнейшего развития этот способ не получил и вскоре был забыт. А ведь еще Петр I в 1720, отвечая на вопрос князя Голицына, зачем нужна «зода», писал: «Зодою умягчают шерсть». В 1780 российский академик Гильденштедт отмечал, что «зуду можно почесть важным товаром в российской торговле. Стекольщики и красильщики много ее издерживают, а впредь еще и больше оной расходиться будет, когда больше станут делать белых стекол».
К сожалению, дальнейшего развития этот способ не получил и вскоре был забыт. А ведь еще Петр I в 1720, отвечая на вопрос князя Голицына, зачем нужна «зода», писал: «Зодою умягчают шерсть». В 1780 российский академик Гильденштедт отмечал, что «зуду можно почесть важным товаром в российской торговле. Стекольщики и красильщики много ее издерживают, а впредь еще и больше оной расходиться будет, когда больше станут делать белых стекол».
«Зодой» или «зудой» называли в России соду. Несмотря на обилие собственного сырья для производства соды ее ввозили в Россию из-за границы вплоть до 1860.
В 1791 французский врач и химик-технолог Никола Леблан, ничего не зная о способе Лаксмана, получил патент на «Способ превращения глауберовой соли в соду» (глауберова соль – декагидрат сульфата натрия Na2SO4·10H2O). Леблан предложил для получения соды сплавлять смесь сульфата натрия, мела (карбоната кальция) и древесного угля. В описании изобретения он указывал: «Над поверхностью плавящейся массы вспыхивает множество огоньков, похожих на огни свечей. Получение соды завершается, когда эти огоньки исчезают».
Получение соды завершается, когда эти огоньки исчезают».
При сплавлении смеси протекает восстановление сульфата натрия углем:
Na2SO4 + 4C = Na2S + 4CO
Образовавшийся сульфид натрия Na2S взаимодействует с карбонатом кальция CaCO3:
Na2S + CaCO3 = Na2CO3+ CaS
После полного выгорания угля и монооксида углерода CO («огоньки исчезают») расплав охлаждают и обрабатывают водой. В раствор переходит карбонат натрия, а сульфид кальция остается в осадке. Соду можно выделить упариванием раствора.
Свою технологию получения соды Леблан предложил герцогу Филиппу Орлеанскому, личным врачом которого он был. В 1789 герцог подписал с Лебланом соглашение и выделил ему двести тысяч серебряных ливров на строительство завода. Содовый завод в пригороде Парижа Сен-Жени назывался «Франсиада – Сода Леблана» и ежедневно давал 100–120 кг соды. Во время Французской революции в 1793 герцог Орлеанский был казнен, собственность его конфискована, а содовый завод и сам патент Леблана – национализированы. Лишь через семь лет Леблану вернули разоренный завод, восстановить который ему уже не удалось. Последние годы Леблана прошли в нищете, а в 1806 он покончил жизнь самоубийством.
Лишь через семь лет Леблану вернули разоренный завод, восстановить который ему уже не удалось. Последние годы Леблана прошли в нищете, а в 1806 он покончил жизнь самоубийством.
Технологию производства соды по Леблану стали использовать во многих странах Европы. Первый содовый завод такого типа в России был основан промышленником М.Прангом и появился в Барнауле в 1864. Но уже через несколько лет в районе теперешнего города Березники был построен крупный содовый завод фирмы «Любимов, Сольве и К°», где выпускалось 20 тысяч тонн соды в год. Этот завод использовал новую технологию производства соды – аммиачный способ, изобретенный бельгийским инженером-химиком Эрнестом Сольве. С этого времени заводы в России и в других странах, использовавшие метод Леблана, не выдержав конкуренции, стали постепенно закрываться: технология Сольве оказалась более экономичной.
Аммиачный способ получения соды был предложен еще в 1838–1840 английскими инженерами-химиками Г.Грей-Дьюаром и Д.Хеммингом. Они пропускали через воду газообразные аммиак NH3 и диоксид углерода CO2, которые при взаимодействии дают раствор гидрокарбоната аммония NH4HCO3:
Они пропускали через воду газообразные аммиак NH3 и диоксид углерода CO2, которые при взаимодействии дают раствор гидрокарбоната аммония NH4HCO3:
NH3 + CO2 + H2O = NH4HCO3,
а затем добавляли к этому раствору хлорид натрия NaCl, чтобы выделить малорастворимый на холоде гидрокарбонат натрия NaHCO3:
NH4HCO3 + NaCl = NaHCO3Ї + NH4Cl
Гидрокарбонат натрия отфильтровывали и нагреванием превращали в соду:
2 NaHCO3 = Na2CO3 + CO2 + H2O
Диоксид углерода CO2, необходимый для проведения процесса, получали из карбоната кальция СаСО3 – мела или известняка – при прокаливании:
CaCO3 = CaO + CO2,
а оксид кальция CaO, который при этом получался, после обработки водой давал гидроксид кальция Ca(OH)2:
CaO + H2O = Ca(OH)2,
необходимый для получения аммиака NH3 из хлорида аммония NH4Cl:
2 NH4Cl + Ca(OH)2 = 2 NH3 + CaCl2 + 2 H2O
Таким образом, аммиак все время находился в обращении и не расходовался, отходом производства оставался только хлорид кальция CaCl2.
Эрнест Сольве не внес принципиальных новшеств в химическую основу содового процесса английских инженеров, он только технологически оформил производство, однако, это тоже непросто. В частности, он применил здесь аппараты колонного типа, которые позволили вести процесс непрерывно и достичь высокого выхода продукта.
Преимущества аммиачного метода над способом Леблана состояли в получении более чистой соды, меньшем загрязнении окружающей среды и экономии топлива (поскольку температура здесь ниже). Все вместе это привело к тому, что в 1916–1920-х закрылись почти все заводы, работавшие по методу Леблана.
Первыми в мире заводами, использующими аммиачный способ получения соды, стали бельгийский завод в Куйе, построенный по проекту самого Сольве в 1865, и Камско-Содовый завод Лихачева в России, который начал работать в 1868. Российский завод был создан полковником Иваном Лихачевым в его имении на берегу реки Камы в Казанской губернии. Лихачев добывал аммиак NH3 путем сухой перегонки отходов, которые ему поставляли почти двести кожевенных мастерских со всей округи. Диоксид углерода СО2 получали прокаливанием известняка, найденного поблизости. Завод просуществовал недолго и уже через четыре года был закрыт из-за нерентабельности: сильно подорожали и кожевенные отходы, и поваренная соль NaCl.
Диоксид углерода СО2 получали прокаливанием известняка, найденного поблизости. Завод просуществовал недолго и уже через четыре года был закрыт из-за нерентабельности: сильно подорожали и кожевенные отходы, и поваренная соль NaCl.
Сейчас в мире производится несколько млн тонн соды в год.
Карбонат натрия применяется в стеклоделии (это составная часть шихты – смеси исходных веществ, из которой выплавляется стекло), для получения мыла и других моющих средств, в целлюлозо-бумажной промышленности (для варки целлюлозы). Много соды потребляется в технологическом процессе получения алюминия, именно сода идет на обработку исходного сырья алюминиевой промышленности – бокситов. Карбонатом натрия нейтрализуют кислоты в промышленных стоках, в том числе – при очистке нефтепродуктов, осаждают из растворов солей нерастворимые карбонаты и гидроксиды, которые после прокаливания используются как пигменты:
Гидрокарбонат натрия тоже не остается без применения – он служит источником углекислого газа при выпечке хлеба и кондитерских изделий, газированных напитков, а также в огнетушителях. Кроме того, питьевая сода по-прежнему занимает свое законное место в домашней аптечке как одно из самых простых и дешевых, но очень нужных лекарственных средств.
Кроме того, питьевая сода по-прежнему занимает свое законное место в домашней аптечке как одно из самых простых и дешевых, но очень нужных лекарственных средств.
Людмила Аликберова
ГОСТ 32802-2014 Добавки пищевые. Натрия карбонаты Е500. Общие технические условия (с Поправкой)
ГОСТ 32802-2014
МКС 67.220.20
Дата введения 2016-01-01
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 “Межгосударственная система стандартизации. Основные положения” и ГОСТ 1.2-2009 “Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены”
Сведения о стандарте
1 РАЗРАБОТАН Государственным научным учреждением Всероссийским научно-исследовательским институтом пищевых ароматизаторов, кислот и красителей Российской академии сельскохозяйственных наук (ГНУ ВНИИПАКК Россельхозакадемии)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 25 июня 2014 г. N 45-2014)
N 45-2014)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
(Поправка. ИУС N 7-2019).
ИУС N 7-2019).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 09 июля 2014 г. N 819-ст межгосударственный стандарт ГОСТ 32802-2014 введен в действие в качестве национального стандарта Российской Федерации с 01 января 2016 г.
5 В настоящем стандарте учтены требования Единого стандарта на пищевые добавки Комиссии Кодекса Алиментариус CODEX STAN 192-1995* “General Standard for Food Additives” (пункт 3.4) в части Спецификации на пищевую добавку Е500 Единого свода спецификаций пищевых добавок Объединенного экспертного комитета по пищевым добавкам ФАО/ВОЗ “Combined compendium of food additive specification JECFA. Volume 4”
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. – Примечание изготовителя базы данных.
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе “Национальные стандарты”, а текст изменений и поправок – в ежемесячном информационном указателе “Национальные стандарты”. В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе “Национальные стандарты”. Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования – на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе “Национальные стандарты”. Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования – на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ВНЕСЕНА поправка, опубликованная в ИУС N 7, 2019 год
Поправка внесена изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на пищевую добавку – карбонаты натрия Е500, представляющую собой натриевые соли угольной кислоты: безводную и водные формы карбоната натрия E500(i), гидрокарбонат натрия E500(ii) и смесь безводного карбоната натрия и гидрокарбоната натрия E500(iii) (далее – пищевые карбонаты натрия) и предназначенные для использования в пищевой промышленности как регуляторы кислотности, антислеживающие агенты и разрыхлители пищевых продуктов.
Требования, обеспечивающие безопасность пищевых карбонатов натрия, изложены в 4.1.5, требования к качеству – в 4.1.3 и 4.1.4, к маркировке – в 4.4.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 8.579-2002 Государственная система обеспечения единства измерений. Требования к количеству фасованных товаров в упаковках любого вида при их производстве, расфасовке, продаже и импорте
ГОСТ 12.0.004-90 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12. 2.007.0-75 Система стандартов безопасности труда. Изделия электротехнические. Общие требования безопасности
2.007.0-75 Система стандартов безопасности труда. Изделия электротехнические. Общие требования безопасности
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.011-89 Система стандартов безопасности труда. Средства защиты работающих. Общие требования и классификация
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 12.4.103-83 Система стандартов безопасности труда. Одежда специальная защитная, средства индивидуальной защиты ног и рук. Классификация
ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
ГОСТ OIML R 76-1-2011 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 450-77 Кальций хлористый технический. Технические условия
ГОСТ 1277-75 Реактивы. Серебро азотнокислое. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 3760-79 Реактивы. Аммиак водный. Технические условия
ГОСТ 3773-72 Реактивы. Аммоний хлористый. Технические условия
ГОСТ 3956-76 Силикагель технический. Технические условия
ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
ГОСТ 4212-76 Реактивы. Методы приготовления растворов для колориметрического и нефелометрического анализа
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4461-77 Реактивы. Кислота азотная. Технические условия
ГОСТ 4517-87 Реактивы. Методы приготовления вспомогательных реактивов и растворов, применяемых при анализе
ГОСТ 4919.1-77 Реактивы и особо чистые вещества. Методы приготовления растворов индикаторов
ГОСТ 5823-78 Реактивы. Цинк уксуснокислый 2-водный. Технические условия
Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 6825-91 Лампы люминесцентные трубчатые для общего освещения
ГОСТ 8050-85 Двуокись углерода газообразная и жидкая. Технические условия
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9262-77 Реактивы. Кальция гидроокись. Технические условия
ГОСТ 10354-82 Пленка полиэтиленовая. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13511-2006 Ящики из гофрированного картона для пищевых продуктов, спичек, табачных изделий и моющих средств
ГОСТ 14192-96 Маркировка грузов
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ 14961-91 Нитки льняные и льняные с химическими волокнами. Технические условия
ГОСТ 15846-2002 Продукция, отправляемая в районы Крайнего Севера и приравненные к ним местности. Упаковка, маркировка, транспортировка и хранение
Упаковка, маркировка, транспортировка и хранение
ГОСТ 17308-88 Шпагаты. Технические условия
ГОСТ 18300-87* Спирт этиловый ректификованный технический. Технические условия
________________
* На территории Российской Федерации действует ГОСТ Р 55878-2013.
ГОСТ 18389-73 Проволока из платины и ее сплавов. Технические условия
ГОСТ 19360-74 Мешки-вкладыши пленочные. Общие технические условия
ГОСТ 20478-75 Реактивы. Аммоний надсернокислый. Технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25794.1-83 Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования
ГОСТ 25794.3-83 Реактивы. Методы приготовления титрованных растворов для титрования осаждением, неводного титрования и других методов
ГОСТ 26927-86 Сырье и продукты пищевые. Методы определения ртути
ГОСТ 26930-86 Сырье и продукты пищевые. Метод определения мышьяка
ГОСТ 26932-86 Сырье и продукты пищевые. Методы определения свинца
Методы определения свинца
ГОСТ 27067-86 Реактивы. Аммоний роданистый. Технические условия
ГОСТ 27752-88 Часы электронно-механические кварцевые настольные, настенные и часы-будильники. Общие технические условия
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29251-91 (ИСО 385-1-84) Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
ГОСТ 30090-93 Мешки и мешочные ткани. Общие технические условия
ГОСТ 30178-96 Сырье и продукты пищевые. Атомно-абсорбционный метод определения токсичных элементов
ГОСТ 30538-97 Продукты пищевые. Методика определения токсичных элементов атомно-эмиссионным методом
Примечание – При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования – на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю “Национальные стандарты”, который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя “Национальные стандарты” за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Классификация
Пищевые карбонаты натрия (Е500) подразделяют:
– на E500(i) карбонаты натрия безводный, моногидрат и декагидрат;
– Е500(ii) гидрокарбонат натрия;
– E500(iii) смесь солей карбоната натрия и гидрокарбоната натрия.
Обозначения, наименования, химические названия, формулы и молекулярные массы пищевых карбонатов натрия приведены в таблице 1.
Таблица 1
Обозначение и наименование пищевого карбоната натрия | Химическое название | Формула | Молекулярная масса, а. |
Е500 (i) Карбонат натрия | Натрий углекислый безводный | NaCO | 106,00 |
Натрий углекислый моногидрат | NaCO·HO | 124,12 | |
Натрий углекислый декагидрат | NaCO·10HO | 287,20 | |
E500(ii) Гидрокарбонат натрия | Натрий углекислый кислый (натрий бикарбонат) | NaHCO | 84,01 |
E500(iii) смесь карбоната и гидрокарбоната натрия | Натрий сесквикарбонат (натриевые соли угольной кислоты) | NaCO·NaHCO·2HO | 226,03 |
4 Технические требования
4.
 1 Характеристики
1 Характеристики
4.1.1 Пищевые карбонаты натрия вырабатывают в соответствии с требованиями [1], [2] и настоящего стандарта и применяют в пищевых продуктах в соответствии с требованиями [1] или нормативных правовых актов, действующих на территории государства, принявшего стандарт.
4.1.2 Пищевые карбонаты натрия хорошо растворимы в воде и не растворимы в этаноле.
4.1.3 По органолептическим показателям пищевые карбонаты натрия должны соответствовать требованиям, указанным в таблице 2.
Таблица 2
Наименование показателя | Характеристика |
Внешний вид, цвет | Белый кристаллический порошок или бесцветные кристаллы |
Запах | Без запаха |
4. 1.4 По физико-химическим показателям пищевые карбонаты натрия должны соответствовать требованиям, указанным в таблице 3.
1.4 По физико-химическим показателям пищевые карбонаты натрия должны соответствовать требованиям, указанным в таблице 3.
Таблица 3
Наименование показателя | Характеристика (значение показателя) | |||
Тест на натрий | Выдерживает испытание | |||
Тест на карбонат | Выдерживает испытание | |||
Массовая доля основного вещества в расчете на сухую основу, % | ||||
Е500 (i), не менее | 99,0* | |||
Е500 (ii), не менее | 99,0* | |||
Е500 (iii): | ||||
Гидрокарбонат натрия NaНСО | от 35,0 до 38,6 включ. | |||
Карбонат натрия NaCO | от 46,4 до 50,0 включ.* | |||
Массовая доля потерь при высушивании, %, | ||||
Е500 (i): | ||||
Карбонаты натрия: | ||||
безводный NaCO, не более | 2 | |||
моногидрат NaCO·HO, не более | 15 | |||
декагидрат NaCO·10HO, | от 55 до 65 включ. | |||
Е500 (ii), не более | 0,25 | |||
рН водного раствора гидрокарбоната натрия (Е500 (ii)) массовой долей 1%, ед. | От 8,0 до 8,6 включ. | |||
Тест на нерастворимые в воде вещества для E500(ii) | Выдерживает испытание | |||
Тест на соли аммония для Е500 (ii) | Выдерживает испытание | |||
Массовая доля хлористого натрия в Е500 (iii), %, не более | 0,5 | |||
Массовая доля воды в E500(iii), % | от 13,8 до 16,7 включ. | |||
Массовая доля (содержание) железа в E500(iii), млн (мг/кг), не более | 20 | |||
* В соответствии с [1] или нормативными правовыми актами, действующими на территории государства, принявшего стандарт. | ||||
4.1.5 Содержание токсичных элементов (мышьяк, свинец, ртуть) в пищевых карбонатах натрия не должно превышать норм, установленных [1] или нормативными правовыми актами, действующими на территории государства, принявшего стандарт.
4.2 Требования к сырью
4.2.1 Для производства пищевых карбонатов натрия используют следующее сырье:
– аммиак водный по ГОСТ 3760;
– двуокись углерода по ГОСТ 8050;
– хлористый натрий по ГОСТ 4233.
Что такое пищевая сода?
Пищевая сода, главный агент разрыхления, заставляет выпечку подниматься. Известный химически как бикарбонат соды или бикарбонат натрия, он может использоваться отдельно в некоторых рецептах, но он также добавляет щелочной ингредиент в разрыхлитель, который включает кислоту, необходимую для запуска реакции, вызывающей подъем. Пищевая сода, используемая отдельно, должна быть объединена в рецепте с кислотными ингредиентами, такими как коричневый сахар, уксус, мед или пахта.
Быстрые факты
- Кулинарное применение: Разрыхлитель и размягчение мяса
- Использование в домашних условиях: Очищает и дезодерирует
- Применение для здоровья: антацид, отбеливатель для зубов
- Срок годности: два года в закрытом виде; через полгода после открытия
Что такое пищевая сода?
Пищевая сода, щелочное соединение, в сочетании с кислотой образует пузырьки углекислого газа.Пузырьки застревают, в результате чего тесто или жидкое тесто расширяются или поднимаются. Это создает воздушную текстуру блинов, пирожных, хлеба и других продуктов. При смешивании с кислыми ингредиентами, такими как пахта, уксус, йогурт или лимонный сок, пищевая сода выделяет углекислый газ.
Пищевая сода также выделяет газ при разложении. При воздействии температур выше 176 градусов по Фаренгейту (80 градусов по Цельсию) в духовке пищевая сода выделяет пузыри и может вызвать подъем пищи.
Пищевая сода находит множество не кулинарных применений в доме: от тушения небольших пожаров до облегчения раздражения от укусов насекомых, полировки серебра, дезодорирования и многого другого. Пищевая сода недорогая и широко доступна.
Пищевая сода недорогая и широко доступна.
Пищевая сода и разрыхлитель
Пищевая сода – это чистый бикарбонат натрия. Разрыхлитель содержит бикарбонат натрия, но также включает подкислитель и осушитель. Рецепты могут включать и пищевую соду, и разрыхлитель, но вы не можете использовать их как взаимозаменяемые. Пищевая сода начинает выделять газ после активации, поэтому продукты, приготовленные только с пищевой содой, необходимо сразу же выпекать, чтобы получить преимущества. Разрыхлитель бывает одинарного или двойного действия.Порошки одностороннего действия активируются, когда они смешиваются с влажными ингредиентами, и, как и в случае с пищевой содой, их необходимо сразу запекать, прежде чем газ рассеется. Порошок двойного действия содержит второй разрыхлитель, активируемый нагреванием, поэтому продукты, содержащие этот ингредиент, могут отдыхать или охлаждаться перед выпечкой и все равно подниматься в духовке.
Для пищевой соды
Смешайте пищевую соду с другими сухими ингредиентами в рецепте, чтобы равномерно распределить ее и защитить от влажных ингредиентов, которые могут активировать ее до того, как вы будете готовы.
Кулинарные традиции часто рекомендуют добавлять небольшое количество пищевой соды в кипящую воду, прежде чем бланшировать зеленые овощи, чтобы сохранить их цвет, но это фактически лишает их витамина С и заставляет их размягчаться быстрее, иногда до кашу.
Помимо выпечки, пищевую соду можно использовать в холодильниках и других местах, подверженных запаху, потому что это естественный дезодорант. В качестве натурального чистящего средства смешайте пищевую соду с небольшим количеством теплой воды, чтобы очистить алюминиевые предметы, например противни.Он может удалить потускнение с серебра, если серебро соприкоснется с алюминиевой фольгой. Загрязненную эмалевую посуду можно восстановить, протерев ее смесью пищевой соды и воды. Пищевая сода также используется с холодной водой для удаления поверхностной ржавчины. (Горячая вода может вызвать коррозию стали). Его также можно использовать в сочетании с теплой водой для удаления пятен от чая и кофе с внутренней стороны кружек.
Пищевая сода также помогает прочистить раковину. Вылейте несколько чайных ложек пищевой соды в канализацию и сбрызните немного белого уксуса.Он будет шипеть и очищать трубы, часто одновременно удаляя засорения.
Какой у него вкус?
Пищевая сода, основное вещество, имеет слегка горький вкус, но ее не следует употреблять отдельно. В сочетании с кислотой и жидкостью химическая реакция вызывает образование пузырьков углекислого газа. По мере того, как они расширяются, они заставляют тесто подниматься, что в конечном итоге приводит к полному растворению пищевой соды. Если вы добавляете пищевую соду в рецепт без достаточного количества влаги или кислоты, чтобы вызвать полноценную реакцию, вы можете почувствовать горький неприятный привкус от оставшегося бикарбоната натрия.
Заменитель пищевой соды
Из-за точного взаимодействия пищевой соды с другими ингредиентами трудно произвести замену с предсказуемыми результатами. Но если вы учтете другие ингредиенты в своем рецепте, вы сможете эффективно заменить их. Бикарбонат калия, который часто продается в качестве замены пищевой соды для диет с низким содержанием натрия, предлагает наиболее простой вариант, но его бывает трудно найти; лучше всего поискать в Интернете. Вы также можете добавить соли, чтобы учесть потерю натрия.Разрыхлитель также может заменить пищевую соду, но в результате получится другая текстура. И вам понадобится полная чайная ложка разрыхлителя, чтобы заменить каждую 1/4 чайной ложки пищевой соды в рецепте. Вам также может потребоваться отрегулировать другие ингредиенты, например, заменить некислотную или менее кислую жидкость на кислую, например, молоко на пахту.
Бикарбонат калия, который часто продается в качестве замены пищевой соды для диет с низким содержанием натрия, предлагает наиболее простой вариант, но его бывает трудно найти; лучше всего поискать в Интернете. Вы также можете добавить соли, чтобы учесть потерю натрия.Разрыхлитель также может заменить пищевую соду, но в результате получится другая текстура. И вам понадобится полная чайная ложка разрыхлителя, чтобы заменить каждую 1/4 чайной ложки пищевой соды в рецепте. Вам также может потребоваться отрегулировать другие ингредиенты, например, заменить некислотную или менее кислую жидкость на кислую, например, молоко на пахту.
Рецепты пищевой соды
Пищевая сода действует как химический разрыхлитель в рецептах, от печенья до пирожных и хлеба.
Где купить
Поищите пищевую соду в любом продуктовом магазине. Обычно он поставляется в картонной коробке или другом герметичном контейнере. Освежители воздуха на основе пищевой соды можно продавать в магазине товаров для дома или в проходе с чистящими средствами продуктового магазина.
Хранилище
Открыв картонную коробку, храните пищевую соду в герметичном пакете или контейнере с застежкой-молнией. Храните его в прохладном темном месте, например, в кладовой, подальше от плиты и шкафа для специй, чтобы он не впитывал нежелательные запахи.Теоретически он действует бесконечно долго, но может потерять активность примерно через шесть месяцев.
После длительного хранения вы можете проверить жизнеспособность пищевой соды, поместив 1/2 чайной ложки в чашку или миску, а затем добавив немного уксуса или немного лимонного сока. Пищевая сода должна сильно пузыриться.
Питание и преимущества
Пищевая сода не имеет никакой питательной ценности. В нем нет калорий, жиров и белков. Один грамм пищевой соды дает 11.Однако 9% рекомендуемой суточной нормы натрия.
Половина чайной ложки пищевой соды, смешанной с 8 унциями холодной воды, может действовать как антацид, снимая изжогу, вздутие живота, кислый желудок и газы. Паста, приготовленная с небольшим количеством воды, также может облегчить боль от солнечных ожогов, укусов насекомых и кожной сыпи.
Пищевая сода – Состав – FineCooking
A.K.A
бикарбонат натрия; бикарбонат соды
Что это?
Чрезвычайно щелочной белый водорастворимый порошок.При смешивании с кислотой он вызывает химическую реакцию, в результате которой образуется углекислый газ, или, проще говоря, он создает пузыри, которые заставляют выпечку подниматься. Вы всегда увидите пищевую соду в рецептах, которые также включают какой-либо кислый ингредиент, например уксус, йогурт, пахту или винный камень.
Как приготовить:
Поскольку он начинает реагировать, как только встречается с кислой жидкостью, смешайте пищевую соду с сухими ингредиентами (не влажными) и готовьте тесто вскоре после добавления жидкости.Чтобы из пищевой соды получались легкие воздушные блины и кексы, тесто должно иметь правильную кислотность (например, пахта, йогурт, лимонный сок, яблочное пюре, уксус или мед). Если в жидком тесте недостаточно кислотности (например, если вы замените пахту свежим молоком), пищевая сода не превратится в углекислый газ. Полученное тесто не поднимется должным образом, а непревращенная пищевая сода оставит неприятный мыльный привкус.
Полученное тесто не поднимется должным образом, а непревращенная пищевая сода оставит неприятный мыльный привкус.
Как хранить:
Пищевая сода долго хранится в прохладном сухом месте.Но его заквасочная способность со временем снижается, поэтому, если это было давно, проверьте срок годности; вам может потребоваться открыть новую коробку.
Перекрестная ссылка
разрыхлитель
Рецепт
Эти супердекадентные горько-сладкие печенья взяты из книги «Радости выпечки» Саманты Сеневиратн и вдохновлены книгой Дори Гринспен, названной «Cookies мира во всем мире».
Рецепт
Этот великолепный бундт со вкусом кофе, отрывок из «Радостей выпечки», более сладкий, чем кофе, и имеет липкую глазурь из сгущенного молока, которую вам, возможно, придется отказаться от еды с…
Рецепт
Эта красочная фриттата станет идеальным блюдом для позднего завтрака, особенно в сочетании с редисом, сельдереем и салатом из фризе.
 Добавление небольшого количества пищевой соды в лук помогает ему быстрее подрумяниться.
Добавление небольшого количества пищевой соды в лук помогает ему быстрее подрумяниться.Рецепт
Коричневое масло и сухое солодовое молоко усиливают теплый, насыщенный, жареный вкус этих хрустящих дрожжевых вафель. Сделайте большую часть теста, затем накройте и поставьте в холодильник на ночь. Следующий…
Рецепт
Сироп из мацерированных долек апельсина и ложка крем-фреш украшают этот деревенский торт, отсылку к сефардским десертам Италии и Испании.Оливковое масло дает…
Рецепт
Вот идеальное праздничное печенье с шоколадной крошкой: с кусочками шоколада, орехами и сухофруктами; немного хрустящая корочка по краю; и жевать посередине.
 Корица, мускатный орех, кардамон и…
Корица, мускатный орех, кардамон и…Рецепт
Имбирь, специи и все остальное – вот из чего сделано это печенье.Лучше всего их есть в тот день, когда они запекаются. Но можно запечь батончики и глазировать их впереди…
Рецепт
Пикантный бекон и сладкий кленовый сироп придают современный вид классическому имбирному печенью. Как и классика, они хрустящие снаружи и жевательные внутри. Если…
Рецепт
Эти батончики с ленточкой пикантной клюквы между слоями сытного овса – отличное угощение в любое время дня, включая завтрак.
Рецепт
Ореховая, слегка горьковатая тахини является хорошей фольгой для шоколадных вафель.
 Вы будете испытывать искушение делать кунжут ломким круглый год; из упаковки этого хрустящего сладкого угощения получается отличный…
Вы будете испытывать искушение делать кунжут ломким круглый год; из упаковки этого хрустящего сладкого угощения получается отличный…
Рецепты
Техника безопасности, очистки и многое другое
Пищевая сода – это неорганическая соль, часто встречающаяся в виде порошка.Он используется в выпечке как разрыхлитель, поскольку выделяет углекислый газ при реакции с кислотой или теплом. Он также используется в широком спектре непродовольственных товаров, таких как стиральные порошки и предметы личной гигиены.
Химическая формула и синонимы
Молекулярная формула пищевой соды – CHNaO 3 , а ее регистрационный номер в фармакопее США (USP) – 144-55-8. Пищевая сода может иметь следующие названия, которые могут быть такими, как она указана на этикетке продукта: ацидозан; мононатриевая соль угольной кислоты; бикарбонат соды; мейлон; нейт; гидрокарбонат натрия; карбонат натрия кислый; бикарбонат натрия; и гидрокарбонат натрия.
Использование для очистки
Пищевая сода очень щелочная по своей природе с высоким pH, это один из лучших экологически чистых чистящих ингредиентов, который используется в нескольких чистящих средствах, особенно в экологически чистых. Вы можете найти его в стиральных и чистящих средствах, средствах для борьбы с плесенью, чистящих средствах, освежителях и чистящих средствах для ковров, мыле для мытья посуды, средствах для автоматических посудомоечных машин, освежителях воздуха, средствах для чистки унитаза, средствах для чистки полов, универсальных чистящих средствах и пятновыводителях.
Он известен своими фантастическими дезодорирующими, отбеливающими, осветляющими, очищающими и нежными свойствами.Благодаря форме порошка он также отлично впитывает жир и пролитую жидкость. Кроме того, он обладает бактерицидной способностью и способностью удалять пятна, как показано в одном исследовании стоматологической помощи, опубликованном в «Журнале пародонтологии» и другом в «Журнале клинической стоматологии» соответственно. Если он может воздействовать на ваши зубы, он определенно будет работать и на других поверхностях. Вы также можете смешать с ним свои собственные творения для зеленой уборки.
Если он может воздействовать на ваши зубы, он определенно будет работать и на других поверхностях. Вы также можете смешать с ним свои собственные творения для зеленой уборки.
Другое применение
Помимо использования в чистящих средствах, пищевую соду можно найти в нескольких продуктах, таких как средства личной гигиены (например,g., средства для ванны, зубная паста, дезодоранты, очищающие средства, мыло), лекарства (например, средства для ухода за кожей), выпечка и наполнитель для кошачьего туалета. Пищевая сода также применяется при изжоге, кислотном расстройстве желудка и расстройстве желудка, вызванном такими проблемами. Кроме того, вы можете использовать его для регулировки pH вашего бассейна.
По данным Агентства по охране окружающей среды (EPA), пищевая сода также считается биопестицидом, то есть пестицидами, полученными из определенных видов природных материалов.
Бренды продуктов, содержащие пищевую соду
Помимо пищевой соды, входящей в знакомую коробку Arm & Hammer, пищевая сода содержится в некоторых других продуктах в качестве ингредиента. Чтобы узнать, содержат ли определенные продукты пищевую соду, попробуйте поискать в базе данных по товарам для дома Министерства здравоохранения и социальных служб США, в Руководстве по здоровой очистке Рабочей группы по охране окружающей среды (EWG), в Good Guide или в базе данных Skin Deep Cosmetic EWG. Помните, если поиск с использованием общего термина «пищевая сода» не дает много результатов, попробуйте ввести один из его синонимов.
Чтобы узнать, содержат ли определенные продукты пищевую соду, попробуйте поискать в базе данных по товарам для дома Министерства здравоохранения и социальных служб США, в Руководстве по здоровой очистке Рабочей группы по охране окружающей среды (EWG), в Good Guide или в базе данных Skin Deep Cosmetic EWG. Помните, если поиск с использованием общего термина «пищевая сода» не дает много результатов, попробуйте ввести один из его синонимов.
Постановление
Когда пищевая сода используется в предметах личной гигиены, пищевых продуктах или лекарствах, это контролируется U.S. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. Для других целей, таких как пестициды и чистящие средства, он контролируется Агентством по охране окружающей среды.
Здоровье и безопасность
В отличие от некоторых других химикатов, используемых в чистящих средствах, пищевая сода является довольно безопасным химическим веществом. Вы даже можете принимать его внутрь как антацид, как указано на упаковке пищевой соды Arm & Hammer. Однако инструкции предупреждают, что сначала следует полностью растворить пищевую соду в воде, а не принимать ее, когда вы наелись.
Однако инструкции предупреждают, что сначала следует полностью растворить пищевую соду в воде, а не принимать ее, когда вы наелись.
Предупреждение
Единственная реальная проблема безопасности пищевой соды заключается в том, что она может вызывать раздражение и покраснение глаз в соответствии с Международной картой химической безопасности. Промыть глаза водой в течение нескольких минут, а затем обратиться к врачу, если она попала вам в глаза. В остальном пищевая сода очень безопасна.
Воздействие на окружающую среду
Нет данных о том, что пищевая сода оказывает негативное воздействие на окружающую среду. Однако он действительно добывается из материала под названием трона, который находится в Вайоминге, а затем перерабатывается в пищевую соду.Второстепенное воздействие на окружающую среду – это углеродный след от добычи и переработки.
Пищевая сода и разрыхлитель
Узнайте, в чем разница между пищевой содой и разрыхлителем, и что делать в крайнем случае, если у вас ее нет под рукой!
Химическая закваска
Пищевая сода и разрыхлитель являются химическими разрыхлителями, используемыми в выпечке. Это означает, что когда эти два вещества смешиваются в тесте или кляре и выпекаются, происходит химическая реакция, заставляющая выпечку подниматься.Процесс закваски не только улучшает качество выпечки, но также делает ее более нежной и поддерживает подрумянивание.
Это означает, что когда эти два вещества смешиваются в тесте или кляре и выпекаются, происходит химическая реакция, заставляющая выпечку подниматься.Процесс закваски не только улучшает качество выпечки, но также делает ее более нежной и поддерживает подрумянивание.
Хотя пищевая сода и разрыхлитель выполняют одну и ту же основную функцию, то, как они работают, чтобы приготовить вкусную выпечку, отличается.
Посмотрите видео о пищевой соде и разрыхлителе
Что такое пищевая сода?
Пищевая сода, также иногда называемая «бикарбонат натрия», представляет собой простой бикарбонат натрия. По шкале ph считается базовой.Чтобы он разрыхлял вашу выпечку, ему необходим кислотный компонент. Когда основные свойства пищевой соды смешиваются с кислотными свойствами другого ингредиента, пищевая сода нейтрализует кислоту, и это вызывает образование пузырьков воздуха (углекислого газа), разрыхляющих выпечку.
В выпечке обычные кислые компоненты включают: пахту, коричневый сахар, патоку, уксус, йогурт, лимонный сок (или другой сок цитрусовых), натуральный какао-порошок (какао-порошок, обработанный голландцами, не является кислым) и шоколад.
Пищевая сода идеально подходит для использования вместо разрыхлителя, если есть кислотный компонент, потому что она примерно в четыре раза более эффективна, чем разрыхлитель.
Что такое разрыхлитель?
Разрыхлитель – это пищевая сода (бикарбонат натрия), уже смешанная с кислотными ингредиентами. Следовательно, разрыхлитель можно использовать сам по себе для закваски выпечки без добавления кислотных ингредиентов.
Разрыхлитель действует так же, как пищевая сода, создавая пузырьки воздуха (углекислый газ), которые заставляют выпечку подниматься.В наши дни большинство разрыхлителей также обладают «двойным действием», что означает, что они фактически содержат два типа кислот: одна реагирует при гидратации, а другая – на тепло духовки.
Разрыхлитель примерно в четыре раза слабее пищевой соды, и у него есть срок годности. Обратите внимание на срок годности. Если вы сомневаетесь, хорош ли ваш разрыхлитель, вы можете его протестировать.
Чтобы проверить, активен ли разрыхлитель или пищевая сода, добавьте чайную ложку примерно в 1 стакан горячей воды.Если он еще свежий, он начнет немного пузыриться. Если он не пузырится, выбросьте его и возьмите новый контейнер.
Почему в некоторых рецептах используются и пищевая сода, и разрыхлитель?
Рецепты, которые требуют и пищевой соды, и разрыхлителя, обычно связаны с тем фактом, что рецепт содержит кислоту, которую необходимо нейтрализовать пищевой содой, но, возможно, недостаточно, чтобы обеспечить желаемое количество разрыхлителя. Разрыхлитель компенсирует провисание. Кроме того, поскольку разрыхлитель имеет двойное действие, он делает выпечку еще лучше.
Замена пищевой соды и разрыхлителя:
Поскольку выпечка – это наука, в большинстве рецептов не рекомендуется заменять пищевую соду и разрыхлитель. Лучше всего найти рецепт, в котором используются ингредиенты, которые у вас есть под рукой.
Лучше всего найти рецепт, в котором используются ингредиенты, которые у вас есть под рукой.
Однако, если вы понимаете, как они взаимодействуют, есть несколько способов заменить любой из них, если это абсолютно необходимо.
Заменитель пищевой соды
Если в вашем рецепте требуется пищевая сода, а у вас ее нет под рукой, вы можете заменить пищевую соду на разрыхлитель.Увеличьте количество разрыхлителя в четыре раза больше пищевой соды, указанной в рецепте.
Заменитель разрыхлителя
Если в вашем рецепте используется разрыхлитель, а у вас его нет, вы можете создать свой собственный заменитель разрыхлителя, если у вас есть пищевая сода и винный камень. Смешайте пищевую соду и зубной камень в соотношении 1: 2. Одна часть пищевой соды на две части зубного камня равняется заменителю разрыхлителя.
Если у вас под рукой нет зубного камня и в вашем рецепте присутствует кислый ингредиент, вы можете заменить разрыхлитель пищевой содой.Используйте 1/4 количества пищевой соды, чем указанное в рецепте количество разрыхлителя. Обратите внимание, что на 1/4 чайной ложки пищевой соды вам потребуется достаточное количество кислотности, что составляет около 1 стакана пахты, 1 стакана коричневого сахара, 1 чайной ложки лимонного сока или 1 чайной ложки уксуса.
Обратите внимание, что на 1/4 чайной ложки пищевой соды вам потребуется достаточное количество кислотности, что составляет около 1 стакана пахты, 1 стакана коричневого сахара, 1 чайной ложки лимонного сока или 1 чайной ложки уксуса.
Выпечка без соды ИЛИ разрыхлителя
Если по какой-либо причине вы не можете использовать пищевую соду или разрыхлитель, вы можете попробовать несколько вещей.
Во-первых, подумайте, насколько важен рост этой выпечки.Это очень важно, как в случае с тортами или печеньем, или это нормально, если конечный результат будет немного более плоским, чем обычно, как печенье? Если рост выпечки не очень важен, попробуйте рецепт без пищевой соды или разрыхлителя. У меня был большой успех в приготовлении печенья без соды или разрыхлителя. Это печенье с шоколадной крошкой – одно из моих любимых.
Если рецепт требует яиц и вам нужно приготовить его без пищевой соды или разрыхлителя, попробуйте разделить яйца и взбить яичные белки до средних пиков. Добавьте яичные белки на самом последнем этапе смешивания жидкого теста. Яичные белки при этом осветляют тесто и помогают ему подняться. Учтите, что это не подойдет для очень крутого теста. Только для тесто. Я использовал эту технику для приготовления блинов без разрыхлителя и для быстрого хлеба без пищевой соды или разрыхлителя.
Добавьте яичные белки на самом последнем этапе смешивания жидкого теста. Яичные белки при этом осветляют тесто и помогают ему подняться. Учтите, что это не подойдет для очень крутого теста. Только для тесто. Я использовал эту технику для приготовления блинов без разрыхлителя и для быстрого хлеба без пищевой соды или разрыхлителя.
Рецепты без разрыхлителя и пищевой соды
Ниже приведены другие мои любимые рецепты, которые можно приготовить без пищевой соды или разрыхлителя!
Easy Waffle Recipe (для приготовления без разрыхлителя см. Примечания к рецепту)
Обычное песочное печенье
Шоколадное печенье без соды и разрыхлителя
Пушистые оладьи безе
10 лучших способов очистки пищевой соды!
Поразительно, сколько вещей можно очистить простой пищевой содой.Ага, эта маленькая коробочка с белым порошком, которая лежит в вашем холодильнике, может делать гораздо больше, чем просто сидеть в холодильнике. Так что же, черт возьми, это за пищевая сода?
Так что же, черт возьми, это за пищевая сода?
Согласно Википедии:
«Бикарбонат натрия или гидрокарбонат натрия – это химическое соединение с формулой NaHCO3. Бикарбонат натрия представляет собой белое твердое вещество, которое является кристаллическим, но часто имеет вид мелкого порошка. У него слегка соленый, щелочной вкус, напоминающий вкус стиральной соды (карбоната натрия).Природная минеральная форма – нахколит. Он входит в состав минерального натрона и растворен во многих минеральных источниках.
Так как соль давно известна и широко используется, она имеет множество связанных названий, таких как пищевая сода, пищевая сода, сода для приготовления пищи и бикарбонат соды. В разговорной речи его название сокращается до бикарбонат натрия, бикарбонат натрия или просто бикарбонат. Слово saleratus от латинского sal æratus, означающего газированную соль, широко использовалось в 19 веке как для бикарбоната натрия, так и для бикарбоната калия. Этот термин теперь вышел из употребления ».
Этот термин теперь вышел из употребления ».
Другими словами, это тип соли, который получают путем смешивания двух природных и очень безопасных соединений: карбоната натрия и диоксида углерода.
Он настолько универсален, что его можно использовать в кулинарии, уборке, медицине, личной гигиене и тушении жировых пожаров.
Итак, специально для вас, мои дорогие, дорогие друзья – я составил список из 10 отличных способов очистки пищевой соды!
10 Сотрите следы со стены.
Для этого просто приготовьте пасту из пищевой соды и воды в соотношении 50/50 и найдите на окрашенной стене любые потертости или рисунок карандашом, аккуратно протрите и вытрите. Вы увидите, что отметки исчезли!
9 Используйте как дезодорант для подмышек.
Просто нанесите щепотку под сухие руки, и пищевая сода уловит даже самый сильный запах тела. Не верьте мне, попробуйте! Только не забудьте сделать это хорошо после того, как вы побрились, иначе гранулы могут вызвать раздражение (у меня это было).
8 Очистите и даже прочистите неприятный запах раковины.
В смеси с уксусом пищевая сода может прорезать почти все. Добавьте чашку пищевой соды в любой сток и оставьте на час. Затем вскипятите 2 стакана уксуса и слейте их в канализацию, налейте горячую воду, и из нее больше не будет пахнуть, это просто фантастика.
7
Очистите раствор.
Я недавно снял видео об этом!
Просто возьмите немного пищевой соды, посыпьте ею линию затирки, сбрызните водой и оставьте пищевую соду на 10 минут или около того.Затем очистите раствор с помощью чистящей зубной щетки или даже обычной зубной щетки. Сотрите остатки порошка и вуаля, самый чистый раствор на блоке.
6 Добавьте абразивный износ к любому чистящему раствору.
Добавление пищевой соды к любому другому чистящему раствору приводит к истиранию и заменяет такие продукты, как VIM и Comet. Подумайте об использовании смеси уксуса и жидкости для посуды в соотношении 50/50, добавив немного пищевой соды и получив продукт, способный противостоять практически любому покупному продукту. Вот наше видео о создании чистящих средств своими руками!
Подумайте об использовании смеси уксуса и жидкости для посуды в соотношении 50/50, добавив немного пищевой соды и получив продукт, способный противостоять практически любому покупному продукту. Вот наше видео о создании чистящих средств своими руками!
5 Дезодорируйте наполнитель для кошачьего туалета.
Если у вас есть туалетный лоток, вы понимаете, насколько болезненно пахнет! Если вам нужны полезные советы по уходу и бесполезная рутина для мусора, проверьте этот пост в блоге . Чтобы дезодорировать туалетный лоток, просто посыпайте немного пищевой соды в лоток каждый раз, чтобы его менять, чтобы все оставалось свежим и чистым.
4 Очистите духовку без самоочистки.
Если духовка не очищается сама по себе, быстро сбрызните внутреннюю часть уксусом, бросьте сверху пищевую соду и оставьте на 30 минут. Начните оттирать, и вы увидите, что никаких едких продуктов здесь не требуется, пищевая сода сама справится с этой сложной задачей.
3 Смывайте с волос наросты.
Если вы любитель средств для волос, попробуйте этот трюк каждые две недели.Добавьте столовую ложку пищевой соды в шампунь (я помещаю немного в салфетку и добавляю после того, как выжимал шампунь) и продолжаю мыть волосы пищевой содой. Удаляет все загрязнения с продуктов и осветляет волосы. Результаты потрясающие!
2 Дезодорируйте ковры.
Если при входе в дом вы чувствуете «запах», скорее всего, ваши ковры (похожие на губки) впитывают много грязи, пыли, омертвевших клеток кожи, запахов и т. П.
Если вы возьмете коробку с пищевой содой и посыпите ею ковры, а затем пропылесосьте ее через 30 минут, ваша комната будет дезодорирована. Ваш пылесос также будет очищен в качестве бонуса!
1 Пищевая сода – отличный усилитель стирки.
Помогает осветлить и дезодорировать одежду. В следующий раз, когда вы постираете белье, добавьте чашку пищевой соды и посмотрите, заметите ли вы разницу. Обожаю этот трюк!
Обожаю этот трюк!
Вот и все – 10 из 46 972 способов очистки с помощью пищевой соды – добро пожаловать.
Если у вас есть какие-то совершенно секретные способы использования пищевой соды – поделитесь ими ниже !!!
10 лучших способов очистки с помощью пищевой соды (очистить царапины, использовать в качестве дезодоранта, прочистить сток, очистить раствор, создать потертости, дезодорировать наполнитель для кошачьего туалета, очистить внутри духовки, осветлить волосы, дезодорировать ковры, улучшить качество стирки)
Разрыхлитель против пищевой соды
Выпечка – это наука, а разрыхлитель и пищевая сода – большая часть ее! Оба творит чудеса, чтобы создать идеальную текстуру в выпечке, такой как торты, кексы и печенье.Но вы когда-нибудь начинали что-то печь и думали: когда лучше использовать разрыхлитель, а не пищевую соду? Они служат одной и той же цели? Могу ли я заменить одно на другое? Действительно ли мне нужно использовать оба, когда рецепт требует их?
Подведем итоги: разрыхлитель и пищевая сода являются разрыхлителями, но действуют по-разному.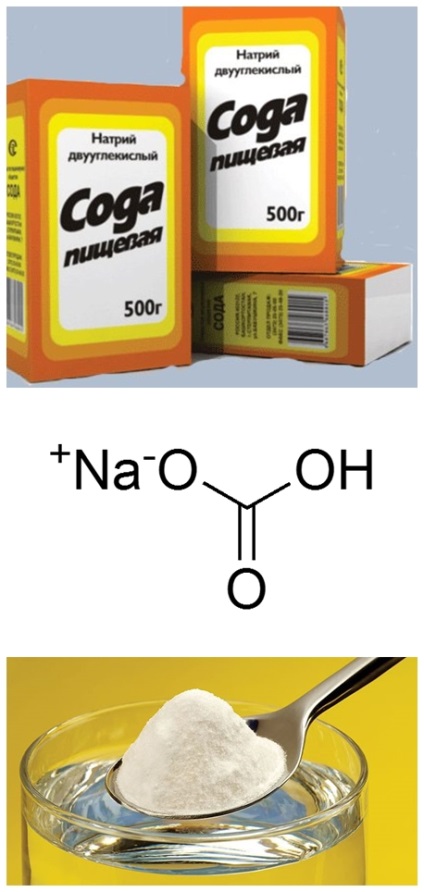 Два ингредиента выглядят очень похожими из-за их белого цвета и порошкообразной текстуры (даже их названия до смеха похожи!), Но оба они привносят что-то особенное на стол.Если у вас нет ни того, ни другого, важно сделать правильную замену, а не полностью исключить закваску. (В противном случае вы можете получить плоское или безвкусное угощение!) Если вы в затруднении, обратите внимание на эти полезные заменители разрыхлителя и пищевой соды – возможно, у вас уже есть отличный заменитель на вашей кухне.
Два ингредиента выглядят очень похожими из-за их белого цвета и порошкообразной текстуры (даже их названия до смеха похожи!), Но оба они привносят что-то особенное на стол.Если у вас нет ни того, ни другого, важно сделать правильную замену, а не полностью исключить закваску. (В противном случае вы можете получить плоское или безвкусное угощение!) Если вы в затруднении, обратите внимание на эти полезные заменители разрыхлителя и пищевой соды – возможно, у вас уже есть отличный заменитель на вашей кухне.
Вот полезный совет перед тем, как использовать разрыхлитель или пищевую соду: ни то, ни другое не длится вечно. Разрыхлитель обычно годен в течение примерно 12 месяцев, а пищевой соды – в течение 6 месяцев, если хранить в прохладном сухом месте, но, как и любые ингредиенты, они могут испортиться раньше.Всегда проверяйте срок годности для начала. Если ваши закваски прошли свой расцвет или если вы беспокоитесь, что они могут быть неэффективными, их легко проверить, чтобы выяснить это. Чтобы проверить разрыхлитель: смешайте ½ чайной ложки разрыхлителя с ½ стакана горячей воды, затем перемешайте. Чтобы проверить пищевую соду: смешайте ½ чайной ложки пищевой соды с 3 столовыми ложками дистиллированного белого уксуса и перемешайте. Обе смеси должны закипеть, как только они смешаются с жидкостью.
Чтобы проверить разрыхлитель: смешайте ½ чайной ложки разрыхлителя с ½ стакана горячей воды, затем перемешайте. Чтобы проверить пищевую соду: смешайте ½ чайной ложки пищевой соды с 3 столовыми ложками дистиллированного белого уксуса и перемешайте. Обе смеси должны закипеть, как только они смешаются с жидкостью.
Этот контент импортирован из {embed-name}. Вы можете найти то же содержимое в другом формате или найти дополнительную информацию на их веб-сайте.
Продолжайте читать, чтобы узнать больше о разрыхлителе и пищевой соде, а также о том, когда использовать один продукт вместо другого. Вы больше никогда не перепутаете эти два основных продукта для выпечки!
Пищевая сода и разрыхлитель – это одно и то же?
Нет! Они могут показаться похожими, но разрыхлитель и пищевая сода – это не одно и то же. Оба являются разрыхлителем, но действуют в рецептах по-разному – см. Ниже. Если вы запекаете, важно знать разницу между двумя ингредиентами. Из-за своего разного химического состава каждый из них играет свою роль в достижении успеха рецепта.
Что такое разрыхлитель?
Разрыхлитель – это пищевая сода, смешанная с сухой кислотой. Когда разрыхлитель контактирует с жидкостью, он выделяет пузырьки углекислого газа, из-за которых выпечка поднимается. Поэтому все, что ему нужно, – это немного воды или другой некислой жидкости, чтобы работать. Большинство разрыхлителей, которые вы покупаете в магазине, имеют двойное действие, что означает, что они активируются один раз при попадании жидкости и еще раз при нагревании.
Что такое пищевая сода?
В отличие от разрыхлителя, пищевая сода не содержит кислоты. Это означает, что ему нужно что-то кислое, например лимонный сок, пахта или уксус, чтобы он работал. Эта химическая реакция является ключом к достижению желаемой подъемной силы. Пищевая сода намного сильнее разрыхлителя (в три или четыре раза сильнее!), Поэтому обычно ее не нужно. Слишком большое количество пищевой соды может сделать пищу металлической или мыльной на вкус, поэтому измеряйте ее правильно.
Пищевая сода Arm & Hammer – 64 унции
Рука и молот
амазонка.com
11,25 $
Почему в некоторых рецептах требуется сода и разрыхлитель?
Если в вашем рецепте требуется и разрыхлитель, и пищевая сода, вероятно, это связано с тем, что в рецепте есть кислота, активирующая пищевую соду, но одной этой химической реакции недостаточно, чтобы придать блюду желаемый объем. (Помните, что слишком много пищевой соды повлияет на вкус). Добавление разрыхлителя обеспечивает баланс и обеспечивает идеальную подтяжку.
Можно ли использовать пищевую соду вместо разрыхлителя?
Лучший заменитель разрыхлителя – это смесь пищевой соды и винного камня. Винный камень добавляет кислотности пищевой соде – это, по сути, домашний разрыхлитель. Используйте это в крайнем случае или сделайте большую партию и храните ее в герметичном контейнере на случай чрезвычайных ситуаций с разрыхлителем. Чтобы приготовить 1 столовую ложку разрыхлителя, смешайте 2 чайные ложки винного камня с 1 чайной ложкой пищевой соды (добавьте 1 чайную ложку кукурузного крахмала, если вы делаете большую порцию – это предотвращает слеживание смеси, но это не обязательно).
Можно ли использовать разрыхлитель вместо пищевой соды?
Поскольку разрыхлитель уже содержит пищевую соду, обычно вы можете использовать около 1 чайной ложки разрыхлителя на каждую 1/4 чайной ложки пищевой соды, указанной в рецепте. А если вы хотите получить супертехнологию, как только вы сделаете этот обмен, подумайте о замене любых кислых жидкостей в рецепте на некислотные жидкости, чтобы дополнительная кислота, содержащаяся в разрыхлителе, не вызывала отдельную реакцию.
Набор мерных ложек
Женщина-пионерка
Walmart.com
5,97 $
Есть ли уловка, чтобы запомнить разницу между разрыхлителем и пищевой содой?
Все еще не уверены, что вспомните, когда использовать разрыхлитель или пищевую соду? Вот простой способ отличить эти два ингредиента друг от друга: разрыхлитель = мощность. Он может поднимать выпечку, так как он уже содержит пищевую соду, поэтому больше ничего ему не нужно. Пищевая сода = соло. Это единственный ингредиент, которому нужна кислота, чтобы помочь ему справиться с тяжелой работой.
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты. Вы можете найти дополнительную информацию об этом и подобном контенте на сайте piano.io.
Разница между пищевой содой, бикарбонатной содой и разрыхлителем
Это вопрос, который задает себе каждый, кто пробовал печь …
В чем разница между разрыхлителем, пищевой содой и бикарбонатом соды?
А какие у них разные приложения?
Что ж, у нас есть для вас ответ.
Пищевая сода и бикарбонат соды – разные названия одного и того же предмета. В Австралии мы в основном называем его бикарбонатом соды, но за рубежом, особенно в Америке, его называют пищевой содой.
Они не взаимозаменяемы, но бикарбонат соды и разрыхлитель являются разрыхлителями.
При включении в жидкое тесто разрыхлитель вызывает расширение пузырьков воздуха (образующихся при перемешивании, взбивании или взбивании во время приготовления, заставляя его «подниматься».
Бикарбонат соды – это чистый разрыхлитель.
Его необходимо смешать с влагой и кислым ингредиентом, чтобы произошла необходимая химическая реакция, которая заставит пищу подняться.
Поскольку для повышения качества ему нужна кислота, его часто используют в рецептах, где уже присутствует кислый ингредиент, например, лимонный сок, шоколад, пахта или мед.
Разрыхлитель, содержащий бикарбонат соды, поставляется предварительно смешанным с кислым ингредиентом, поэтому все, что вам нужно добавить, – это добавить влагу.
Кислый ингредиент, который чаще всего используется в разрыхлителе, – это винный камень.
Вы можете сделать свой собственный разрыхлитель: просто смешайте две части винного камня с одной частью бикарбоната соды.
Разрыхлитель имеет нейтральный вкус и часто используется в рецептах с другими ингредиентами с нейтральным вкусом, такими как молоко.
СМОТРИТЕ НИЖЕ: семь советов, которые помогут вам стать лучшим пекарем. История продолжается после видео.
 то же, что пищевая сода; гидрокарбонат натрия (NaHCO3) ◆ Всякую зелень надо для сохранения её цвета опускать в солёный кипяток, с прибавлением чуть-чуть соды, и варить в эмалированной закрытой кастрюльке. Е. И. Молоховец, «Подарок молодым хозяйкам», 1875–1900 г. (цитата из Национального корпуса русского языка, см. Список литературы)
то же, что пищевая сода; гидрокарбонат натрия (NaHCO3) ◆ Всякую зелень надо для сохранения её цвета опускать в солёный кипяток, с прибавлением чуть-чуть соды, и варить в эмалированной закрытой кастрюльке. Е. И. Молоховец, «Подарок молодым хозяйкам», 1875–1900 г. (цитата из Национального корпуса русского языка, см. Список литературы) рекомендации).
рекомендации).  *
* рН
рН Добавление небольшого количества пищевой соды в лук помогает ему быстрее подрумяниться.
Добавление небольшого количества пищевой соды в лук помогает ему быстрее подрумяниться. Корица, мускатный орех, кардамон и…
Корица, мускатный орех, кардамон и… Вы будете испытывать искушение делать кунжут ломким круглый год; из упаковки этого хрустящего сладкого угощения получается отличный…
Вы будете испытывать искушение делать кунжут ломким круглый год; из упаковки этого хрустящего сладкого угощения получается отличный…