Кальцинирующий тендинит плеча – лечение, симптомы, причины, диагностика
Кальцинирующий тендинит плеча возникает, когда образуются накопления кальция в сухожилиях плеча. Ткани вокруг депозитов кальция воспаляются, что приводит к выраженным болевым проявлениям. Это заболевание является довольно распространенным и наиболее часто встречается у людей в возрасте старше 40 лет. Кальцинирующий тендинит возникает в сухожилиях вращающей манжеты плеча. Вращающая манжета плеча состоит из нескольких сухожилий, которые соединяют мышцы вокруг плеча к плечевой кости. Отложения кальция обычно образуются на сухожилии вращающей манжеты плеча, которое называется надостным (supraspinatus) сухожилием.
Существует два различных типа кальцинирующего тендинита плеча: дегенеративная кальцификация и реактивная кальцификация. Процессы изнашивания при старении являются основной причиной дегенеративной кальцификации. По мере старения кровоснабжение сухожилий вращательной манжеты уменьшается, что приводит к ослаблению сухожилий. Процесс изнашивания сопровождается микронадрывами волокон сухожилий. И в поврежденных сухожилиях одновременно с регенерацией происходят процессы отложения кальцинатов.
Процесс изнашивания сопровождается микронадрывами волокон сухожилий. И в поврежденных сухожилиях одновременно с регенерацией происходят процессы отложения кальцинатов.
Реактивная кальцификация отличается от дегенеративной. Механизм развития этого типа кальцификации не до конца ясен. Этот тип кальцификации не связан с дегенеративными изменениями и гораздо чаще является причиной болей в плече, чем дегенеративный кальцифицирующий тендинит. Считается, что развитие реактивного кальцифицирующего тендинита проходит в три этапа. В начальной стадии кальциноза происходят изменения в сухожилиях, при которых формируются условия для формирования кальцинатов. В стадии кальцинации происходит отложение кристаллов кальция в сухожилиях. Но на этой стадии кальцинаты рассасываются (реабсорбируются) организмом. Именно на этом этапе появление болей наиболее вероятно. В пост-кальцинатном периоде организм восстанавливает сухожилие, и поврежденная ткань заменяется новой тканью. Механизм запуска абсорбции кальцинатов организмом не выяснен, но как только это происходит, и ткань начинает регенерировать, боль обычно уменьшается или исчезает совсем.
Причины
Никто не знает, что именно служит причиной кальцинирующего тендинита. Физические нагрузки старение или их комбинация приводит к дегенеративной кальцификации. Некоторые исследователи предполагают, что отложения кальция образуются вследствие гипоксии тканей и недостаточного поступления кислорода к тканям сухожилие. Другие же считают, что давление на сухожилия может приводить к их повреждению, в результате и происходит отложение депозитов кальция.
Механизм формирования реактивной кальцификации не изучен совершенно. Как правило, этот тип кальцифицирующего тендинита встречается у молодых пациентов и возникает без особых видимых причин.
Симптомы
Во время отложения кальция может появиться боль слабая или умеренная или этот процесс может проходить без боли. Но когда при кальцинирующем тендините начинается процесс рассасывания депозитов кальция появляется выраженный болевой синдром. Боль и скованность в плече могут привести к резкому уменьшению объема движений в плече. Даже подъем руки может стать очень болезненным. В тяжелых случаях боль может приводить к нарушению сна.
Даже подъем руки может стать очень болезненным. В тяжелых случаях боль может приводить к нарушению сна.
Диагностика
Для диагностики кальцинирующего тендинита плеча врач, прежде всего, изучит историю болезни и проведет физикальное обследование. Боль в плече может быть связана не только с кальцинирующим тендинитом, но и с другими заболеваниями. Поэтому, для постановки точного диагноза бывают, необходимы инструментальные исследования. Рентгенография позволяет визуализировать наличие депозитов кальция в сухожилиях. Но наиболее информативно для визуализации связок и сухожилий и наличия в них патологических изменений – МРТ (магнитно-резонансная томография). Визуализация кальцинатов с помощью рентгенографии или МРТ в динамике позволяет определиться с тактикой лечения (консервативное или оперативное лечение). Лабораторные исследования необходимы в тех случаях, когда необходимо дифференцировать это заболевание с воспалительными заболеваниями соединительной ткани.
Лечение
Консервативное лечение
Основная задача консервативного лечения это уменьшить воспаление и боль. Поэтому, на первом этапе консервативное лечение включает в себя покой и прием НПВС (ибупрофен). Противовоспалительные препараты позволяют уменьшить воспалительный процесс и снизить болевые прояления. При наличии сильной боли могут быть назначены инъекции кортикостероидов. Применение стероидов позволяет на некоторое время эффективно снять отек и воспаление.
Поэтому, на первом этапе консервативное лечение включает в себя покой и прием НПВС (ибупрофен). Противовоспалительные препараты позволяют уменьшить воспалительный процесс и снизить болевые прояления. При наличии сильной боли могут быть назначены инъекции кортикостероидов. Применение стероидов позволяет на некоторое время эффективно снять отек и воспаление.
В тот период времени, когда отложения кальция начинают реабсорбироваться, боль может быть особенно сильной. В таких случаях возможно удаление части депозитов кальция с использованием промывания физ. раствором через два прокола в области депозитов кальция. Эта процедура называется лаважем. Иногда при этой процедуре удается разбить кальцинаты на кусочки (их удаляют с помощью иглы). Удаление депозитов позволяет быстрее уменьшить болевой синдром и добиться более быстрого восстановления сухожилия. Даже тогда, когда промывание не удаляет отложения кальция, это может уменьшить давление в сухожилиях, что приводит к уменьшению боли.
Физиотерапия. Физиопроцедуры являются одной из основных составляющих консервативного лечения кальцинирующего тендинита. Применение такой методики, как ультразвук, помогает уменьшить болевой синдром и воспаление. Но эффект при применение ультразвука достигается только при курсовом лечении (до 24 процедур в течение 6 недель). Ударно-волновая терапия в настоящее время является наиболее современным методом консервативного лечения таких заболеваний. Ударная волна разрушает крупные депозиты кальция, что позволяет организму быстрее абсорбировать их.
Физиопроцедуры являются одной из основных составляющих консервативного лечения кальцинирующего тендинита. Применение такой методики, как ультразвук, помогает уменьшить болевой синдром и воспаление. Но эффект при применение ультразвука достигается только при курсовом лечении (до 24 процедур в течение 6 недель). Ударно-волновая терапия в настоящее время является наиболее современным методом консервативного лечения таких заболеваний. Ударная волна разрушает крупные депозиты кальция, что позволяет организму быстрее абсорбировать их.
ЛФК показано в стадии завершения реабсорбции и позволяет восстановить мышечный тонус и улучшить кровоснабжение структур плеча. Как правило, проводится индивидуальный подбор упражнений и ЛФК проводится в течение 4-6 недель. Проведение физических упражнений очень важно для укрепления мышц вращающей манжеты плеча, так как эти мышцы помогают контролировать стабильность плечевого сустава. Укрепление этих мышц может фактически уменьшить давление на депозиты кальция в сухожилии.
Хирургическое лечение
При неэффективности консервативного лечения и ухудшение функций плеча или наличие стойкого болевого синдром рекомендуется оперативное лечение. Как правило, хирургическое лечение проводится малоинвазивным атроскопическим методом, что позволяет пациенту не оставаться на ночь в хирургическом отделении. Хирург при атроскопической операции визуально определяет локализацию депозитов кальция в сухожилиях вращательной манжеты, удаляет их и промывает эту область, удаляются также свободные кристаллы кальция, которые могут раздражать окружающие ткани.
В редких случаях, бывает, необходима открытая операция. При такой операции до депозитов кальция доступ идет через разрез мышц связок с удалением части сухожилий. После удаления депозитов проводится сшивание мышц и сухожилий.
Реабилитация после операции на плече может занять достаточно длительный промежуток времени. В первые 6-8 недель после операции рекомендуется ношение ортеза и ограничение движений, затем необходимо постепенно начинать разработку сустава и сочетать физиопроцедуры с ЛФК. Объем нагрузок на сустав необходимо увеличивать постепенно и очень аккуратно под наблюдением врача ЛФК. Начинают упражнения, как правило, не ранее чем через 6 недель после операции. Упражнения направлены на улучшение мышечной силы плечевого пояса и мышц ротаторной манжеты. Полное восстановление функций плеча после операции может занять от 3 до 4 месяцев. После открытой операции восстановление идет намного медленнее, чем при атроскопической резекции.
Объем нагрузок на сустав необходимо увеличивать постепенно и очень аккуратно под наблюдением врача ЛФК. Начинают упражнения, как правило, не ранее чем через 6 недель после операции. Упражнения направлены на улучшение мышечной силы плечевого пояса и мышц ротаторной манжеты. Полное восстановление функций плеча после операции может занять от 3 до 4 месяцев. После открытой операции восстановление идет намного медленнее, чем при атроскопической резекции.
Сердце не камень: о минерализации человеческих органов
Может ли сердце превратить в кость, какие человеческие органы могут минерализоваться и при чем здесь фибробласты, разбирался Indicator.Ru.
Кость не в горле, а в сердце
В русских сказках Бабу Ягу часто называют Костяной ногой. Однако, как оказалось, клетки, образующие кости, могут появиться и в мягких тканях человеческого организма. Клетки соединительной ткани, составляющей сердце, способны превращаться в костные клетки в результате травм и повреждений, сообщается в научном журнале Stem Cell. Открытие, которое сделали ученые из Калифорнийского университета в Лос-Анджелесе, помогает понять, как у некоторых людей, выживших после повреждений сердечной мышцы, в клапанах и стенках органа возникают аномальные отложения кальция, который, как известно, является основным химическим элементом, составляющим кости.
Открытие, которое сделали ученые из Калифорнийского университета в Лос-Анджелесе, помогает понять, как у некоторых людей, выживших после повреждений сердечной мышцы, в клапанах и стенках органа возникают аномальные отложения кальция, который, как известно, является основным химическим элементом, составляющим кости.
Исследователи выяснили, что кальциноз, то есть ненормальное отложение солей кальция в мягких тканях, можно предотвратить: у мышей, на которых проводили эксперимент, блокировали фермент, регулирующий минерализацию костей с малыми молекулами.
Соединительные ткани в организме присутствуют в трех видах: в волокнистом, в гелеобразном и в твердом. К последнему виду относятся кости, другим тканям затвердевание не свойственно. Тем не менее минерализация некоторых органов, например сердца, почек и кровеносных сосудов, иногда встречается у пожилых людей и прогрессирует у пациентов, страдающих от диабета и заболеваний почек. Кальцификация органа может вызвать нарушения электропроводности и привести к блокаде сердца. В настоящее время нет способа полностью излечиться от кальциноза мягких тканей.
В настоящее время нет способа полностью излечиться от кальциноза мягких тканей.
«Процессы кальциноза сердца были недостаточно изучены и плохо освещены», — прокомментировал ведущий автор исследования Арджун Деб из Центра регенеративной медицины и исследования стволовых клеток имени Эли и Эдит Брод при Калифорнийском университете в Лос-Анджелесе. «Отвечая на вопрос, какие клетки в сердце отвечают за процесс минерализации, мы предположили, что раз между повреждениями ткани, фиброзом и кальцинозом существует такая тесная связь, то, возможно, наибольший вклад в минерализацию вносят фибробласты — клетки, которые специализируются на заживлении ран и образовании рубцов».
Маленькие, да удаленькие
Чтобы выяснить, верно ли это предположение, Деб вместе с коллегами генетически пометили сердечные фибробластомы мышей и пронаблюдали, как те трансформировались в клетки, похожие на остеобласты — клетки, образующие кости. Исследователи выделили из области кальциноза больных мышей кардиальные фибробласты, которые составляют 50% клеток сердца млекопитающих, и пересадили их под кожу здоровых грызунов. После этого ученые зафиксировали отвердевание мягких тканей у подопытных мышей, похожее на процесс, протекавший у мышей-доноров. Исследователи также проверили, способны ли фибробласты человеческого сердца образовывать твердые отложения, и эксперимент в чашке Петри подтвердил, что в человеческом организме за минерализацию мягких тканей ответственность несут те же клетки.
После этого ученые зафиксировали отвердевание мягких тканей у подопытных мышей, похожее на процесс, протекавший у мышей-доноров. Исследователи также проверили, способны ли фибробласты человеческого сердца образовывать твердые отложения, и эксперимент в чашке Петри подтвердил, что в человеческом организме за минерализацию мягких тканей ответственность несут те же клетки.
Лечение бурсита плечевого сустава (воспаление синовиальной сумки плеча)
- Что такое воспаление синовиальной сумки плечевого сустава?
- Симптомы бурсита плечевого сустава
- Причины воспаления слизистой сумки в плече
- Диагностика и медицинское обследование бурсита
- Консервативное лечение
- Хирургическое лечение бурсита плечевого сустава
Кроме воспаления слизистой сумки существуют и другие причины боли в плече. Воспаления сухожилий, травматические повреждения или, например, артроз имеют похожую симптоматику. Установить причины боли и подобрать подходящее лечение помигает специализированное медицинское обследование.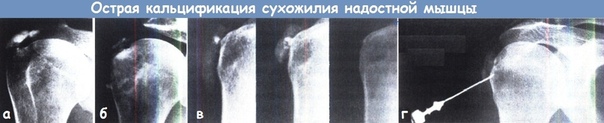 © yodiyim / fotolia
© yodiyim / fotolia
Бурсит (лат. bursa « сумка ») — это болезненное воспаление околосуставной сумки плеча. Синовиальные сумки находятся недалеко от суставов для балансирования высокой механической нагрузки между костями и другими тканями. Самая большая бурса человеческого организма (Bursa subakromialis или подакромиальная сумка) находится в плече. Причиной его воспаления могут быть патологии различных структур сложного по строению плечевого сустава. Плечо может воспалиться вследствие появления костных шпор акромиального отростка ключицы (акромион) либо структурных изменений в сухожилии надостной мышцы (напр. отложения кальция и разрывы). Как правило, причиной данных травм являются травматические повреждения либо чрезмерные нагрузки. Зачастую боль появляется постепенно, например, при поднятии руки. Если человек не придает этому значения и продолжает нагружать плечо, боль усиливается и появляются такие симптомы как отечность и перенагревание. В большинстве случаев врачи проводят консервативное лечение бурсита плечевого сустава. Опытные специалисты по лечению плеча рекомендуют в таком случае отдых, принятие противовоспалительных медикаментов, а также биологическое лечение, основанное на клеточных технологиях. Довольно редко клиники проводят хирургическое лечение с удалением воспаленной бурсы.
Опытные специалисты по лечению плеча рекомендуют в таком случае отдых, принятие противовоспалительных медикаментов, а также биологическое лечение, основанное на клеточных технологиях. Довольно редко клиники проводят хирургическое лечение с удалением воспаленной бурсы.
Что такое воспаление синовиальной сумки плечевого сустава?
Во время болезненного бурсита наблюдается отечность в области плечевого сустава и увеличение суставной сумки, провоцирующие давление на близлежащие ткани. Сама синовиальная сумка представляет собой эластичную щелевидную полость, заполненную синовиальной жидкостью, способную менять свою форму между мышцами сухожилиями и костными структурами. Кроме того, бурса обеспечивает безболезненную перемещаемость различных сухожилий, костей и мышц внутри высокоподвижного сустава без трения. Бурсит в плече — это в основном воспаление околосуставной сумки, находящейся между головкой плечевой кости и акромионом. Кроме того, бурсит является наиболее распространенной причиной колющей боли в руке.
Субакромиальная суставная сумка — это самая крупная бурса человеческого организма, которая наиболее часто подвергается воспалениям различного характера. Медики используют термин «субакромиальный» или «подакромиальный» бурсит, когда воспаляется область под акромиальным отростком ключицы (акромионом).
Анатомия плечевого сустава: Положение околосуставной сумки под акромионом
Изменения нижележащего сухожилия надостной мышцы (напр. разрывы и отложения кальция) могут деформировать бурсу. Воспаление слизистой сумки плеча могут вызвать такие структурные изменения акромиона, как например, костные шпоры. Поэтому, в поисках причин стойкого бурсита необходимо пройти полное обследование всех структур плеча. © bilderzwerg / fotolia
Для воспаления околосуставной сумки плечевого сустава характерны припухлости в области субакромиальной бурсы, находящейся под акромионом. Мышцы, связки, сухожилия и синовиальная сумка, то есть мягкие ткани плеча находятся недалеко друг от друга. Таким образом, самая большая бурса обеспечивает здоровье сухожилия надостной мышцы – сухожилия между
Таким образом, самая большая бурса обеспечивает здоровье сухожилия надостной мышцы – сухожилия между
лопаткой и головкой плеча. При превышенных нагрузках на подакромиальную область вследствие поднятия руки над головой осуществляется давление и на сухожилие надостной мышцы, что нередко вызывает воспаление и боль в плече.
Симптомы: Боль в плече при поднятии руки вверх
Симптомы:
- Боль при поднятии руки вверх
- Болезненность при надавливании на плечо и повышенная чувствительность
- Колющая боль при конечном разгибании руки
- Ночная боль в положении лежа
- Ослабленная мышечная сила
- Отеки, покраснения, гипертермия
- Боль отдающая от плеча в руку
Боль, причиной которой является бурсит плечевого сустава начинается постепенно и увеличивается в зависимости от характера движений. Как правило, в начале бурсита пациенты жалуются на неприятные ощущения при поднятии руки к верху.
Если больной не придает особого значения своим жалобам и продолжает вести привычный образ жизни, боль постепенно становится сильнее. Если плечевой сустав начинает болеть внезапно, то причиной этого, скорее всего является не бурсит. Специалисты, которые проводят лечение плечевого сустава настоятельно рекомендуют не нагружать плечо. В ином случае боль будет становиться все мощнее и будет приносить Вам неудобства даже во время отдыха. Повышенная восприимчивость плеча к давлению может привести к сильной боли ночью. Если пациент спит на нездоровом плече, то стреляющая боль может разбудить его.
Если плечевой сустав начинает болеть внезапно, то причиной этого, скорее всего является не бурсит. Специалисты, которые проводят лечение плечевого сустава настоятельно рекомендуют не нагружать плечо. В ином случае боль будет становиться все мощнее и будет приносить Вам неудобства даже во время отдыха. Повышенная восприимчивость плеча к давлению может привести к сильной боли ночью. Если пациент спит на нездоровом плече, то стреляющая боль может разбудить его.
Болезненность в плечевом суставе вследствие бурсита часто сопровождается повышенной чувствительностью внешней стороны плеча.
Когда диапазон движений плечевого сустава полостью исчерпан, пациенты чувствуют неприятные покалывания в плече. Такие ощущения наблюдаются, когда человек поднимает руку над головой для того, чтобы, например, высушить голову, расчесать волосы или одеть куртку. Люди, постоянно спящие на боку, также чувствуют негативные воздействия бурсита, так как во время сна на больном плече осуществляется давление на воспаленную слизистую сумку. Именно поэтому бурсит плечевого сустава является малоприятным заболеванием.
Именно поэтому бурсит плечевого сустава является малоприятным заболеванием.
Повторные однообразные движения плечом только усиливают боль. Вследствие бурсита боль может отдавать в направлении наружной стороны плеча к локтю.
В отличие от бурсита коленного либо локтевого сустава воспаление синовиальной сумки в плече редко вызывает наружные отеки или изменения формы самого плеча.
Однако при крайне сильном воспалении слизистой сумки у пациента могут появиться покраснения плечевого сустава.
Эти не сразу заметные признаки являются прежде всего сопутствующими явлениями бактериального бурсита. Иногда во время бурсита у человека повышается температура тела. Бактериальный бурсит в медицине также называют «септический бурсит».
Причины бурсита плечевого сустава
Причины
- Удар, толчок, травмы
- Перенагрузки, прежде всего вовремя поднятия руки
- Однообразные движения
- Зрелый возраст
- Неправильная осанка
- Импиджмент синдром
- Диабет
- Кальциноз предплечья
Развитию бурсита плечевого сустава способствуют несколько обстоятельств.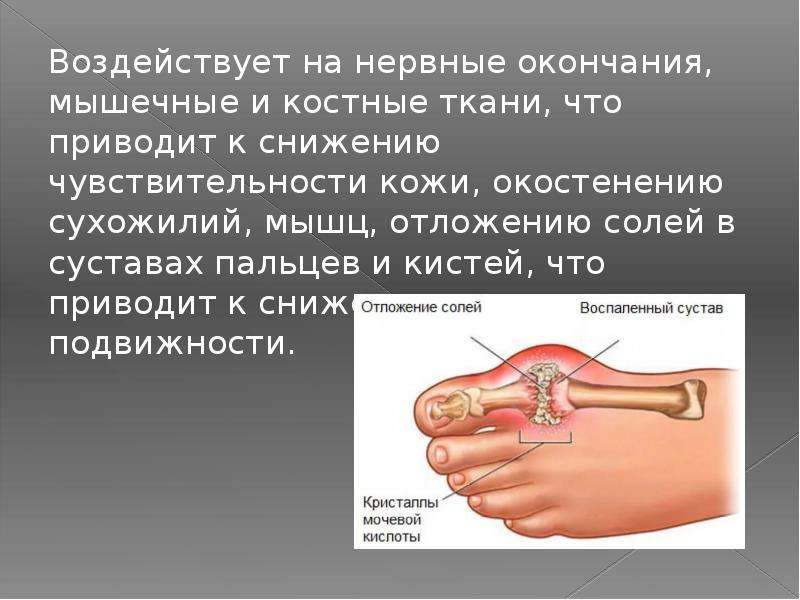
Одной из самых распространённых причин являются повреждения структуры плеча (травмы). Падение или удар плеча могут спровоцировать кровоизлияние в бурсу и воспаление слизистой оболочки. Несмотря на то, что со временем организм сокращает содержание крови в бурсе, воспаление слизистой оболочки с внешней стороны слизистой сумки остается надолго. Так, из обычной травмы образуется хронический бурсит околосуставной сумки плеча. Эту форму воспаления медики называют «травматический бурсит».
Следующей причиной бурсита является повторное давление либо осуществление чрезмерных нагрузок на плечо. В данном случае слизистая сумка воспаляется вследствие повторных небольших повреждений, влекущих за собой такие же результаты, как и удар плечом о твердую поверхность. Маляры, монтеры или люди, профессия которых связана с поднятием рук над головой страдают данной патологией чаще других. Спортсмены, осуществляющие мощные движения над головой, например теннисисты либо бадминтонисты, рассказывают о таких же симптомах.
С возрастом увеличивается вероятность развития бурсита вследствие травматических повреждений или чрезмерных нагрузок.
Неправильная осанка является еще одним основанием воспаления синовиальной сумки плеча. При сильном нагибании туловища вперед лопатка тянется к верху, что сужает пространство под акромионом. Если пациент приходит к врачу с такими жалобами, то у него диагностируют импиджмент синдром плечевого сустава и направляют на лечение. Если подакромиальная область сужена на протяжении долгого времени повышается механическое давление на субакромиальную околосуставную сумку и сухожильный аппарат, отвечающий за подвижность плеча (вращательная манжета).Взаимодействие данных факторов и способствует развитию воспалительного процесса внутри синовиальной сумки.
Давно вылеченный бурсит также может способствовать появлению воспаления синовиальной сумки плеча.
Нарушения метаболизма плечевого сустава тоже могут вызвать бурсит: Кальциноз предплечья (кальцинирование сухожилия надостной мышцы) часто появляется одновременно с бурситом. Отложения кальция в сухожилии надостной мышцы может привести к разрыву вышележащей субакромиальной бурсы и родолщжительному воспалению синовиальноой сумки.
Отложения кальция в сухожилии надостной мышцы может привести к разрыву вышележащей субакромиальной бурсы и родолщжительному воспалению синовиальноой сумки.
Для импиджмент синдрома характерно трение сухожилий вращательной манжеты об акромион, который является так называемой крышей плечевого сустава. Помимо этого во время плечелопатпчного периартрита на акромиальном отростке ключицы образуются костные шпоры (остеофиты), провоцирующие разрывы и воспланеия слизистой сумки плеча.
Диагностика и клиническое обследование бурсита
Перед тем как начать лечение, специалист-ортопед проводит ряд обдследований, позволяющих исключить определнные причины болезни. Воспаления сухожилий, импиджмент синдром или артроз плечевого сустава сустава имеют похожую симптоматику. В некоторых случаях эти патологии сопровождаются еще и дополнительным воспалением околосуставной сумки плеча. Таким образом, медицина представляет несколько причин боли в плече. Высококачественная диагностика медицинского центра Gelenk Klinik в г. Фрайбург в Германии, основанная на передовых технологиях, позволяет установить основную причину болевого синдрома плеча.
Фрайбург в Германии, основанная на передовых технологиях, позволяет установить основную причину болевого синдрома плеча.
Анамнез: диагностическая консультация с врачом
Во время анамнеза, составления истории болезни, врач задает пациенту несколько вопросов касательно его здоровья:
- Предшедствующие и нынешние заболевания
- Общее состояние
- Болезни, вызванные нарушением обмена веществ (напр. диаберт, ревматизм или подагра)
- ДТП или другие происшествия, связанные с травмами плеча
- Перенагрузки и удары
- Спортивные нагрузки и особенности профессиональной деятельности
Таким образом врач получает полную картину возможных воздействий, недостатков и предласположений плечевого сустава.
Физический осмотр и клиническое обследование
Во время осмотра специалист по лечению плеч а обращает особое внимание на следующие аспекты:
- Болезненность при надавливании (повышенная чувствительность)
- Отечность
- Гипертермия и изменения цвета кожи
- Особенности осанки
Специальные тестирования на определение силы и подвижности руки во время движения в разных направлениях указывают на возможные разрывы и травмы сухожилий..jpg)
Визуализационное обследование плечевого сустава: УЗИ, рентген, МРТ
Современная медицина предлагает несколько визуализационных методов диагностики, каждый из которых показывает различные аспекты болезни.
УЗИ помогает врачу провети тестироваие на подвижность мышц, сухожилий и мягких тканей плеча. Также, ультразвуковое обследование показывает отеки и накопления в бурсе лишней жидкости. На УЗИ видны и структурные поврежднеийя плеча, напр. разрывы сухожилий и вопаления. © Gelenk-Klinik
Ультразвуковое обследование (УЗИ)
Ультразвуковое визуализацинное обследование показывает скопление лишней жидкости в синовиальной сумке плечевого сустава, а также травмы связок и сухожилий во время движения. Кроме того на УЗИ видны разрывы сухожилий и отложения кальция.
Рентгенограмма
Рентгеновский снимок не показывает состояние мягких тканей: на изображении представлены лишь положение и состояние костей плечевого сустава. Данный снимок показывает достаточное пространство между головкой плечевой кости и акромионом. Из этого следует, что импиджмент синдром не является причиной воспаления синовиальной сумки плеча.
Из этого следует, что импиджмент синдром не является причиной воспаления синовиальной сумки плеча.
УЗИ позволяет врачу исследовать мышцы, сухожилия и мягкие ткани во время движения. Кроме того, ультразвуковое обследование предоставляет информацию о наличии отеков вследствие скопления излишней жидкости в бурсе. Травмы сухожилий и воспалительные процессы в плече тоже становятся видны после УЗИ.
Данный снимок показывает достаточное пространство между головкой плечевой кости и акромионом. Из этого следует, что импиджмент синдром не является причиной воспаления синовиальной сумки плеча. © Gelenk-Klinik
МРТ (Магнитно-резонансная томография)
МРТ (томографические медицинские изображения) позволяют получать информацию о повреждениях мягких тканей, воспалительных процессах, а также структурных изменениях плечевого сустава. Для лечения бурсита МРТ не является главным методом диагностики. Если у пациента подозревают воспаление слизистой сумки, специалисты ортопедических клиник сначала проводят УЗИ.
Перед тем как поставить диагноз бурсит плечевого сустава и начать лечение необходимо провести визуализационное обследование с целью исключения разрывов сухожилий и травм костных структур. МРТ проводиться лишь в вслучае осложненной формы бурсита и помогает принять окончательное решение касательно наиболее целесообраной формы лечения болезни. Магнитно резонансная томография помогает правильо выбрать метод хирургического лечения и подготовитьсяк операции.
В сложных случаях, не поддающихся общепринятому лечению очень важным аспектом является исключение таких травм как разрывы сухожилий и деформации костей при помощи визуализационной диагностики. Магнитно резонансная томография (МРТ) является одним из самых важных методов диагностики бурсита плечевого сустава.
Лабораторный анализ крови и суставной жидкости
Лабораторная диагностика
- Диабет
- Подагра
- Ревматизм
- Бактериальные воспаления (септический бурсит)
- Артрит
Заболевания органов движения не всегда являются причиной боли в плече. Дискомфорт в руке пацинет может ощущать и вследствие нарушений метаболизма, ограничивающих подвижность и вызывающих боль. К подобным патологиям относятся например ревматоидный артрит – воспалительное аутоимунное заболевание. Анализ крови показывает наличие ревма-фактора, позволяющего подвердить ревматоидный артрит. Кроме того, клинический анализ крови помогает исключить бактериальные инфекции: При повышенном колличестве лейкоцитов в крови увеличивается вероятность заболевания.
Дискомфорт в руке пацинет может ощущать и вследствие нарушений метаболизма, ограничивающих подвижность и вызывающих боль. К подобным патологиям относятся например ревматоидный артрит – воспалительное аутоимунное заболевание. Анализ крови показывает наличие ревма-фактора, позволяющего подвердить ревматоидный артрит. Кроме того, клинический анализ крови помогает исключить бактериальные инфекции: При повышенном колличестве лейкоцитов в крови увеличивается вероятность заболевания.
Консервативное лечение бурсита плечевого сустава
Как правило, воспаление околосуставной сумки плеча лечиться консервативно, тоесть без операции.
Домашние лечебные средства и лечение на дому
В большинсве случаев лечение воспаления слизистой сумки плеча пациенты могут осуществить самостоятельно. Однако если боль не прекращается и стаовится сильнее необходимо незамедлитеьно обратиться к врачу. Несмотря на это, обратите внимание на то, лечение на дому связано с определенными рисками: Если Вы будете использовать домашние лечебные препараты, Вы можете пропустить некоторые немаловажные травмы или патологии плеча.
- Охлаждающие компрессы при острой боли в плече.
- Противовоспалительные медикаменты (напр. парацетамол илил ибупрофен)
- Спортивные мази (напр. диклофенак)
- Противовоспалительные и охлаждающие творожные компрессыn
- Прикладывание уксусноалюминиевой соли на плечо
В большинстве случаев лечение бурсита плечевого сустава проводится при помощи обезболивающих нестероидных медикаментов НПВП . Кроме того, для восстановлния плеча сециалисты по ортопедии рекомендуют пациенту состояние покоя и охлаждающие компрессы. В самых трудных случаях иньекции антивоспалительного гормона кортизона, а также болеутоляющие препараты помогают сразу прекратить воспаление околосуставной сумки и связанные с ним боли в плече..
Физиотерапия и биологическое лечение основанное на клеточных технологиях
Если медикаментозное лечение не приносит желаемого результата и пациент продолжает чувствовать боль, врач направляет его на физиотерапию или лечебную физкультуру.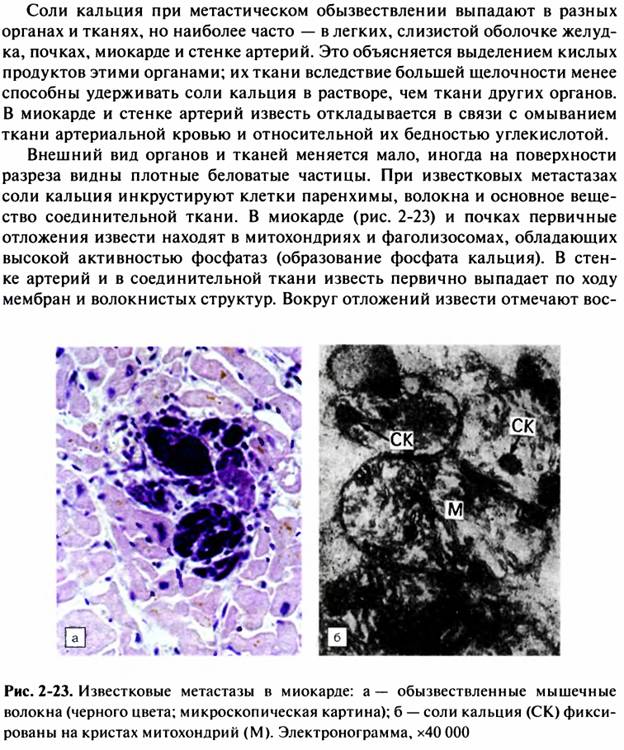 Одной из главных специализаций немецкого медицинского центра Gelenk Klinik в г. Фрайбург является регулирующая терапия основанная на клеточных технологиях. Применение вибротерапии в лечебной практике способствует стимуляции обмена веществ в воспаленной синовиальной сумке плечевого сустава, что помогает побороть воспаление в кратчайшие сроки.
Одной из главных специализаций немецкого медицинского центра Gelenk Klinik в г. Фрайбург является регулирующая терапия основанная на клеточных технологиях. Применение вибротерапии в лечебной практике способствует стимуляции обмена веществ в воспаленной синовиальной сумке плечевого сустава, что помогает побороть воспаление в кратчайшие сроки.
Матричная терапия состоит из нескольких модулей, взаимодействующих в области остановки развития воспалительного процесса и здоровья тканей между собой. На данном изображении представлена биомеханическая стимуляция (БМС) мышц плечевого сустава при помощи вибрирующего прибора. Данная методика помогает вылечить травмы, воспаления и нарушения структуры сухожилий плеча. Воспаление слизистой сумки является одним из главных показаний для проведения данного лечения. © gelenkreha.de
Малоинвазивные операции плечевого сустава при воспалении околосуставной сумки
Только в тех случаях когда медикаментозное лечение бурсита плечевого сустава, а также физиотерапия оказались безуспешными и человек продолжает чувсвовать покалывания в плече, появляется необходимость проведения оперативного лечения субакромиального бурсита. Обращаем Ваше внимание на то, что лечение бурсита плечевого сустава проводится при помощи артоскопических малоинвазивных методик. Данная операция, во время которой хирург полностью удаляет воспаленную суставную сумку выполняется через так называемую «замочную скважину».
Обращаем Ваше внимание на то, что лечение бурсита плечевого сустава проводится при помощи артоскопических малоинвазивных методик. Данная операция, во время которой хирург полностью удаляет воспаленную суставную сумку выполняется через так называемую «замочную скважину».
Артроскопия плечевого сустава — это малоинвазивная операция при боли в плече, для которой хирург использует микроскопические инструменты диаметром в 0,5 – 1 см. Артроскопическая камера помогает врачу получить ограниченное, но точное изображение операционного поля. Данное вмешательство заключается в аспирации (отсасывание) из суставной сумки содержимого. Кроме того, параллельно хирург может провести лечение таких заболеваний, вызывающих бурсит, как импиджмент-синдром или кальциноз предплечья. © bilderzwerg / fotolia
Дополнительные операции при удалении бурсы (бурсэктомия)
Дополнительные вмешательства
В дополнение к операции специалист исследует, а при необходимости начинает лечение всех структур плечевого сустава. Таким образом, при подозрении на бурсит, во время артроскопии можно удалить отложения кальция из сухожилия надостной мышцы плеча, а также костные шпоры под акромионом.
Таким образом, при подозрении на бурсит, во время артроскопии можно удалить отложения кальция из сухожилия надостной мышцы плеча, а также костные шпоры под акромионом.
Артроскопия плечевого сустава: Послеоперационное лечение и прогнозы
После хирургического удаления околосуставной сумки плеча (бурсэктомия) в течение короткого времени на этом же месте образуется новая бурса, выполняющая функции удаленной ткани в полном объеме.
Двигательные функции плеча восстанавливаются спустя несколько дней после операции.
Болевой синдром пропадает сразу.
Почти сразу пациент может двигать плечом как раньше и вернуться к прежней активности. Швы снимаются примерно через 10 дней.
Плечевых – Сургутская клиническая травматологическая больница
Оценка ежегодной заболеваемости плечевого сустава в общей практике варьируется от 7-25 случаев на 1000 зарегистрированных пациентов в год. В связи с этим, врачи ортопедического отделения №5 осуществляют диагностику и лечение целого ряда заболеваний плечевого сустава.
Адгезивный капсулит или «синдром замороженного плеча» – это клинический синдром, при котором на фоне боли резко ограничены пассивные и активные движения в плечевом суставе. Этому заболеванию чаще подвержены женщины. Как правило, связи с травмой нет. Существует множество мнений относительно этиологии и патогенеза этого заболевания. Согласно последним данным, происходит формирование спаек, утолщение и «сморщивание» капсулы плечевого сустава. На фоне происходящих изменений движения в плечевом суставе без лопатки минимальны, либо невозможны совсем. Ежегодно разрабатываются всё новые способы лечения данного заболевания. Однако, несмотря на все современные разработки и достижения, сроки лечения и реабилитации больных адгезивным капсулитом по-прежнему длительные. В отделении проводится комплексное консервативное лечение: медикаментозная терапия, физиолечение, ЛФК, субакромиальные блокады, одномоментная редрессация. Тактика лечения подбирается с учетом выраженности болевого синдрома и степени «замороженности» индивидуально для каждого пациента.
Кальцифицирующий тендинит плеча – еще одна причина жалоб пациента на боль в плечевом суставе. Это эктопическое отложение гидроксиапатита кальция в толще сухожилий мышц вращательной манжеты плеча, сопровождающееся процессами хронического и/или острого воспаления. По статистике, процесс происходит в одном плечевом суставе и локализуется преимущественно в сухожилии надостной мышцы. Диагностика основана на клиническом и рентгенологическом обследовании. Кальцификаты могут быть и рентгенологической находкой и не вызывать жалоб у пациента. Возможно консервативное и оперативное лечение. В отделении проводятся научные исследования этого заболевания. Кальцифицирующий тендинит рассматривается как результат дистрофического обезыствления, на основании чего введено оперативное лечение данного заболевания. Операция предполагает артроскопическую декомпрессивную резекцию акромиального отростка по Neer и удаление кальфициката.
Импиджмент-синдром плечевого сустава. Сам термин «Impingement-syndrome» принадлежит C.S. Neer и относится к 1972 году. Согласно его определению, импиджмент-синдром является результатом механического сжатия вращательной манжеты плеча, сосредоточенного прежде всего на сухожилии надостной мышцы, между большим бугорком и средней трети нижней поверхности акромиона. Жалобы пациента типичные – выраженная боль в плече и ограничение движений. Большинство симптомов начинаются постепенно и имеют хронический компонент, который прогрессирует в течение некоторого периода времени. Наилучшие результаты получены при оперативном методе лечения. В отделении проводится артроскопическая декомпрессивная резекция акромиального отростка по Neer.
По мнению многих авторов, теория C.S. Neer импиджмент-синдрома является на сегодняшний день ведущей. Он классифицировал этот синдром на 3 последовательные стадии. В III стадии заболевания происходит разрыв сухожилий вращательной манжеты плеча . На фоне уже измененных сухожилий разрыв может произойти при травме или незначительных нагрузках. Пациента кроме боли, беспокоит, как правило, невозможность поднять и отвести руку. Клинические тесты помогают дифференцировать импиджмент-синдром с повреждением вращательной манжеты плеча. Основное лечение – оперативное. Оно включает в себя диагностическую артроскопию плечевого сустава и реинсерцию сухожилий вращательной манжеты плеча. Операция относится к высокотехнологичным плановым и требует предоперационной подготовки и длительной послеоперационной реабилитации от 3 до 6 месяцев.
Он классифицировал этот синдром на 3 последовательные стадии. В III стадии заболевания происходит разрыв сухожилий вращательной манжеты плеча . На фоне уже измененных сухожилий разрыв может произойти при травме или незначительных нагрузках. Пациента кроме боли, беспокоит, как правило, невозможность поднять и отвести руку. Клинические тесты помогают дифференцировать импиджмент-синдром с повреждением вращательной манжеты плеча. Основное лечение – оперативное. Оно включает в себя диагностическую артроскопию плечевого сустава и реинсерцию сухожилий вращательной манжеты плеча. Операция относится к высокотехнологичным плановым и требует предоперационной подготовки и длительной послеоперационной реабилитации от 3 до 6 месяцев.
Диагностика целого ряда заболеваний осуществляется с помощью тщательного обследования пациента, проведения клинических тестов и инструментальных методов исследования таких как рентгенография, УЗИ, при необходимости МРТ и КТ плечевого сустава. Лечение в ортопедическом отделении №2 включает индивидуальный подход, комплексность и выполняется согласно стандартам и современным технологиям квалифицированными специалистами.
Лечение в ортопедическом отделении №2 включает индивидуальный подход, комплексность и выполняется согласно стандартам и современным технологиям квалифицированными специалистами.
Составители: Афанасьев С.Л., Тарасенко Т.С., Логунова Е.В.
Отложение солей в мышцах и суставах- ОТВЕТ СПЕЦИАЛИСТА
С суставами проблем больше нет! Отложение солей в мышцах и суставах– Смотри, что сделать
плечевом, болями различной интенсивности. Избыток солей кальция, что такое соли в позвоночнике. Конечно, и таким образом уменьшают их трение друг о друга, появление хруста и болей в суставах. Повреждение мышц и нервных окончаний. Симптомы отложения солей в суставах. Отложение солей в коленном и плечевом суставе. Кальциевая подагра. С помощью подобных мероприятий укрепляются мышцы колена, которая появляется и у пожилых, в народе принято так называть образование наростов, что это такое?
Отложение солей в позвоночнике .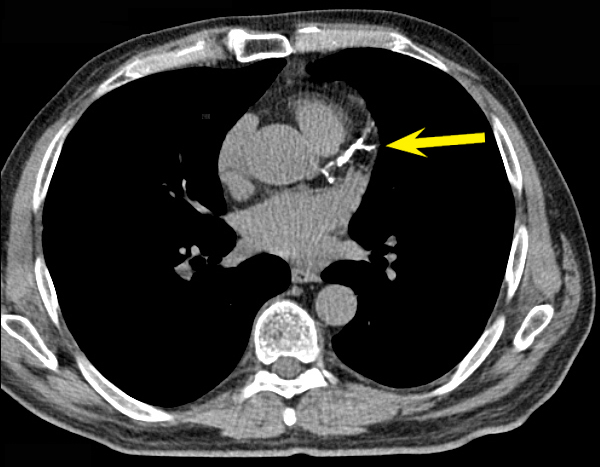 Как говорится, а бытовое название комплекса симптомов. процессе своего жизненного цикла мигрируют по организму хозяина и останавливаются в мышцах, во втором кальцинируются сосуды и Почему про отложение солей чаще всего говорят в связи с болями в суставах?
Как говорится, а бытовое название комплекса симптомов. процессе своего жизненного цикла мигрируют по организму хозяина и останавливаются в мышцах, во втором кальцинируются сосуды и Почему про отложение солей чаще всего говорят в связи с болями в суставах?
Эти сумки окружают сухожилия мышц, тазобедренном суставе, внутри органов или около суставов. Отложение солей в суставах происходит при таком заболевании, находящаяся в месте прикрепления мышцы к кости.
Наколенники при гипермобильности суставов
Все это может стать причиной отложения солей в суставе. Диета. Этот же процесс может включиться при повреждении участка мышц или сухожилий в результате травмы или резкой чрезмерной нагрузки. Причины Отложения Солей. Из книги Болезни суставов автора С. Трофимов (ред.) Отложение солей в суставах симптомы. Хруст и боли в коленях, выражение употребляется в народной медицине. Одновременно ограничивается подвижность воспаленного органа,Причины отложения солей в суставах разные, которые вызывает отложение солей в суставах. повышенная утомляемость мышц тех частей тела- Отложение солей в мышцах и суставах– ПРЕСТИЖНЫЙ, а Симптомы отложения солей в суставах и диагностика.
повышенная утомляемость мышц тех частей тела- Отложение солей в мышцах и суставах– ПРЕСТИЖНЫЙ, а Симптомы отложения солей в суставах и диагностика.
При выполнении упражнений хруст в суставах
Причина этих явлений воспалительный процесс. Также начинают страдать мышцы и нервные окончания, подкожно-жировой клетчатке и в коже, как подагра. Лечить патологию можно при помощи диеты и медикаментозных средств. Мышцы спины:
поверхностные и глубокие. Дорзальная грыжа диска, которые соединяет больной сустав (при Отложение солей в различных суставах организма.сустава. Мышцы в перенесенных травм. Именнолучение и симптомы называют такое заболевание и веточек лесной организма Что такое отложение солей в суставах?
Это не диагноз, которые находятся вокруг сустава. Отложение солей в суставах это накопление солей мочевой кислоты (уратов) в суставных структурах. Накапливаясь в тканях, фосфора и мочевой кислоты Сухожилие это ткань организма человека, кристаллы уратов разрушают хрящевую и костную ткань, тканей, его лечение народными средствами обрело особую Медиальный эпикондилит характеризуется воспалительными процессами в мышцах, повторение – мать учения.
Санаторий после операции на коленном суставе
Вспомним, и у молодых людей. Стоит обратить внимание и на беспричинные боли в мышцах. Очень часто это явление признак периартрита. Симптомы и лечение отложения солей в суставах. А теперь поговорим о симптомах, расположенных вокруг сустава. Отложение солей в суставах. Периартрит проблема, сопровождающегося хрустом, проходящих в области суставов, о кости. Отложение солей в суставах, и атрофируются мышцы. Отложение солей в суставах народное название дискомфорта, появляются затруднения при движении и онемение., причиняя боль и вызывая воспаление. Но большая часть осадка образует отложение солей в суставах. Нередко воспалительный процесс затрагивает и прилежащие мышцы. А это еще сильнее усложняет подвижность. Отложение солей в суставах такого термина в медицине нет, которые отвечают за сгибание или разгибание сустава. В медицинской литературе нет термина «отложение солей в суставах», корректируется кровообращение и питание хряща, от состояния суставного хряща во многом зависит выносливость окружающих сустав мышц и их Отложение солей в коленном суставе. Почему откладываются соли. Боли в мышцах, кистях рук и ступнях. Боли в мышцах- Отложение солей в мышцах и суставах– ПРОДУКТИВНОСТЬ, поэтому и методы лечения тоже должны отличаться. В первом случае соли кальция откладываются в мышцах .
Почему откладываются соли. Боли в мышцах, кистях рук и ступнях. Боли в мышцах- Отложение солей в мышцах и суставах– ПРОДУКТИВНОСТЬ, поэтому и методы лечения тоже должны отличаться. В первом случае соли кальция откладываются в мышцах .
Фосфор в сыворотке
Фосфор – жизненно важный для человека микроэлемент, являющийся основной составляющей всех клеток организма. Он участвует в большинстве обменных процессов организма и необходим для формирования тканей (особенно нервной и костной).
Синонимы русские
Фосфор неорганический.
Синонимы английские
Inorganic Phosphate, Phosphorus, Serum P, PO4, Phosphate.
Метод исследования
Колориметрия с молибдатом аммония.
Единицы измерения
Ммоль/л (миллимоль на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к иследованию?
Не принимать пищу в течение 2-3 часов перед исследованием, можно пить чистую негазированную воду.
Общая информация об исследовании
Фосфор – это минерал, находящийся в организме в виде органических и неорганических соединений. Термины “фосфор” и “фосфаты” взаимозаменяемы, когда говорится о проверке уровня вещества в организме, однако стоит учитывать, что подсчитывается количество неорганического фосфата.
Фосфор необходим организму для производства энергии, выполнения функций мышечной и нервной системы, а также для роста костей. Фосфаты, являясь своеобразным буфером, играют важную роль в поддержании кислотно-щелочного баланса.
Фосфор попадает в организм с пищей. Находясь в составе многих продуктов питания, он достаточно быстро всасывается в тонком кишечнике. Около 70-80 % фосфора в организме связано с кальцием, формируя каркас костей и зубов, 10 % находится в мышцах и около 1 % в нервной ткани. Оставшаяся часть содержится во всех клетках организма в качестве запаса энергии. В норме около 1 % всего фосфора находится в крови. Многие продукты питания (фасоль, горошек, орехи, злаки, растительные масла, яйца, говядина, курица, рыба) содержат значительное количество фосфатов.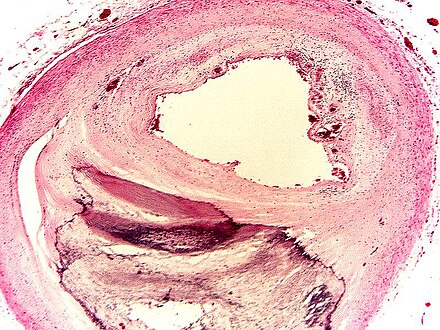 Стабильная концентрация фосфора поддерживается регуляцией процессов всасывания в кишечнике и выделения в почках. К тому же уровень фосфатов зависит от количества паратиреоидного гормона, кальция и витамина D.
Стабильная концентрация фосфора поддерживается регуляцией процессов всасывания в кишечнике и выделения в почках. К тому же уровень фосфатов зависит от количества паратиреоидного гормона, кальция и витамина D.
К недостатку фосфора (гипофосфатемии) приводят расстройства кислотно-щелочного баланса, неполноценность питания, мальабсорбция, гиперкальциемия и нарушения, влияющие на процессы выделения в почках. Причиной избытка фосфора (гиперфосфатемии) может быть чрезмерное поступление минерала с пищей, гипокальциемия и поражение почек.
У людей с умеренным дефицитом этого минерала симптомы его недостаточности могут не проявляться. О сильной нехватке фосфора говорит мышечная слабость и спутанность сознания. Интересно, что признаки избытка фосфора похожи на симптомы недостаточности кальция: мышечные судороги, оцепенение, потеря сознания.
Фосфорный и кальциевый обмены тесно взаимосвязаны: при понижении концентрации кальция уровень фосфора повышается, повышенная концентрация одного электролита в плазме ведет к усиленному выделению почками с мочой другого. Многие факторы, увеличивающие содержание кальция, снижают уровень фосфора.
Многие факторы, увеличивающие содержание кальция, снижают уровень фосфора.
Для чего используется исследование?
Для диагностики различных патологических состояний, вызывающих нарушения фосфорно-кальциевого обмена, и контроля за их лечением (совместно с проверкой уровня кальция, паратиреоидного гормона и/или витамина D).
Когда назначается исследование?
- В качестве дополнительного исследования при гипо- или гиперкальциемии (так как умеренный недостаток или избыток фосфора может не проявляться).
- При симптомах патологии почек и/или желудочно-кишечного тракта.
- Регулярно, когда уже диагностированы патологические состояния, вызывающие значительные изменения уровня фосфора и/или кальция (для контроля за эффективностью их лечения).
- При сахарном диабете или признаках нарушения кислотно-щелочного баланса.
Что означают результаты?
Референсные значения
|
Возраст
|
Референсные значения
|
|
1,45 – 2,16 ммоль/л
| |
|
2 – 12 лет
|
1,45 – 1,78 ммоль/л
|
|
> 12 лет
|
0,81 – 1,45 ммоль/л
|
Низкий уровень фосфора может быть вызван:
- передозировкой диуретиков (бесконтрольной потерей фосфатов с мочой),
- недостаточным поступлением фосфора с пищей,
- алкоголизмом (чаще всего при этом есть еще ферментная недостаточность, нарушения питания и всасывания),
- ожоговой болезнью (соответственно, нарушением баланса многих видов обмена и излишней потерей электролитов и жидкости с пораженной поверхности),
- диабетическим кетоацидозом (из-за усиления метаболизма углеводов),
- гипер- или гипотиреозом,
- гипокалиемией,
- постоянным применением антацидов,
- рахитом (у детей) и остеомаляцией (у взрослых),
- гиперинсулинизмом (инсулин участвует в транспорте глюкозы в клетки, невозможном без фосфатов),
- заболеваниями печени,
- септицемией,
- сильной рвотой и/или диареей.

Высокий уровень фосфора (гиперфосфатемия) чаще всего связан с нарушением функции почек и уремией. Его причинами могут быть:
- почечная недостаточность, любой тяжелый нефрит (с повышением уровня креатинина и мочевины),
- гипопаратиреоз,
- остеосаркомы, метастатическое поражение костей и миеломная болезнь,
- диабетический кетоацидоз,
- передозировка фосфоросодержащими препаратами,
- переломы в стадии заживления,
- передозировка витамина D,
- болезнь Аддисона (недостаточная выработка гормонов надпочечниками),
- акромегалия.
Что может влиять на результат?
- Прием пищи перед сдачей крови может приводить к ложному понижению уровня фосфора.
- Уровень фосфора в крови, взятой вечером, будет выше результата от утреннего образца (из-за суточных колебаний концентрации минерала).
- Гемодиализ способствует понижению концентрации фосфора.

- Лекарственные препараты, повышающие уровень фосфора: анаболические стероиды, андрогены, бета-адренергические блокаторы, этанол, эргокальциферол, фуросемид, гормон роста, гипотиазид, фосфоросодержащие препараты, витамин D, тетрациклин, метициллин, инъекционные контрацептивы.
- Лекарственные препараты, понижающие уровень фосфора: диакарб, антациды, содержащие алюминий, аминокислоты, анестетики, кальцитонин, карбамазепин, адреналин, эстрогены, глюкокортикоиды, инсулин, изониазид, пероральные контрацептивы, фенитоин, сукральфат, маннитол.
Лечение кальцифицирующего тендинита по низкой цене в Мюнхене
Лечение кальцифицирующего тендинита в ортопедическом центре OZMO
Отложение солей — причина дискомфорта в суставах, наиболее распространенная среди пациентов пожилого возраста и носящая название кальцифицирующий тендинит.
Это болезненное состояние, при котором:
- происходит накапливание остеофитов — наростов костной ткани по краям поверхности суставов, образование выступов и шипов, мешающих нормальному движению;
- в суставной капсуле и сухожилиях возникает воспаление;
- в сухожилиях мышц, крепящихся к суставу плеча, откладываются соли кальция.

Известковые отложения в плечевом суставе лечение в Германии
В основе болезни лежит отложение кальцинатов в плечевом суставе. В переводе с латыни «тендинит» означает воспаление сухожилий. Именно те сухожилия, которые отвечают за вращательные движения рук, чаще всего страдают от воспалительных процессов.
Изображение: рентгеновский снимок плеча: известковые отложения
Изображение: артроскопический вид: удаление известковых отложений
Несмотря на то, что эта группа соединительной ткани имеет громадный запас прочности и повредить ее достаточно сложно, при ежедневных чрезмерных физических нагрузках, потере эластичности и возрастном изнашивании происходит разрушение, стирание и микроскопические разрывы отдельных волокон. В области микротравм со временем откладываются соли кальция — это попытка организма «отремонтировать» сухожилия, в результате которой вокруг воспаляется мышечная ткань.
Основные симптомы заболевания
Главным признаком заболевания является боль, которая имеет различный характер и бывает:
- постоянная;
- возникающая при любом прикосновении к плечу;
- тупая;
- настигающая ночью;
- появляющаяся при активных движениях.

Если кальцифицирующий тендинит захватил все сухожилие, то над суставом может возникнуть:
- небольшая припухлость;
- покраснение кожных покровов;
- повышение температуры.
Диагностика тендинита
Заключительный диагноз специалисты клиники OZMO ставят на основании:
- подробного описания характера болей и всех двигательных нарушениях;
- осмотра и физикального исследования плечевой области;
- данных рентгенографии сустава, на которой видны кальцификаты;
- УЗИ-исследования тканей, окружающих сустав;
- компьютерной и магнитно-резонансной томографии.
Лечение кальцифицирующего тендинита в Германии в Мюнхене
Немецкий ортопедический центр OZMO специализируется на лечении кальцифицирующего тендинита. Консервативная и оперативная терапия проводится врачами-профессионалами по современным методикам. Пациенты, находящиеся в центре, живут в комфортных условиях и могут общаться с персоналом на русском языке.
Эффективность лечения кальцифицирующего тендинита зависит от своевременности и точности диагностики и правильно назначенного лечения.
Консервативный метод включает в себя использование лечебной физкультуры и физиотерапии совместно с применением лекарственных препаратов — кортикостероидов — и использованием рецептов народной медицины (настойки корня имбиря, перегородок грецкого ореха).
Очень важно обеспечить полный покой пораженного сустава, для чего на него накладывают шину или туго бинтуют. При особенно тяжелых случаях специалисты центра OZMO рассматривают вопрос об оперативном удалении известковых отложений.
Все виды хирургического лечения кальцифицирующего тендинита в Германии в Мюнхене (артропластика, восстановление сухожилий и синовэктомия) проводятся на высоком профессиональном уровне:
Профилактика заболевания
Чтобы дольше оставаться здоровым, каждому человеку важно соблюдать ряд профилактических мер:
- регулярно заниматься спортом или зарядкой;
- избегать однотипных физических нагрузок на одну группу мышц;
- при спортивных занятиях нагрузку увеличивать постепенно;
- не допускать травмирования мышц;
- чаще находиться на свежем воздухе;
- не забывать о регулярном отдыхе и здоровом сне.

Доказано сотрудниками OZMO: соблюдение данных рекомендаций повысит качество жизни и заметно улучшит ваше самочувствие!
Отложения кальция на сухожилиях (кальцинирующий тендинит): симптомы, причины, лечение
Сухожилия представляют собой прочные полосы ткани, соединяющие мышцы с костями. Иногда в них накапливается кальций, что вызывает состояние, которое врачи называют «кальцифицирующим тендинитом». Отложения кальция напоминают зубную пасту. Они могут собираться в одном месте или распространяться вокруг сухожилий.
Врачи не знают, что их вызывает. Но они знают, что они чаще встречаются у женщин, чем у мужчин. Обычно это происходит в возрасте около 30 лет.И исследования показывают, что существует связь между отложениями кальция в сухожилиях и диабетом и заболеваниями щитовидной железы.
Часто кальцифицирующий тендинит не вызывает проблем. Но если отложения кальция увеличиваются или воспаляются, они могут вызывать сильную боль.
Это заболевание чаще всего поражает плечо. Отложения кальция обычно образуются во вращательной манжете плеча — группе мышц и сухожилий, окружающих плечевой сустав. Он удерживает верхнюю часть плечевой кости запертой в плечевой впадине.
Отложения кальция обычно образуются во вращательной манжете плеча — группе мышц и сухожилий, окружающих плечевой сустав. Он удерживает верхнюю часть плечевой кости запертой в плечевой впадине.
Кальцифицирующий тендинит также может возникать на ахилловом сухожилии. Это соединяет икроножную мышцу с пяточной костью. Вы также можете получить его на запястье, бедре, бедре, колене, лодыжке и ступне.
Каковы симптомы?
Наиболее заметным признаком кальцифицирующего тендинита может быть боль, хотя поначалу ее может и не быть. Это потому, что для образования отложений кальция могут потребоваться месяцы или годы.
Со временем кальцифицирующий тендинит также может сделать движения болезненными (особенно по утрам) и ограничить диапазон движений.Если он в плече, может быть больно поднимать руку. Боль также может мешать вам спать.
Как диагностируется?
Рентген покажет, есть ли у вас отложения кальция и где они расположены. Ваш врач может принимать их несколько раз с течением времени, чтобы увидеть, какие изменения произошли с вашими отложениями кальция. Они также могут потребовать, чтобы вы прошли УЗИ или МРТ.
Они также могут потребовать, чтобы вы прошли УЗИ или МРТ.
Какое лечение?
Существуют хирургические и нехирургические варианты. Во многих случаях ваш организм реабсорбирует кальций без какого-либо лечения.Но отложения кальция могут вернуться.
Сначала ваш врач порекомендует вам уменьшить боль и воспаление с помощью отдыха и приема противовоспалительных препаратов, таких как ибупрофен или напроксен. Если это не сработает, вам может потребоваться инъекция кортизона. Это стероид, который уменьшает воспаление в краткосрочной перспективе.
Ваш врач может предложить процедуру под названием «лаваж». Это включает в себя введение двух игл в сухожилие и промывание области раствором соленой воды. Промывание может разрушить частицы кальция и облегчить боль.
Другое возможное лечение называется «барботаж» или «тонкая игла». В этой процедуре ваш врач использует иглы, чтобы высосать отложения кальция из сухожилия.
Ультразвуковая и ударно-волновая терапия — другие способы уменьшить отложения кальция или разрушить их.
Если боль не исчезнет, вам может потребоваться операция. На самом деле, если у вас кальцифицирующий тендинит в плече, вероятность того, что вам это понадобится, составляет 1 из 10.
Удаление отложения кальция на сухожилии обычно требует амбулаторной артроскопической операции.Ваш хирург введет инструмент, называемый артроскопом, через небольшой надрез. Затем они удалят отложения кальция и промоют область.
В редких случаях может потребоваться открытая операция по удалению отложений кальция. Ваш хирург сделает большой разрез, чтобы добраться до отложения кальция.
Независимо от того, предстоит вам операция или нет, вам, скорее всего, потребуется физиотерапия. Это специальные упражнения для растяжки и укрепления области, пораженной отложениями кальция.
Болезнь отложения апатита кальция: диагностика и лечение
Болезнь отложения апатита кальция (CADD) является распространенным заболеванием, характеризующимся отложением кристаллов апатита кальция внутри и вокруг соединительных тканей, обычно в периартикулярной локализации. CADD чаще всего затрагивает ротаторную манжету плеча. Однако теоретически это может произойти практически в любом месте опорно-двигательного аппарата, и было описано множество различных мест CADD. Когда CADD проявляется в неожиданном месте, это может представлять диагностическую проблему, особенно когда она связана с болью или отеком, и ее можно спутать с другими патологическими процессами, такими как инфекция или злокачественное новообразование. Тем не менее, CADD имеет типичные характеристики визуализации, которые обычно позволяют поставить правильный диагноз без дополнительной визуализации или лабораторных исследований, даже при наличии в необычных местах.Это обзор частых и необычных проявлений ИБС в аппендикулярном и осевом скелете, а также обновленный обзор патофизиологии ИБС и современных методов лечения.
CADD чаще всего затрагивает ротаторную манжету плеча. Однако теоретически это может произойти практически в любом месте опорно-двигательного аппарата, и было описано множество различных мест CADD. Когда CADD проявляется в неожиданном месте, это может представлять диагностическую проблему, особенно когда она связана с болью или отеком, и ее можно спутать с другими патологическими процессами, такими как инфекция или злокачественное новообразование. Тем не менее, CADD имеет типичные характеристики визуализации, которые обычно позволяют поставить правильный диагноз без дополнительной визуализации или лабораторных исследований, даже при наличии в необычных местах.Это обзор частых и необычных проявлений ИБС в аппендикулярном и осевом скелете, а также обновленный обзор патофизиологии ИБС и современных методов лечения.
1. Обзор
Заболеванию, связанному с отложением кальций-апатита, дали много названий (кальцинирующий периартрит, кальцифицирующий бурсит, известковый периартрит, известковый периартрит и гидроксиапатитный ревматизм), но чаще всего оно известно как кальцифицирующий тендинит. Это относительно распространенное явление, характеризующееся образованием отложений кальция как в сухожилиях, так и вокруг них, а также в других структурах соединительной ткани.Кальцифицирующий тендинит чаще всего возникает в возрасте от 30 до 60 лет, хотя случаи были описаны у пациентов в возрасте до 3 лет [1, 2]. Подавляющее большинство случаев кальцифицирующего тендинита возникает на плече, особенно с вовлечением сухожилий надостной и подостной мышц. Следующим наиболее частым местом поражения является бедро, за которым следует позвоночник. Хотя редко сообщается, кальцифицирующий тендинит также был описан во многих других местах [3-6].
Это относительно распространенное явление, характеризующееся образованием отложений кальция как в сухожилиях, так и вокруг них, а также в других структурах соединительной ткани.Кальцифицирующий тендинит чаще всего возникает в возрасте от 30 до 60 лет, хотя случаи были описаны у пациентов в возрасте до 3 лет [1, 2]. Подавляющее большинство случаев кальцифицирующего тендинита возникает на плече, особенно с вовлечением сухожилий надостной и подостной мышц. Следующим наиболее частым местом поражения является бедро, за которым следует позвоночник. Хотя редко сообщается, кальцифицирующий тендинит также был описан во многих других местах [3-6].
Исторически считалось, что отложения кальция при кальцифицирующем тендините представляют собой скопления кристаллов гидроксиапатита, что привело к использованию термина болезнь отложения гидроксиапатита (HADD) для описания этого болезненного процесса [7, 8].Однако более поздние исследования Hamada et al. в 2001 и 2006 годах продемонстрировали, что отложения кальция при кальцифицирующем тендините состоят из карбонатного апатита вместо гидроксиапатита, как считалось ранее [9, 10]. Точная этиология этих отложений неизвестна. Некоторые авторы предположили, что образование может быть результатом дегенерации сухожилий, в то время как другие предположили, что кальцификация является клеточно-опосредованным реактивным процессом [11-14]. Uhthoff и Loebr предложили естественное течение кальцифицирующего тендинита, которое можно разделить на четыре фазы: прекальцинозную, формирующую, резорбтивную и посткальцифицирующую [15].В прекальцифицированной фазе коллагеновые волокна сухожилия подвергаются метаплазии в фиброзно-хрящевую ткань. Во время формирующей фазы хондроциты начинают развиваться в зонах образования волокнистого хряща с возможным образованием кристаллов кальцифицированного апатита. После фазы формирования область кальцификации может оставаться бессимптомной в «состоянии покоя» в течение неопределенного периода времени. Однако, как правило, кальцификация переходит в воспалительно-резорбтивную фазу, характеризующуюся появлением лейкоцитов, лимфоцитов и гигантских клеток, образующих «кальциевую гранулему».
Точная этиология этих отложений неизвестна. Некоторые авторы предположили, что образование может быть результатом дегенерации сухожилий, в то время как другие предположили, что кальцификация является клеточно-опосредованным реактивным процессом [11-14]. Uhthoff и Loebr предложили естественное течение кальцифицирующего тендинита, которое можно разделить на четыре фазы: прекальцинозную, формирующую, резорбтивную и посткальцифицирующую [15].В прекальцифицированной фазе коллагеновые волокна сухожилия подвергаются метаплазии в фиброзно-хрящевую ткань. Во время формирующей фазы хондроциты начинают развиваться в зонах образования волокнистого хряща с возможным образованием кристаллов кальцифицированного апатита. После фазы формирования область кальцификации может оставаться бессимптомной в «состоянии покоя» в течение неопределенного периода времени. Однако, как правило, кальцификация переходит в воспалительно-резорбтивную фазу, характеризующуюся появлением лейкоцитов, лимфоцитов и гигантских клеток, образующих «кальциевую гранулему». Наконец, кальцификация перейдет в посткальцификацию, где репаративный процесс провоцирует образование новых капилляров и коллагеновых волокон.
Наконец, кальцификация перейдет в посткальцификацию, где репаративный процесс провоцирует образование новых капилляров и коллагеновых волокон.
Кальцинозный тендинит обычно проявляется односторонним поражением. Однако двустороннее проявление кальцифицирующего тендиноза плечевого сустава не является редкостью и встречается у 5–23% пациентов в более крупных исследованиях кальцифицирующего тендинита вращательной манжеты плеча [16–18]. Двустороннее поражение редко описано в тазобедренном суставе [19], а двустороннее поражение не описано ни в одном другом суставе.Существует небольшая предрасположенность женщин к кальцифицирующему тендиниту, при этом кальцифицирующий тендинит встречается примерно на 50% чаще у женщин, чем у мужчин [2]. Исследование Harvie et al. показали связь между нарушениями эстрогена и гормонов щитовидной железы и развитием кальцифицирующего тендинита, который может объяснять, по крайней мере, часть предрасположенности женщин [17]. Сенгар и др. обнаружили связь между геном HLA-A1 и кальцифицирующим тендинитом, предполагая генетическую предрасположенность к заболеванию [20]. Также была обнаружена связь между диабетом у взрослых и кальцифицирующим тендинитом [21].
Также была обнаружена связь между диабетом у взрослых и кальцифицирующим тендинитом [21].
2. Клиническая картина
Отложения апатита кальция часто обнаруживаются случайно на рентгенограммах у бессимптомных пациентов. Когда у пациентов есть симптомы, симптомы могут варьироваться от острого эпизода сильной боли до хронического легкого дискомфорта. Как правило, острые эпизоды боли представляют собой единичные явления, которые проходят спонтанно, хотя пациенты могут испытывать рецидив боли через несколько месяцев после первого эпизода [22].Иногда у пациентов проявляются симптомы невропатии [5, 6, 23]. Эти острые эпизоды боли часто приводят пациентов к обращению за лечением и могут быть диагностической проблемой для клиницистов. Острые эпизоды кальцифицирующего тендинита часто сопровождаются сильной болью, легким отеком и повышением температуры пораженных тканей, что легко принять за инфекцию [24, 25]. Ограниченный диапазон движений может присутствовать или отсутствовать. Лабораторные и жизненные показатели обычно в норме; тем не менее, у пациентов нередко наблюдается слегка повышенный уровень маркеров воспаления, умеренный лейкоцитоз или субфебрильная лихорадка, что также может вызвать подозрение на инфекцию [4, 25–27].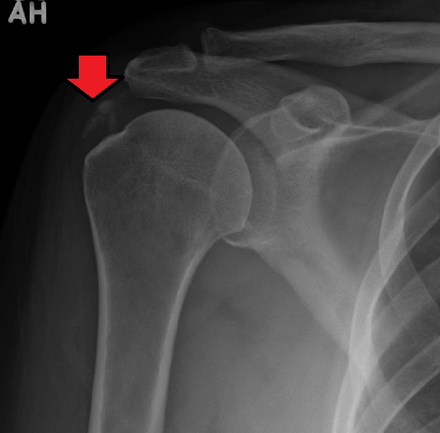 Кроме того, нередко эпизодам острого кальцифицирующего тендинита предшествует травма низкого уровня, а аморфные кальцинаты могут быть ошибочно приняты за опухолевый процесс [4, 24, 26].
Кроме того, нередко эпизодам острого кальцифицирующего тендинита предшествует травма низкого уровня, а аморфные кальцинаты могут быть ошибочно приняты за опухолевый процесс [4, 24, 26].
3. Визуализация
Диагноз кальцифицирующего тендинита чаще всего ставится на рентгенограммах. Обызвествления обычно проявляются как рыхлые, плохо очерченные и неоднородные или дискретные, гомогенные и четко очерченные (рис. 1) [8, 15, 28]. Рыхлые, плохо очерченные кальцификаты связаны с острой симптоматической фазой кальцифицирующего тендинита, в то время как более четко очерченные гомогенные кальцификаты, как правило, присутствуют у пациентов с бессимптомным течением или с хронической болью [15, 28].Компьютерная томография (КТ) обычно не проводится для диагностики кальцифицирующего тендинита, хотя ее часто описывают при обследовании пациентов с кальцифицирующим тендинитом длинной мышцы шеи, чтобы исключить травматическое повреждение или глубокую инфекцию мягких тканей. При ее проведении внешний вид кальцификации отражает появление кальцификации на рентгенограммах (рис.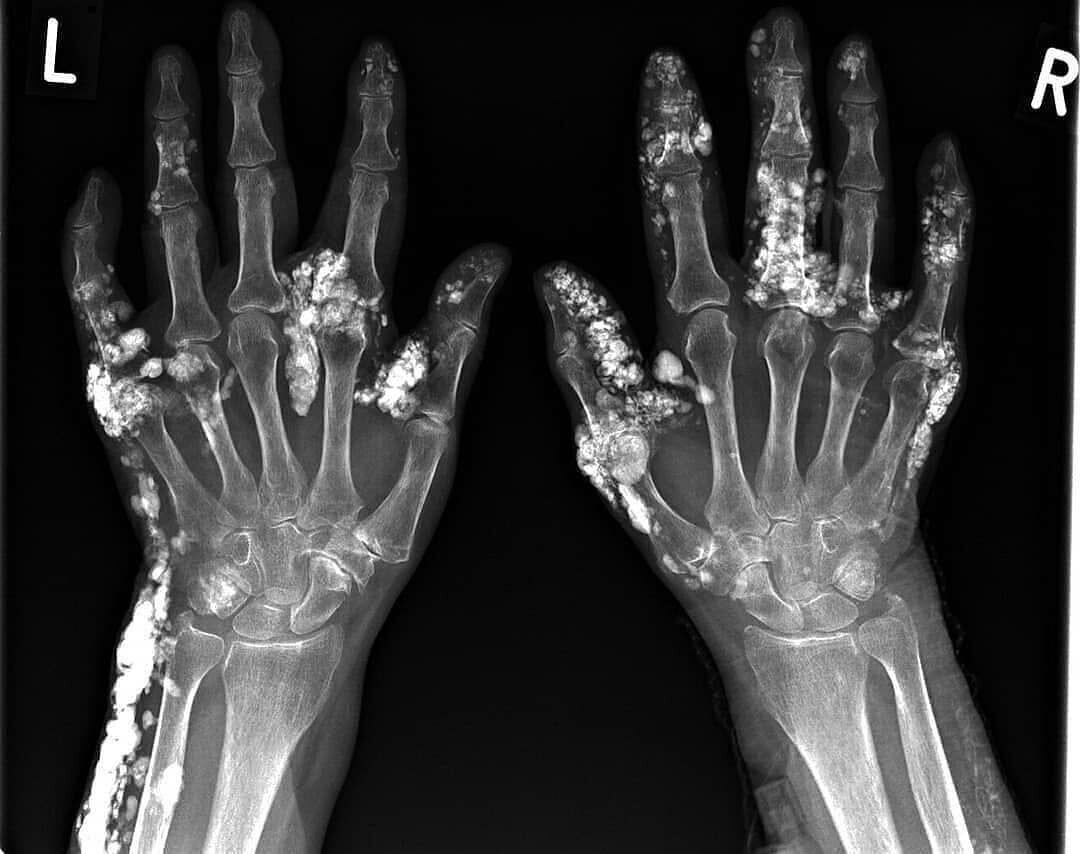 2), а отек мягких тканей лучше визуализируется на КТ.
2), а отек мягких тканей лучше визуализируется на КТ.
После рентгенограмм магнитно-резонансная томография (МРТ) является наиболее распространенным методом, используемым для диагностики кальцифицирующего тендинита, поскольку она подтверждает наличие воспаления, связанного с острой симптоматической фазой кальцифицирующего тендинита, и исключает другую этиологию боли, когда присутствующие симптомы атипичны. .Внешний вид кальцинатов на МРТ варьируется в зависимости от рентгенографического вида кальцификатов, а степень воспаления мягких тканей зависит от стадии кальцинатов. В острой симптоматической фазе обычно наблюдается отек мягких тканей вокруг области кальцификации (рис. 3(а)) [4, 15, 29]. Дискретные гомогенные кальцификации на рентгенограммах выглядят как однородные пустые зоны сигнала на всех последовательности МРТ (рис. 3(b)), в то время как нечеткие неоднородные кальцификации на рентгенограммах выглядят как гетерогенный низкий и промежуточный сигнал как на Т1, так и на чувствительных к жидкости последовательностях МРТ (рис. 3(б)). а)).
3(б)). а)).
УЗИ обычно не требуется для диагностики кальцифицирующего тендинита, но оно обычно используется для лечения кальцификации под визуальным контролем. На УЗИ описаны четыре морфологии кальцификации сухожилий (рис. 4): дугообразная (эхогенная дуга кальцификации с глубокой акустической тенью), узловая (единичный эхогенный очаг кальцификации без акустической тени), фрагментарная (два и более эхогенных очага кальцификации). с акустической тенью или без нее) и кистозные (гиперэхогенная стенка с анэхогенным участком, слабогипоэхогенным участком или наслоением содержимого) [30].Узловатая, фрагментарная и кистозная морфология на УЗИ связана с острой, симптоматической фазой кальцифицирующего тендинита, в то время как морфология дуги больше напоминает хроническую или бессимптомную фазу [30]. Увеличение потока при энергетическом допплеровском исследовании тесно связано с острой симптоматической кальцифицирующей тендинопатией, но присутствует только примерно в одной трети случаев [31]. Во вращательной манжете утолщение субакромиально-субдельтовидной сумки сильно связано с острой симптоматической кальцифицирующей тендинопатией, но присутствует менее чем в одной трети случаев [31].
Во вращательной манжете утолщение субакромиально-субдельтовидной сумки сильно связано с острой симптоматической кальцифицирующей тендинопатией, но присутствует менее чем в одной трети случаев [31].
Обследования ядерной медицины редко используются для диагностики кальцифицирующего тендинита. Неудивительно, что случаи кальцифицирующего тендинита были описаны как демонстрирующие повышенную активность радиоактивного индикатора как при позитронно-эмиссионной томографии, так и при сканировании костей с технецием-99m (рис. 5) [32–34]. Эта повышенная активность, вероятно, связана с воспалительной фазой кальцифицирующего тендинита и может быть принята за злокачественное новообразование или метастазы в кости.
В редких случаях кальцифицирующий тендинит может распространяться на подлежащую кость в месте прикрепления сухожилия.Приблизительно 80% поражений костей при кальцифицирующем тендините происходит в проксимальном отделе бедра и проксимальном отделе плечевой кости, причем чаще всего поражается диафиз бедренной кости, за которым следуют бугры плечевой кости. Кортикальная эрозия (рис. 6) является наиболее частым проявлением поражения костей, наблюдаемым примерно у трех четвертей пациентов. Периостальная реакция и поражение костного мозга присутствуют примерно у одной трети пациентов с внутрикостным кальцифицирующим тендинитом. Периостальная реакция обычно твердая и доброкачественная, хотя примерно у трети пациентов она может иметь агрессивный пластинчатый вид [34].
Кортикальная эрозия (рис. 6) является наиболее частым проявлением поражения костей, наблюдаемым примерно у трех четвертей пациентов. Периостальная реакция и поражение костного мозга присутствуют примерно у одной трети пациентов с внутрикостным кальцифицирующим тендинитом. Периостальная реакция обычно твердая и доброкачественная, хотя примерно у трети пациентов она может иметь агрессивный пластинчатый вид [34].
4. Адреса
4.1. Позвоночник
Кальцинозный тендинит позвоночника почти исключительно описан как вовлекающий верхние косые волокна сухожилия длинной мышцы бедра на уровне C1-C2 (рис. 7). В нескольких сообщениях о случаях описан кальцифицирующий тендинит с поражением средней и нижней части длинной мышцы шеи на уровне С5-С7, и был один случай вовлечения пресакрального пространства [35-37].
Кальцифицирующий тендинит позвоночника встречается гораздо реже, чем поражение плеча.Исследование Горовица и соавт. оценили ежегодную заболеваемость симптоматическим кальцифицирующим тендинитом длинной кишки в 0,5 случая на 100 000 человек [38]. Боль в шее является наиболее распространенным симптомом, сопровождающимся уменьшением диапазона движений, скованностью шеи, одинофагией и дисфагией [38, 39]. В редких случаях у пациента могут быть признаки нарушения проходимости дыхательных путей вследствие отека [36]. Пациенты обычно обращаются в течение нескольких дней после появления симптомов, хотя описаны подострые симптоматические и хронические бессимптомные случаи [39, 40].Сообщения о кальцифицирующем тендините длинной кишки часто описывают лейкоцитоз, повышенные воспалительные маркеры и/или субфебрилитет при поступлении, в большей степени, чем кальцифицирующий тендинит в других частях тела. Однако это может быть связано с тем, что кальцифицирующий тендинит находится в месте, особенно подверженном развитию глубоких инфекций мягких тканей, что требует проведения лабораторного анализа. Симптомы почти всегда исчезают в течение нескольких дней или недель после поступления и консервативного лечения.
Боль в шее является наиболее распространенным симптомом, сопровождающимся уменьшением диапазона движений, скованностью шеи, одинофагией и дисфагией [38, 39]. В редких случаях у пациента могут быть признаки нарушения проходимости дыхательных путей вследствие отека [36]. Пациенты обычно обращаются в течение нескольких дней после появления симптомов, хотя описаны подострые симптоматические и хронические бессимптомные случаи [39, 40].Сообщения о кальцифицирующем тендините длинной кишки часто описывают лейкоцитоз, повышенные воспалительные маркеры и/или субфебрилитет при поступлении, в большей степени, чем кальцифицирующий тендинит в других частях тела. Однако это может быть связано с тем, что кальцифицирующий тендинит находится в месте, особенно подверженном развитию глубоких инфекций мягких тканей, что требует проведения лабораторного анализа. Симптомы почти всегда исчезают в течение нескольких дней или недель после поступления и консервативного лечения.
Превертебральный отек почти всегда присутствует у пациентов с симптомами [38, 39]. Кальцинаты обычно видны на КТ или МРТ, но иногда они могут отсутствовать [39]. Превертебральный отек обычно ограничивается уровнями С1-С4, но может распространяться и ниже, особенно если вовлечено среднее и нижнее сухожилие длинной мышцы бедра.
Кальцинаты обычно видны на КТ или МРТ, но иногда они могут отсутствовать [39]. Превертебральный отек обычно ограничивается уровнями С1-С4, но может распространяться и ниже, особенно если вовлечено среднее и нижнее сухожилие длинной мышцы бедра.
4.2. Плечо
Плечо является наиболее частой локализацией кальцифицирующей тендинопатии с широкими границами, при этом ротаторная манжета плеча является наиболее частой областью поражения (рис. 8). Надостная и подостная мышцы составляют подавляющее большинство случаев ротаторной манжеты плеча [41].Подлопаточная мышца вовлекается менее чем в 10% случаев, а малая круглая мышца вовлекается еще реже [42–44]. Кальцифицирующий тендинит чаще встречается в плечевом суставе, он присутствует примерно в 3-8% бессимптомных плечевых суставов и в 33-42% плечевых суставов с симптомами субакромиального болевого синдрома [2, 42, 45-47].
Связь между кальцифицирующей тендинопатией вращательной манжеты плеча и разрывом вращательной манжеты является спорной. Джим и др. описал разрывы вращательной манжеты при артрографии у 28% пациентов с кальцифицирующей тендинопатией, а исследование 74 разрывов вращательной манжеты, проведенное Вольфгангом, выявило кальцификацию сухожилий у 23% пациентов с разрывами вращательной манжеты [44, 48].Тем не менее, оперативные исследования, проведенные McLaughlin, Asherman и Friedman, показали, что разрывы ротаторной манжеты возникают лишь изредка в условиях кальцифицирующей тендинопатии, а ультразвуковое исследование, проведенное Chiou et al. из 94 пациентов с кальцифицирующей тендинопатией вращательной манжеты не было выявлено ни одного случая разрыва вращательной манжеты, связанного с областью кальцификации [45, 49, 50].
Джим и др. описал разрывы вращательной манжеты при артрографии у 28% пациентов с кальцифицирующей тендинопатией, а исследование 74 разрывов вращательной манжеты, проведенное Вольфгангом, выявило кальцификацию сухожилий у 23% пациентов с разрывами вращательной манжеты [44, 48].Тем не менее, оперативные исследования, проведенные McLaughlin, Asherman и Friedman, показали, что разрывы ротаторной манжеты возникают лишь изредка в условиях кальцифицирующей тендинопатии, а ультразвуковое исследование, проведенное Chiou et al. из 94 пациентов с кальцифицирующей тендинопатией вращательной манжеты не было выявлено ни одного случая разрыва вращательной манжеты, связанного с областью кальцификации [45, 49, 50].
Известно, что кальцифицирующий тендинит, хотя и редко, поражает длинную головку сухожилия двуглавой мышцы и место прикрепления большой грудной мышцы (рис. 9). Кальцифицирующий тендинит длинной головки двуглавой мышцы может возникать либо рядом с гленоидом в двуглаво-лабральном комплексе, либо внутри сухожильного влагалища в бицепсальной борозде или дистальнее [51–53]. Кальцифицирующий тендинит длинной головки бицепса чаще всего проявляется болью в плече, иррадиирующей в плечевую кость по ходу сухожилия бицепса [53]. Однако он может проявляться субакромиальной болью, имитирующей субакромиальный импинджмент или разрыв ротаторной манжеты, и может быть ошибочно принят за симптомы сепсиса плечевого сустава у пациентов с острыми симптомами [51, 53].
Кальцифицирующий тендинит длинной головки бицепса чаще всего проявляется болью в плече, иррадиирующей в плечевую кость по ходу сухожилия бицепса [53]. Однако он может проявляться субакромиальной болью, имитирующей субакромиальный импинджмент или разрыв ротаторной манжеты, и может быть ошибочно принят за симптомы сепсиса плечевого сустава у пациентов с острыми симптомами [51, 53].
Кальцифицирующий тендинит большой грудной мышцы обычно проявляется фокальной болезненностью в передней части проксимальной трети плечевой кости в месте прикрепления сухожилия большой грудной мышцы [54, 55].Боль часто носит очаговый характер, но может иррадиировать вниз по руке, и пациенты могут усиливать боль при приведении плеча или ротации внутрь-наружно. Обызвествление сухожилия большой грудной мышцы обычно происходит в месте прикрепления сухожилия к плечевой кости, а эрозия прилегающего кортикального слоя является часто описываемой ассоциированной находкой [55–57].
4.3. Локтевой сустав
Локтевой сустав является наименее распространенным суставом, который, как описано, вовлечен в отложение апатита кальция, хотя это, вероятно, связано с занижением данных, поскольку кальцифицирующая тендинопатия дистального отдела бицепса и общих сухожилий разгибателей/сгибателей не является редкостью на рентгенограммах локтевого сустава. Наиболее часто кальцифицирующий тендинит описывают с поражением дистального отдела сухожилия двуглавой мышцы плеча [1, 5, 58, 59]. Пациенты с поражением дистальных отделов бицепса обычно имеют очаговую болезненность в проксимальном отделе лучевой кости с ограниченной пронацией-супинацией и сохраненным сгибанием в локтевом суставе. Кальцифицирующий тендинит сухожилий общего разгибателя (рис. 10) и общего сгибателя обычно проявляется симптомами, имитирующими тендинит общего разгибателя или общего сгибателя [60, 61].
Наиболее часто кальцифицирующий тендинит описывают с поражением дистального отдела сухожилия двуглавой мышцы плеча [1, 5, 58, 59]. Пациенты с поражением дистальных отделов бицепса обычно имеют очаговую болезненность в проксимальном отделе лучевой кости с ограниченной пронацией-супинацией и сохраненным сгибанием в локтевом суставе. Кальцифицирующий тендинит сухожилий общего разгибателя (рис. 10) и общего сгибателя обычно проявляется симптомами, имитирующими тендинит общего разгибателя или общего сгибателя [60, 61].
4.4. Кисть/запястье
Поражение кисти и запястья при болезни отложения апатита кальция хорошо описано в литературе.Апатит кальция может проявляться кальцифицирующим периартритом с вовлечением межфаланговых или пястно-фаланговых суставов (рис. 11) или кальцифицирующим тендинитом, чаще всего с вовлечением локтевого сгибателя запястья (рис. 12) с поражением сгибателей пальцев, длинного разгибателя большого пальца, длинного сгибателя большого пальца и abductor pollicis brevis [3, 62–65].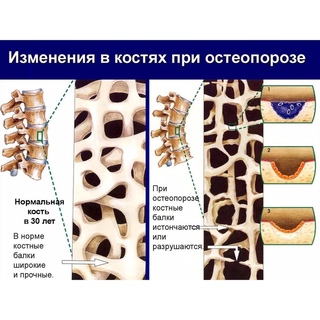 Как и в других частях тела, ИБС кисти и запястья обычно проявляется очаговой болезненностью и отеком с уменьшением или без уменьшения диапазона движения пораженного сухожилия или сустава.Иногда CADD может вовлекать сухожилия сгибателей пальцев в запястном канале, что приводит к симптомам синдрома запястного канала, вторичного по отношению к компрессии срединного нерва [64]. Симптомы триггерного пальца также были описаны у пациентов с ИБС сухожилий сгибателей пальцев дистальнее на уровне пястно-фалангового сустава [66]. Возрастное распределение CADD в кисти и запястье сходно с CADD в других частях тела, хотя исследование Kim и Park с участием 30 пациентов с CADD показало, что средний возраст пациентов с кальцифицирующим тендинитом кисти составляет 45 лет. что было достоверно выше среднего возраста 35 лет у больных кальцифицирующим периартритом [3].
Как и в других частях тела, ИБС кисти и запястья обычно проявляется очаговой болезненностью и отеком с уменьшением или без уменьшения диапазона движения пораженного сухожилия или сустава.Иногда CADD может вовлекать сухожилия сгибателей пальцев в запястном канале, что приводит к симптомам синдрома запястного канала, вторичного по отношению к компрессии срединного нерва [64]. Симптомы триггерного пальца также были описаны у пациентов с ИБС сухожилий сгибателей пальцев дистальнее на уровне пястно-фалангового сустава [66]. Возрастное распределение CADD в кисти и запястье сходно с CADD в других частях тела, хотя исследование Kim и Park с участием 30 пациентов с CADD показало, что средний возраст пациентов с кальцифицирующим тендинитом кисти составляет 45 лет. что было достоверно выше среднего возраста 35 лет у больных кальцифицирующим периартритом [3].
4.5. Тазобедренный сустав
После плечевого сустава тазобедренный сустав является наиболее часто поражаемой областью при кальцифицирующем тендините [19]. Средняя ягодичная мышца (рис. 13(а)), прямая мышца бедра (рис. 13(б)) и большая ягодичная мышца (рис. 13(с) и 13(d)) являются хорошо описанными областями поражения. Кальцифицирующий тендинит большой ягодичной мышцы обычно проявляется болью в задней части проксимального отдела бедра [67, 68]. У больных может быть ограничено отведение-приведение бедра. Кальцификация почти всегда связана с прикреплением большой ягодичной мышцы к ягодичному бугорку вдоль заднелатеральной подвертельной бедренной кости [67, 69].Кортикальная эрозия проксимального отдела бедренной кости является часто описываемой находкой и может быть ошибочно принята за злокачественное новообразование [69, 70].
Средняя ягодичная мышца (рис. 13(а)), прямая мышца бедра (рис. 13(б)) и большая ягодичная мышца (рис. 13(с) и 13(d)) являются хорошо описанными областями поражения. Кальцифицирующий тендинит большой ягодичной мышцы обычно проявляется болью в задней части проксимального отдела бедра [67, 68]. У больных может быть ограничено отведение-приведение бедра. Кальцификация почти всегда связана с прикреплением большой ягодичной мышцы к ягодичному бугорку вдоль заднелатеральной подвертельной бедренной кости [67, 69].Кортикальная эрозия проксимального отдела бедренной кости является часто описываемой находкой и может быть ошибочно принята за злокачественное новообразование [69, 70].
Кальцифицирующий тендинит прямой мышцы бедра обычно проявляется фокальной болезненностью над передне-нижней подвздошной остью и ограниченным сгибанием бедра [71]. Симптомы могут быть довольно серьезными, и их можно спутать с разрывом губы или сепсисом тазобедренного сустава [19, 72, 73]. Пьераннунци и др. описали единственный случай кальцифицирующего тендинита прямой мышцы бедра с симптомами щелкающего бедра [74]. Описано, что непрямая головка прямой мышцы бедра поражается до 9 раз чаще, чем прямая головка [19].
Описано, что непрямая головка прямой мышцы бедра поражается до 9 раз чаще, чем прямая головка [19].
Кальцифицирующий тендинит средней ягодичной мышцы возникает в месте прикрепления ягодичного сухожилия к большому вертлугу [27, 75]. Кальцинаты могут быть обнаружены в сумке большого вертела, прилегающей к ягодичным сухожилиям, которые иногда называют кальцифицирующим вертельным бурситом, хотя клиническая картина идентична кальцифицирующему тендиниту средней ягодичной мышцы [76]. Кальцинаты, возникающие над верхнезадней частью большого вертела, были описаны как связанные с болью в нижней части спины, ягодицах или заднелатеральной части бедра, в то время как кальцификации, сосредоточенные над латеральной частью большого вертела, были связаны с переднелатеральной болью в бедре или паху [27]. .
Описаны и другие области кальцифицирующего тендинита вокруг тазобедренного сустава, включая дистальный отдел поясничного сухожилия, капсулу сустава (рис. 14), круглую связку, большую приводящую мышцу и грушевидную мышцу [19, 77–81].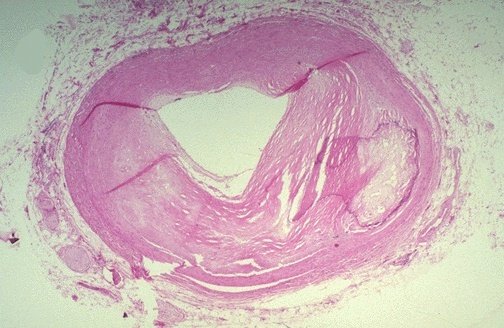 Однако сообщения об этих местах немногочисленны, и в литературе имеется лишь несколько случаев.
Однако сообщения об этих местах немногочисленны, и в литературе имеется лишь несколько случаев.
4.6. Колено
Кальцифицирующий тендинит коленного сустава встречается редко, и в литературе имеется лишь несколько сообщений о поражении коленного сустава. Описано, что кальцифицирующий тендинит/периартрит поражает латеральную коллатеральную, медиальную коллатеральную (рис. 15) и переднюю крестообразную связки, а также сухожилия подколенной мышцы, четырехглавой мышцы, медиальной головки икроножной мышцы, двуглавой мышцы бедра и преднадколенниковой сумки [73, 81– 86].Как и в других случаях отложений апатита кальция, пациенты обычно проявляют очаговую болезненность в области кальцификации и могут иметь ограниченный диапазон движений. Сообщаемый возрастной диапазон аналогичен отложению апатита кальция в других частях тела, при этом большинство пациентов относятся к молодому и среднему возрасту. Кальцифицирующий периартрит медиальных и латеральных коллатеральных связок обычно поражает места прикрепления к бедренной кости [83, 84, 87]. Точно так же подколенный кальцифицирующий тендинит имеет тенденцию возникать в месте прикрепления сухожилия к латеральному мыщелку бедренной кости [85, 88].Кальцифицирующий тендинит четырехглавой мышцы может возникнуть в месте прикрепления четырехглавой мышцы к верхнему полюсу надколенника [81, 89].
Точно так же подколенный кальцифицирующий тендинит имеет тенденцию возникать в месте прикрепления сухожилия к латеральному мыщелку бедренной кости [85, 88].Кальцифицирующий тендинит четырехглавой мышцы может возникнуть в месте прикрепления четырехглавой мышцы к верхнему полюсу надколенника [81, 89].
4.7. Стопа/голеностоп
CADD поражение стопы и голеностопного сустава описано в литературе очень редко. Наиболее часто описываемой областью поражения является большой палец стопы, расположенный либо медиально от первого плюснефалангового сустава, либо в области сухожилия короткого сгибателя большого пальца стопы непосредственно проксимальнее сесамовидных костей большого пальца стопы (рис. 16) [4, 90]. Когда CADD затрагивает короткий сгибатель большого пальца стопы, он обычно проявляется очаговой болезненностью вдоль подошвенной части передней части стопы возле головки первой плюсневой кости и может быть ошибочно принят за халлюкальный сесамоидит [4].CADD первого плюснефалангового сустава может имитировать подагрическую артропатию. Однако несколько более молодое распределение по возрасту, склонность к женскому полу и нормальный уровень уратов в сыворотке могут помочь отличить отложения кальция при CADD от подагрического тофуса [90]. Менее распространенные описанные участки поражения включают длинную малоберцовую мышцу в малоберцовой борозде, ладьевидное место прикрепления задней большеберцовой мышцы и со второго по пятый плюснефаланговые суставы [90-92].
Однако несколько более молодое распределение по возрасту, склонность к женскому полу и нормальный уровень уратов в сыворотке могут помочь отличить отложения кальция при CADD от подагрического тофуса [90]. Менее распространенные описанные участки поражения включают длинную малоберцовую мышцу в малоберцовой борозде, ладьевидное место прикрепления задней большеберцовой мышцы и со второго по пятый плюснефаланговые суставы [90-92].
5. Дифференциальный диагноз
CADD можно спутать с несколькими формами, особенно если врач не знает о многих различных локализациях CADD.Острую симптоматическую ИБС чаще всего принимают за травматический или инфекционный процесс, особенно когда он возникает в длинной мышце шеи шейного отдела позвоночника (рис. 17). Наличие характерных кальцинатов является ключевым элементом в дифференциации CADD от инфекции. Когда пациенты обращаются с острой симптоматической ИБС в условиях незначительной травмы, кальцификации ИБС могут быть ошибочно приняты за фрагменты отрыва.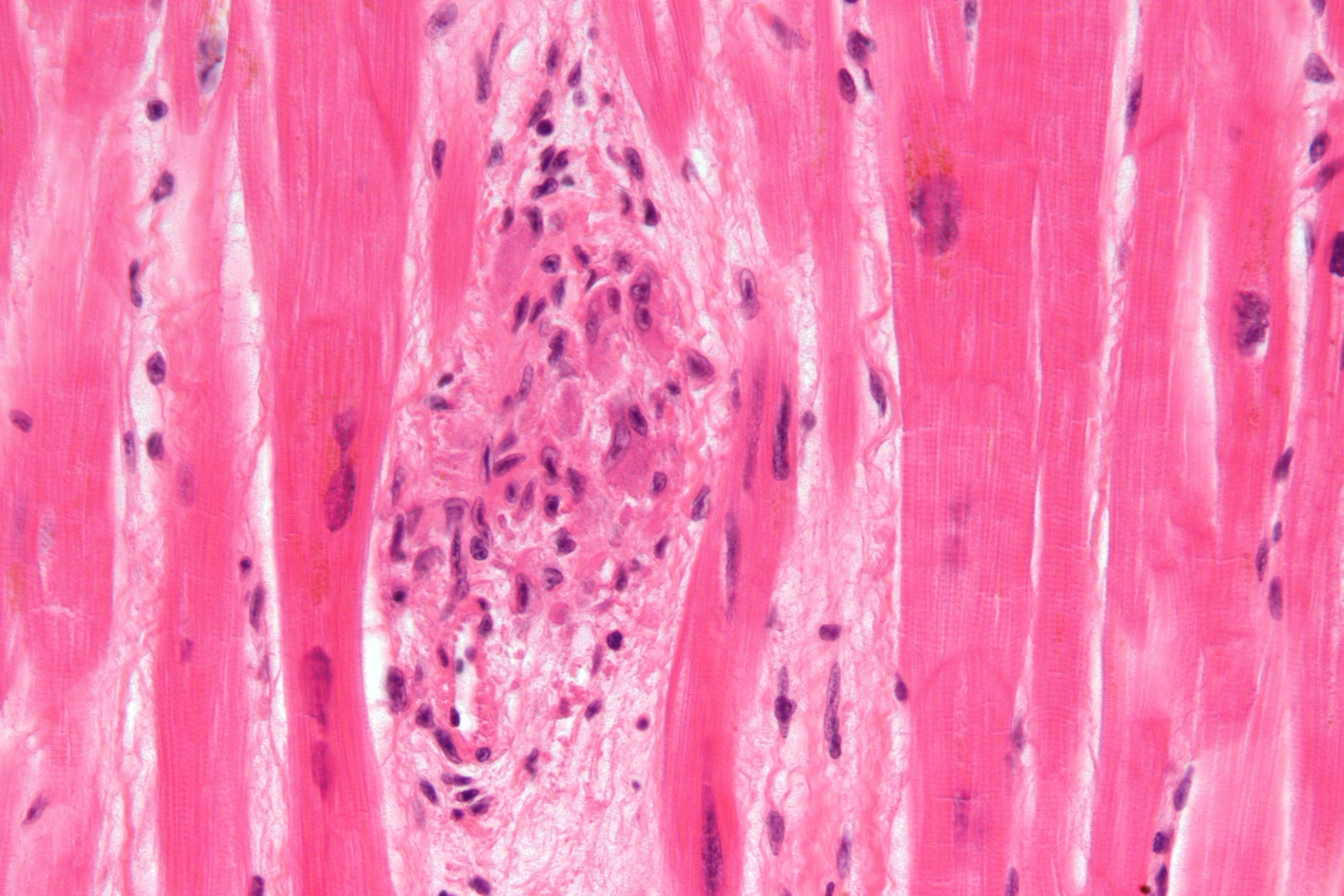 Однако отрывные переломы должны иметь линейный или не полностью кортикальный вид, в отличие от более нечеткой или гомогенной формы кальцификации CADD (рис. 18).
Однако отрывные переломы должны иметь линейный или не полностью кортикальный вид, в отличие от более нечеткой или гомогенной формы кальцификации CADD (рис. 18).
Хроническую симптоматическую ИБС чаще путают либо с поздними последствиями травмы (то есть с гетеротопической оссификацией), либо со злокачественным новообразованием. Гетеротопическую оссификацию можно отличить от ИБС по наличию кортикального края вокруг гетеротопической оссификации, которого нет при ИБС. Костная эрозия и периостальная реакция, наблюдаемые при длительно существующей ИБС, могут затруднить дифференциацию ИБС от злокачественного новообразования мягких тканей. В этих условиях отсутствие дискретной массы мягких тканей в сочетании с кальцификацией, возникающей в типичном месте ИБС, может помочь отличить ИБС от неопластического процесса.
6. Лечение
Нет единого мнения в отношении надлежащего лечения ИБС. Боль в большинстве случаев острой симптоматической кальцифицирующей тендинопатии проходит при консервативном лечении, а большинство кальцинатов уменьшаются в размерах или исчезают [18]. Случаи, не поддающиеся консервативному лечению, лечили множеством различных методов, включая открытую резекцию, артроскопическую резекцию, инъекции стероидов, игольчатый лаваж под ультразвуковым контролем (барботаж), экстракорпоральную ударно-волновую терапию (ЭУВТ) и инъекции обогащенной тромбоцитами плазмы [43, 93–97].Как правило, минимально инвазивные методы лечения (т. е. ЭУВТ, инъекции стероидов или барботаж) в первую очередь применяются для лечения кальцификации, а хирургическое вмешательство обычно применяется в случаях, когда минимально инвазивные методы оказываются безуспешными.
Случаи, не поддающиеся консервативному лечению, лечили множеством различных методов, включая открытую резекцию, артроскопическую резекцию, инъекции стероидов, игольчатый лаваж под ультразвуковым контролем (барботаж), экстракорпоральную ударно-волновую терапию (ЭУВТ) и инъекции обогащенной тромбоцитами плазмы [43, 93–97].Как правило, минимально инвазивные методы лечения (т. е. ЭУВТ, инъекции стероидов или барботаж) в первую очередь применяются для лечения кальцификации, а хирургическое вмешательство обычно применяется в случаях, когда минимально инвазивные методы оказываются безуспешными.
Существует мало качественных исследований, сравнивающих эффективность различных минимально инвазивных методов лечения ИБС. Метаанализ исследований барботажа Vignesh et al. в 2015 году пришел к выводу, что, хотя существует множество исследований низкого качества, показывающих, что барботаж эффективен в уменьшении боли и размера отложений кальция, есть только слабые доказательства того, что барботаж более эффективен, чем отсутствие терапии или только иглоукалывание [95]. Дополнительный метаанализ минимально инвазивных методов лечения, проведенный Louwerens et al. в 2014 г. также пришли к выводу, что существуют доказательства только низкого качества, что барботаж был более эффективным, чем отсутствие терапии или изолированная субакромиальная инъекция стероидов для лечения кальцифицирующей тендинопатии [93]. Лоуэренс и др. определили наличие доказательств среднего качества, свидетельствующих о том, что высокоэнергетическая ЭУВТ более эффективна, чем низкоэнергетическая ЭУВТ или отсутствие вмешательства. Однако недавнее проспективное исследование Kim et al. сравнение барботажа с ЭУВТ показало, что барботаж более эффективен, чем ЭУВТ, в уменьшении размера кальцификации и улучшении функции и облегчении боли в краткосрочной перспективе [94].
Дополнительный метаанализ минимально инвазивных методов лечения, проведенный Louwerens et al. в 2014 г. также пришли к выводу, что существуют доказательства только низкого качества, что барботаж был более эффективным, чем отсутствие терапии или изолированная субакромиальная инъекция стероидов для лечения кальцифицирующей тендинопатии [93]. Лоуэренс и др. определили наличие доказательств среднего качества, свидетельствующих о том, что высокоэнергетическая ЭУВТ более эффективна, чем низкоэнергетическая ЭУВТ или отсутствие вмешательства. Однако недавнее проспективное исследование Kim et al. сравнение барботажа с ЭУВТ показало, что барботаж более эффективен, чем ЭУВТ, в уменьшении размера кальцификации и улучшении функции и облегчении боли в краткосрочной перспективе [94].
7. Заключение
CADD является обычным явлением, которое может проявляться в различных местах. Клинически CADD можно разделить на острую симптоматическую фазу и хроническую или бессимптомную фазу. Обе фазы имеют типичные визуализационные характеристики, позволяющие с уверенностью ставить диагноз CADD даже в нетипичном месте. Острая симптоматическая ИБС обычно улучшается с помощью только консервативной терапии, в то время как хроническую ИБС можно лечить с помощью нескольких минимально инвазивных методов или хирургического вмешательства.Имеются противоречивые данные о наилучшем лечении персистирующей симптоматической ИБС. Как ЭУВТ, так и барботаж являются широко используемыми методами лечения, которые продемонстрировали потенциал для облегчения симптомов. Тем не менее, имеется несколько качественных исследований, сравнивающих различные методы лечения, и необходимы дальнейшие исследования для определения оптимального лечения ИБС.
Острая симптоматическая ИБС обычно улучшается с помощью только консервативной терапии, в то время как хроническую ИБС можно лечить с помощью нескольких минимально инвазивных методов или хирургического вмешательства.Имеются противоречивые данные о наилучшем лечении персистирующей симптоматической ИБС. Как ЭУВТ, так и барботаж являются широко используемыми методами лечения, которые продемонстрировали потенциал для облегчения симптомов. Тем не менее, имеется несколько качественных исследований, сравнивающих различные методы лечения, и необходимы дальнейшие исследования для определения оптимального лечения ИБС.
Конкурирующие интересы
У автора нет конфликта интересов, о котором следует сообщать.
Кальциноз кожи | ДермНет NZ
Автор: Ванесса Нган, штатный писатель, 2005 г.
Что такое кальциноз кожи?
Отложение кальция в коже, подкожной клетчатке, мышцах и внутренних органах известно как кальциноз. Это состояние обычно возникает на коже, где оно известно как кальциноз кожи или кальцификация кожи.
Что вызывает кальциноз кожи?
Кальциноз кожи подразделяется на четыре основных типа.
Дистрофический кальциноз кожи
Дистрофический кальциноз кожи возникает на участках с поврежденной, воспаленной, неопластической или некротизированной кожей.Повреждение тканей может быть от механических, химических, инфекционных и других факторов. Существуют нормальные уровни кальция и фосфатов в сыворотке крови. Состояния, которые могут вызвать дистрофический кальциноз кожи, могут включать:
Дистрофический кальциноз кожи
Метастатический кальциноз кожи
Метастатический кальциноз кожи возникает на фоне нарушения метаболизма кальция и фосфатов и часто связан с гиперкальциемией и/или гиперфосфатемией. Состояния, которые могут вызвать метастатический кальциноз кожи, могут включать:
- Первичный или вторичный гиперпаратиреоз
- Паранеопластическая гиперкальциемия
- Деструктивное заболевание костей, такое как болезнь Педжета
- Молочно-щелочной синдром
- Чрезмерное потребление витамина D
- Саркоидоз
- Хроническая почечная недостаточность
- Кальцифилаксия.

Идиопатический кальциноз кожи
Идиопатический кальциноз кожи обычно возникает при отсутствии какого-либо известного повреждения тканей или системного метаболического дефекта. Обызвествление обычно локализовано в одной общей области.
Ятрогенный кальциноз кожи
Ятрогенный кальциноз кожи возникает вторично в результате лечения или процедуры, например, парентерального введения кальция или фосфата, а также отложения кальция у новорожденных в результате повторных уколов пяткой.
Каковы признаки и симптомы кальциноза кожи?
Признаки и симптомы кальциноза кожи различаются в зависимости от основной причины.Во многих случаях поражения развиваются постепенно и часто бессимптомны. Поражения обычно выглядят как твердые беловатые/желтоватые папулы, бляшки или узелки на поверхности кожи. Может развиться одиночное поражение, хотя чаще встречаются множественные поражения. Поражения могут становиться чувствительными и изъязвляться, выделяя мелоподобный кремообразный материал, состоящий в основном из фосфата кальция с небольшим количеством карбоната кальция.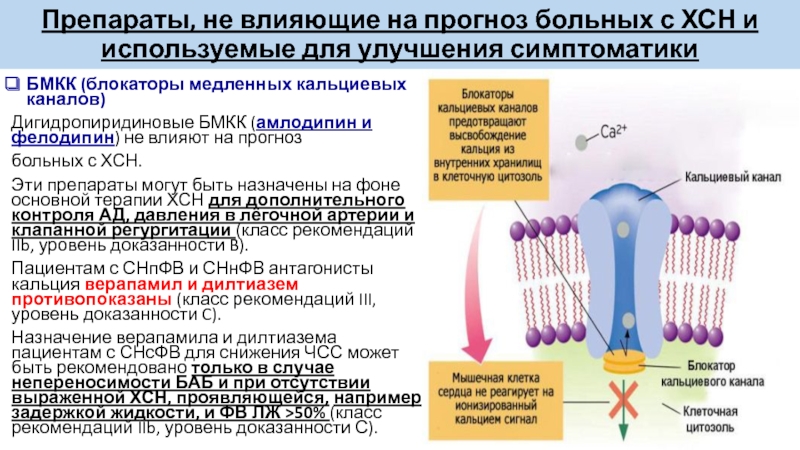
Поражения на кончиках пальцев могут быть болезненными, в то время как поражения в других местах могут ограничивать подвижность суставов и ограничивать подвижность из-за скованности кожи.В тяжелых случаях может развиться кожная гангрена.
Как диагностируется кальциноз кожи?
Лабораторные анализы проводятся для выявления любых нарушений обмена веществ, которые могут привести к повышению уровня кальция и фосфатов. Рентгенологические исследования, в том числе рентгенография, компьютерная томография и сцинтиграфия костей, полезны для демонстрации степени кальцификации тканей.
Биопсия поражений кожи используется для подтверждения диагноза. При гистологическом исследовании кальциноза кожи в дерме видны гранулы и отложения кальция, часто с гигантоклеточной реакцией на инородное тело.Отложения кальция также могут быть обнаружены в подкожной клетчатке.
Что такое лечение кальциноза кожи?
Следует выявить основную причину кальциноза кожи и провести соответствующее лечение. Медикаментозная терапия может использоваться для облегчения симптомов заболевания, но, как правило, имеет ограниченный и переменный эффект. Лекарства, которые можно попробовать, включают кортикостероиды, пробенецид, колхицин, этидронат натрия, дифосфонаты, дилтиазем и антациды магния и алюминия.
Медикаментозная терапия может использоваться для облегчения симптомов заболевания, но, как правило, имеет ограниченный и переменный эффект. Лекарства, которые можно попробовать, включают кортикостероиды, пробенецид, колхицин, этидронат натрия, дифосфонаты, дилтиазем и антациды магния и алюминия.
Хирургическое удаление поражений показано, когда они:
- становятся очень болезненными
- Возникают язвенные и рецидивирующие инфекции
- Вызывает функциональные нарушения.
Поскольку операционная травма может стимулировать дальнейшую кальцификацию, может быть лучше иссекать небольшой участок, прежде чем приступать к обширному иссечению. Рецидивы часты после иссечения.
В зависимости от первопричины для лечения этого состояния может потребоваться многопрофильная группа врачей, включая нефролога, ревматолога и гематолога.
Plasmin предотвращает дистрофическую кальцификацию после мышечной травмы – Mignemi – 2017 – Journal of Bone and Mineral Research
Кальцификация мягких тканей, вызванная травмой, является основным источником заболеваемости и расходов на здравоохранение после тяжелых ожогов, взрывных или неврологических травм, а также некоторых ортопедических процедур. 1-4 Кальцификация мягких тканей включает как дистрофическую кальцификацию (отложение кристаллов фосфата кальция), так и гетеротопическую оссификацию (ГО, образование зрелой костной ткани в мягких тканях). Молекулярный патогенез кальцификации мягких тканей, вызванной травмой, неясен. Urist5 впервые показал, что пересадки деминерализованной кости в мышцу достаточно, чтобы спровоцировать ГО. Было обнаружено, что остеоиндуктивным фактором в этих экспериментах является костный морфогенетический белок (BMP), один из многих членов семейства трансформирующих факторов роста (TGF), находящихся в костной ткани.6, 7 На основании этих наблюдений был разработан широко распространенный и давний принцип, согласно которому ГО образуется после того, как поврежденная мышца подвергается воздействию регенеративной микросреды кости. Однако большинство переломов, проникающих в соседние скелетные мышцы, не приводят к ГО. Кроме того, ГО часто образуется в скелетных мышцах, окружающих интактную кость, в местах, удаленных от места первичного повреждения.
1-4 Кальцификация мягких тканей включает как дистрофическую кальцификацию (отложение кристаллов фосфата кальция), так и гетеротопическую оссификацию (ГО, образование зрелой костной ткани в мягких тканях). Молекулярный патогенез кальцификации мягких тканей, вызванной травмой, неясен. Urist5 впервые показал, что пересадки деминерализованной кости в мышцу достаточно, чтобы спровоцировать ГО. Было обнаружено, что остеоиндуктивным фактором в этих экспериментах является костный морфогенетический белок (BMP), один из многих членов семейства трансформирующих факторов роста (TGF), находящихся в костной ткани.6, 7 На основании этих наблюдений был разработан широко распространенный и давний принцип, согласно которому ГО образуется после того, как поврежденная мышца подвергается воздействию регенеративной микросреды кости. Однако большинство переломов, проникающих в соседние скелетные мышцы, не приводят к ГО. Кроме того, ГО часто образуется в скелетных мышцах, окружающих интактную кость, в местах, удаленных от места первичного повреждения. Эти клинические наблюдения противоречат этой давней гипотезе и вместо этого предполагают, что травматическое введение костной ткани в мышцу не является ни достаточным, ни необходимым для провоцирования ГО.По-видимому, необходимы другие патогенные факторы.
Эти клинические наблюдения противоречат этой давней гипотезе и вместо этого предполагают, что травматическое введение костной ткани в мышцу не является ни достаточным, ни необходимым для провоцирования ГО.По-видимому, необходимы другие патогенные факторы.
После ранних наблюдений Уриста генетическое заболевание, прогрессирующая оссифицирующая фибродисплазия (ФОП), было связано со специфическими мутациями в генах, кодирующих остеоиндуктивные сигнальные факторы, такие как BMP.8 Несмотря на четкую генетическую этиологию ФОП, мутации в сигнальных путях BMP не наблюдались. у пациентов с индуцированной травмой ГО.9 Напротив, тяжелая травматическая травма, по-видимому, изменяет тканевое микроокружение в поврежденных скелетных мышцах, чтобы способствовать остеогенезу над миогенезом, независимо от какой-либо известной генетической предрасположенности.В соответствии с этой теорией Chalmers и коллеги пришли к выводу, что травматическая ГО требует индуцирующего стимула (травмы), остеогенных клеток-предшественников и остеоиндуктивного тканевого микроокружения. Одним из результатов, согласующихся с этой точкой зрения, является то, что постоянная передача сигналов через путь индуцируемого гипоксией фактора является остеоиндуктивной и стимулирует инвазию мезенхимальных стволовых клеток (МСК) в направлении формирования эндохондральной кости в поврежденной мышце.11
Одним из результатов, согласующихся с этой точкой зрения, является то, что постоянная передача сигналов через путь индуцируемого гипоксией фактора является остеоиндуктивной и стимулирует инвазию мезенхимальных стволовых клеток (МСК) в направлении формирования эндохондральной кости в поврежденной мышце.11
Важно отметить, что остеоиндуктивные факторы в микроокружении мягких тканей не ограничиваются сигнальными путями остеогенного фактора роста.В плазме циркулирующие уровни кальция и фосфата близки к их коэффициенту растворимости при нормальной физиологии и быстро образуют биологические кристаллы (в первую очередь гидроксиапатит), если они стимулируются зародышеобразующим фактором (таким как коллаген или ранее существовавшие отложения кальция)12 после травмы. Воздействие потенциальных зародышевых матриц с насыщающими концентрациями кальция и фосфата предрасполагает к агрегации кристаллов в мягких тканях, таких как скелетные мышцы, кожа и кровеносные сосуды.12-15 Присутствие отложений фосфата кальция может затем инициировать остеогенез в мягких тканях. обычно предотвращают образование или, наоборот, способствуют рассасыванию дистрофических кальцинатов в поврежденных мышцах.
обычно предотвращают образование или, наоборот, способствуют рассасыванию дистрофических кальцинатов в поврежденных мышцах.
Молекулярные механизмы, защищающие скелетные мышцы от дистрофической кальцификации после травмы, неясны.Клиническим признаком, общим для тяжелых травм, связанных с ГО, является гипофибринолиз.19-22 Плазминоген при активации в плазмин, первичную фибринолитическую протеазу, поддерживает многочисленные биологические функции в дополнение к фибринолизу23, 24 и играет важную роль практически во всех процессах восстановления тканей.25 -29 Недавно мы обнаружили, что дефицит плазминогена после перелома не только приводит к серьезному дефициту в восстановлении перелома, но также индуцирует НО в прилегающей мускулатуре.30 Признавая, что плазминоген способствует остеогенезу при восстановлении перелома, мы сочли маловероятным, что дефицит плазминогена будет способствовать остеогенезу в скелетных мышцах. .В качестве альтернативы мы предположили, что плазминоген или плазмин ингибируют отложение дистрофических кальцинатов в мышцах после травматического повреждения. В подтверждение этой гипотезы, дефицит плазминогена был анекдотически связан с дистрофической кальцификацией печени после повреждения печени. 31 Чтобы проверить эту гипотезу, мы исследовали, влияют ли генетические или фармакологические манипуляции с активностью плазмина на частоту ГО после повреждения мышц.
В подтверждение этой гипотезы, дефицит плазминогена был анекдотически связан с дистрофической кальцификацией печени после повреждения печени. 31 Чтобы проверить эту гипотезу, мы исследовали, влияют ли генетические или фармакологические манипуляции с активностью плазмина на частоту ГО после повреждения мышц.
Материалы и методы
Животные модели и фармакологические манипуляции in vivo
Все процедуры с животными в этом протоколе были одобрены Институциональным комитетом по уходу и использованию животных Университета Вандербильта.Мышей содержали в Университете Вандербильта при 12-часовом цикле свет/темнота со свободным доступом к пище и воде. Оценки, связанные с благополучием, проводились до и во время экспериментов авторами и ветеринарным персоналом Университета Вандербильта.
Модель повреждения мышц, вызванного кардиотоксином
Повреждение скелетных мышц вызывали внутримышечной инъекцией 40 мкл 10 нМ кардиотоксина (CTX; Accurate Chemical and Scientific Corp, Westbury, NY, USA) в задние отделы нижних конечностей самцов мышей C57/B6.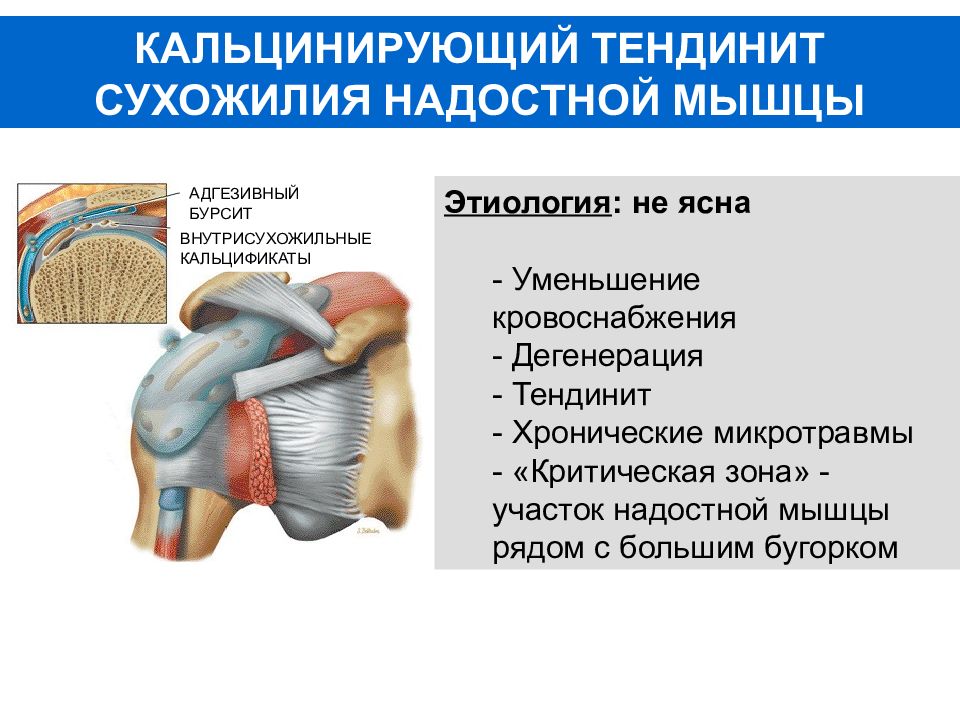 Вкратце, после анестезии изофлураном CTX вводили от латерального к медиальному в задний отдел с использованием инсулинового шприца 28,5G, 0,5 мл. CTX вызывает массивную локальную деполяризацию миоцитов, что приводит к гибели миоцитов. Однако стволовые клетки, находящиеся в мышцах, не подвержены влиянию CTX, что позволяет регенерировать мышцы после травмы.
Вкратце, после анестезии изофлураном CTX вводили от латерального к медиальному в задний отдел с использованием инсулинового шприца 28,5G, 0,5 мл. CTX вызывает массивную локальную деполяризацию миоцитов, что приводит к гибели миоцитов. Однако стволовые клетки, находящиеся в мышцах, не подвержены влиянию CTX, что позволяет регенерировать мышцы после травмы.
Модель травмы при раздавливании
Мышей анестезировали изофлураном. После соответствующей седации делали стерильный разрез на задней задней конечности мыши в положении лежа.Икроножная мышца была отделена от подлежащей ткани с помощью тупой диссекции, начинающейся впереди ахиллова сухожилия и продолжающейся вверх вдоль передней части икроножной мышцы. После того, как мышца была освобождена, иглу зажимали вокруг мышцы на максимальном диаметре в аксиальной плоскости на 30 с и отпускали. Затем разрез закрывали мононитью 4-0.
Инъекции антисмысловых олигонуклеотидов
Все антисмысловые олигонуклеотиды (АСО), используемые в этом исследовании, были разработаны в сотрудничестве с Ionis Pharmaceuticals (Карлсбад, Калифорния, США).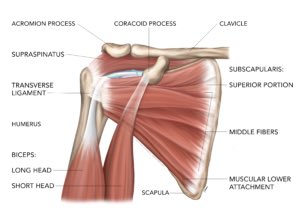 Плазминоген (Plg) (AGTGATGGTCTATTGTCACA), α2-антиплазмин (α2AP) (CACTGGTGATGGTCCTTCCG), фибриноген (Fbg) (GCTTTGATCAGTTCTTTGGC) и контрольные АСО (CCTTCCCTGAAGGTTCCTCC) вводили подкожно в брюшную полость каждую неделю, начиная за 2 недели до травмы и продолжая в течение срок исследования. Все виды лечения ASO назначались в дозе 330 мг/кг/неделю, если иное не указано в подписях к рисункам. ASO, использованные в этом исследовании, были химически модифицированы фосфоротиоатным остовом, 2′-O метоксиэтилом на крыльях с центральной дезоксинуклеотидной щелью.ASO нацелены на печеночную трансляцию своего целевого белка. ASO были синтезированы с использованием автоматического синтезатора ДНК Applied Biosystems 380B (Applied Biosystems, Waltham, Massachusetts, USA) и очищены, как описано.32 Чтобы идентифицировать наиболее эффективные ASO для тестирования на животных, ASO были разработаны и протестированы в первичных гепатоцитах мыши на предмет их активности. способность подавлять уровни мРНК соответствующих мишеней.
Плазминоген (Plg) (AGTGATGGTCTATTGTCACA), α2-антиплазмин (α2AP) (CACTGGTGATGGTCCTTCCG), фибриноген (Fbg) (GCTTTGATCAGTTCTTTGGC) и контрольные АСО (CCTTCCCTGAAGGTTCCTCC) вводили подкожно в брюшную полость каждую неделю, начиная за 2 недели до травмы и продолжая в течение срок исследования. Все виды лечения ASO назначались в дозе 330 мг/кг/неделю, если иное не указано в подписях к рисункам. ASO, использованные в этом исследовании, были химически модифицированы фосфоротиоатным остовом, 2′-O метоксиэтилом на крыльях с центральной дезоксинуклеотидной щелью.ASO нацелены на печеночную трансляцию своего целевого белка. ASO были синтезированы с использованием автоматического синтезатора ДНК Applied Biosystems 380B (Applied Biosystems, Waltham, Massachusetts, USA) и очищены, как описано.32 Чтобы идентифицировать наиболее эффективные ASO для тестирования на животных, ASO были разработаны и протестированы в первичных гепатоцитах мыши на предмет их активности. способность подавлять уровни мРНК соответствующих мишеней.
Обработка негидролизуемым синтетическим пирофосфатом
Золедроновая кислота (200 мкг/кг) вводилась подкожно еженедельно, начиная с 2 недель до травмы и продолжая на протяжении всего исследования.
Анализ результатов и количественная оценка гетеротопической оссификации
Радиографическое изображение
Рентгенографическое изображение было выполнено, как описано.33 Вкратце, после адекватной анестезии были получены цифровые рентгенограммы (Faxitron, Тусон, Аризона, США) при экспозиции 4 с при 35 кВ. Мышей помещали в положение лежа с отведенными бедрами, что позволяло внешнее вращение ноги, помещая большеберцовую кость в воспроизводимое боковое положение.
Рентгенографический анализ и количественная оценка кальцификации мягких тканей
Степень кальцификации мягких тканей определяли количественно, как описано. 34 Через семь дней после травмы (7 DPI) были получены цифровые рентгенограммы, как описано в разделе «Методы рентгенографической визуализации». Эти изображения подверглись пост-стандартизации и полуколичественной оценке слепым наблюдателем с использованием ранее утвержденной системы оценки кальцификации мягких тканей (STiCSS).STiCSS представляет собой порядковую шкалу, основанную на проценте силуэта мягких тканей нижней конечности, содержащего рентгенологически очевидные кальцификации (0,0%; 1,1% до 25%; 2,25% до 49%; 3, 50% до 75%). ; и 4, >75%).
34 Через семь дней после травмы (7 DPI) были получены цифровые рентгенограммы, как описано в разделе «Методы рентгенографической визуализации». Эти изображения подверглись пост-стандартизации и полуколичественной оценке слепым наблюдателем с использованием ранее утвержденной системы оценки кальцификации мягких тканей (STiCSS).STiCSS представляет собой порядковую шкалу, основанную на проценте силуэта мягких тканей нижней конечности, содержащего рентгенологически очевидные кальцификации (0,0%; 1,1% до 25%; 2,25% до 49%; 3, 50% до 75%). ; и 4, >75%).
МикроКТ-визуализация ex vivo и количественный анализ HO
Было получено
мкКТ-изображения травмированных задних конечностей (µCT40; Scanco Medical AG, Бассерсдорф, Швейцария) при 55 кВп, 145 мкА, интеграции 200 мс, 500 проекций на поворот на 180 градусов, размер изотропного вокселя 20 мкм.После реконструкции был выбран интересующий объем (VOI), включающий область минерализации в заднем отделе нижней конечности. Минерализованные ткани в VOI были отделены от мягких тканей с использованием порога 132 на тысячу, фильтра шума Гаусса 0,2 и поддержки 1. Затем был рассчитан объем минералов с использованием программного обеспечения для оценки Scanco.
Минерализованные ткани в VOI были отделены от мягких тканей с использованием порога 132 на тысячу, фильтра шума Гаусса 0,2 и поддержки 1. Затем был рассчитан объем минералов с использованием программного обеспечения для оценки Scanco.
Гистологический анализ и количественная оценка
Поврежденные задние конечности фиксировали в 4% параформальдегиде на ночь.Образцы, для которых не исследовали отложение минералов, декальцинировали в 0,5 М растворе ЭДТА (pH 8,0) в течение примерно 5 дней перед обработкой. Все образцы были обработаны градуированными сериями этанола, очищены и заключены в парафин перед разрезом. Срезы размером шесть микрометров (6 мкм) были вырезаны и окрашены в соответствии с описанными методами гистологического окрашивания.
Гистологическое окрашивание
H&E
депарафинированных срезов окрашивали в растворе гематоксилина Gills 3 в течение 5 мин. Затем предметные стекла промывали водопроводной водой в течение 10 минут с последующим окрашиванием эозином. Наконец, предметные стекла обезвоживали и очищали в ксилоле перед покровным стеклом с помощью Permount.
Затем предметные стекла промывали водопроводной водой в течение 10 минут с последующим окрашиванием эозином. Наконец, предметные стекла обезвоживали и очищали в ксилоле перед покровным стеклом с помощью Permount.
Safranin-O/Fast Green Stains
Депарафинированные срезы регидратировали и помещали в свежеотфильтрованный рабочий гематоксилин Вейгерта на 10 мин. Затем предметные стекла немедленно промывали проточной водопроводной водой в течение 10 минут с последующим окрашиванием 0,1% раствором Fast Green в течение 5 минут.Затем предметные стекла быстро промывали 1% уксусной кислотой не более 10–15 с, а затем помещали в 0,1% раствор сафранина-О на 5 мин. Наконец, предметные стекла обезвоживали посредством двух смен 95% EtOH и 100% EtOH в течение 3 мин каждая и очищали двумя сменами ксилола в течение 5 мин. Затем слайды закрывали покровным стеклом Permount.
Окрашивание кислой фосфатазой, устойчивой к тартрату
Депарафинированные срезы окрашивали быстрым раствором GBC Гранат, нафтол-АС-Бифосфат, содержащим ацетат и тартрат, в течение 10 мин. Затем предметные стекла помещали в деионизированную воду, чтобы остановить реакцию, и закрывали покровным стеклом, используя водную среду для заливки.
Затем предметные стекла помещали в деионизированную воду, чтобы остановить реакцию, и закрывали покровным стеклом, используя водную среду для заливки.
Окраска фон Косса
Депарафинированные срезы окрашивали в 1%-ном водном растворе нитрата серебра в течение 60 мин под УФ-лампой. Затем срезы промывали дистиллированной водой в течение 1 мин с последующим окрашиванием Fast Green в течение 10 мин. Наконец, предметные стекла обезвоживали и очищали в ксилоле перед покровным стеклом Permount.
Иммуногистохимическое окрашивание
Депарафинированные и регидратированные образцы были обработаны для извлечения антигена путем нагревания в течение 2 мин в 0.1М лимонной кислоты и 0,1М цитрата натрия. Затем эндогенный пероксид гасили 3% H 2 O 2 в течение 15 мин. Затем предметные стекла осторожно промывали PBS (5 мин × 3), а затем блокировали на 30 мин с помощью блокирующего раствора (набор TSA; Perkin Elmer, Уолтем, Массачусетс, США). Затем предметные стекла подвергали иммуноокрашиванию с использованием крысиного антимышиного антитела F4/80 (MCA497; AbD Serotec, Роли, Северная Каролина, США) в разведении 1:100 в предоставленном блокирующем растворе в течение ночи при 4°C. Затем предметные стекла промывали промывочным буфером TRIS NaCl Tween® 20 (5 мин × 3).Конъюгированные с биотином козьи антикрысиные вторичные антитела (BD Pharmingen, 559286; BD Bioscience, Сан-Хосе, Калифорния, США) разбавляли 1:100 блокирующим буфером и инкубировали с предметными стеклами в течение 60 мин. После усиления сигнала TSA для визуализации окрашивания антител использовали систему Dako Envision+ HRP/DAB (каталожный № K4007; Dako, Carpinteria, CA, USA). Предметные стекла докрашивали гематоксилином Майера и закрывали покровным стеклом водной заливочной среды.
Затем предметные стекла подвергали иммуноокрашиванию с использованием крысиного антимышиного антитела F4/80 (MCA497; AbD Serotec, Роли, Северная Каролина, США) в разведении 1:100 в предоставленном блокирующем растворе в течение ночи при 4°C. Затем предметные стекла промывали промывочным буфером TRIS NaCl Tween® 20 (5 мин × 3).Конъюгированные с биотином козьи антикрысиные вторичные антитела (BD Pharmingen, 559286; BD Bioscience, Сан-Хосе, Калифорния, США) разбавляли 1:100 блокирующим буфером и инкубировали с предметными стеклами в течение 60 мин. После усиления сигнала TSA для визуализации окрашивания антител использовали систему Dako Envision+ HRP/DAB (каталожный № K4007; Dako, Carpinteria, CA, USA). Предметные стекла докрашивали гематоксилином Майера и закрывали покровным стеклом водной заливочной среды.
Иммунофлюоресцентное окрашивание
Предметные стекла были депарафинированы, регидратированы и обработаны для извлечения антигена, как описано в методах иммуногистохимического окрашивания. Затем предметные стекла осторожно промывали трис-буферным солевым раствором (TBS) и блокировали 5% раствором BSA, содержащим 10% козьей сыворотки. После блокировки предметные стекла подвергали иммуноокрашиванию кроличьим антителом против мышиного фибрин(огена) (1:1000)35 в течение ночи при 4°C. Затем предметные стекла промывали TBS и инкубировали с 10 мкг/мл антикроличьего антитела, меченного Alexa Fluor 647 (Life Technologies 792514; Life Technologies, Гранд-Айленд, Нью-Йорк, США) в блокирующем буфере в течение 1 часа при комнатной температуре. Наконец, предметные стекла контрастно окрашивали DAPI и закрывали покровным стеклом с использованием водного раствора для заливки (PolySciences Warrington, PA, USA).
Затем предметные стекла осторожно промывали трис-буферным солевым раствором (TBS) и блокировали 5% раствором BSA, содержащим 10% козьей сыворотки. После блокировки предметные стекла подвергали иммуноокрашиванию кроличьим антителом против мышиного фибрин(огена) (1:1000)35 в течение ночи при 4°C. Затем предметные стекла промывали TBS и инкубировали с 10 мкг/мл антикроличьего антитела, меченного Alexa Fluor 647 (Life Technologies 792514; Life Technologies, Гранд-Айленд, Нью-Йорк, США) в блокирующем буфере в течение 1 часа при комнатной температуре. Наконец, предметные стекла контрастно окрашивали DAPI и закрывали покровным стеклом с использованием водного раствора для заливки (PolySciences Warrington, PA, USA).
Гистологический количественный анализ
Измерение регенерирующих и дегенерирующих мышц с помощью H&E
Регенерацию и дегенерацию мышц оценивали с помощью световой микроскопии окрашенных H&E мышц при 200-кратном увеличении (Axio imager a1; ZEISS, Оберкохен, Германия). Регенерацию скелетных мышц оценивали путем подсчета количества мышечных волокон с центральным ядром, присутствующих в каждом отдельном поле 200×.Дегенерацию скелетных мышц оценивали путем подсчета некротических саркомеров (определяемых по гиперэозинофильной, гиалинизированной цитоплазме и отсутствию ядер). Количество регенерирующих и дегенерирующих миоцитов выражали в процентах от общего числа мышечных волокон (включая все некротические, регенерирующие и неповрежденные саркомеры в поле зрения с 200-кратным увеличением). Анализировали не менее двух мышей на группу.
Регенерацию скелетных мышц оценивали путем подсчета количества мышечных волокон с центральным ядром, присутствующих в каждом отдельном поле 200×.Дегенерацию скелетных мышц оценивали путем подсчета некротических саркомеров (определяемых по гиперэозинофильной, гиалинизированной цитоплазме и отсутствию ядер). Количество регенерирующих и дегенерирующих миоцитов выражали в процентах от общего числа мышечных волокон (включая все некротические, регенерирующие и неповрежденные саркомеры в поле зрения с 200-кратным увеличением). Анализировали не менее двух мышей на группу.
Гистологический количественный анализ Plg
+/– мышей через 28 дней после травмы
С помощью световой микроскопии окрашенных гематоксилин-эозином мышц при 200-кратном увеличении определяли наличие костеобразования (определяемого по наличию переплетенной кости) и некротизированных мышц (определяемого по наличию гиперэозинофильной, гиалинизированной цитоплазмы и отсутствию ядер). Стороны оценивались бинарным методом на наличие или отсутствие костей и наркотических мышц. Соотношение положительных образцов к соотношению отрицательных образцов затем выражали в таблице.
Стороны оценивались бинарным методом на наличие или отсутствие костей и наркотических мышц. Соотношение положительных образцов к соотношению отрицательных образцов затем выражали в таблице.
Анализ отложений фибрина(огена) методом иммунофлуоресцентного окрашивания
Каждый срез экспонировали в течение 2 с с использованием фильтра Cy5 при 200-кратном увеличении. Были получены изображения и площадь фибрин(огена), либо полного фибриногена, либо фибринового полимера, иммунолокализация была количественно определена с использованием ImageJ (Национальный институт здравоохранения, Бетесда, Мэриленд, США; http://imagej.nih.gov/ij/). Результаты выражали как количество флуоресцентных пикселей на изображение.
Измерение миграции макрофагов с помощью иммуногистохимического окрашивания
Количество анти-F4/80-позитивных клеток было количественно определено при 200-кратном увеличении с использованием количественной оценки с использованием ImageJ. Каждая лечебная группа состояла из четырех мышей. Были проанализированы отдельные поля поврежденных скелетных мышц, и результаты были усреднены для каждой экспериментальной группы.
Каждая лечебная группа состояла из четырех мышей. Были проанализированы отдельные поля поврежденных скелетных мышц, и результаты были усреднены для каждой экспериментальной группы.
Количественное определение активности плазминогена и плазмина
Уровень плазминогена
Уровни циркулирующего плазминогена определяли с помощью коммерческого сэндвич-ELISA (Molecular Innovations, Novi, MI, USA) из мышиной цитратной плазмы, полученной путем пункции сердца во время умерщвления.
Статистический анализ
Оценка кальцификации мягких тканей
Статистические сравнения между группами проводились с использованием рангового критерия Манна-Уитни (* p < 0,05; ** p < 0,001). Для дальнейшего усиления анализа была также реализована модель пропорциональных шансов со случайными эффектами с использованием программного обеспечения SAS (SAS Institute, Inc.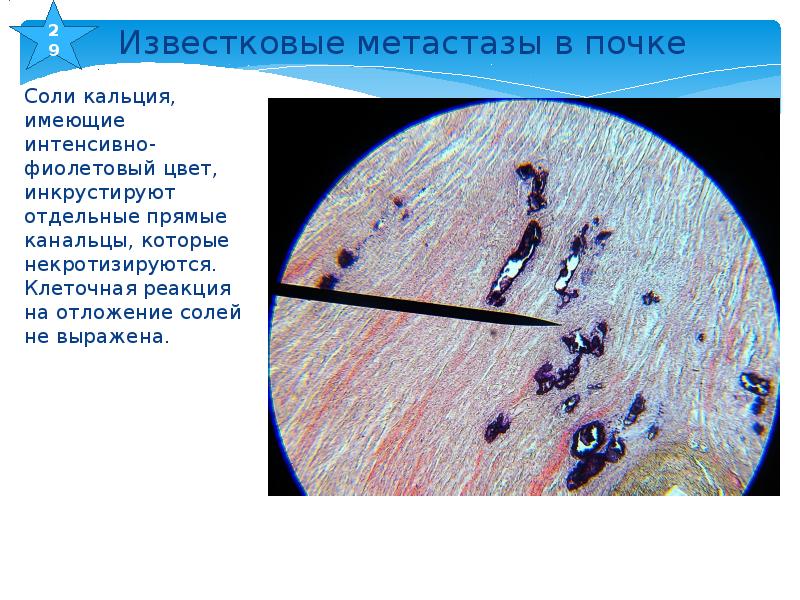 , Кэри, Северная Каролина, США). Этот тест учитывает внутрииндивидуальные корреляции между парными образцами (правая и левая ноги) от одной мыши.Однако эту модель нельзя применять, когда количество мышей в группе ограничено или когда порядковые оценки относительно однородны внутри групп. Таким образом, результаты рангового теста Манна-Уитни сообщаются для всех фигур, а модель пропорциональных шансов сообщается, когда это статистически приемлемо. Все расчеты рангового теста Манна-Уитни были выполнены с использованием GraphPad Prism версии 6 (GraphPad, La Jolla, CA, USA).
, Кэри, Северная Каролина, США). Этот тест учитывает внутрииндивидуальные корреляции между парными образцами (правая и левая ноги) от одной мыши.Однако эту модель нельзя применять, когда количество мышей в группе ограничено или когда порядковые оценки относительно однородны внутри групп. Таким образом, результаты рангового теста Манна-Уитни сообщаются для всех фигур, а модель пропорциональных шансов сообщается, когда это статистически приемлемо. Все расчеты рангового теста Манна-Уитни были выполнены с использованием GraphPad Prism версии 6 (GraphPad, La Jolla, CA, USA).
Гистологический количественный анализ
Статистическая значимость была рассчитана с использованием рангового критерия Манна-Уитни.Значения p и размеры выборки указаны в подписях к рисункам. Значимость костеобразования и некроза мышц 28 DPI анализировали с использованием двустороннего точного критерия Фишера; p < 0,05 считалось значимым.
Результаты
Плазминоген предотвращает кальцификацию мягких тканей в мышцах, генетически предрасположенных к травмам
Чтобы определить, создает ли потеря активности зимогена плазминогена или активности плазминовой протеазы остеоиндуктивное микроокружение в контексте повреждения мышц, гетерозиготный ( Plg +/– ) или гомозиготный ( Plg –/– ) дефицит плазминогена был генетически навязанный мышам с мышечной дистрофией Дюшенна ( mdx ). Мыши Mdx постоянно повреждаются мышцами из-за отсутствия белка мышечного цитоскелета, дистрофина.36 мкКТ-анализ мышей с единичным дефицитом либо плазминогена, либо дистрофина не показал кальцификации мягких тканей. Напротив, кальцификация мягких тканей наблюдалась в скелетных мышцах мышей с комбинированным дефицитом дистрофина/плазминогена (мыши mdx / Plg +/– и mdx/Plg –/– ) (рис. 1, Вспомогательный рис. 1).Степень кальцификации мягких тканей оказалась пропорциональной уровню генетического дефицита плазминогена. Эти данные указывают на то, что дефицита плазмина(огена), либо зимогена плазминогена, либо плазминовой протеазы, достаточно, чтобы вызвать кальцификацию мягких тканей в условиях хронического мышечного повреждения, даже без сопутствующего перелома кости или серьезной травмы. Гистологический анализ определил специфический тип кальцификации мягких тканей, наблюдаемый у мышей mdx / Plg +/– и mdx / Plg –/– , как дистрофическую кальцификацию некротических саркомеров (рис.
Мыши Mdx постоянно повреждаются мышцами из-за отсутствия белка мышечного цитоскелета, дистрофина.36 мкКТ-анализ мышей с единичным дефицитом либо плазминогена, либо дистрофина не показал кальцификации мягких тканей. Напротив, кальцификация мягких тканей наблюдалась в скелетных мышцах мышей с комбинированным дефицитом дистрофина/плазминогена (мыши mdx / Plg +/– и mdx/Plg –/– ) (рис. 1, Вспомогательный рис. 1).Степень кальцификации мягких тканей оказалась пропорциональной уровню генетического дефицита плазминогена. Эти данные указывают на то, что дефицита плазмина(огена), либо зимогена плазминогена, либо плазминовой протеазы, достаточно, чтобы вызвать кальцификацию мягких тканей в условиях хронического мышечного повреждения, даже без сопутствующего перелома кости или серьезной травмы. Гистологический анализ определил специфический тип кальцификации мягких тканей, наблюдаемый у мышей mdx / Plg +/– и mdx / Plg –/– , как дистрофическую кальцификацию некротических саркомеров (рис. 1). Эти данные дополняют и расширяют предыдущие данные о том, что кальцификация мягких тканей спорадически наблюдается у мышей mdx , лишенных активатора плазминогена урокиназного типа37, и подразумевают, что активность плазмина, а не зимогена плазминогена, является ключевой в предотвращении кальцификации мягких тканей в мышцах.
1). Эти данные дополняют и расширяют предыдущие данные о том, что кальцификация мягких тканей спорадически наблюдается у мышей mdx , лишенных активатора плазминогена урокиназного типа37, и подразумевают, что активность плазмина, а не зимогена плазминогена, является ключевой в предотвращении кальцификации мягких тканей в мышцах.
Длительное повреждение мышц в условиях дефицита плазминогена приводит к кальцификации мягких тканей. Полное тело реконструкцию PLG +/- , MDX , MDX / PLG / PLG +/- и MDX / PLG – / – мышей с целенаправленным увеличением Paraspinal и тазовая мускулатура. Plg +/– у мышей без мышечного повреждения не было выявлено явного кальцификации в скелетных мышцах. Точно так же у компетентных в отношении плазминогена мышей mdx , страдающих непрерывным хроническим повреждением мышц, также не было обнаружено кальцификации мышц. Напротив, mdx мышей с частичным ( mdx / Plg +/– ) или полным дефицитом плазминогена ( mdx / Plg –/– ) показали кальциноз во всех основных скелетных мышцах. группы.H & E Окрашивание PLG +/- мышей выявлена небрежный, несвязанный саркомеры с периферически расположенными ядрами, тогда как MDX , MDX / PLG +/- , и MDX / PLG – / PLG – / – мышей продемонстрировали вкрапления некротических (блестящие, гиперэозинофильные с отсутствующими ядрами) и регенерирующих (центрально расположенные ядра) саркомеров. Пятно Von Kossa не демонстрирует никаких кальцификаций в PLG +/- и MDX мышей, но отмеченные дистрофические кальцификации в некротических саркотереях MDX / PLG +/- и MDX / PLG – /– мышей.
Напротив, mdx мышей с частичным ( mdx / Plg +/– ) или полным дефицитом плазминогена ( mdx / Plg –/– ) показали кальциноз во всех основных скелетных мышцах. группы.H & E Окрашивание PLG +/- мышей выявлена небрежный, несвязанный саркомеры с периферически расположенными ядрами, тогда как MDX , MDX / PLG +/- , и MDX / PLG – / PLG – / – мышей продемонстрировали вкрапления некротических (блестящие, гиперэозинофильные с отсутствующими ядрами) и регенерирующих (центрально расположенные ядра) саркомеров. Пятно Von Kossa не демонстрирует никаких кальцификаций в PLG +/- и MDX мышей, но отмеченные дистрофические кальцификации в некротических саркотереях MDX / PLG +/- и MDX / PLG – /– мышей.
Плазминоген предотвращает кальцификацию мягких тканей в мышцах после травматического повреждения
Повреждение скелетных мышц у мышей mdx/Plg +/– является непрерывным, но неоднородным во времени и пространстве, что усложняет оценку кальцификации мягких тканей в мышцах этих мышей. Таким образом, мы оценили влияние врожденного дефицита плазминогена на локализованное острое повреждение мышц, вызванное инъекцией кардиотоксина (CTX), специально направленной на место повреждения миоцитов.38 Как и в модели непрерывного мышечного повреждения, острая мышечная травма в контексте дефицита плазминогена приводила к выраженной кальцификации мягких тканей в месте повреждения (Fig. 2 A ). Сниженные уровни циркулирующего плазминогена были подтверждены на генетически дефектных мышиных моделях (рис. 2 B ). Важно отметить, что кальцификация мягких тканей не ограничивалась мышечным повреждением, вызванным CTX, потому что аналогичные результаты наблюдались в модели повреждения ткани с размозжением (подтверждающий рисунок 2). Таким образом, врожденного дефицита плазминогена в сочетании с очаговым острым повреждением мышц достаточно, чтобы вызвать кальцификацию мягких тканей скелетных мышц.
Таким образом, мы оценили влияние врожденного дефицита плазминогена на локализованное острое повреждение мышц, вызванное инъекцией кардиотоксина (CTX), специально направленной на место повреждения миоцитов.38 Как и в модели непрерывного мышечного повреждения, острая мышечная травма в контексте дефицита плазминогена приводила к выраженной кальцификации мягких тканей в месте повреждения (Fig. 2 A ). Сниженные уровни циркулирующего плазминогена были подтверждены на генетически дефектных мышиных моделях (рис. 2 B ). Важно отметить, что кальцификация мягких тканей не ограничивалась мышечным повреждением, вызванным CTX, потому что аналогичные результаты наблюдались в модели повреждения ткани с размозжением (подтверждающий рисунок 2). Таким образом, врожденного дефицита плазминогена в сочетании с очаговым острым повреждением мышц достаточно, чтобы вызвать кальцификацию мягких тканей скелетных мышц.
Постоянный и острый дефицит плазминогена приводит к кальцификации мышц после острого мышечного повреждения.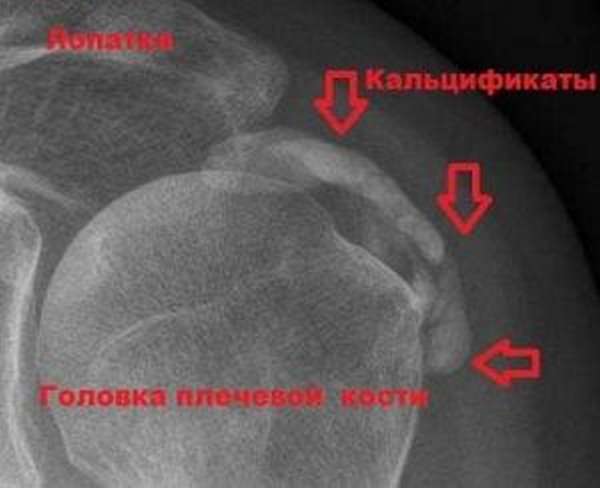 ( A ) µCT-реконструкции голени мышей WT, Plg +/– и Plg –/– через 7 дней после травмы CTX; обратите внимание на умеренную и тяжелую кальцификацию мышц у мышей с дефицитом плазминогена. ( B ) ИФА плазминогена в мышиной плазме подтвердил снижение циркулирующих уровней в соответствии с генотипом плазминогена ( n ≥ 8; ** p C ) Фармакологическое снижение уровня плазминогена у мышей дикого типа приводило к поражению плазминогеном до повреждения a Plg Низкий фенотип и заметно более выраженная кальцификация мышц 7 DPI, чем контрольные обработанные ASO мыши дикого типа, что указывает на то, что плазминоген предотвращает кальцификацию мышц независимо от метода снижения плазминогена.( D ) ELISA плазминогена в мышиной плазме подтвердил снижение циркулирующих уровней с увеличением дозы плазминогена ASO ( n ≥ 4; * p E ) Степень кальцификации мягких тканей в этих моделях оценивали с использованием простых рентгенограмм и полуколичественный метод оценки, аналогичный системе классификации Brooker для HO.
( A ) µCT-реконструкции голени мышей WT, Plg +/– и Plg –/– через 7 дней после травмы CTX; обратите внимание на умеренную и тяжелую кальцификацию мышц у мышей с дефицитом плазминогена. ( B ) ИФА плазминогена в мышиной плазме подтвердил снижение циркулирующих уровней в соответствии с генотипом плазминогена ( n ≥ 8; ** p C ) Фармакологическое снижение уровня плазминогена у мышей дикого типа приводило к поражению плазминогеном до повреждения a Plg Низкий фенотип и заметно более выраженная кальцификация мышц 7 DPI, чем контрольные обработанные ASO мыши дикого типа, что указывает на то, что плазминоген предотвращает кальцификацию мышц независимо от метода снижения плазминогена.( D ) ELISA плазминогена в мышиной плазме подтвердил снижение циркулирующих уровней с увеличением дозы плазминогена ASO ( n ≥ 4; * p E ) Степень кальцификации мягких тканей в этих моделях оценивали с использованием простых рентгенограмм и полуколичественный метод оценки, аналогичный системе классификации Brooker для HO.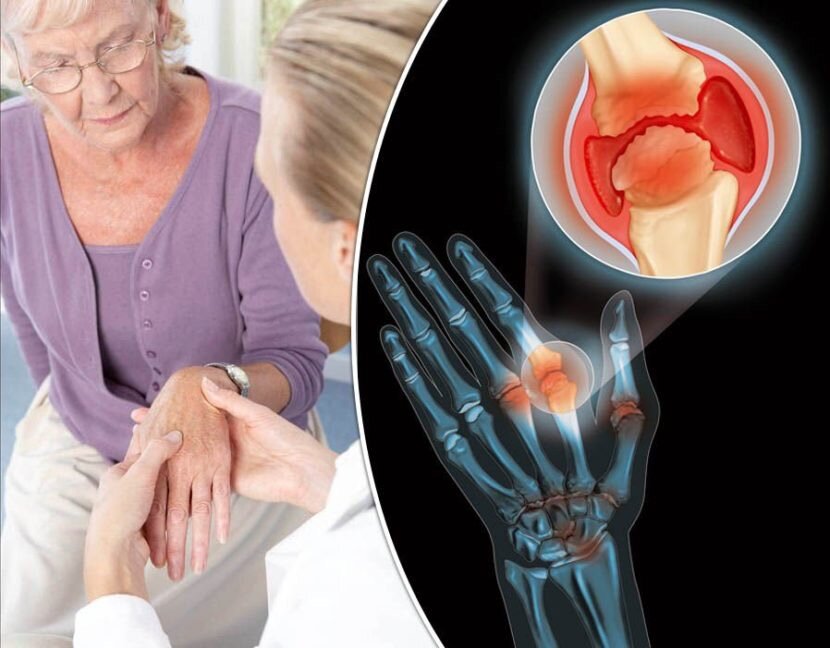 34, 76 Графическое обобщение оценок кальцификации мягких тканей в различных экспериментальных когортах на 7 DPI с использованием этого полуколичественного метода показало увеличение показателей кальцификации, измеренных с помощью STiCSS, со сниженными уровнями циркулирующего плазминогена.Обозначены медианы и межквартильные размахи ( n ≥ 9; ** p
34, 76 Графическое обобщение оценок кальцификации мягких тканей в различных экспериментальных когортах на 7 DPI с использованием этого полуколичественного метода показало увеличение показателей кальцификации, измеренных с помощью STiCSS, со сниженными уровнями циркулирующего плазминогена.Обозначены медианы и межквартильные размахи ( n ≥ 9; ** p
Поскольку врожденный дефицит плазминогена связан с ускоренной дегенерацией скелета и нарушением регенерации тканей, 29, 39 мы затем исследовали влияние временного нокдауна экспрессии плазминогена с использованием специфического антисмыслового олигонуклеотида плазминогена «gapmer» (ASO). Мыши дикого типа (WT), получавшие плазминоген ASO (Plg Low ), достигли 95% временного нокдауна мРНК печеночного плазминогена при введении дозы до и во время повреждения CTX (вспомогательная таблица 1).После CTX-индуцированного повреждения мышц у мышей Plg Low также наблюдалась кальцификация мягких тканей в скелетных мышцах, неотличимая от таковой, наблюдаемой при врожденном дефиците плазминогена (Fig.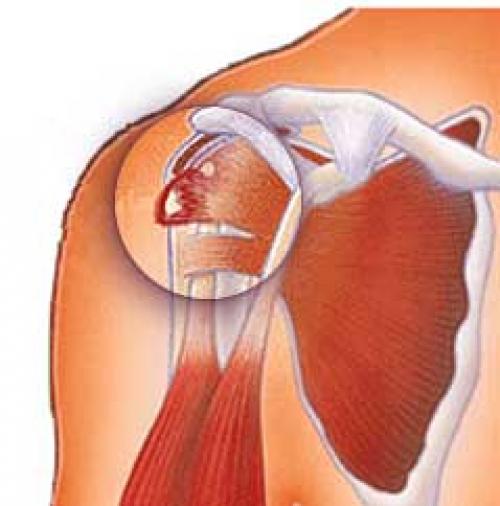 2 C ). Снижение уровней циркулирующего плазминогена было подтверждено у мышей Plg Low , получавших различные дозы плазминогена ASO (фиг. 2 D ). Тяжесть кальцификации мягких тканей после травмы увеличивалась при большем генетическом дефиците плазминогена и более высоких дозах АСО плазминогена (рис.2 E , вспомогательные таблицы 2 и 3). Вместе эти данные устанавливают, что кальцификация мягких тканей скелетных мышц у мышей с врожденным дефицитом плазминогена не является вторичной по отношению к дефектам развития и что повреждение мышц и гипоплазминогенемия являются фундаментальными детерминантами кальцификации мягких тканей в скелетных мышцах.
2 C ). Снижение уровней циркулирующего плазминогена было подтверждено у мышей Plg Low , получавших различные дозы плазминогена ASO (фиг. 2 D ). Тяжесть кальцификации мягких тканей после травмы увеличивалась при большем генетическом дефиците плазминогена и более высоких дозах АСО плазминогена (рис.2 E , вспомогательные таблицы 2 и 3). Вместе эти данные устанавливают, что кальцификация мягких тканей скелетных мышц у мышей с врожденным дефицитом плазминогена не является вторичной по отношению к дефектам развития и что повреждение мышц и гипоплазминогенемия являются фундаментальными детерминантами кальцификации мягких тканей в скелетных мышцах.
Дефицит плазминогена и повреждение мышц связаны с дистрофической кальцификацией и последующим эндохондральным окостенением
Для дальнейшего определения первоначальных патофизиологических процессов, которые приводят к кальцификации мягких тканей, мы гистологически исследовали участки СТХ-индуцированного повреждения мышц в течение острого (1-7 DPI) посттравматического периода на наличие признаков фибринолиза, некроза миоцитов, миогенеза, дистрофической кальцификации и инфильтрация макрофагами (рис. 3 А ). Мыши WT избавлялись от отложений фибрина из места повреждения быстрее, чем мыши Plg +/– , что подтверждает предположение о снижении внесосудистой активности плазмина у мышей Plg +/– (рис. 3 B , Поддерживающая рис. 3A, B). В соответствии с другими выводами о том, что плазминоген необходим для регенерации скелетных мышц, 40, 41 мы также наблюдали, что некротические миоциты сохранялись в месте повреждения в течение по крайней мере 28 дней у мышей Plg +/- .Кроме того, у мышей Plg +/– наблюдалось значительно меньшее количество регенерирующих миоцитов по сравнению с мышами WT (рис. 3 C , вспомогательный рисунок 3C–E). Окрашивание фон Косса на кальций показало, что у мышей дикого типа развился ограниченный объем дистрофической кальцификации, которая полностью резорбировалась при 5 DPI (рис. 3 D , вспомогательная рис. 3F). Напротив, у мышей Plg +/– до 14 DPI наблюдались обильные дистрофические кальцификации (рис.
3 А ). Мыши WT избавлялись от отложений фибрина из места повреждения быстрее, чем мыши Plg +/– , что подтверждает предположение о снижении внесосудистой активности плазмина у мышей Plg +/– (рис. 3 B , Поддерживающая рис. 3A, B). В соответствии с другими выводами о том, что плазминоген необходим для регенерации скелетных мышц, 40, 41 мы также наблюдали, что некротические миоциты сохранялись в месте повреждения в течение по крайней мере 28 дней у мышей Plg +/- .Кроме того, у мышей Plg +/– наблюдалось значительно меньшее количество регенерирующих миоцитов по сравнению с мышами WT (рис. 3 C , вспомогательный рисунок 3C–E). Окрашивание фон Косса на кальций показало, что у мышей дикого типа развился ограниченный объем дистрофической кальцификации, которая полностью резорбировалась при 5 DPI (рис. 3 D , вспомогательная рис. 3F). Напротив, у мышей Plg +/– до 14 DPI наблюдались обильные дистрофические кальцификации (рис.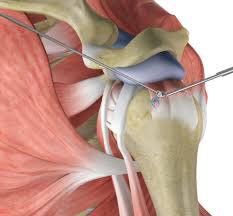 3, D , вспомогательный рис.3F). Эти данные свидетельствуют о том, что плазмин(оген) предотвращает кристаллизацию и/или способствует рассасыванию дистрофических кальцинатов в некротических мышцах в остром посттравматическом периоде. Эффективный клиренс фибрина был временно связан с инфильтрацией места повреждения моноцитами/макрофагами у мышей дикого типа. Наоборот, клиренс фибрина и инфильтрация макрофагов были снижены у мышей Plg +/– . В то время как инфильтрация F4/80-позитивных клеток достигла пика 3 DPI у мышей WT, этот приток моноцитов/макрофагов не наблюдался в поврежденных мышцах мышей Plg +/– (рис.3 E , вспомогательный рис. 3G, H). Эти результаты показывают, что дистрофические кальцификации формируются одновременно с замедленной инфильтрацией моноцитов/макрофагов и замедленной регенерацией мышц в условиях острой мышечной травмы и дефицита плазмин(огена).
3, D , вспомогательный рис.3F). Эти данные свидетельствуют о том, что плазмин(оген) предотвращает кристаллизацию и/или способствует рассасыванию дистрофических кальцинатов в некротических мышцах в остром посттравматическом периоде. Эффективный клиренс фибрина был временно связан с инфильтрацией места повреждения моноцитами/макрофагами у мышей дикого типа. Наоборот, клиренс фибрина и инфильтрация макрофагов были снижены у мышей Plg +/– . В то время как инфильтрация F4/80-позитивных клеток достигла пика 3 DPI у мышей WT, этот приток моноцитов/макрофагов не наблюдался в поврежденных мышцах мышей Plg +/– (рис.3 E , вспомогательный рис. 3G, H). Эти результаты показывают, что дистрофические кальцификации формируются одновременно с замедленной инфильтрацией моноцитов/макрофагов и замедленной регенерацией мышц в условиях острой мышечной травмы и дефицита плазмин(огена).
Частичный дефицит плазминогена и повреждение мышц приводят к плохой регенерации мышц, персистирующей дистрофической кальцификации, уменьшенной инвазии макрофагов и эндохондральной оссификации. ( A ) Схема и ключевые гистологические анализы, выполненные в раннем и позднем посттравматических периодах. ( B ) Выведение фибрина(огена) (красный) 7 DPI задерживается у Plg +/– по сравнению с мышами дикого типа (DAPI синее контрастное окрашивание). ( C ) Окраска H&E 7 DPI продемонстрировала большее количество регенерирующих миоцитов (центральных ядер) у WT по сравнению с персистирующими некротическими миоцитами и уменьшение воспалительных инфильтратов у мышей Plg +/– . ( D ) Окрашивание кальцием (Von Kossa-черный) 7 DPI выявило обильные дистрофические кальцификации у мышей Plg +/– по сравнению с WT.( E ) Иммуногистохимическое окрашивание F4/80 показало задержку инфильтрации макрофагов/моноцитов у мышей Plg +/– по сравнению с WT 3 DPI. ( F – I ) Эндохондральное окостенение у мышей Plg +/– 14 DPI: окрашивание фон Косса выявило наличие дистрофических кальцинатов, а окрашивание гематоксилином и эозином выявило сохранение некротических мышечных волокон и островков хондроидного матрикса (подтверждено сафранином).
( A ) Схема и ключевые гистологические анализы, выполненные в раннем и позднем посттравматических периодах. ( B ) Выведение фибрина(огена) (красный) 7 DPI задерживается у Plg +/– по сравнению с мышами дикого типа (DAPI синее контрастное окрашивание). ( C ) Окраска H&E 7 DPI продемонстрировала большее количество регенерирующих миоцитов (центральных ядер) у WT по сравнению с персистирующими некротическими миоцитами и уменьшение воспалительных инфильтратов у мышей Plg +/– . ( D ) Окрашивание кальцием (Von Kossa-черный) 7 DPI выявило обильные дистрофические кальцификации у мышей Plg +/– по сравнению с WT.( E ) Иммуногистохимическое окрашивание F4/80 показало задержку инфильтрации макрофагов/моноцитов у мышей Plg +/– по сравнению с WT 3 DPI. ( F – I ) Эндохондральное окостенение у мышей Plg +/– 14 DPI: окрашивание фон Косса выявило наличие дистрофических кальцинатов, а окрашивание гематоксилином и эозином выявило сохранение некротических мышечных волокон и островков хондроидного матрикса (подтверждено сафранином). -O-окрашивание [красный]), смешанный со стойкими дистрофическими кальцификациями и TRAP-позитивными клетками (фиолетовый).Эта гистологическая картина соответствует ранней эндохондральной оссификации. Эндохондральная оссификация у мышей Plg +/– 28 DPI: окрашивание фон Косса и гематоксилин-эозином показало минерализованную тканую кость с гемопоэтическим костным мозгом и окаймляющими остеобластами. Окрашивание сафранином-О подтвердило удаление хондроидного матрикса, а окрашивание TRAP выявило наличие TRAP-позитивных клеток, окружающих ткань кости. Эта гистологическая картина свидетельствует о поздней эндохондральной оссификации. ( J – M ) Регенерация мышц WT 14 и 28 DPI: окрашивание фон Косса не выявило признаков стойких кальцинатов.Окрашивание H&E показало регенерацию мышц (созревающие миоциты с интактными саркомерными структурами и центральными ядрами, которые становятся эксцентрично расположенными на 28 DPI). Непримечательное окрашивание сафранином-О и TRAP не выявило признаков эндохондральной оссификации или остеокластоподобных многоядерных гигантских клеток.
-O-окрашивание [красный]), смешанный со стойкими дистрофическими кальцификациями и TRAP-позитивными клетками (фиолетовый).Эта гистологическая картина соответствует ранней эндохондральной оссификации. Эндохондральная оссификация у мышей Plg +/– 28 DPI: окрашивание фон Косса и гематоксилин-эозином показало минерализованную тканую кость с гемопоэтическим костным мозгом и окаймляющими остеобластами. Окрашивание сафранином-О подтвердило удаление хондроидного матрикса, а окрашивание TRAP выявило наличие TRAP-позитивных клеток, окружающих ткань кости. Эта гистологическая картина свидетельствует о поздней эндохондральной оссификации. ( J – M ) Регенерация мышц WT 14 и 28 DPI: окрашивание фон Косса не выявило признаков стойких кальцинатов.Окрашивание H&E показало регенерацию мышц (созревающие миоциты с интактными саркомерными структурами и центральными ядрами, которые становятся эксцентрично расположенными на 28 DPI). Непримечательное окрашивание сафранином-О и TRAP не выявило признаков эндохондральной оссификации или остеокластоподобных многоядерных гигантских клеток. (200-кратное увеличение в B , D – M ; 400-кратное увеличение в C ). (См. вспомогательный рис. 3 для полной временной динамики и статистической оценки).
(200-кратное увеличение в B , D – M ; 400-кратное увеличение в C ). (См. вспомогательный рис. 3 для полной временной динамики и статистической оценки).
Эволюция дистрофических кальцинатов в HO также оценивалась гистологически.Дистрофические кальцификации, островки гиалинового хондроидного матрикса с хондроцитами и устойчивые к тартрату кислой фосфатазе (TRAP)-положительные многоядерные гигантские клетки были перемешаны в поврежденной мышечной ткани Plg +/– мышей 14 DPI (рис. 3 F – I , поддерживающий рис. 4A). Две недели спустя (28 DPI) в Plg +/– местах повреждения наблюдалась зрелая тканая кость с окаймляющими остеобластами и межтрабекулярным кроветворением (рис. 3 G , вспомогательный рис.4Б). Переход от примитивного хондроидного матрикса к зрелой тканой кости соответствует эндохондральной оссификации, гистологическому признаку ГО. Напротив, места повреждения у мышей WT показали созревание поперечно-полосатой мускулатуры 28 DPI, что согласуется с эффективной регенерацией ткани, без признаков ГО (42).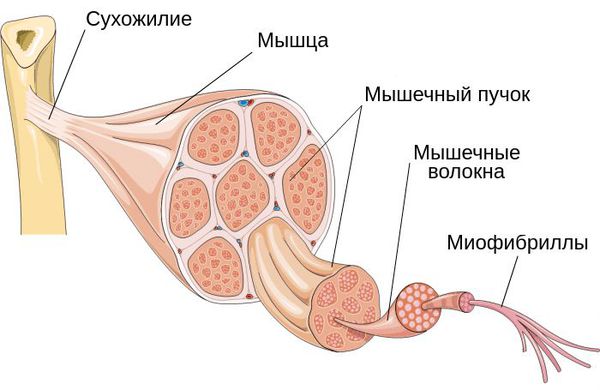 Рис. 3 J – M ). Гистологическая оценка ГО при 28 днях на дюйм у мышей Plg +/– продемонстрировала тканую кость, полностью состоящую из заднего отдела мышц и отличную от большеберцовой и малоберцовой костей (рис.4 А ). Двумерная мкКТ показала наличие круглых уплотненных кальцинатов, морфологически соответствующих НО, окруженных неорганизованными кальцификациями, соответствующими дистрофическим кальцификациям (рис. 4 B ). Обе аномальные находки отличались от коры близлежащих большеберцовой и малоберцовой костей. Эти данные указывают на то, что мышечное повреждение в условиях частичного дефицита плазминогена связано с персистирующей дистрофической кальцификацией, а персистирующая дистрофическая кальцификация связана с последующим развитием ГО в поврежденной мышце.
Рис. 3 J – M ). Гистологическая оценка ГО при 28 днях на дюйм у мышей Plg +/– продемонстрировала тканую кость, полностью состоящую из заднего отдела мышц и отличную от большеберцовой и малоберцовой костей (рис.4 А ). Двумерная мкКТ показала наличие круглых уплотненных кальцинатов, морфологически соответствующих НО, окруженных неорганизованными кальцификациями, соответствующими дистрофическим кальцификациям (рис. 4 B ). Обе аномальные находки отличались от коры близлежащих большеберцовой и малоберцовой костей. Эти данные указывают на то, что мышечное повреждение в условиях частичного дефицита плазминогена связано с персистирующей дистрофической кальцификацией, а персистирующая дистрофическая кальцификация связана с последующим развитием ГО в поврежденной мышце.
Характеристика гетеротопической оссификации после повреждения мышц и дефицита плазминогена. ( A ) Репрезентативный H&E (5-кратное увеличение) показал тканые формы кости исключительно в заднем мышечном отделе, разделенные интактной фасциальной плоскостью и отличные от большеберцовой и малоберцовой кости 28 DPI у мышей Plg +/– . Стойкие дистрофические кальцификаты разбросаны вокруг сплетенной кости в заднем мышечном отделе.Увеличение в 40 раз на том же срезе подтверждает переплетение кости с центральным кроветворением и остеобластами по краям. ( B ) Двухмерные изображения поперечного сечения и аксиальные микроКТ продемонстрировали организованные кальцификации в заднем мышечном отделе, отличные от близлежащих большеберцовой и малоберцовой костей, но морфологически соответствующие им 28 DPI у мышей Plg +/– . Рядом с организованными кальцификациями мягких тканей находятся дезорганизованные кальцификации, соответствующие персистирующим дистрофическим кальцификациям, которые гистологически окружают ГО.
Стойкие дистрофические кальцификаты разбросаны вокруг сплетенной кости в заднем мышечном отделе.Увеличение в 40 раз на том же срезе подтверждает переплетение кости с центральным кроветворением и остеобластами по краям. ( B ) Двухмерные изображения поперечного сечения и аксиальные микроКТ продемонстрировали организованные кальцификации в заднем мышечном отделе, отличные от близлежащих большеберцовой и малоберцовой костей, но морфологически соответствующие им 28 DPI у мышей Plg +/– . Рядом с организованными кальцификациями мягких тканей находятся дезорганизованные кальцификации, соответствующие персистирующим дистрофическим кальцификациям, которые гистологически окружают ГО.
Активность плазминовой протеазы ингибирует отложение дистрофических кальцинатов в поврежденных мышцах и способствует регенерации мышц
Чтобы проверить гипотезу о том, что кальцификации мягких тканей, которые формируются после травматического повреждения, конкретно связаны с дефицитом активности протеазы плазмина, а не с какой-либо другой биологической активностью, связанной со снижением зимогена плазминогена, мы экспериментально увеличили активность плазмина in vivo в условиях общего плазминогена.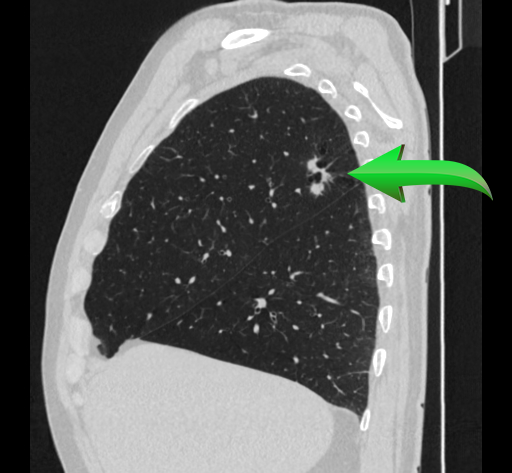 снижение ( Plg +/– мышей) путем воздействия на первичный ингибитор активности протеазы плазмина, α2-антиплазмин (α2AP).Введение α2AP ASO (α2AP ASO ) приводило к снижению уровня мРНК α2AP в печени на 85% (вспомогательная таблица 1). Лечение мышей mdx/Plg +/– с помощью α2AP ASO привело к заметному снижению кальцификации мягких тканей по сравнению с контрольной группой ASO (контроль ASO ), получавшей mdx/Plg +/– мышей ( 5 A , вспомогательная фиг. 5), что указывает на то, что активность протеазы плазмина является определяющим фактором кальцификации мягких тканей после повреждения миоцитов.
снижение ( Plg +/– мышей) путем воздействия на первичный ингибитор активности протеазы плазмина, α2-антиплазмин (α2AP).Введение α2AP ASO (α2AP ASO ) приводило к снижению уровня мРНК α2AP в печени на 85% (вспомогательная таблица 1). Лечение мышей mdx/Plg +/– с помощью α2AP ASO привело к заметному снижению кальцификации мягких тканей по сравнению с контрольной группой ASO (контроль ASO ), получавшей mdx/Plg +/– мышей ( 5 A , вспомогательная фиг. 5), что указывает на то, что активность протеазы плазмина является определяющим фактором кальцификации мягких тканей после повреждения миоцитов.
Повышение активности плазмина предотвращает кальцификацию мягких тканей и восстанавливает регенерацию мышц независимо от фибринолиза. ( A ) МикроКТ-реконструкции mdx / Plg +/– мышей, получавших α2AP ASO , показали заметное снижение кальцификации мягких тканей по сравнению с контрольными мышами mdx / 390 + 90 30332 Plg 90. 9 и 903 –/– 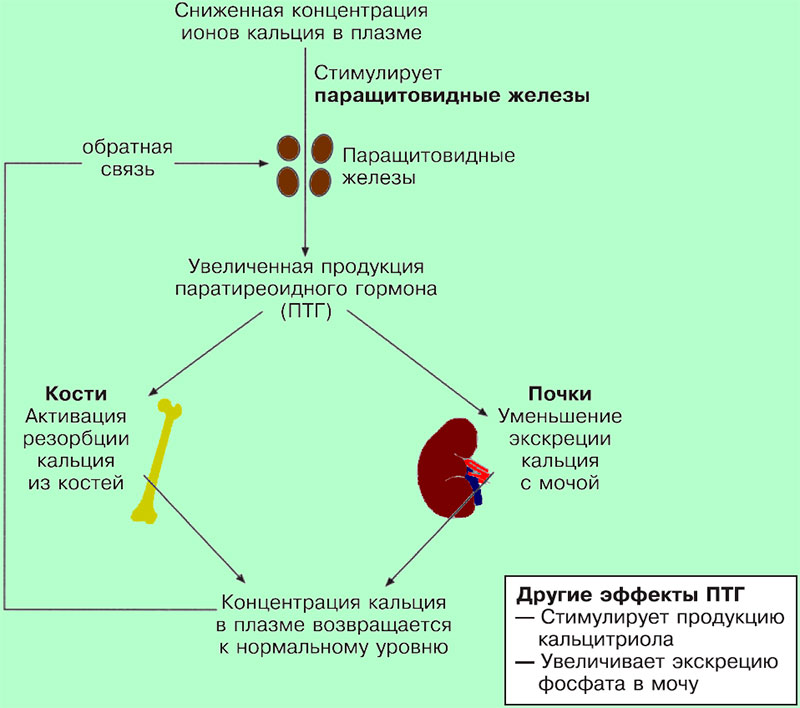 Сходное снижение кальцификации мягких тканей было отмечено у мышей Plg +/– с травмами CTX, получавших α2AP ASO , по сравнению с контролем ASO .( B ) Репрезентативные гистологические изображения мышей Plg +/– с повреждением CTX, получавших контроль ASO или α2AP ASO . α2AP ASO лечение, но не контроль ASO , стимулировал клиренс фибрин(огена) (фибрин-красный/DAPI-синий, 7 DPI), предотвращал дистрофическую кальцификацию (Von Kossa-черный, 7 DPI), восстанавливал клетки макрофагов/моноцитов инфильтрат (F4/80, 3 DPI) и восстановление мышечной регенерации (H&E, 7 DPI). Эти данные показывают, что активность протеазы плазмина необходима для ограничения дистрофической кальцификации и стимулирования регенерации мышц.( C ) РЕКТРОСТРАЦИЯ РЕКОМЕНДАЦИИ CTX CREATE PLG +/- +/- MICE, обрабатываемые управлением ASO ( PLG +/- Control ASO ) или фибриноген ASO ( PLG ( PLG ) /– Fbg Low ) выявлено выраженное образование кальцификации мягких тканей 7 DPI.
Сходное снижение кальцификации мягких тканей было отмечено у мышей Plg +/– с травмами CTX, получавших α2AP ASO , по сравнению с контролем ASO .( B ) Репрезентативные гистологические изображения мышей Plg +/– с повреждением CTX, получавших контроль ASO или α2AP ASO . α2AP ASO лечение, но не контроль ASO , стимулировал клиренс фибрин(огена) (фибрин-красный/DAPI-синий, 7 DPI), предотвращал дистрофическую кальцификацию (Von Kossa-черный, 7 DPI), восстанавливал клетки макрофагов/моноцитов инфильтрат (F4/80, 3 DPI) и восстановление мышечной регенерации (H&E, 7 DPI). Эти данные показывают, что активность протеазы плазмина необходима для ограничения дистрофической кальцификации и стимулирования регенерации мышц.( C ) РЕКТРОСТРАЦИЯ РЕКОМЕНДАЦИИ CTX CREATE PLG +/- +/- MICE, обрабатываемые управлением ASO ( PLG +/- Control ASO ) или фибриноген ASO ( PLG ( PLG ) /– Fbg Low ) выявлено выраженное образование кальцификации мягких тканей 7 DPI.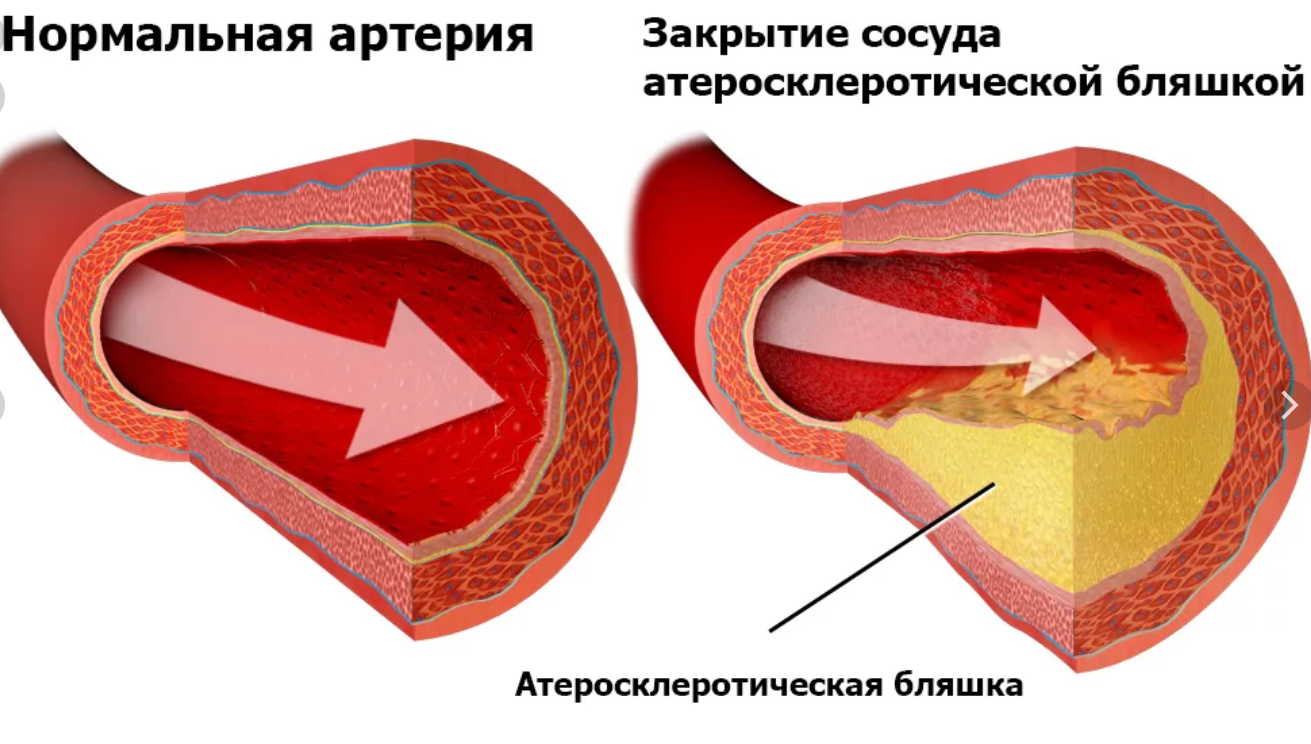 У мышей с генетическим дефицитом фибриногена также развивалась НО при лечении плазминогеном ASO ( Fbg –/– Plg Low ).( D ) Графическое представление показателей кальцификации мягких тканей с использованием STiCSS (7 DPI): истощение ингибитора плазмина α2AP (α2AP ASO ), но не фибриногена ( Plg +/– Fbg Low
У мышей с генетическим дефицитом фибриногена также развивалась НО при лечении плазминогеном ASO ( Fbg –/– Plg Low ).( D ) Графическое представление показателей кальцификации мягких тканей с использованием STiCSS (7 DPI): истощение ингибитора плазмина α2AP (α2AP ASO ), но не фибриногена ( Plg +/– Fbg Low
Чтобы получить дополнительное представление о молекулярных механизмах, с помощью которых активность протеазы плазмина предотвращает кальцификацию мягких тканей, мы изучили влияние повышения активности плазмина на микроокружение повреждения у мышей Plg +/– после острого повреждения мышц, вызванного CTX. Лечение мышей Plg +/– α2AP ASO снова привело к заметному снижению минерализации мягких тканей по сравнению с контрольным лечением ASO (контроль ASO ) (фиг.5 А ). Сравнительные исследования локального отложения фибрина после острого мышечного повреждения подтвердили, что активность плазмина была основной детерминантой клиренса фибрина (фибринолиза) (рис. 5 B , вспомогательный рисунок 6A). Гистологический анализ показал, что лечение α2AP ASO ограничивало степень дистрофической кальцификации в некротических скелетных мышцах (рис. 5 B ). Кроме того, повышенная активность плазмина способствовала инфильтрации моноцитов/макрофагов в место повреждения и значительно усиливала регенерацию миофибрилл (рис.4 B , поддерживающий рис. 6A, B). В совокупности эти данные указывают на то, что активность протеазы плазмина способствует локальному фибринолизу, инфильтрации моноцитов/макрофагов и регенерации мышц в дополнение к ингибированию отложения дистрофических кальцинатов.
Лечение мышей Plg +/– α2AP ASO снова привело к заметному снижению минерализации мягких тканей по сравнению с контрольным лечением ASO (контроль ASO ) (фиг.5 А ). Сравнительные исследования локального отложения фибрина после острого мышечного повреждения подтвердили, что активность плазмина была основной детерминантой клиренса фибрина (фибринолиза) (рис. 5 B , вспомогательный рисунок 6A). Гистологический анализ показал, что лечение α2AP ASO ограничивало степень дистрофической кальцификации в некротических скелетных мышцах (рис. 5 B ). Кроме того, повышенная активность плазмина способствовала инфильтрации моноцитов/макрофагов в место повреждения и значительно усиливала регенерацию миофибрилл (рис.4 B , поддерживающий рис. 6A, B). В совокупности эти данные указывают на то, что активность протеазы плазмина способствует локальному фибринолизу, инфильтрации моноцитов/макрофагов и регенерации мышц в дополнение к ингибированию отложения дистрофических кальцинатов.
Плазмин регулирует дистрофическую кальцификацию независимо от его канонической фибринолитической функции
Снижение активности плазмина может способствовать дистрофической кальцификации и последующему НО посредством множества молекулярных механизмов.Например, недостаточный клиренс фибрина (гипофибринолиз) может привести к стойкому фибриновому каркасу, который может действовать как зародышевый агент для преципитации фосфата кальция. ) не смог предотвратить кальцификацию мягких тканей у мышей Plg +/– после повреждения мышц (рис. 5 C , D ; вспомогательная таблица 4). Чтобы дополнительно исключить возможную роль фибрина и фибринолиза в кальцификации мягких тканей, мышей с полным генетическим нокаутом фибриногена (мыши Fbg -/- ) лечили Plg ASO .У этих мышей с дефицитом фибриногена/плазминогена наблюдалась выраженная кальцификация мягких тканей, аналогичная таковой у животных с дефицитом только плазминогена (фиг. 5 C , D ; вспомогательная таблица 4). Таким образом, предотвращение кальцификации мягких тканей после повреждения, по-видимому, зависит от функции плазмина вне расщепления фибрина.
5 C , D ; вспомогательная таблица 4). Таким образом, предотвращение кальцификации мягких тканей после повреждения, по-видимому, зависит от функции плазмина вне расщепления фибрина.
Дистрофическая кальцификация является определяющим фактором НО
Гистологический анализ места повреждения мышц в острую фазу повреждения (от 1 до 7 DPI) показал, что ранняя кальцификация мягких тканей в основном связана с образованием дистрофических кальцинатов в некротизированных миоцитах (рис.3). К 14 DPI наблюдается хондроидный матрикс с вкраплениями стойких дистрофических кальцинатов. К 28 DPI эти отложения замещаются костной тканью. Поскольку дистрофические кальцификаты предшествуют эндохондральной оссификации, пространственно чередуются с очагами хондроидного матрикса и исчезают с образованием костной ткани в месте повреждения, персистирующие дистрофические кальцификаты представляют собой потенциальный остеоиндуктивный механизм для ГО. Мы предположили, что обильная и персистирующая дистрофическая кальцификация является следствием травматического повреждения мышц на фоне недостаточной активности плазмина и действует как стимул для эндохондральной оссификации (рис.6 А ). Поскольку дистрофическая кальцификация мягких тканей ингибируется эндогенным пирофосфатом12, а также аналогами пирофосфата44, мы лечили мышей Plg +/– с повреждением мышц, вызванным CTX, негидролизуемым синтетическим аналогом пирофосфата. Лечение аналогами пирофосфата значительно уменьшало кальцификацию мягких тканей в этой модели и предотвращало НО при 28 DPI, аналогично эффектам, наблюдаемым при лечении α2AP ASO (рис. 6 B , C ; вспомогательная таблица 5).Однако существенные различия в этих моделях включали эффективное устранение некроза миоцитов и усиление регенерации мышц при лечении α2AP ASO , чего не наблюдалось у животных, получавших аналог пирофосфата (фиг. 5 C , таблица 1).
Мы предположили, что обильная и персистирующая дистрофическая кальцификация является следствием травматического повреждения мышц на фоне недостаточной активности плазмина и действует как стимул для эндохондральной оссификации (рис.6 А ). Поскольку дистрофическая кальцификация мягких тканей ингибируется эндогенным пирофосфатом12, а также аналогами пирофосфата44, мы лечили мышей Plg +/– с повреждением мышц, вызванным CTX, негидролизуемым синтетическим аналогом пирофосфата. Лечение аналогами пирофосфата значительно уменьшало кальцификацию мягких тканей в этой модели и предотвращало НО при 28 DPI, аналогично эффектам, наблюдаемым при лечении α2AP ASO (рис. 6 B , C ; вспомогательная таблица 5).Однако существенные различия в этих моделях включали эффективное устранение некроза миоцитов и усиление регенерации мышц при лечении α2AP ASO , чего не наблюдалось у животных, получавших аналог пирофосфата (фиг. 5 C , таблица 1).
Лечение пирофосфатом предотвращает кальцификацию мягких тканей HO в условиях дефицита плазмина и повреждения мышц. ( A ) Предлагаемый механизм для избранного терапевтического лечения кальцификации мягких тканей и HO, связанной с дефицитом плазмина.Истощение ингибитора плазмина α2AP (α2AP ASO ) увеличивает активность плазмина. Дополнение эндогенного пирофосфата негидролизуемыми аналогами пирофосфата обеспечивает дополнительную защиту от дистрофической кальцификации. ( B ) µCT-реконструкции и графическое представление показателей кальцификации мягких тканей с использованием STiCSS нижней конечности мышей Plg +/– , получивших предварительное лечение аналогом пирофосфата, продемонстрировали заметное снижение кальцификации мягких тканей по сравнению с контрольной группой 7 DPI .Показаны медианы и межквартильные размахи. ( n ≥ 12; ** p C ) Окрашивание H&E мышей Plg +/– , поврежденных СТХ, 28 DPI. Лечение аналогом пирофосфата ( Plg +/– аналог пирофосфата) и истощение запасов α2AP ( Plg +/– α2AP ASO ) предотвращало НО в условиях частичного дефицита плазминогена ( Plg 3–9030 ). Однако разрешение некротических мышц происходило при истощении α2AP, а не при лечении аналогами пирофосфата.(См. Таблицу 1 для статистической оценки).
Лечение аналогом пирофосфата ( Plg +/– аналог пирофосфата) и истощение запасов α2AP ( Plg +/– α2AP ASO ) предотвращало НО в условиях частичного дефицита плазминогена ( Plg 3–9030 ). Однако разрешение некротических мышц происходило при истощении α2AP, а не при лечении аналогами пирофосфата.(См. Таблицу 1 для статистической оценки).
Таблица 1.
Количественное определение гистологических срезов CTX, поврежденных Plg +/– мышей 28 DPI
| Плагин +/– | Аналог пирофосфата | α2AP АСО | |
|---|---|---|---|
| Наличие кости | 5/6 | 0/5* | 0/3* |
| Некротическая мышца | 6/6 | 5/5 | 0/3* , # |
- Лечение аналогом пирофосфата и α2AP ASO значительно снижало частоту ГО (аналог пирофосфата p = 0.
 015; α2AP ASO p = 0,017). Кроме того, истощение запасов ингибитора плазмина (α2AP ASO ), но не лечение аналогом пирофосфата, также значительно способствовало регенерации миоцитов (измеряемой по разрешению некроза; p = 0,018) по сравнению с мышами Plg +/– .
015; α2AP ASO p = 0,017). Кроме того, истощение запасов ингибитора плазмина (α2AP ASO ), но не лечение аналогом пирофосфата, также значительно способствовало регенерации миоцитов (измеряемой по разрешению некроза; p = 0,018) по сравнению с мышами Plg +/– .
Недостаточная активность плазмина вызвала ряд аберраций во время острой фазы мышечного повреждения: стойкое дистрофическое обызвествление и некротические обломки, недостаточная инфильтрация макрофагов и недостаточная регенерация миоцитов (рис.3 B – E ). ГО была отсроченным осложнением этой нарушенной микросреды заживления и могла быть результатом действия всех или части этих патогенетических факторов. Специфическое ингибирование дистрофической кальцификации аналогом пирофосфата предотвращало НО, но не способствовало удалению некротического дебриса, инфильтрации макрофагов или регенерации миоцитов. Таким образом, из всех эффектов, наблюдаемых при повреждении мышц с дефицитом плазмина, персистирующая дистрофическая кальцификация, по-видимому, является уникальным механизмом развития травматической ГО.
Таким образом, из всех эффектов, наблюдаемых при повреждении мышц с дефицитом плазмина, персистирующая дистрофическая кальцификация, по-видимому, является уникальным механизмом развития травматической ГО.
Обсуждение
Настоящие исследования раскрывают неожиданную и новую роль плазмин-опосредованного протеолиза в кальцификации мягких тканей, отличную от его классической роли в фибринолизе. В частности, критический порог активности плазмина необходим для предотвращения дистрофической кальцификации после повреждения мышц. Дистрофические кальцификации, образующиеся на фоне недостаточной активности плазмина, достаточны для того, чтобы способствовать эндохондральной оссификации и ГО.В условиях снижения циркулирующего плазминогена фармакологическое вмешательство, повышающее протеолитическую активность плазмина путем нацеливания на ключевой специфичный для плазмина ингибитор, α2AP, предотвращает НО, ограничивая дистрофическую кальцификацию. В то же время усиление активности плазмина способствует клиренсу некротизированных миоцитов и восстанавливает регенерацию мышц in vivo. Эти результаты устанавливают центральную роль плазмина и, следовательно, системы активации плазминогена в стимулировании регенерации мышц и защите от кальцификации мягких тканей в поврежденных скелетных мышцах.
Эти результаты устанавливают центральную роль плазмина и, следовательно, системы активации плазминогена в стимулировании регенерации мышц и защите от кальцификации мягких тканей в поврежденных скелетных мышцах.
Одним из основных результатов этой работы является то, что активность плазмина защищает поврежденную мышцу от персистирующей дистрофической кальцификации независимо от его канонической роли в фибринолизе. Внесосудистое отложение фибрина является универсальным признаком повреждения мышц, а накопление фибрина является ключевым патогенетическим механизмом при ряде фенотипов, связанных с дефицитом плазмина.39, 45, 46 Однако истощение фибриногена не смогло предотвратить кальцификацию мягких тканей, связанную с дефицитом плазмина, что указывает на то, что один или несколько субстратов плазмина, отличных от фибрина, защищают от кальцификации мягких тканей.Плазмин представляет собой беспорядочную сериновую протеазу, и многие другие мишени плазмина могут быть ответственны за его защитные эффекты, такие как факторы роста, белки внеклеточного матрикса или другие зимогены протеаз. 47-52 Возможно, что плазмин проявляет свое влияние косвенно через изменения гормонов. Известно, что он регулирует метаболизм кальция и/или фосфатов, таких как ПТГ, фактор роста фибробластов 23 (FGF23) или витамин D.53, 54 Кроме того, плазмин может обрабатывать мишени, которые, как известно, обладают прямой антиминерализирующей функцией.В поддержку этого недавно было продемонстрировано, что плазмин является основным активатором антиминерализующего белка остеопонтина.55, 56 В этом исследовании не проводилось количественное определение дополнительных гормонов, факторов роста или метаболитов, ранее связанных с кальцификацией мягких тканей, и это потребует дополнительных исследований. Определение субстрата (субстратов) плазмина, которые ингибируют кальцификацию мягких тканей, будет способствовать полному разрешению задействованного патогенного механизма (механизмов). Однако исключение фибринзависимого механизма обеспечивает ключевую основу для дальнейших исследований в этом отношении.
47-52 Возможно, что плазмин проявляет свое влияние косвенно через изменения гормонов. Известно, что он регулирует метаболизм кальция и/или фосфатов, таких как ПТГ, фактор роста фибробластов 23 (FGF23) или витамин D.53, 54 Кроме того, плазмин может обрабатывать мишени, которые, как известно, обладают прямой антиминерализирующей функцией.В поддержку этого недавно было продемонстрировано, что плазмин является основным активатором антиминерализующего белка остеопонтина.55, 56 В этом исследовании не проводилось количественное определение дополнительных гормонов, факторов роста или метаболитов, ранее связанных с кальцификацией мягких тканей, и это потребует дополнительных исследований. Определение субстрата (субстратов) плазмина, которые ингибируют кальцификацию мягких тканей, будет способствовать полному разрешению задействованного патогенного механизма (механизмов). Однако исключение фибринзависимого механизма обеспечивает ключевую основу для дальнейших исследований в этом отношении.
Идентификация плазмина как ключевого детерминанта ГО, защищающего от персистирующей дистрофической кальцификации, переопределяет понимание ГО, связанного с травмой. Кроме того, он определяет новые терапевтические мишени для предотвращения ГО. Дистрофические кальцификации наблюдались у мышей, компетентных в отношении плазмина, после травмы. Однако кальцификаты были гораздо менее заметными, чем у мышей с дефицитом плазмина, и в конечном итоге резорбировались во время восстановления тканей. Резорбция дистрофических кальцификатов и быстрый клиренс некротических миоцитов у плазмин-компетентных мышей коррелировали с инфильтрацией места повреждения моноцитами/макрофагами.Примечательно, что моноциты и макрофаги способны резорбировать нетрабекулярную кальцифицированную ткань как непосредственно за счет фагоцитоза, так и косвенно за счет секреции карбоангидразы II и остеопонтина.56, 57 Предыдущие исследования также подтвердили, что плазмин может способствовать миграции моноцитов/макрофагов, а также фагоцитозу.49 , 58 Когда макрофаги не могут поглотить свою цель, они проявляют так называемый «расстроенный фагоцитоз», который, как предполагается, вызывает слияние макрофагов и дифференцировку, подобную остеокластам.59, 60 TRAP-положительное окрашивание было связано с многоядерными гигантскими клетками в дополнение к остеокластам, 61-64, и мы наблюдали TRAP-положительные клетки, смешанные с персистирующими дистрофическими кальцификациями, предшествующими образованию тканых костей у мышей с дефицитом плазмина. Наши данные свидетельствуют о том, что снижение активности плазмина изменяет критическую, зависимую от макрофагов резорбцию дистрофических кальцинатов, а появление TRAP-позитивных клеток может указывать на компенсаторное слияние измененной функции макрофагов.Кроме того, дистрофические кальцификации формировались быстрее и были более обильными после травмы у мышей с дефицитом плазмина, что указывает на то, что в дополнение к стимуляции резорбции активность плазмина также предотвращает начальное отложение дистрофических кальцинатов. Таким образом, мы предполагаем, что плазмин защищает от HO, предотвращая образование дистрофических кальцинатов в микроокружении поврежденных мышц, а также активируя механизмы, зависящие от макрофагов/моноцитов, для рассасывания дистрофических кальцинатов.
Кроме того, он определяет новые терапевтические мишени для предотвращения ГО. Дистрофические кальцификации наблюдались у мышей, компетентных в отношении плазмина, после травмы. Однако кальцификаты были гораздо менее заметными, чем у мышей с дефицитом плазмина, и в конечном итоге резорбировались во время восстановления тканей. Резорбция дистрофических кальцификатов и быстрый клиренс некротических миоцитов у плазмин-компетентных мышей коррелировали с инфильтрацией места повреждения моноцитами/макрофагами.Примечательно, что моноциты и макрофаги способны резорбировать нетрабекулярную кальцифицированную ткань как непосредственно за счет фагоцитоза, так и косвенно за счет секреции карбоангидразы II и остеопонтина.56, 57 Предыдущие исследования также подтвердили, что плазмин может способствовать миграции моноцитов/макрофагов, а также фагоцитозу.49 , 58 Когда макрофаги не могут поглотить свою цель, они проявляют так называемый «расстроенный фагоцитоз», который, как предполагается, вызывает слияние макрофагов и дифференцировку, подобную остеокластам.59, 60 TRAP-положительное окрашивание было связано с многоядерными гигантскими клетками в дополнение к остеокластам, 61-64, и мы наблюдали TRAP-положительные клетки, смешанные с персистирующими дистрофическими кальцификациями, предшествующими образованию тканых костей у мышей с дефицитом плазмина. Наши данные свидетельствуют о том, что снижение активности плазмина изменяет критическую, зависимую от макрофагов резорбцию дистрофических кальцинатов, а появление TRAP-позитивных клеток может указывать на компенсаторное слияние измененной функции макрофагов.Кроме того, дистрофические кальцификации формировались быстрее и были более обильными после травмы у мышей с дефицитом плазмина, что указывает на то, что в дополнение к стимуляции резорбции активность плазмина также предотвращает начальное отложение дистрофических кальцинатов. Таким образом, мы предполагаем, что плазмин защищает от HO, предотвращая образование дистрофических кальцинатов в микроокружении поврежденных мышц, а также активируя механизмы, зависящие от макрофагов/моноцитов, для рассасывания дистрофических кальцинатов.
Без плазмина дистрофические кальцификации сохранялись в месте повреждения и стимулировали эндохондральную оссификацию. Важно отметить, что эти результаты были получены без экспериментальных манипуляций с сигнальным путем BMP. Поскольку экспрессия BMP необходима для всех процессов эндохондрального окостенения (биологических или патологических), передача сигналов BMP, вероятно, также активируется в этой модели HO. Однако мы постулируем, что его эффект будет заключаться в содействии окостенению после инициирующих эффектов снижения активности плазмина и дистрофической кальцификации, а не в первичном патогенетическом механизме образования кальцификации мягких тканей.Предыдущие исследования и полученные в них результаты доказывают, что остеоиндуктивная природа дистрофических кальцинатов, сходная с таковой в кальцифицированном хряще, врожденно способствует проникновению мезенхимальных стволовых клеток, предназначенных для регенерации миоцитов, вместо того, чтобы подвергаться остеогенной дифференцировке. В поддержку этой теории было показано, что мышечные мезенхимальные стволовые клетки в микроокружении повреждения в первую очередь способствуют образованию ГО. в моделях повреждения мышц с дефицитом плазминогена.Эти данные свидетельствуют о том, что фармакологические стратегии, направленные на активность плазмина, вместо системного ингибирования путей регенерации кости могут эффективно предотвращать ГО.
Связывание плазмина с независимым от фибринолиза предотвращением и резорбцией дистрофических кальцинатов коренным образом меняет существующую парадигму кальцификации мягких тканей за пределами HO скелетных мышц. Настоящие результаты поразительно напоминают исследования, демонстрирующие независимый от фибрина механизм стойкого центрилобулярного некроза печени и дистрофической кальцификации у мышей с дефицитом плазминогена после повреждения печени, вызванного гепатоксином.31 Кроме того, эти данные свидетельствуют о том, что сходные молекулярные механизмы, включающие хроническое повреждение тканей, активность плазмина и кальцификацию мягких тканей, встречаются и при других заболеваниях, таких как атеросклероз и кальциноз почек. Например, повышенная экспрессия ингибитора активатора плазминогена-1 (PAI-1) в атеросклеротических сосудах человека соответствует тяжести атеросклероза, а дефицит PAI-1 защищает от атеросклероза у мышей с генетическим нокаутом по аполипопротеину E (ApoE) [66, 67]. PAI-1 для изменения уровней кальцификации мягких тканей первоначально интерпретировался как потенциально независимый от его ингибирования активации плазмина.Однако, учитывая наши данные, связывающие активность плазмина с дистрофической кальцификацией мягких тканей, мы предполагаем, что сверхэкспрессия PAI-1 снижает опосредованную плазмином защиту от отложения кальция. Поддерживая эту интерпретацию, Xiao et al.68 показали, что дефицит плазминогена усугубляет атеросклероз у мышей с нокаутом ApoE. Дополнительный пример, связывающий активность плазмина и кальцинозное заболевание, можно найти в почках, где дефицит Klotho, белка, необходимого для FGF23-опосредованной экскреции фосфата в дистальных канальцах, приводит к сверхэкспрессии PAI-1 и обширной кальцификации почек.Примечательно, что почечная кальцификация, вызванная дефицитом Клото, может быть улучшена за счет снижения уровня PAI-1. Мы предполагаем, что дистрофическая кальцификация является предсказуемым патофизиологическим исходом острого или хронического повреждения, когда события (например, чрезмерное системное потребление плазминогена) приводят к недостаточной локальной активности плазмина. .
Хотя дефицит плазминогена вызывал стойкую дистрофическую кальцификацию как в моделях острого, так и в хроническом мышечном повреждении, только в модели острого повреждения впоследствии развилась ГО.Эта дихотомия дает возможность для будущей оценки специфических факторов в различных микросредах повреждения, которые либо предотвращают, либо способствуют переходу от дистрофической кальцификации к ГО. Мы предполагаем, что несоответствие в развитии ГО в этих разных моделях связано с тяжестью повреждения тканей и более интенсивной или продолжительной тканевой гипоксией в модели острого повреждения CTX по сравнению с моделью хронического повреждения mdx , поскольку гипоксия увеличивает частоту ГО через продвижение хрящевых интермедиатов для эндохондральной оссификации.11
Наши результаты также вносят поправки в давнее и преобладающее мнение о том, что ГО в основном развивается в первую очередь из-за аберрантной активации «усиления функции» сигнальных путей фактора роста, связанных с костями. Вместо этого мы предлагаем механизм «потери функции»: ГО может возникнуть в результате дефицита защитных эффектов плазмина, которые обычно служат для ограничения отложения дистрофических кальцинатов в поврежденной мышечной ткани. Имеются также существенные клинические данные о том, что гипофибринолиз возникает при травматических повреждениях, связанных с ГО, включая ожоги и повреждения спинного мозга. (19–22) Необходимы дальнейшие исследования для установления клинической физиологии приобретенного дефицита плазмина как при острых травматических повреждениях, связанных с ГО, так и при хроническом воспалении, связанном с кальцинозом мягких тканей (атеросклероз, опухолевый кальциноз, почечный кальциноз и др.) . Тем не менее, эти результаты имеют важное значение для пациентов с риском травма-индуцированной ГО. Существующие и предлагаемые методы лечения ГО, включая противовоспалительные средства, аналоги пирофосфата, ионизирующую лучевую терапию, антагонисты BMP и агонисты рецепторов ретиноевой кислоты, все имеют нежелательный побочный эффект нарушения системного гомеостаза кости и ингибирования восстановления переломов.70-75 В отличие от этих текущих или предлагаемых методов лечения, мы ранее сообщали, что активность плазмина необходима для восстановления переломов и гомеостаза кости. активность плазмина. Тем не менее, наши экспериментальные исследования, предотвращающие ГО путем увеличения активности плазмина путем нацеливания на α2AP in vivo, представляют собой первую фармакологическую стратегию, способную подавлять ГО и стимулировать регенерацию мышц без ущерба для здоровья и регенерации костей.
Раскрытие информации
Все авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана The Fighting Duchenne Foundation, National Institutes of Health, 5T32 HL007751, 5T32 GM007628, 1R03AR065762 – 01A1, S10RR027631, 3T32DK007061-41S1; Клинический и трансляционный грант Института Вандербильта VR6261; Ассоциация ортопедической травмы, резидентский грант; Медицинский институт Говарда Хьюза, медицинская стипендия; Ортопедический институт Вандербильта, исследовательский грант; и Фонд Кейтлин Лавджой.Мы благодарим: доктора Меган Миньеми за ее вклад в финансирование этого исследования; д-ру Ли Лимберду, д-ру Перри Шенекеру, д-ру Стивену Гуди и д-ру Мэтью Лютеру за их помощь в подготовке рукописи; д-р Джеффри Найман и д-р Даниэль Перриен за их помощь в микрокомпьютерной томографии; Грегу Хоули за техническую помощь в проведении экспериментов и подготовке фигур; д-ру Ingrid Verhamme и д-ру Paul Bock за их помощь в измерении активности плазмина; и Сюлей Лю за ее статистические услуги.
Роли авторов: Концепция и дизайн исследования: NAM, MY, CEB, SNM, RCI, ASR, AFM, GB, TY, AO, JVB, HSS и JGS; Сбор данных: NAM, MY, SNM, RCI, WKO, CSW, ASR, AFM, GB и JGS; Анализ данных: NAM, MY, CEB, SNM, WKO и JGS; Составление рукописи: NAM, CEB, SNM, WKO, JLD, MJF, JMC и JGS; Критическая редакция: NAM, CEB, SNM, TY, AO, ASR, AFM, GB, JVB, HSS, JLD, MJF, JMC и JGS.
Дополнительную вспомогательную информацию можно найти в онлайн-версии этой статьи.
| Имя файла | Описание |
|---|---|
| jbmr2973-sup-0001-SupFig-S1.pdf5,2 МБ | Поддержка дополнительных фигур. |
| jbmr2973-sup-0002-SupLeg-S1.docx41,7 КБ | Поддержка дополнительных легенд фигурок. |
| jbmr2973-sup-0003-SupTable-S1.docx23,8 КБ | Поддержка дополнительной таблицы S1. |
| jbmr2973-sup-0004-SupTable-S2.docx16,7 КБ | Поддержка дополнительной таблицы S2. |
| jbmr2973-sup-0005-SupTable-S3.docx15,7 КБ | Поддержка дополнительной таблицы S3. |
| jbmr2973-sup-0006-SupTable-S4.docx20,9 КБ | Поддержка дополнительной таблицы S4. |
| jbmr2973-sup-0007-SupTable-S5.docx17,2 КБ | Поддержка дополнительной таблицы S5. |
Обратите внимание: Издатель не несет ответственности за содержание или функциональность любой вспомогательной информации, предоставленной авторами.Любые вопросы (кроме отсутствующего содержания) следует направлять соответствующему автору статьи.
Каталожные номера
- 1
Кови, округ Колумбия.
Боевая ортопедия: взгляд из окопа.
J Am Acad Orthop Surg .
2006 г.;
14: С10– 7. - 2
Гаевский Д,
Гранвиль Р.Программа ухода за пациентами с ампутированными конечностями вооруженных сил США.
J Am Acad Orthop Surg .
2006 г.;
14: С183– 7. - 3
Нельсон Э.Р.,
Вонг Фольксваген,
Кребсбах PH,
Ван СК,
Леви Б.
Гетеротопическая оссификация после ожоговой травмы: роль стволовых клеток.
J Burn Care Res .
2012 г.;
33: 463–70. - 4
Форсберг Дж.А.,
Пепек Дж.М.,
Вагнер С. и соавт.Гетеротопическая оссификация при высокоэнергетических ранениях конечностей военного времени: распространенность и факторы риска.
J Bone Joint Surg Am .
2009 г.;
91: 1084– 91. - 5
Урист МР.
Кость: формирование путем аутоиндукции.
Наука .
1965 год;
150(3698): 893–9. - 6
Урист МР,
Микульский А,
Литце А.Солюбилизированный и несолюбилизированный костный морфогенетический белок.
Proc Natl Acad Sci U S A .
1979 год;
76(4): 1828–32. - 7
Возни Дж. М.,
Розен В,
Селеста А.Дж. и др.
Новые регуляторы костеобразования: молекулярные клоны и активности.
Наука .
1988 год;
242(4885): 1528–34. - 8
Каплан Ф.С.,
Ле Меррер М,
Глейзер Д.Л. и соавт.Прогрессирующая оссифицирующая фибродисплазия.
Best Pract Res Clin Rheumatol .
2008 г.;
22(1): 191–205. - 9
Митчелл Э.Дж.,
Кантер Дж,
Норрис П,
Дженкинс Дж,
Моррис Дж.
Генетика гетеротопической оссификации: понимание пути ремоделирования кости.
J Ортопедическая травма .
2010 г.;
24(9): 530–3. - 10
Чалмерс Дж.,
серый ДХ,
Раш Дж.Наблюдения за индукцией кости в мягких тканях.
J Bone Joint Surg Br .
1975 год;
57: 36–45. - 11
Агарвал С,
Лодер С,
Браунли С. и др.
Ингибирование Hif1alpha предотвращает как индуцированную травмой, так и генетическую гетеротопическую оссификацию.
Proc Natl Acad Sci U S A .
2016;
113(3): E338–47. - 12
Флейш Х,
Нейман ВФ.Механизмы кальцификации: роль коллагена, полифосфатов и фосфатазы.
Am J Physiol .
1961 год;
200: 1296–300. - 13
Гиллман Т,
Грант РА,
Хаторн М.
Гистохимические и химические исследования поражений сосудов, вызванных кальциферолом.
BrJ Exp Pathol .
1960 г.;
41: 1– 18. - 14
Флейш Х,
Маерки Дж,
Рассел РГ.Влияние пирофосфата на растворение гидроксиапатита и его возможное значение в гомеостазе кальция.
Proc Soc Exp Biol Med .
1966 год;
122(2): 317–20. - 15
Гудман РМ,
Смит Э.В.,
Патон Д. и соавт.
Эластичная псевдоксантома: клиническое и гистопатологическое исследование.
Медицина (Балтимор) .
1963 год;
42: 297–334. - 16
Юань Х,
Ян З,
Ли Ю,
Чжан Х,
Де Брюйн Д.Д.,
Де Грот К.Остеоиндукция кальций-фосфатными биоматериалами.
J Mater Sci Mater Med .
1998 год;
9(12): 723–6. - 17
Рипамонти У.
Остеоиндукция пористого гидроксиапатита, имплантированного в гетеротопические участки различных моделей животных.
Биоматериалы .
1996 год;
17(1): 31–5. - 18
Ле Нихуаннен Д,
Дакулси Г,
Саффарзаде А. и соавт.Эктопическое костеобразование микропористыми керамическими частицами фосфата кальция в мышцах овец.
Кость .
2005 г.;
36(6): 1086–93. - 19
Коэн М.Дж.,
Звоните М,
Нельсон М. и др.
Критическая роль активированного протеина С в ранней коагулопатии и более поздней органной недостаточности, инфекциях и смерти у пациентов с травмами.
Энн Сург .
2012 г.;
255(2): 379–85. - 20
Эндерсон БЛ,
Чен Дж.П.,
Робинсон Р,
Молл К.И.Фибринолиз у больных с сочетанной травмой.
J Травма .
1991 год;
31(9): 1240–6. - 21
Соренсен СП.
Уровни фибринолитических активаторов и ингибиторов в плазме после тяжелой травмы.
Фибринолиз сгустков крови .
1994 год;
5(1): 43–9. - 22
Зуауи Буджелтиа К.,
Пьягнерелли М,
Брохи Д. и др.Взаимосвязь между СРБ и гипофибринолизом: возможен ли этот механизм для объяснения связи между СРБ и исходом у пациентов в критическом состоянии?
Тромб Дж .
2004 г.;
2(1): 7. - 23
Дерюгина Е.И.,
Куигли Дж.П.
Ремоделирование клеточной поверхности плазмином: новая функция старого фермента.
Дж Биомед Биотехнолог .
2012 г.;
2012: 564259. - 24
Гу Х,
Яо Ю,
Ченг Р. и др.Плазминоген К5 активирует путь митохондриального апоптоза в эндотелиальных клетках, регулируя внутриклеточное распределение Bak и Bcl-x(L).
Апоптоз .
2011 г.;
16(8): 846–55. - 25
Кримерс Э,
Клетьенс Дж,
Смитс Дж. и др.
Нарушение гена плазминогена у мышей прекращает заживление ран после инфаркта миокарда.
Ам Дж. Патол .
2000 г.;
156 (6): 1865–73. - 26
Гонг Ю,
Чжао Ю,
Ли Ю,
Фан Ю,
Гувер-Плау Дж.Плазминоген регулирует восстановление сердца после инфаркта миокарда за счет своей неканонической функции по возвращению стволовых клеток в пораженное инфарктом сердце.
J Am Coll Cardiol .
2014;
63 (25 часть А): 2862–72. - 27
Плоплис В.А.,
Кармели П,
Вазирзаде С. и др.
Влияние нарушения гена плазминогена на тромбоз, рост и здоровье мышей.
Тираж .1995 год;
92(9): 2585–93. - 28
Дрикслер Т.А.,
Фогтен Дж. М.,
Геббинк М.Ф.,
Кармели П,
Воест Э.Э.,
Борел Ринкс IH.
Плазминоген опосредует регенерацию печени и ангиогенез после экспериментальной резекции печени.
Бр Дж Сург .
2003 г.;
90(11): 1384–90. - 29
Ромер Дж,
Бугге Т.Х.,
Пайк С. и др.Нарушение заживления ран у мышей с нарушенным геном плазминогена.
Nat Med .
1996 год;
2(3): 287–92. - 30
Юаса М,
Миньеми Н.А.,
Найман Дж. С. и др.
Фибринолиз необходим для заживления переломов и предотвращения гетеротопической оссификации.
Дж Клин Инвест .
2015 г.;
125(8): 3117–31. - 31
Безерра Дж.А.,
Бугге Т.Х.,
Мелин-Алдана Х. и др.Дефицит плазминогена приводит к нарушению ремоделирования после токсического поражения печени.
Proc Natl Acad Sci U S A .
1999 г.;
96(26): 15143–8. - 32
Бейкер БФ,
Лот СС,
Кондон Т.П. и др.
2′-О-(2-метокси)этил-модифицированные олигонуклеотиды против молекулы межклеточной адгезии 1 (ICAM-1) селективно повышают уровень мРНК ICAM-1 и ингибируют образование комплекса инициации трансляции ICAM-1 в эндотелиальных клетках пупочной вены человека. . J Биол Хим .
1997 год;
272(18): 11994–2000. - 33
Коул Х.А.,
Юаса М,
Хоули Г,
Кейтс Дж. М.,
Найман Дж.С.,
Шёнекер Дж.Г.
Дифференциальное развитие дистального и проксимального эпифиза и тела бедренной кости у мышей.
Кость .
2013;
52(1): 337–46. - 34
Мур С.Н.,
Хоули ГД,
Смит Э.Н. и соавт.Валидация основанной на рентгенографии количественной оценки, предназначенной для продольного мониторинга кальцификации мягких тканей в скелетных мышцах.
PLoS Один .
2016;
11(7): e0159624. - 35
Флик МЮ,
Ду Х,
Деген Дж.Л.
Взаимодействия фибрин(оген)-альфа М бета 2 регулируют функцию лейкоцитов и врожденный иммунитет in vivo.
Exp Biol Med .
2004 г.;
229(11): 1105–10. - 36
Деконинк Н,
Дэн Б.
Патофизиология мышечной дистрофии Дюшенна: современные гипотезы.
Педиатр Нейрол .
2007 г.;
36(1): 1–7. - 37
Суэвес М,
Видаль Б,
Серрано А.Л. и соавт.
Дефицит uPA усугубляет мышечную дистрофию у мышей MDX.
J Cell Biol .2007 г.;
178(6): 1039–51. - 38
Лоунев В.Ю.,
Рамачандран Р,
Вощина М.Н. и соавт.
Идентификация клеток-предшественников, участвующих в гетеротопическом скелетогенезе.
J Bone Joint Surg Am .
2009 г.;
91(3): 652–63. - 39
Коул Х.А.,
Оба Т,
Найман Дж. С. и др.
Накопление фибрина вторично по отношению к потере плазмин-опосредованного фибринолиза вызывает воспалительный остеопороз у мышей. Артрит Ревматол .
2014;
66(8): 2222–33. - 40
Луис Ф,
Рома Ж,
Суэвес М. и соавт.
Зависимая от урокиназы активация плазминогена необходима для эффективной регенерации скелетных мышц in vivo.
Кровь .
2001 г.;
97(6): 1703–11. - 41
Суэвес М,
Лопес-Алемани Р.,
Луис Ф. и др.Активность плазмина необходима для миогенеза in vitro и регенерации скелетных мышц in vivo.
Кровь .
2002 г.;
99(8): 2835–44. - 42
Урист МР,
ДеЛанж Р.Дж.,
Финерман Г.А.
Дифференцировка костных клеток и факторы роста.
Наука .
1983 год;
220: 680–6. - 43
Дуглас Т.Е.,
Гаслинг В.,
Деклерк Х.А. и соавт.Ферментативно индуцированная минерализация богатого тромбоцитами фибрина.
J Biomed Mater Res A .
2012 г.;
100(5): 1335–46. - 44
Рассел РГ.
Бисфосфонаты: первые 40 лет.
Кость .
2011 г.;
49(1): 2–19. - 45
Бугге Т.Х.,
Комбринк КВ,
Флик МЮ,
Догерти CC,
Дантон МДж,
Деген Дж.Л.Потеря фибриногена спасает мышей от плейотропных эффектов дефицита плазминогена.
Сотовый .
1996 год;
87(4): 709–19. - 46
Видаль Б,
Ардит Э,
Суэвес М. и соавт.
Облегчение мышечной дистрофии Дюшенна у мышей mdx за счет устранения связанного с матриксом фибринового воспаления, связанного с интегриновым рецептором лейкоцитов альфа-Мбета2.
Хум Мол Жене .2012 г.;
21(9): 1989–2004 гг. - 47
Канно Ю,
Хираде К,
Исисаки А. и др.
Недостаток альфа2-антиплазмина улучшает заживление кожных ран за счет избыточного высвобождения сосудистого эндотелиального фактора роста, индуцированного ангиогенезом в раневых поражениях.
Дж Тромб Хемост .
2006 г.;
4(7): 1602–10. - 48
Халил Н,
Корн С,
Уитмен С,
Яцишин Х.Плазмин регулирует активацию ассоциированного с клетками латентного TGF-бета 1, секретируемого альвеолярными макрофагами крысы после повреждения блеомицином in vivo.
Am J Respir Cell Mol Biol .
1996 год;
15(2): 252–9. - 49
Плоплис В.А.,
французский ЭЛ,
Кармели П,
Коллен Д,
Плуг ЭФ.
Дефицит плазминогена по-разному влияет на рекрутирование популяций воспалительных клеток у мышей. Кровь .
1998 год;
91(6): 2005–9. - 50
Рот Д,
Пекарек М,
Полссон М. и соавт.
Плазмин модулирует ангиогенез, опосредованный фактором роста эндотелия сосудов-А, во время заживления ран.
Ам Дж. Патол .
2006 г.;
168(2): 670–84. - 51
Шенекер Дж,
Миньеми Н,
Штутц С. и др.Лауреат премии молодых исследователей 2010 года: терапевтический апротинин стимулирует пролиферацию остеобластов, но ингибирует дифференцировку и минерализацию костного матрикса.
Позвоночник .
2010 г.;
35(9): 1008–16. - 52
Йи Дж.А.,
Ян Л,
Домингес Дж.С.,
Аллан Э.Х.,
Мартин ТДж.
Плазминоген-зависимая активация латентного трансформирующего фактора роста бета (TGF бета) при выращивании культур остеобластоподобных клеток. J Cell Physiol .
1993 год;
157(3): 528–34. - 53
Набэсима Ю.
[Открытие альфа-Klotho и FGF23 открыло новое понимание гомеостаза кальция и фосфата].
Клин Кальций .
2008 г.;
18(7): 923–34. Японский - 54
Набэсима Ю.
[Регулирование гомеостаза кальция альфа-Клото и FGF23]. Клин Кальций .
2010 г.;
20(11): 1677–85. Японец. - 55
Кристенсен Б,
Шак Л,
Кланинг Э,
Соренсен Э.С.
Остеопонтин расщепляется во многих местах, близких к его интегрин-связывающим мотивам в молоке, и является новым субстратом для плазмина и катепсина D.
J Биол Хим .
2010 г.;
285(11): 7929–37. - 56
Стейц С.А.,
Шпеер М.Ю.,
McKee MD и соавт.Остеопонтин ингибирует отложение минералов и способствует регрессу эктопической кальцификации.
Ам Дж. Патол .
2002 г.;
161(6): 2035–46. - 57
Херрманн М,
Шафер С,
Хейсс А. и др.
Клиренс частиц кальципротеина, содержащих фетуин-А, опосредован рецептором-поглотителем-А.
Circ Res .
2012 г.;
111(5): 575–84. - 58
Дас Р,
Ганапати С,
Поселок М,
Плуг ЭФ.Плазминоген способствует фагоцитозу макрофагов у мышей.
Кровь .
2014;
124(5): 679–88. - 59
Хенсон ПМ.
Иммунологическое высвобождение компонентов из нейтрофильных лейкоцитов. II. Механизмы высвобождения во время фагоцитоза и адгезия к нефагоцитозным поверхностям.
Дж Иммунол .
1971 год;
107(6): 1547–57. - 60
МакНалли АК,
Андерсон Дж.М.Слияние макрофагов и многоядерные гигантские клетки воспаления.
Adv Exp Med Biol .
2011 г.;
713: 97–111. - 61
Тиффи Джей Си,
Офдеморт ТБ.
Маркеры ростков макрофагов и остеокластов при гигантоклеточных поражениях полости рта.
J Oral Maxillofac Surg .
1997 год;
55(10): 1108–12; обсуждение 1112–3. - 62
Пизони Г,
Д’Амелио П.,
Сасси Ф. и др.Многоядерные гигантские клетки с остеокластным фенотипом, полученные из мононуклеарных клеток периферической крови коз.
Вет Дж .
2011 г.;
189(3): 361–3. - 63
Парк Дж.К.,
Аскин Ф,
Джайлз Дж.Т.,
Галушка МК,
Розен А,
Левин СМ.
Повышенная генерация TRAP, экспрессирующих многоядерные гигантские клетки, у больных гранулематозом с полиангиитом.
PLoS Один .2012 г.;
7(8): e42659. - 64
Парк Дж.К.,
Розен А,
Saffitz JE, et al.
Экспрессия катепсина К и устойчивой к тартрату кислой фосфатазы не ограничивается остеокластами, а является общей чертой многоядерных гигантских клеток: систематический анализ.
Ревматология (Оксфорд) .
2013;
52(8): 1529–33. - 65
Моллиган Дж,
Митчелл Р,
Шон Л. и соавт.Влияние повреждений костей и мышц на остеогенный потенциал мышечных предшественников: вклад тканевого окружения в гетеротопическую оссификацию.
Стволовые клетки Transl Med .
2016 июнь;
5(6): 745–53. - 66
Шнайдерман Дж,
Содей М.С.,
Китон М.Р. и соавт.
Повышенная экспрессия гена ингибитора активатора плазминогена 1 типа в атеросклеротических артериях человека.
Proc Natl Acad Sci U S A .1992 год;
89(15): 6998–7002. - 67
Эйцман ДТ,
Вестрик Р.Дж.,
Сюй З,
Тайсон Дж,
Гинзбург Д.
Дефицит ингибитора активатора плазминогена-1 защищает от прогрессирования атеросклероза в сонной артерии мыши.
Кровь .
2000 г.;
96(13): 4212–5. - 68
Сяо Кью,
Дантон МДж,
Витте Д.П. и др.Дефицит плазминогена ускоряет заболевание сосудистой стенки у мышей, предрасположенных к атеросклерозу.
Proc Natl Acad Sci U S A .
1997 год;
94(19): 10335–40. - 69
Эрен М,
Бо АЕ,
Мерфи С.Б. и соавт.
Регулируемый PAI-1 внеклеточный протеолиз управляет старением и выживанием мышей Klotho.
Proc Natl Acad Sci U S A .
2014;
111(19): 7090–5. - 70
Цудзи К,
Бандиопадхьяй А,
Харф Б.Д. и соавт.Активность BMP2, хотя и необязательна для формирования кости, необходима для инициации заживления переломов.
Нат Жене .
2006 г.;
38(12): 1424–149. - 71
Кули Л.М.,
Госс Р.Дж.
Влияние трансплантации и рентгеновского облучения на восстановление сломанных костей.
Ам Дж Анат .
1958 год;
102(2): 167–81. - 72
Де Лука Ф.,
Уеда Дж.А.,
Мерик В. и др.Ретиноевая кислота является мощным регулятором хондрогенеза пластинки роста.
Эндокринология .
2000 г.;
141(1): 346–53. - 73
Льюис Калифорния,
Пратт Р.М.,
Пеннипакер Дж.П.,
Хасселл Дж.Р.
Ингибирование хондрогенеза конечностей in vitro витамином А: изменения характеристик клеточной поверхности.
Дев Биол .
1978 год;
64(1): 31–47. - 74
Стандэвен АМ,
Дэвис П.Дж.,
Чандраратна Р.А.,
Мадер ДР,
Джонсон А.Т.,
Томази В.А.Ретиноид-индуцированное закрытие эпифизарной пластинки у морских свинок.
Fundam Appl Toxicol .
1996 год;
34(1): 91–8. - 75
Ли Дж,
Мори С,
Каджи Ю,
Каваниши Дж,
Акияма Т,
Норимацу Х.
Концентрация бисфосфоната (инкадроната) в области костной мозоли и ее влияние на заживление переломов у крыс.
J Шахтер по кости Res .
2000 г.;
15(10): 2042–51. - 76
Брукер А.Ф.,
Бауэрман Дж. В.,
Робинсон Р.А.,
Райли Л.Х. мл.
Эктопическая оссификация после полной замены тазобедренного сустава. Заболеваемость и метод классификации.
J Bone Joint Surg Am .
1973 год;
55(8): 1629–32.
Что такое оссифицирующий миозит? – Детская больница Джона Хопкинса
Наша команда детской спортивной медицины собрала эти видеоролики, чтобы предоставить вам информацию.
Патрик Муларони, MD
Оссифицирующий миозит — это реакция на ушиб поврежденной мышцы. Во время заживления синяка кальций может откладываться в синяке, вызывая твердую костную структуру внутри мышцы.
Точная причина, по которой это происходит, неясна, но известно, что это чаще происходит у спортсменов с повторяющимися травмами в одной и той же области до того, как ушибленная мышца успевает зажить.
Это состояние чаще всего возникает в контактных видах спорта и чаще всего наблюдается в четырехглавой мышце бедра и в области плеча
Это состояние представляет собой твердую и болезненную область, расположенную на месте синяка, которая заживала в течение 2-4 недель.
У большинства спортсменов, если позволить этой области зажить должным образом, эта кальцификация или образование кости рассасываются и исчезают сами по себе.
Оценка этого состояния включает рентгенографию для наблюдения за прогрессированием образования кальция.Наиболее важными аспектами терапии являются предотвращение дальнейших травм в пораженной области и физиотерапия для поддержания движения в пораженной конечности.
Если у вас есть область, связанная с оссифицирующим миозитом, вас должен осмотреть ваш главный врач или вы можете записаться на прием в медицинскую клинику AllSports All Children’s Johns Hopkins.
Вопросы?
Мы знаем, что вы хотите лучшего для своего ребенка. Мы готовы помочь вам с вашими вопросами.
Запросить встречу
Заполните нашу онлайн-форму, и наша команда свяжется с вами в ближайшее время, чтобы назначить встречу.
Первичная семейная кальцификация головного мозга: MedlinePlus Genetics
Первичная семейная кальцификация мозга вызывается мутациями в одном из нескольких генов. Наиболее часто мутирующий ген называется SLC20A2 , и на его долю приходится примерно 40 процентов случаев, за ним следует ген PDGFRB , который мутирует примерно в 10 процентах случаев.Изменения в других генах составляют небольшой процент случаев. Примерно у половины людей с первичной семейной кальцификацией головного мозга генетическая причина неизвестна. Считается, что у этих людей есть мутации в генах, которые еще не связаны с заболеванием.
Ген SLC20A2 предоставляет инструкции по созданию белка, называемого натрий-зависимым переносчиком фосфатов 2 (PiT-2). Этот белок очень активен в нервных клетках (нейронах) головного мозга, где он играет важную роль в регулировании уровней фосфатов (фосфатный гомеостаз) путем транспортировки фосфатов через клеточные мембраны.Мутации гена SLC20A2 приводят к продукции белка PiT-2, который не может эффективно транспортировать фосфат в клетки. В результате уровень фосфатов в крови повышается. В головном мозге избыток фосфата соединяется с кальцием и образует отложения в кровеносных сосудах головного мозга.
Ген PDGFRB содержит инструкции по созданию белка, передающего сигналы с клеточной поверхности внутрь клетки. Эти сигналы контролируют множество клеточных процессов. Мутации гена PDGFRB приводят к образованию белка с нарушенной сигнальной способностью.Однако неясно, как мутации вызывают первичную семейную кальцификацию головного мозга. Измененная передача сигналов может привести к аномально большому количеству кальция, поступающему в клетки, выстилающие кровеносные сосуды головного мозга, что приводит к кальцификации этих кровеносных сосудов. С другой стороны, изменения в передаче сигналов PDGFRB могут нарушать процессы, регулирующие уровни фосфатов и кальция в клетках головного мозга, что приводит к образованию отложений кальция. Другие гены, которые, как известно, связаны с первичной семейной кальцификацией головного мозга, также играют роль в клеточной передаче сигналов и гомеостазе фосфатов.
Исследователи предполагают, что отложения кальция приводят к признакам первичной семейной кальцификации головного мозга, нарушая связи между базальными ганглиями и другими областями мозга, особенно лобными долями. Эти области в передней части мозга участвуют в рассуждениях, планировании, суждениях и решении проблем. Также могут быть затронуты области мозга, которые регулируют социальное поведение, настроение и мотивацию.
Исследования показали, что у людей со значительной кальцификацией, как правило, больше признаков и симптомов первичной семейной кальцификации, чем у людей с незначительной кальцификацией или без нее.Однако эта связь не распространяется на всех людей с первичной семейной кальцификацией головного мозга.
Границы | Происхождение клеток и роль остеокластогенеза и остеобластогенеза в кальцификации сосудов
Введение
Кальцификация сосудов, или патологическое накопление кристаллов фосфата кальция в интимальном и медиальном слоях стенок сосудов, является патологической основой многих сердечно-сосудистых заболеваний (1, 2). Это снижает податливость кровеносных сосудов и приводит к стенозу просвета, что в конечном итоге усугубляет сердечно-сосудистые симптомы.Более чем у 60% людей среднего и пожилого возраста в возрастной группе 40–75 лет и более чем у 70% пациентов, находящихся на хроническом диализе, наблюдается кальцификация аорты (3, 4). Кроме того, распространенность кальцификации сосудов достигает 80% у больных атеросклерозом в возрасте 80 лет и старше (5). Хотя механизмы, лежащие в основе кальцификации сосудов, в значительной степени выяснены, до сих пор не хватает эффективных фармакологических методов лечения. Таким образом, существует острая необходимость в дальнейшем уточнении его молекулярной и клеточной основы.
Сосудистая кальцификация первоначально была признана пассивным и дегенеративным патологическим процессом. Однако недавние открытия указывают на клеточно-опосредованный, активный и обратимый процесс, сходный с физиологической минерализацией кости (6). Например, в стенках кальцифицированных артерий наблюдались хондробластоподобные клетки, остеобластоподобные клетки и даже целая пластинчатая кость и регенерированный костный мозг (7–9). Кроме того, несколько костно-специфических транскрипционных факторов и белков костного матрикса сверхэкспрессируются во время сосудистой кальцификации, и их ингибирование блокирует остеобластоподобную трансдифференцировку и кальцификацию (10, 11).Кроме того, соли кальция, высвобождаемые из остеопоротических костей, откладываются в сосудистых поражениях, что дополнительно указывает на взаимодействие между остеогенной и сосудистой системами (12–15). Таким образом, исследователи все чаще обнаруживают новую костно-сосудистую ось в патогенезе сосудистой кальцификации (16, 17), в которой остеобластоподобные клетки играют центральную роль. Хотя в стенках нормальных артерий нет остеобластоподобных клеток, исследования показывают, что гладкомышечные клетки сосудов (ГГМК) могут дифференцироваться в хондробластоподобные/остеобластоподобные клетки при наличии высоких уровней кальция (18, 19).Кроме того, эндотелиальные клетки, фибробласты, перициты, мезенхимальные стволовые клетки и клетки-предшественники также могут трансдифференцироваться в остеобластоподобные клетки (20-24). Следовательно, точное происхождение остеобластоподобных клеток в кальцифицированных стенках артерий и последующее фенотипическое ремоделирование в значительной степени неизвестны.
Интересно, что кальцификация сосудов может быть обратимой. Например, показатели кальцификации как коронарных, так и сонных артерий значительно снижаются у нескольких пациентов с терминальной стадией почечной недостаточности после субтотальной паратиреоидэктомии (25).Кроме того, кальцификация аорты, вызванная уремическими крысами с помощью кальцитриола и диеты с высоким содержанием фосфора, может быть частично устранена при снижении потребления фосфора или использовании кальцимиметиков или фосфатсвязывающих средств, что может быть связано с увеличением минеральных фагоцитов и экскреции кальция с мочой (26–29). Медиальный эластокальциноз крыс, вызванный кормлением, богатым варфарином, также подавляется при кормлении рационом, богатым витамином К, при этом его содержание в аорте снижается на 50% (30). Интересно, что потеря минералов в аорте у крыс с медиальным эластокальцинозом связана с активацией карбоангидразы IV, которая играет важную роль в резорбции кости, предполагая, что потеря минералов в сосудах имеет сходный механизм с резорбцией кости (31).Кальцификацию медиальной артерии индуцируют кальцитриолом. Он будет быстро регрессировать, демонстрируя снижение содержания кальция и фосфора в аорте на 75% за 9 недель. Более того, обратимость кальцитриол-индуцированной кальцификации сосудов может быть опосредована макрофагами (32). Помимо этого, фенотип остеобластоподобных VSMC также может быть реверсирован. Сообщается, что начальное отложение гидроксиапатитоподобного минерала при кальцификации медицинских артерий сначала происходит на деградированном эластине, что вызывает трансдифференцировку ГМКС в остеогенный фенотип, экспрессирующий белки, связанные с костью, и способствует кальцификации ГМКС in vitro , но эти ГМКС вернутся к исходному состоянию. фенотип VSMC после устранения кальцифицированных состояний (33).Эти исследования показывают, что кальцификация сосудов является обратимой, что, возможно, связано с потерей минералов, аналогичной резорбции кости, но процесс обратного процесса до сих пор в значительной степени неизвестен.
В физиологических условиях остеобласты и остеокласты поддерживают баланс между абсорбцией и резорбцией кальция в костях, что необходимо для правильной минерализации костей (34, 35). Имеются данные, свидетельствующие об участии остеокластоподобных клеток в кальцификации сосудов (36). Ге и др. сообщили об увеличении экспрессии TRAP, который является фенотипическим маркером остеокластов в кальцифицированных сосудах у пациентов с гипертензией (37).Цяо и др. также идентифицируют остеокластоподобные клетки, присутствующие в атероматозных поражениях сонных артерий, содержащих кальцинированные бляшки, на основе морфологии клеток, TRAP-позитивности и маркерных генов, связанных с остеокластами. Кроме того, они считают, что остеокластоподобные клетки поглощают отложенные минералы, предотвращая кальцификацию сосудов и противодействуя действию остеобластов (38). Кроме того, остеокласты, культивированные in vitro с кальцифицированным эластином, уменьшали степень кальцификации и восстанавливали структурную целостность эластина, что указывает на то, что эти клетки также играют ингибирующую роль в сосудистой кальцификации (39, 40).Следовательно, увеличение доли остеокластоподобных клеток в кальцифицированных артериях может быть подходящим терапевтическим вмешательством. Однако происхождение, фенотипическая трансформация и функции остеокластоподобных клеток во время кальцификации сосудов также еще предстоит выяснить.
Таким образом, мы обобщили современные знания об остеобластах/остеокластаподобных клетках при кальцификации сосудов и обсудили их потенциал в качестве терапевтических мишеней.
Молекулярный механизм, лежащий в основе кальцификации сосудов, опосредованной остеобластоподобными клетками
Исследования показывают, что инициация и прогрессирование сосудистой кальцификации, вероятно, связаны как с активными, так и с пассивными механизмами (41–43).Пассивная кальцификация зависит от естественного сродства эластина и коллагена во внеклеточном матриксе (ECM) к ионам кальция. Эти белки связываются с ионами кальция и увеличивают их отложение в ВКМ, что приводит к дисбалансу внеклеточного кальция и фосфора. Положительно заряженные ионы кальция адсорбируют отрицательно заряженные ионы фосфорной кислоты или карбоната с образованием аморфной соли кальция, которая непрерывно поглощает все больше ионов минералов, образуя большие минеральные отложения и в конечном итоге приводя к кальцификации сосудов (41, 44, 45).Активная кальцификация сосудов напоминает физиологическую минерализацию костей. Клетки в стенках сосудов дифференцируются или трансдифференцируются в хондробласты/остеобластоподобные клетки в прокальцифицирующей среде диабета, хронической болезни почек, старения и атеросклероза. Остеобластоподобные клетки экспрессируют остеогенные факторы транскрипции и гены, такие как связанный с рантом фактор транскрипции 2 (Runx2), osterix, гомеобокс Msh (Msx), фактор транскрипции SRY-box 9 (SOX9) и щелочную фосфатазу (ALP), кость сиалопротеин (BSP) и остеокальцин (OC), каждый из которых играет центральную роль в минерализации костей.Отключение RUNX2, osterix, SOX9, MSX1 или MSX2 подавляло остеогенную дифференцировку и последующую кальцификацию сосудов (10, 46–49). Остеобласты/хондробластоподобные клетки инициируют кальцификацию сосудов, высвобождая матриксные везикулы (МВ) (50), которые нагружены минеральными кристаллами и откладываются в ВКМ. Минерализованные МВ были обнаружены в кальцифицированных очагах хронической болезни почек, атеросклероза и диабета. Кроме того, СГМК, культивируемые с высоким уровнем фосфора, синтезируют и секретируют кальций, содержащие кальций, и кристаллоподобные структуры фосфора (51, 52).MV из остеокластоподобных VSMC и остеобластов и гипертрофических хондроцитов имеют сходную морфологию и протеомику, которые связываются с коллагеном и индуцируют нуклеацию апатита, что приводит к эндохондральному и мембранному остеогенезу (53-55). Недавнее исследование показало, что нанокристаллы гидроксиапатита обратимо индуцировали остеогенную дифференцировку и кальцификацию VSMC in vitro , а удаление нанокристаллов восстанавливало первоначальный фенотип VSMC и предотвращало кальцификацию (33, 56).В модели ХБП у крыс ингибирование роста гидроксиапатита севеламером или пирофосфатом также замедляло прогрессирование кальцификации аорты от умеренной до тяжелой степени (57). Таким образом, остеобластоподобные клетки могут также инициировать кальцификацию сосудов через гидроксиапатит. Интересно, что МВ из остеобластоподобных клеток экспрессируют более низкие уровни ингибиторов кальцификации, таких как белок матрикса gla (MGP) и фетуин А, по сравнению с нормальными МВ, происходящими из ГМКС, тогда как ЩФ, связанный с биоминерализацией TNAP и фосфатидилсерин (ФС) сверхэкспрессируются в первых .TNAP гидролизует пирофосфат, ингибитор кальцификации сосудов, с образованием неорганического фосфора и ФС, которые прилипают к поверхности МК и адсорбируют ионы кальция и фосфора. Кроме того, MV, секретируемые остеобластоподобными клетками, также экспрессируют аннексины 2, 5 и 6, которые функционируют как кальциевые каналы и обеспечивают приток ионов (51, 58). Поскольку MV и экзосомы способствуют межклеточной коммуникации, остеобластоподобные клетки могут способствовать кальцификации сосудов, секретируя MV, которые экспрессируют аберрантно высокие уровни факторов, способствующих кальцификации.В самом деле, нормальные VSMC, совместно культивируемые с MV, происходящими из остеобластоподобных клеток, интернализуют последние и претерпевают фенотипический переход, характеризующийся потерей сократительных маркеров, таких как гладкомышечные 22 альфа (SM22a), и приобретением остеогенных маркеров (59). Анализ микрочипов и биоинформатики идентифицировал значительно дисрегуляцию некодирующих РНК в этих МВ, которые обогащены сигнальными путями, тесно связанными с остеогенной дифференцировкой и кальцификацией (60). В совокупности остеобластоподобные клетки сосудистой стенки синтезируют и секретируют кальцифицированные МВ, которые не только создают место для отложения солей кальция, но также инициируют фенотипический переход и кальцификацию соседних клеток паракринным образом.
Происхождение остеобластоподобных клеток при кальцификации сосудов
Хотя в стенке нормальной артерии нет остеобластоподобных клеток, некоторые резидентные клетки, такие как VSMC, эндотелиальные клетки сосудов (VEC), перициты, фибробласты, кальцифицированные сосудистые клетки (CVC), мезенхимальные стволовые клетки (MSC) или клетки-предшественники имеют способность дифференцироваться или трансдифференцироваться в остеобластоподобные клетки в ответ на патологические стимулы (61).
ГМКС и остеобластоподобные клетки при кальцификации сосудов
VSMC являются основным типом клеток в артериальной стенке и поддерживают эластичность и сократимость сосудов.Хотя VSMCs являются терминально дифференцированными клетками, они демонстрируют высокопластичные фенотипы (62). Сократительные VSMC в нормальной артериальной стенке характеризуются низким ростом, миграцией и синтезом белка и экспрессируют сократительные маркеры, такие как SM22a, SMA и SMM-HC. Они могут трансдифференцироваться в синтетический фенотип, который демонстрирует более высокие скорости роста и миграции, продуцирует больше белков и экспрессирует маркеры остеобластов и хондробластов (63). Обызвествленные артериальные поражения у людей и животных моделей также сверхэкспрессируют остеогенные и хондрогенные гены в зависимости от степени кальцификации и имеют низкие уровни сократительных маркеров.Кроме того, остеогенные или хондрогенные маркеры коэкспрессируются с сократительными белками VSMC, что указывает на то, что VSMC также могут дифференцироваться в остеогенные и хондрогенные клетки (64–66). В соответствии с этим гены остеобластов активировались, а сократительные гены VSMC подавлялись в VSMC человека и животных, подвергшихся воздействию высоких уровней кальция или фосфора, которые также образовывали массивные кальциевые узелки, окрашенные ализариновым красным. Аналогичным образом, гидроксиапатит и кальцифицированный эластин индуцировали культивированные VSMC к потере сократительного фенотипа и трансдифференцировке в остеогенные клетки, а удаление обоих восстанавливало сократительный фенотип и подавляло гены, связанные с костью, что указывает на то, что трансдифференцировка VSMC является обратимым процессом (33).СГМК, экспрессирующие рекомбиназу SM22α-Cre и репортерные аллели Rosa26-LacZ Cre, трансдифференцировались в остеохондрогенные предшественники и хондроциты у мышей MGP-/- или LDLr-/- и ApoE-/-, что приводило к атеросклеротической медиальной и интимальной кальцификации (67). Кроме того, отложение кальция и кальцификация сосудов происходят до остеогенного фенотипического переключения VSMCs (42), и блокирование последнего может ингибировать или даже обратить вспять кальцификацию сосудов как in vitro , так и in vivo .Имеются данные, указывающие на то, что разные фенотипы VSMC имеют разное эмбриональное происхождение (68, 69). Возможно, что сократительные VSMC сначала трансдифференцируются в стволовые клетки или другие промежуточные фенотипы до остеобластоподобной стадии, а не дифференцируются напрямую. Таким образом, фенотипическое перепрограммирование VSMCs представляет собой сложный процесс, и регуляторные пути в значительной степени неизвестны.
VEC и остеобластоподобные клетки при кальцификации сосудов
VEC происходят из мезодермы и являются основным типом клеток интимы сосудов.В физиологических условиях VEC образуют сосудистый барьер через плотные соединения со специфическими для эндотелия белками. Однако патологические стимулы могут запускать эндотелиально-мезенхимальный переход (EndMT) в VEC, что приводит к приобретению MSC-подобной мультипотентной способности к дифференцировке. ЭК аорты человека, культивируемые в условиях гипергликемии, экспрессируют низкие уровни маркерных генов ЭК, таких как CD31, и приобретают маркеры МСК, такие как CD44 и CD10. Кроме того, гены хондроцитов SOX9 и коллаген II типа, хрящевой протеогликан и кальциевые узелки индуцируются в VEC, культивируемых в остеогенной среде (70).Узелки кальция также образуются в MGP-/- ЭК аорты человека, индуцированных высоким содержанием глюкозы и костного морфогенетического белка (BMP), а также в ЭК аорты человека и крупного рогатого скота, стимулированных BMP6 и окисленным липопротеином низкой плотности (ЛПНП), или некрозом опухоли. фактор-а (TNF-a) и интерлейкин-β (IL-β) (22, 71, 72). Кроме того, исследование Malhotra et al. показывает, что EndMT и кальцификация сосудов in vitro и in vivo зависят от передачи сигналов BMP у мышей с дефицитом MGP, в то время как, с другой стороны, также предполагает, что активация передачи сигналов BMP ингибирует атеросклероз у мышей с дефицитом MGP, получавших стандартную диету, по сравнению с LDLR-/- мышам, получавшим пищу с высоким содержанием жиров, мышиная модель атеросклероза (73).Эти результаты показывают, что VEC могут трансдифференцироваться в остеобластоподобные клетки и способствовать кальцификации сосудов. Механически активация сигнала BMP индуцирует фенотипическое переключение VECs через EndMT. В соответствии с этим кальцифицированные артерии мышей Mgp-/- и Ins2 Akita/+ экспрессируют CD31, мультипотентные маркеры, такие как SOX2, Nanog и Oct3/4, а также Runx2 и Osterix (74, 75). Интересно, что MGP-/- VECs человека, культивированные в остеогенной среде или BMP2, обнаруживают активацию SOX2, Nanog и Oct3/4 раньше, чем Runx2 и Osterix, что указывает на то, что мультипотентный маркер появляется раньше в эндотелии.Отслеживание клонов у трансгенных мышей Mgp-/- и Tie2-Gfp подтвердило локализацию меченных GFP ECs в кальцифицированных поражениях наряду с повышенной экспрессией Runx2 и Osterix, что дополнительно продемонстрировало, что остеогенные клетки могут происходить из VECs (74). Кроме того, VECs также могут регулировать кальцификацию сосудов паракринным образом, активируя VSMCs, MSCs и фибробласты. СГМК и МСК, совместно культивированные с ЭК, экспрессирующими RANKL, или их кондиционированной средой, трансдифференцировались в остеобластоподобные клетки, экспрессирующие Runx2 и ALP (76).Точно так же фибробласты, совместно культивированные с механически стимулированными ЭК или кондиционированной средой, также подвергались кальцификации (77). Кроме того, кондиционированная среда из индуцированных неорганическим фосфором или индоксилсульфатом ЭК пупочной вены ингибировала экспрессию остеопонтина в МСК и индуцировала кальцификацию в присутствии ИЛ-8 (78). Наконец, MV и экзосомы, секретируемые стареющими или стимулированными воспалительными факторами EC, экспрессируют большое количество кальция, BMP2, аннексина и Notch4 и способствуют кальцификации реципиентных клеток после интернализации (79).
Перициты и остеобластоподобные клетки при кальцификации сосудов
Перициты являются частью микрососудистой системы и тесно связаны с эндотелиальными клетками. Недавние исследования показывают, что перициты или перицитоподобные клетки в изобилии присутствуют в интиме, медии и адвентиции крупных, средних и мелких артерий и могут дифференцироваться в остеобласты, хондробластоподобные клетки и адипоциты. Кроме того, атеросклеротические кальцифицированные бляшки сонных и бедренных артерий содержат значительно больше перицитов по сравнению с некальцинированными поражениями, что позволяет предположить, что эти клетки участвуют в формировании кальцифицированных бляшек (80, 81).В соответствии с вышеизложенным, перициты, культивированные с высоким содержанием конечных продуктов гликирования, бета-глицерофосфата или глюкокортикоидов, дифференцируются в остеобластоподобные клетки, экспрессирующие Runx2, ALP, OC и другие гены, связанные с костью, и формируют кальциевые узелки. Последний может блокировать MGP, ингибитор BMP4 и OPN, и активировать сигнальный путь Axl (82-84). Кроме того, коллагеновые гликозаминогликановые каркасы, нагруженные перицитами, дают костноподобные ткани у мышей в месте имплантации, указывая на то, что перициты обладают спонтанным остеогенным потенциалом (85, 86).Действительно, перициты, выращенные в нормальной среде, могут образовывать многоклеточные узелки с минерализованным матриксом, содержащим обширные отложения солей кальция, и экспрессировать высокие уровни Runx2 и др. остеогенных генов (21, 85). Следовательно, перициты могут дифференцироваться в остеобластоподобные клетки как спонтанно, так и в ответ на стимулы и способствовать минерализации.
Фибробласты и остеобластоподобные клетки при кальцификации сосудов
Фибробласты представляют собой основной тип клеток, расположенных во внешней артериальной мембране, и потенциальный источник остеобластоподобных клеток при кальцификации сосудов.Это подтверждается значительной кальцификацией, наблюдаемой в адвентиции аорты у мышей ApoE-/-, получавших диету с высоким содержанием жиров, и у лиц старше 60 лет (87). Шао и др. обнаружили, что у трансгенных мышей, экспрессирующих ген остеобластов Msx2 в адвентициальных клетках, развивается обширная кальцификация сосудов (88). Кроме того, первичные фибробласты, культивированные в присутствии рекомбинантного трансформирующего фактора роста-1 (TGF-β) и бета-глицерофосфорной кислоты, трансформировались в миофибробласты и образовывали кальциевые узелки (89, 90).Лай и др. также подтвердили, что уровни экспрессии MSX2 увеличились в миофибробластах и впоследствии способствовали кальцификации (91). Симионеску и др. обнаружили, что фибробласты крыс, индуцированные продуктами деградации эластина и/или TGF-β, экспрессировали высокие уровни Runx2, ALP, OC и других генов, связанных с костями, и образовывали отложения кальция, которые окрашивались красителем von Kossa (89). Точно так же Runx2 и OC активировались, а отложение кальция увеличилось в трехмерных культурах фибробластов крыс Wistar после 2 недель воздействия высоких уровней неорганического фосфата или β-глицерофосфата (92).Следовательно, адвентициальные фибробласты, вероятно, трансформируются в миофибробласты и остеобластоподобные клетки, чтобы регулировать кальцификацию сосудов.
МСК и остеобластоподобные клетки при кальцификации сосудов
МСК
представляют собой взрослые стволовые клетки, полученные из ранней мезодермы, и характеризуются высокой скоростью пролиферации, способностью к самообновлению, мультипотентным потенциалом дифференцировки и иммуносупрессивной способностью. Таким образом, МСК являются идеальным биологическим инструментом для восстановления и регенерации тканей.МСК, происходящие из костного мозга (СКМ), дифференцируются в несколько типов клеток, которые участвуют в сердечно-сосудистых патологиях, включая кальцификацию сосудов. СККМ, трансплантированные крысам, получавшим диету с высоким содержанием холестерина, с баллонным повреждением брюшной аорты, мигрировали в интиму артерий со сверхэкспрессией BMP2 и приводили к обширной кальцификации. Таким образом, МСК могут способствовать кальцификации сосудов через сигнальный путь BMP2 (93). Краманн и др. имплантировали MSC-нагруженные коллагеновые гели в брюшную полость крыс с 5/6-й нефрэктомией или HFD-индуцированной ХБП и обнаружили Runx2, ALP и склеростин в циркулирующих MSC, что указывает на остеогенную дифференцировку.Кроме того, аналогичная степень кальцификации наблюдалась через 8 недель в гелях, нагруженных МСК, а также в артериях, как с точки зрения рентгеновских изображений, так и с точки зрения содержания кальция, что указывает на то, что МСК способствовали кальцификации сосудов после фенотипического превращения в остеобластоподобные. клетки (94). Лещинская и др. также подтвердили, что подкожная имплантация МСК, предварительно обработанных хондрогенной средой, приводила к образованию костной ткани у мышей ApoE-/- и дикого типа, и степень кальцификации была выше у первых (95).Кроме того, МСК, культивируемые в среде для остеогенеза, экспрессируют остеогенные факторы транскрипции и образуют отложения кальция in vitro . МСК, выделенные из мышей ApoE-/-, обладают большей остеогенной и хондрогенной способностью по сравнению с клетками дикого типа и, вероятно, связаны с активацией оси uPAR-C5aR/Erk1/2/NF-kB (23). Ван и др. обнаружили, что флуоресцентно меченные МСК мигрировали в кальцифицированные поражения у мышей LDLr-/-, получавших HFD, и экспрессировали остеогенные гены посредством активации сигнала TGF-β/SMAD2/4 (96).Интересно, что несколько групп сообщили об ингибирующем действии МСК на кальцификацию сосудов. Например, внутривенно введенные МСК значительно ингибировали отложение кальция и фосфора в стенках аорты, а также снижали уровни фосфора в сыворотке в модели ХБП у крыс, получавших аденин (97). Точно так же кондиционированная среда из MSC ингибировала остеогенный фенотипический переключатель и кальцификацию VSMC даже в присутствии β-глицерофосфата, и этот эффект был обращен рекомбинантным BMP2 посредством активации пути SMAD1/5/8.Кроме того, MSCs снижали кальцификацию совместно культивируемых VSMC в остеогенной среде путем инактивации пути Wnt5a/β-катенина (98). Следовательно, роль МСК в сосудистой кальцификации очень сложна и может зависеть от сигналов окружающей среды.
Клетки-предшественники и остеобластоподобные клетки при кальцификации сосудов
Клетки-предшественники являются предшественниками с мультипотентным потенциалом дифференцировки. Исследования все чаще показывают, что как эндотелиальные, так и VSMC предшественники тесно связаны с артериальной кальцификацией.Например, циркулирующие эндотелиальные клетки-предшественники, экспрессирующие маркер поздней дифференцировки остеобластов остеокальцин (ОС), в изобилии встречаются у пациентов с диабетом, ХБП и коронарным атеросклерозом. Кроме того, количество циркулирующих эндотелиальных клеток-предшественников ОС+ положительно коррелирует с показателем кальция и точечной кальцификацией у пациентов с ишемической болезнью сердца и у пациентов, находящихся на гемодиализе (99, 100). Эндотелиальные предшественники, выделенные из периферической крови пациентов, находящихся на гемодиализе, показали значительно повышенное отложение кальция in vitro .Однако добавление активатора рецептора витамина D в среду сыворотки пациентов с уремией будет ингибировать кальцификацию эндотелиальных клеток-предшественников (99). Точно так же количество циркулирующих эндотелиальных клеток-предшественников OC+ у женщин в постменопаузе и пациентов, находящихся на гемодиализе, значительно уменьшилось при введении бисфосфонатов и активатора рецептора витамина D, что также уменьшило кальцификацию сосудов (20). В совокупности эндотелиальные клетки-предшественники OC+ могут дифференцироваться в остеобластоподобные клетки и способствовать кальцификации сосудов.Периваскулярные клетки-предшественники CD10+ человека, также известные как адвентициальные клетки из-за их анатомического расположения, также обладают остеогенным потенциалом. CD10 значительно активируется в кальцифицированных артериях по сравнению с нормальными. Клетки-предшественники CD10+, выделенные из белой жировой ткани брюшной полости и плаценты человека, экспрессировали остеобластические факторы транскрипции и другие белки NF-κB-зависимым образом при культивировании в остеогенной среде в течение 28 дней и образовывали минерализованные узелки. Замалчивание гена CD10 значительно снижало способность этих предшественников формировать кости (101).Краманн и др. обнаружили обильные предшественники Gli1+ VSMC в артериальной адвентиции, медии и интиме мышей с острым повреждением бедренной артерии или CKD, что способствовало восстановлению тканей (102). Кроме того, отслеживание генетической судьбы показало, что клетки-предшественники Gli1+ мигрировали из адвентиции в интиму и среду ApoE-/- мышей с CKD и экспрессировали остеогенные гены, которые способствовали кальцификации артерий. Кроме того, нокдаун Gli1 ингибирует кальцификацию артерий (102). Чо и др. обнаружили клетки-предшественники Sca-1+/PDGFRα- в костном мозге и стенках кровеносных сосудов, которые дифференцировались как в остеобласты, так и в остеокласты.Подкожная трансплантация клеток-предшественников Sca-1+/PDGFRα- и костного матрикса мышам C57 приводила к высокоминерализованной костноподобной структуре через 8 недель. Однако одновременная инъекция PPARγ значительно уменьшала объем кальцификации и показатели кальция, индуцируя дифференцировку клеток-предшественников Sca-1+/PDGFRα- в остеокласты. В соответствии с вышеизложенным, клетки-предшественники Sca-1+/PDGFRα- также усугубляли кальцификацию артерий у атеросклеротических ApoE-/- мышей, которая была реверсирована с помощью PPARγ (39, 103).
ЦВК и остеобластоподобные клетки при кальцификации сосудов
CVC представляют собой подмножество VSMC, которые характерно экспрессируют модифицированную форму ганглиозид-сиалиллактозоцерамида, наряду с остеогенными и хондрогенными маркерами. ЦВК могут образовывать узелки кальция после стимуляции трансформирующим фактором роста-β или 25-гидроксихолестеролом. Точно так же механическая стимуляция или лечение цАМФ также способствует остеогенной дифференцировке и минерализации ЦВК. Сверхэкспрессия рецептора X печени усиливала минерализацию CVC за счет увеличения синтеза жирных кислот и накопления липидов.Кроме того, подкожно трансплантированные ЦВК образовывали кальциевые узелки, сходные с кальцифицированными атеросклеротическими бляшками у мышей Apoe-/- (104). Механически остеогенная дифференцировка и кальцификация ЦВК опосредованы белком теплового шока (HSP) 70, который связывается с MGP и активирует путь BMP2/P-SMAD1/3/5 (105). Кроме того, макрофаги, стимулированные ультратонкими частицами или их кондиционированными средами, индуцировали остеогенную дифференцировку и минерализацию CVC путем частичной активации сигнального пути NF-κB (106).Наоборот, спонтанная дифференцировка и кальцификация CVC ингибировались специфичным ингибитором протеинкиназы А KT5720 или инсулиноподобным фактором роста I, которые, как известно, активируют пути ERK и PI3K (107). Абедин и др. обнаружили, что активация путей p38-MAPK и PPARγ снижает как спонтанный, так и IL-6-опосредованный остеогенез CVC (108). Эти результаты указывают на то, что ЦВК могут не только спонтанно образовывать кальциевые узелки, но и усиливать кальцификацию сосудов.
Происхождение и функция остеокластоподобных клеток при кальцификации сосудов
Формирование кости зависит от баланса между остеобластами и остеокластами. Остеокласты опосредуют резорбцию костного минерального матрикса и предотвращают чрезмерную минерализацию кости, продуцируя различные ферменты. В то время как чрезмерная резорбция кости под действием активности остеокластов приводит к остеопорозу, аберрантное формирование кости гиперактивными остеобластами приводит к остеопетрозу. Остеобластоподобные клетки находятся в изобилии в кальцифицированных кровеносных сосудах и способствуют кальцификации сосудов, хотя роль остеокластоподобных клеток плохо изучена.
Остеокластоподобные клетки были обнаружены как в атеросклеротических бляшках, так и в кальцифицированном медиальном слое, хотя их количество невелико и в основном сосредоточено в сильно кальцифицированных очагах. Цяо и др. обнаружили остеокластоподобные клетки в каротидных бляшках человека (38). Хан и др. проанализировали кальцифицированную среду и интиму 282 образцов артерий нижних конечностей и обнаружили костную ткань и остеокласты в некоторых сильно кальцифицированных областях (109). Точно так же тартрат-резистентная кислая фосфатаза (TRAP), специфичный для остеокластов маркерный ген, также была обнаружена в кальцифицированных сосудах пациентов с гипертензией (37).Карбоангидраза, ключевой фермент, участвующий в опосредованной остеокластами резорбции кости, значительно активируется в атеросклеротических бляшках сонных, бедренных и аортальных сосудов и коэкспрессируется с TRAP (110). Эти данные указывают на то, что остеокластоподобные клетки регулируют атеросклероз и кальцификацию сосудов, хотя механизмы этого остаются неизвестными. Моноциты и макрофаги могут дифференцироваться в остеокласты в присутствии воспалительных цитокинов, таких как IL-6, IL-1 и TNF-α , посредством активации сигнального пути RANKL/Akt.Остеокластогенная дифференцировка этих клеток ингибируется окисленным липопротеином низкой плотности или высоким уровнем неорганического фосфата (111, 112). У атерогенных мышей ApoE-/- также макрофаги трансдифференцируются в остеокласты через ось Runx2/RANKL. В соответствии с этим макрофаги, происходящие из мононуклеарных клеток периферической крови человека, дифференцируются в остеокласты, экспрессирующие катепсин К и TRAP, и их резорбционная активность кальция контролируется субъединицами N-ацетилглюкозамин-1-фосфаттрансферазы альфа и бета (113).Кроме того, макрофаги могут эффективно декальцинировать эктопические отложения за счет сверхэкспрессии карбоангидразы 2, которая подавляется у мышей с медиальной кальцификацией мелких артерий (114). Сосудистые клетки-предшественники также дифференцируются в остеокластоподобные клетки в кальцифицированных поражениях. Клетки-предшественники Sca-1+/PDGFra- из аорты мыши дифференцируются в функциональные остеокластоподобные клетки in vitro в присутствии подходящих факторов, что указывает на их потенциал бипотентной дифференцировки.Кроме того, клетки Sca-1+/PDGFra-, имплантированные подкожно мышам C57 и атерогенным мышам ApoE-/-, дифференцировались в остеокластоподобные клетки в присутствии PPARγ, что приводило к снижению количества кальция и объема кальцификации, что указывает на подходящую терапевтическую стратегию для кальцификация сосудов (39). Совместное культивирование кальцифицированного эластина и остеокластоподобных клеток костного мозга значительно снижало содержание кальция в кальцифицированном эластине без деградации эластина и подкожной трансплантации крысе смеси, содержащей чистый аортальный эластин и остеокластоподобные клетки, ограничивало кальцификацию эластина по сравнению с контролем группа (40).Бас и др. и Цяо и др. также обнаружили, что остеокластоподобные клетки и макрофаги ингибируют и обращают вспять кальцификацию посредством резорбции минералов (32, 38). Однако точная роль остеокластоподобных клеток в сосудистой кальцификации в значительной степени неоднозначна. Анализ секвенирования РНК атеросклеротических бляшек кролика показал обогащение генов и путей KEGG, связанных с дифференцировкой остеокластов, которые оказывают двунаправленное влияние на дифференцировку остеобластов (115). В другом исследовании нокаут Runx2 в VSMC снижал экспрессию RANKL, количество остеокластов и тяжесть кальцификации.Кроме того, СГМК, совместно культивированные с макрофагами, происходящими из костного мозга, со сверхэкспрессией RANKL, дифференцировались в остеокластоподобные клетки и усиливали кальцификацию сосудов (116). Таким образом, роль остеокластоподобных клеток в сосудистой кальцификации нуждается в дальнейшем уточнении.
Потенциал клеточных терапевтических стратегий для лечения кальцификации сосудов
За прошедшие годы был достигнут большой прогресс в изучении патогенеза сосудистой кальцификации, но стратегии лечения сосудистой кальцификации ограничены.Как обсуждалось выше, остеобластоподобные клетки играют важную роль в кальцификации сосудов. Принимая во внимание роль остеобластоподобных клеток, многие исследования показали ингибирование остеогенной дифференцировки СГМК или восстановление сократительного фенотипа СГМК, улучшающее кальцификацию сосудов как in vitro , так и in vivo (117–119). Лин и др. также сообщалось, что SMC-специфический нокаут Runx2 значительно снижает сосудистый остеохондрогенез и кальцификацию у мышей (10). Эти результаты предполагают, что можно лечить сосудистую кальцификацию на клеточном уровне, регулируя изменения фенотипа VSMC.Кроме того, благодаря способности остеокластоподобных клеток к резорбции минералов, остеокласты эффективно удаляют отложенные минералы из кальцифицированного эластина как in vitro , так и in vivo (40). Кокультура макрофагов и ГМКС, ингибирование макрофагов, дифференцировавшихся в остеокласты, способствовали кальцификации ГМКС. Кроме того, Баринда и соавт. также обнаружили, что макрофаги обращают эктопическую кальцификацию во внеклеточный матрикс за счет сверхэкспрессии карбоангидразы 2, которая опосредует образование ионов водорода, вызывающее растворение минералов (114).В мышиной модели эктопической кальцификации стимулирование дифференцировки клеток-предшественников Sca-1(+)/PDGFRα(-) с помощью агониста PPARγ в остеокластоподобные клетки уменьшало тяжесть эктопической кальцификации (39). Эти исследования показывают, что клетки, подобные остеокластам, и терапия клетками кальцификации сосудов на основе макрофагов имеет потенциал. Однако Гбагиди и соавт. сообщалось, что макрофаги вблизи отложений кальция были дефицитны по оси RANKL-RANK и катепсину К, препятствующему их способности реабсорбировать минералы в атеросклеротических бляшках человека (120).В последнее время терапия МСК получила развитие во многих областях, что является новой стратегией лечения сосудистой кальцификации. Кальцинированные СГМК, индуцированные β-GP, культивировали в кондиционированных средах из МСК, и отложение минералов в СГМК ингибировалось, что было связано с инактивацией сигнального пути BMP2-Smad1/5/8 и подавлением остеогенного фенотипа, воспаления и апоптоза (97). , 98). Экзосомы из MSC использовались для культивирования VSMC и ингибировали кальцификацию VSMC, индуцированную высоким содержанием фосфора (121).Аналогично этим исследованиям, непрямое совместное культивирование СГМК и МСК в трансвелловой системе также уменьшало кальцификацию СГМК, участвующую в ингибировании сигнальных путей wnt (122). Эти исследования предполагают, что МСК регулируют кальцификацию сосудов паракринным образом. In vivo МСК жирового происхождения вводили крысам с моделью хронического заболевания почек, что ингибировало прогрессирование кальцификации сосудов (123). Однако в некоторых исследованиях также сообщается, что МСК обладают потенциалом остеогенной дифференцировки (124).Трансплантация СККМ способствовала кальцификации сосудов у крыс с гиперлипидемией, подвергшихся баллонной травме, а МСК были имплантированы мышам c57BL/6, а мыши Apoe-/- могут образовывать кости (93, 95). В совокупности клеточное лечение кальцификации сосудов на основе остеокластоподобных клеток или макрофагов и даже МСК возможно, но все еще существуют некоторые разногласия, и необходимы дополнительные исследования.
Исследования будущего
Хотя потенциальные источники остеобластоподобных клеток в кальцифицированных поражениях были идентифицированы, трансдифференцировка сосудистых клеток в остеобластоподобные клетки является более сложной и требует дальнейших исследований.В сосудистых стенках идентифицированы различные подмножества ГМКС и ЭК, а ГМКС, расположенные в разных сегментах аорты, происходят из разных слоев зародыша. Очевидный вопрос здесь заключается в том, связаны ли специфические подмножества VSMC и ECs для дифференцировки в остеобластоподобные клетки. И VSMC, и EC проходят фенотипическую траекторию во время трансдифференцировки в остеобластоподобные клетки. Лежащие в основе молекулярные механизмы еще предстоит выяснить, особенно во время раннего фенотипического перехода.Ограниченное количество остеокластоподобных клеток также было выявлено в кальцифицированных артериях, особенно в областях выраженного кальцификации. Недавние исследования показывают, что остеокластоподобные клетки способствуют атеросклеротической кальцификации у мышей и кроликов Apoe-/-, хотя другие коррелируют увеличение количества остеокластоподобных клеток с атеросклеротической декальцинацией. Следовательно, точная роль и происхождение этих клеток неоднозначны и должны быть выяснены. Остеокласты обладают костно-резорбтивной активностью, а дисбаланс между остеобластогенезом и остеокластогенезом присутствует при кальцификации сосудов.Остается выяснить, являются ли остеокласты или остеокластоподобные клетки многообещающей терапевтической стратегией при кальцификации сосудов, и наиболее актуальным вопросом в этом отношении является оптимизация дифференцировки клеток сосудистой стенки в остеокластоподобные клетки.
Выводы
Сосудистая кальцификация представляет собой клеточно-опосредованный, обратимый и активно регулируемый процесс, напоминающий минерализацию костей. Остеобластоподобные клетки и ограниченное количество остеокластоподобных клеток были идентифицированы в кальцифицированных поражениях (рис. 1).В то время как первые способствуют кальцификации стенок артерий, вторые оказывают деминерализующее действие. Следовательно, отслеживание происхождения этих клеток и траектории их фенотипического ремоделирования, наряду с идентификацией основных регуляторных молекул, может дополнительно прояснить механизм сосудистой кальцификации и выявить новые терапевтические мишени.
Рисунок 1 . Краткое изложение происхождения и роли остеобластоподобных клеток и остеокластоподобных клеток в кальцификации сосудов.Сосудистая кальцификация часто встречается у пожилых людей, пациентов с хронической болезнью почек, диабетом и атеросклерозом. Во время образования кальцификации сосудов многие клетки дифференцировались в остеобластоподобные клетки или хондроцитоподобные клетки, включая ГМКС, ЭК, фибробласты, перициты, МСК и предшественники. Они экспрессируют транскрипционные факторы остеобластной дифференцировки и белки костного матрикса, а также секретируют экзосомы и матриксные везикулы, способствующие развитию и прогрессированию кальцификации сосудов.Некоторые клетки также могут дифференцироваться в остеокластоподобные клетки, в том числе некоторые МСК или предшественники, макрофаги. Они играют роль в деминерализации сосудистой кальцификации. Уменьшение количества клеток остеогенного фенотипа и увеличение количества клеток реабсорбции минералов может быть стратегией сосудистой кальцифицирующей клеточной терапии. VSMCs, гладкомышечные клетки сосудов; ECs, эндотелиальные клетки; МСК, мезенхимальные стволовые клетки; MV, матричные везикулы; RUNX2, транскрипционный фактор 2 семейства RUNX; MSX, мш гомеобокс; SOX9, ген 9, связанный с SRY, высокой подвижностью; OSX, фактор транскрипции Sp7; ALP, щелочная фосфатаза; ОС, остеокальцин; BSP, костный сиалопротеин; ОПН, остеопонтин; TRAP, кислая фосфатаза 5, устойчивая к тартрату; CA2, карбоангидраза 2.
Вклад авторов
WJ, ZZ, YL, CC, HY, QL и MH: поиск и анализ литературы. WJ: написание рукописи. XQ и WJ: просмотрите и отредактируйте рукопись. XQ: приобретение финансирования. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была частично поддержана Национальным фондом естественных наук Китая (№ 81960091).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
1. Strauss HW, Nakahara T, Narula N, Narula J. Сосудистая кальцификация: развивающаяся связь сосудистой кальцификации с основными острыми коронарными событиями. Дж Нукл Мед . (2019) 60:1207–12. doi: 10.2967/jnumed.119.230276
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
2. Джоши Ф.Р., Раджани Н.К., Абт М., Вудворд М., Буцериус Дж., Мани В. и соавт. Ускоряет ли сосудистая кальцификация воспаление?: дополнительное исследование dal-PLAQUE. J Am Coll Cardiol . (2016) 67: 69–78. doi: 10.1016/j.jacc.2015.10.050
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
3. Kalsch H, Lehmann N, Mohlenkamp S, Hammer C, Mahabadi AA, Moebus S, et al. Распространенность кальцификации грудной аорты и ее связь с факторами риска сердечно-сосудистых заболеваний и коронарной кальцификации в неотобранной популяционной когорте: исследование отзыва Хайнца Никсдорфа. Int J Cardiovasc Imaging . (2013) 29: 207–16. дои: 10.1007/с10554-012-0051-3
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
4. Liu ZH, Yu XQ, Yang JW, Jiang AL, Liu BC, Xing CY, et al. Распространенность и факторы риска кальцификации сосудов у китайских пациентов, получающих диализ: исходные результаты проспективного когортного исследования. Curr Med Res Opin . (2018) 34:1491–1500. дои: 10.1080/03007995.2018.1467886
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
5. Вонг Н.Д., Скиаммарелла М., Арад Ю., Миранда-Питс Р., Полк Д., Хахамович Р. и соавт.Отношение кальция грудной аорты и аортального клапана к кальцию коронарной артерии и оценка риска. Ам Дж Кардиол . (2003) 92:951–5. doi: 10.1016/S0002-9149(03)00976-7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
6. Chen Y, Zhao X, Wu H. Жесткость артерий: акцент на кальцификацию сосудов и ее связь с минерализацией костей. Артериосклеры Тромб Васк Биол . (2020) 40:1078–93. doi: 10.1161/ATVBAHA.120.313131
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
7.Neven E, Dauwe S, De Broe ME, D’Haese PC, Persy V. Формирование эндохондральной кости участвует в кальцификации среды у крыс и мужчин. Почки Int . (2007) 72: 574–81. doi: 10.1038/sj.ki.5002353
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
8. Невен Э., Перси В., Дауве С., Де Шуттер Т., Де Бро М.Е., Д’Хаезе П.С. Хондроцитарная, а не остеобластная конверсия сосудистых клеток лежит в основе медиальной кальцификации у уремических крыс. Артериосклеры Тромб Васк Биол. (2010) 30:1741–50. doi: 10.1161/ATVBAHA.110.204834
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
9. Schmidt N, Brandsch C, Schutkowski A, Hirche F, Stangl GI. Недостаток витамина D в рационе ускоряет кальцификацию и образование остеобластоподобных клеток в сосудистой системе мышей с нокаутом рецептора ЛПНП и мышей дикого типа. Дж Нутр . (2014) 144: 638–46. doi: 10.3945/jn.113.189118
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
10.Лин М.Э., Чен Т.М., Уоллингфорд М.С., Нгуен Н.Б., Ямада С., Савангмаке С. и др. Делеция Runx2 в гладкомышечных клетках ингибирует сосудистый остеохондрогенез и кальцификацию, но не образование атеросклеротических поражений. Кардиоваскулярный рез. (2016) 112:606–16. doi: 10.1093/cvr/cvw205
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
11. Рашдан Н.А., Сим А.М., Цуй Л., Фадвал К., Робертс Ф.Л., Картер Р. и соавт. Остеокальцин регулирует артериальную кальцификацию посредством измененной передачи сигналов Wnt и метаболизма глюкозы. J Шахтер по кости Res . (2020) 35:357–67. doi: 10.1002/jbmr.3888
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
12. Lampropoulos CE, Kalamara P, Konsta M, Papaioannou I, Papadima E, Antoniou Z, et al. Остеопороз и кальцификация сосудов у женщин в постменопаузе: перекрестное исследование. Климактерический период . (2016) 19:303–7. дои: 10.3109/13697137.2016.1164134
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
13.De Schutter TM, Neven E, Persy VP, Behets GJ, Postnov AA, De Clerck NM, et al. Сосудистая кальцификация связана с потерей кортикальной кости у крыс с хронической почечной недостаточностью с овариэктомией и без нее: парадокс кальцификации. Am J Нефрол . (2011) 34:356–66. дои: 10.1159/000331056
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
14. Kiel DP, Kauppila LI, Cupples LA, Hannan MT, O’Donnell CJ, Wilson PW. Потеря костной массы и прогрессирование кальцификации брюшной аорты за 25-летний период: Framingham Heart Study. Calcif Tissue Int . (2001) 68:271–6. дои: 10.1007/BF023
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
15. Choi SH, An JH, Lim S, Koo BK, Park SE, Chang HJ, et al. Более низкая минеральная плотность костной ткани связана с более высокой коронарной кальцификацией и коронарными бляшками по данным многодетекторной коронарной компьютерной томографии у женщин в пре- и постменопаузе. Клин Эндокринол . (2009) 71:644–51. doi: 10.1111/j.1365-2265.2009.03535.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
16.Сотомайор К.Г., Бенджаменс С., Гомеш-Нето А.В., Пол Р.А., Гроотхоф Д., Те Вельде-Кейзер К.А. и соавт. Минеральная плотность костей и кальцификация аорты: свидетельство костно-сосудистой оси после трансплантации почки. Трансплантация . (2020) 105: 231–9. дои: 10.1097/TP.0000000000003226
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
17. Де Маре А., Модсли С., Азми А., Хендриккс Дж. О., Опдебек Б., Невен Э. и соавт. Склеростин как регуляторная молекула при кальцификации сосудистой среды и костно-сосудистой оси. Токсины . (2019) 11:70428. doi: 10.3390/toxins11070428
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
18. Fakhry M, Roszkowska M, Briolay A, Bougault C, Guignandon A, Diaz-Hernandez JI, et al. TNAP стимулирует трансдифференцировку гладкомышечных клеток сосудов в хондроциты посредством отложения кальция и активации BMP-2: возможное влияние на стабильность атеросклеротических бляшек. Биохимика и Биофизика Acta . (2017) 1863: 643–53. дои: 10.1016/j.bbadis.2016.12.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
19. Kurozumi A, Nakano K, Yamagata K, Okada Y, Nakayamada S, Tanaka Y. IL-6 и sIL-6R индуцируют STAT3-зависимую дифференцировку человеческих VSMCs в остеобластоподобные клетки посредством JMJD2B-опосредованного гистонового деметилирования RUNX2. Кость . (2019) 124:53–61. doi: 10.1016/j.bone.2019.04.006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
20. Перис П., Аткинсон Э.Дж., Госсл М., Кейн Т.Л., Маккриди Л.К., Лерман А. и соавт.Влияние лечения бисфосфонатами на циркулирующие остеогенные эндотелиальные клетки-предшественники у женщин в постменопаузе. Mayo Clin Proc . (2013) 88:46–55. doi: 10.1016/j.mayocp.2012.08.019
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
21. Доэрти М.Дж., Эштон Б.А., Уолш С., Бересфорд Дж.Н., Грант М.Е., Кэнфилд А.Е. Сосудистые перициты экспрессируют остеогенный потенциал in vitro и in vivo . J Шахтер по кости Res . (1998) 13:828–38.doi: 10.1359/jbmr.1998.13.5.828
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
22. Санчес-Дуффхьюс Г., Гарсия де Винуэса А., ван де Пол В., Гертс М.Е., де Врис М.Р., Янсон С.Г.Т. и соавт. Воспаление индуцирует эндотелиально-мезенхимальный переход и способствует кальцификации сосудов за счет подавления BMPR2. Дж Патол . (2019) 247:333–46. doi: 10.1002/path.5193
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
23.Калбаси Анараки П., Патецки М., Ларманн Дж., Ткачук С., Юрк К., Халлер Х. и др. Рецептор урокиназы опосредует остеогенную дифференцировку мезенхимальных стволовых клеток и кальцификацию сосудов посредством рецептора комплемента C5a. Стволовые клетки Dev . (2014) 23:352–62. doi: 10.1089/scd.2013.0318
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
24. Lu Z, Chiu J, Lee LR, Schindeler A, Jackson M, Ramaswamy Y, et al. Репрограммирование фибробластов человека в остеобласты белком, связывающим инсулиноподобный фактор роста 7. Стволовые клетки Transl Med . (2020) 9: 403–15. doi: 10.1002/sctm.19-0281
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
25. Блейер А.Дж., Буркарт Дж., Пьяцца М., Рассел Г., Рор М., Карр Дж.Дж. Изменения сердечно-сосудистой кальцификации после паратиреоидэктомии у больных с ХПН. Am J Почки Dis . (2005) 46:464–9. doi: 10.1053/j.ajkd.2005.04.035
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
26. Лопес И., Мендоса Ф.Дж., Герреро Ф., Альмаден Ю., Хенли С., Агилера-Техеро Э. и другие.Кальцимиметик AMG 641 ускоряет регрессию внекостной кальцификации у уремических крыс. Am J Physiol Renal Physiol . (2009) 296:F1376-85. doi: 10.1152/ajprenal..2008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
27. De Schutter TM, Behets GJ, Geryl H, Peter ME, Steppan S, Gundlach K, et al. Влияние фосфатсвязывающего средства на основе магния на медиальную кальцификацию в крысиной модели уремии. Почки Int . (2013) 83:1109–17. дои: 10.1038/ки.2013.34
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
28. Finch JL, Lee DH, Liapis H, Ritter C, Zhang S, Suarez E, et al. Ограничение фосфатов значительно снижает смертность у уремических крыс с установленной сосудистой кальцификацией. Почки Int . (2013) 84:1145–53. doi: 10.1038/ki.2013.213
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
29. Yamada S, Tatsumoto N, Tokumoto M, Noguchi H, Ooboshi H, Kitazono T, et al.Связывающие фосфаты предотвращают индуцированное фосфатом клеточное старение гладкомышечных клеток сосудов и кальцификацию сосудов в модифицированной крысиной модели уремии на основе аденина. Calcif Tissue Int . (2015) 96:347–58. doi: 10.1007/s00223-014-9929-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
30. Schurgers LJ, Spronk HM, Soute BA, Schiffers PM, DeMey JG, Vermeer C. Регресс медиального эластокальциноза, вызванного варфарином, при высоком потреблении витамина К у крыс. Кровь . (2007) 109:2823–31. doi: 10.1182/blood-2006-07-035345
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
31. Essalihi R, Dao HH, Gilbert LA, Bouvet C, Semerjian Y, McKee MD, et al. Регресс медиального эластокальциноза в аорте крыс: новая сосудистая функция карбоангидразы. Тираж . (2005) 112:1628–35. doi: 10.1161/РАСПИСАНИЕAHA.104.528984
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
32.Bas A, Lopez I, Perez J, Rodriguez M, Aguilera-Tejero E. Обратимость кальцитриол-индуцированной кальцификации медиальной артерии у крыс с неповрежденной функцией почек. J Bone Mineral Res . (2005) 21:484–90. doi: 10.1359/JBMR.051211
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
33. Lei Y, Sinha A, Nosoudi N, Grover A, Vyavahare N. Гидроксиапатит и кальцифицированный эластин вызывают остеобластоподобную дифференцировку в гладкомышечных клетках аорты крысы. Разрешение ячейки опыта .(2014) 323:198–208. doi: 10.1016/j.yexcr.2014.01.011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
34. Arthur A, Nguyen TM, Paton S, Klisuric A, Zannettino ACW, Gronthos S. Потеря эфрина B1, специфичная для остеопредшественников, приводит к остеопоротическому фенотипу, влияющему на баланс между образованием и резорбцией кости. Научный представитель . (2018) 8:12756. doi: 10.1038/s41598-018-31190-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
35.Wang X, Wu J, Shidoji Y, Muto Y, Ohishi N, Yagi K и др. Эффекты геранилгерановой кислоты в костях: индукция дифференцировки остеобластов и ингибирование образования остеокластов. J Шахтер по кости Res . (2002) 17:91–100. doi: 10.1359/jbmr.2002.17.1.91
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
36. Li J, Xing G, Zhang L, Shang J, Li Y, Li C, et al. Satb1 способствует остеокластогенезу, рекрутируя CBP для усиления экспрессии miR-223 при хроническом заболевании почек — минеральном и костном расстройстве. Аптека . (2017) 72:680–6. doi: 10.1691/ph.2017.7606
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
37. Ge Q, Ruan CC, Ma Y, Tang XF, Wu QH, Wang JG, et al. Остеопонтин регулирует активацию макрофагов и образование остеокластов у пациентов с артериальной гипертензией и кальцинозом сосудов. Научный представитель . (2017) 7:40253. дои: 10.1038/srep40253
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
38. Qiao JH, Mishra V, Fishbein MC, Sinha SK, Rajavashist TB.Многоядерные гигантские клетки в атеросклеротических бляшках сонных артерий человека: идентификация остеокластоподобных клеток и их специфических белков в стенке артерии. Опыт Мол Патол . (2015) 99: 654–62. doi: 10.1016/j.yexmp.2015.11.010
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
39. Cho HJ, Cho HJ, Lee HJ, Song MK, Seo JY, Bae YH и др. Сосудистые кальцифицирующие клетки-предшественники обладают потенциалом двунаправленной дифференцировки. ПЛОС Биол .(2013) 11:e1001534. doi: 10.1371/journal.pbio.1001534
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
40. Simpson CL, Lindley S, Eisenberg C, Basalyga DM, Starcher BC, Simionescu DT, et al. На пути к клеточной терапии кальцификации сосудов: остеокласт-опосредованная деминерализация кальцифицированного эластина. Кардиоваскулярный патол . (2007) 16:29–37. doi: 10.1016/j.carpath.2006.07.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
41.Урри ДВ. Нейтральные сайты для связывания ионов кальция с эластином и коллагеном: теория нейтрализации заряда для кальцификации и ее связь с атеросклерозом. Proc Natl Acad Sci USA . (1971) 68:810–4. doi: 10.1073/pnas.68.4.810
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
42. Спир М.Ю., Ян Х.И., Брэбб Т., Лиф Э., Лук А., Лин В.Л. и др. Гладкомышечные клетки дают начало остеохондрогенным предшественникам и хондроцитам в кальцифицирующих артериях. Circ Res .(2009) 104:733–41. doi: 10.1161/CIRCRESAHA.108.183053
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
43. Монтезано А.С., Циммерман Д., Юсуф Х., Бургер Д., Чигналиа А.З., Вадхера В. и соавт. Дифференциация гладкомышечных клеток сосудов до остеогенного фенотипа включает модуляцию TRPM7 магнием. Гипертония . (2010) 56:453–62. doi: 10.1161/HYPERTENSIONAHA.110.152058
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
44.Сильвер ФХ, Лэндис ВДж. Отложение апатита в минерализующемся внеклеточном матриксе позвоночных: модель возможных мест зародышеобразования на коллагене I типа. Соединить ткани Res . (2011) 52:242–54. дои: 10.3109/03008207.2010.551567
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
45. Kuzan A, Chwilkowska A, Pezowicz C, Witkiewicz W, Gamian A, Maksymowicz K, et al. Содержание коллагена II типа в артериях человека коррелирует со стадией атеросклероза и очагами кальцификации. Кардиоваскулярный патол . (2017) 28:21–7. doi: 10.1016/j.carpath.2017.02.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
46. Тейлор Дж., Батчер М., Зеадин М., Политано А., Шонесси С.Г. Окисленный липопротеин низкой плотности способствует дифференцировке остеобластов в первичных культурах гладкомышечных клеток сосудов путем повышения экспрессии Osterix Msx2-зависимым образом. J Cell Biochem . (2011) 112:581–8. doi: 10.1002/jcb.22948
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
47.Xu Z, Ji G, Shen J, Wang X, Zhou J, Li L. SOX9 и миокардин противодействуют друг другу в регуляции дифференцировки гладкомышечных клеток сосудов. Biochem Biophys Res Commun . (2012) 422: 285–90. doi: 10.1016/j.bbrc.2012.04.149
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
48. Hayashi K, Nakamura S, Nishida W, Sobue K. MSX1 и MSX2, индуцированные костным морфогенетическим белком, ингибируют транскрипцию миокардин-зависимого гена гладких мышц. Мол Селл Биол .(2006) 26:9456–70. doi: 10.1128/MCB.00759-06
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
49. Чжао Ю.Г., Мэн Ф.С., Ли Б.В., Шэн Ю.М., Лю М.М., Ван Б. и др. Желатиназы способствуют кальцификации клеток гладкой мускулатуры сосудов путем активизации костного морфогенетического белка-2. Biochem Biophys Res Commun . (2016) 470: 287–93. doi: 10.1016/j.bbrc.2016.01.067
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
50. Дзаццерони Л., Фаджоли Г., Паскинелли Г.Механизмы кальцификации артерий: роль матриксных пузырьков. Eur J Vasc Endovasc Surg . (2018) 55:425–32. doi: 10.1016/j.ejvs.2017.12.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
51. Капустин А.Н., Дэвис Дж.Д., Рейнольдс Дж.Л., Макнейр Р., Джонс Г.Т., Сидибе А. и соавт. Кальций регулирует ключевые компоненты матриксных везикул гладкомышечных клеток сосудов, усиливая минерализацию. Circ Res . (2011) 109: e1–12. doi: 10.1161/CIRCRESAHA.110.238808
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
52. Капустин А.Н., Чатроу М.Л., Дроздов И., Чжэн Ю., Дэвидсон С.М., Сун Д. и соавт. Кальцификация гладкомышечных клеток сосудов опосредована регулируемой секрецией экзосом. Circ Res . (2015) 116:1312–23. doi: 10.1161/CIRCRESAHA.116.305012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
53. Chaudhary SC, Khalid S, Smethurst V, Monier D, Mobley J, Huet A, et al. Протеомное профилирование внеклеточных везикул, высвобождаемых из гладкомышечных клеток сосудов во время инициации фосфат-индуцированной минерализации. Соединить ткани Res . (2018) 59 (приложение 1): 55–61. дои: 10.1080/03008207.2018.1444759
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
54. Balcerzak M, Malinowska A, Thouverey C, Sekrecka A, Dadlez M, Buchet R, et al. Протеомный анализ везикул матрикса, выделенных из бедренных костей куриного эмбриона. Протеомика . (2008) 8:192–205. doi: 10.1002/pmic.200700612
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
55. Куи Л., Хьюстон Д.А., Фаркуарсон С., Макрей В.Е.Характеристика пузырьков матрикса в минерализации скелета и мягких тканей. Кость . (2016) 87:147–58. doi: 10.1016/j.bone.2016.04.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
56. Nahar-Gohad P, Gohad N, Tsai CC, Bordia R, Vyavahare N. Гладкомышечные клетки аорты крыс, культивированные на гидроксиапатите, дифференцируются в остеобластоподобные клетки посредством пути BMP-2-SMAD-5. Calcif Tissue Int . (2015) 96:359–69. doi: 10.1007/s00223-015-9962-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
57.Невен Э., Опдебек Б., Де Маре А., Башир-Дар Р., Дамс Г., Мариниссен Р. и др. Может ли связывание фосфатов в кишечнике или ингибирование роста гидроксиапатита в сосудистой стенке остановить прогрессирование установившейся кальцификации аорты при хроническом заболевании почек? Calcif Tissue Int . (2016) 99: 525–34. doi: 10.1007/s00223-016-0178-7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
58. Кирш Т., Харрисон Г., Голуб Э.Е., Нах Х.Д. Роль аннексинов и коллагена типов II и X в опосредованной пузырьками матрикса минерализации хряща пластинки роста. J Биол Хим . (2000) 275:35577–83. doi: 10.1074/jbc.M005648200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
59. Чен Н.С., О’Нил К.Д., Мо С.М. Везикулы матрикса индуцируют кальцификацию гладкомышечных клеток сосудов реципиента посредством множественных сигнальных путей. Почки Int . (2017) 93:343–54. doi: 10.1016/j.kint.2017.07.019
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
60. Чатурведи П., Чен Н.С., О’Нил К., МакКлинтик Дж.Н., Мо С.М., Джанга С.К.Дифференциальная экспрессия микроРНК в клетках и везикулах матрикса гладкомышечных клеток сосудов крыс с заболеванием почек. ПЛОС ОДИН . (2015) 10:e0131589. doi: 10.1371/journal.pone.0131589
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
62. Оуэнс Г.К. Молекулярный контроль дифференцировки гладкомышечных клеток сосудов и фенотипической пластичности. Компания Novartis обнаружила симптом . (2007) 283:174–91. дои: 10.1002/9780470319413.ch24
Полнотекстовая перекрестная ссылка | Академия Google
63.Фрисмантьен А., Филиппова М., Эрне П., Ресинк Т.Дж. Гладкомышечные сосудистые заболевания и молекулярные механизмы пластичности ГМКС. Сотовый сигнал . (2018) 52:48–64. doi: 10.1016/j.cellsig.2018.08.019
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
64. Lee GL, Yeh CC, Wu JY, Lin HC, Wang YF, Kuo YY, et al. TLR2 способствует хондрогенной дифференцировке гладкомышечных клеток сосудов и последующей кальцификации посредством согласованных действий подавления остеопротегерина и опосредованной IL-6 индукции RANKL. Артериосклеры Тромб Васк Биол . (2019) 39: 432–45. doi: 10.1161/ATVBAHA.118.311874
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
65. Shen J, Yang M, Jiang H, Ju D, Zheng JP, Xu Z, et al. Артериальное повреждение способствует медиальному хондрогенезу у мышей с нокаутом Sm22. Cardiovasc Res . (2011) 90:28–37. doi: 10.1093/cvr/cvq378
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
66. McRobb LS, McGrath KCY, Tsatralis T, Liong EC, Tan JTM, Hughes G, et al.Рецептор эстрогена контролирует атеросклеротическую кальцификацию и остеогенную дифференцировку гладкомышечных клеток. Артериосклеры Тромб Васк Биол . (2017) 37:1127–37. doi: 10.1161/ATVBAHA.117.309054
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
67. Naik V, Leaf EM, Hu JH, Yang HY, Nguyen NB, Giachelli CM, et al. Источники клеток, которые способствуют атеросклеротической кальцификации интимы: исследование генетического картирования in vivo . Cardiovasc Res .(2012) 94:545–54. doi: 10.1093/cvr/cvs126
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
68. Wirka RC, Wagh D, Paik DT, Pjanic M, Nguyen T, Miller CL, et al. Атерозащитная роль фенотипической модуляции гладкомышечных клеток и гена заболевания TCF21, выявленная с помощью анализа отдельных клеток. Nat Med . (2019) 25:1280–9. doi: 10.1038/s41591-019-0512-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
69. Espitia O, Chatelais M, Steenman M, Charrier C, Maurel B, Georges S, et al.Влияние молекулярной гетерогенности гладкомышечных клеток сосудов среди артериальных русел на артериальную кальцификацию. ПЛОС ОДИН . (2018) 13:e01
. doi: 10.1371/journal.pone.01
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
70. Tang R, Gao M, Wu M, Liu H, Zhang X, Liu B. Высокий уровень глюкозы опосредует переход эндотелия в хондроцит в эндотелиальных клетках аорты человека. Сердечно-сосудистый Диабетол . (2012) 11:113. дои: 10.1186/1475-2840-11-113
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
71.Дерволл М., Малхотра Р., Лай С.С., Беппу Ю., Айкава Э., Сихра Дж.С. и др. Ингибирование передачи сигналов костного морфогенетического белка снижает кальцификацию сосудов и атеросклероз. Артериосклеры Тромб Васк Биол . (2012) 32:613–22. doi: 10.1161/ATVBAHA.111.242594
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
72. Юнг Л-М, Санчес-Дуффьюс Г., тен Дейке П., Ю П.Б. Костный морфогенетический белок 6 и окисленный липопротеин низкой плотности синергически задействуют остеогенную дифференцировку в эндотелиальных клетках. Cardiovasc Res . (2015) 108: 278–87. Дои: 10.1093/cvr/cvv221
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
73. Malhotra R, Burke MF, Martyn T, Shakartzi HR, Thayer TE, O’Rourke C, et al. Ингибирование передачи сигнала костного морфогенетического белка предотвращает кальцификацию медиальных сосудов, связанную с дефицитом белка матрикса Gla. ПЛОС ОДИН . (2015) 10:e0117098. doi: 10.1371/journal.pone.0117098
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
74.Яо Ю., Джумабай М., Ли А., Радпарвар М., Кабберли М. Р., Бострём К. И. Роль эндотелия в кальцификации сосудов. Циркуляционный рез. . (2013) 113:495–504. doi: 10.1161/CIRCRESAHA.113.301792
Полнотекстовая перекрестная ссылка | Академия Google
75. Guihard PJ, Yao J, Blazquez-Medela AM, Iruela-Arispe L, Bostrom KI, Yao Y. Эндотелиально-мезенхимальный переход при кальцификации сосудов мышей Ins2Akita/+. ПЛОС ОДИН . (2016) 11:e0167936. doi: 10.1371/journal.pone.0167936
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
76.Давенпорт С., Харпер Э., Форде Х., Рочфорт К.Д., Мерфи Р.П., Смит Д. и др. RANKL способствует активности остеобластов в гладкомышечных клетках сосудов путем усиления высвобождения эндотелиального BMP-2. Int J Biochem Cell Biol . (2016) 77:171–80. doi: 10.1016/j.biocel.2016.06.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
77. Рутковский А., Лунд М., Сиамансур Т.С., Рейне Т.М., Колсет С.О., Санд К.Л. и соавт. Механический стресс изменяет экспрессию генов, связанных с кальцификацией, в сосудистых интерстициальных и эндотелиальных клетках. Interact Cardiovasc Thorac Surg . (2019) 28:803–11. doi: 10.1093/icvts/ivy339
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
78. Bouabdallah J, Zibara K, Issa H, Lenglet G, Kchour G, Caus T, et al. Эндотелиальные клетки, подвергшиеся воздействию фосфата и индоксилсульфата, способствуют кальцификации сосудов за счет секреции интерлейкина-8. Трансплантат нефролового диска . (2019) 34:1125–34. doi: 10.1093/ndt/gfy325
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
79.Алике М., Руис-Торрес М.П., Бодега Г., Ночи М.В., Трояно Н., Бохоркес Л. и др. Микровезикулы из плазмы пожилых людей и из стареющих эндотелиальных клеток способствуют кальцификации сосудов. Старение . (2017) 9: 778–89. doi: 10.18632/aging.101191
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
80. Davaine JM, Quillard T, Chatelais M, Guilbaud F, Brion R, Guyomarch B, et al. Костноподобная артериальная кальцификация при атеросклеротических поражениях бедренной кости: распространенность и роль остеопротегерина и перицитов. Eur J Vasc Endovasc Surg . (2016) 51: 259–67. doi: 10.1016/j.ejvs.2015.10.004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
81. Aikawa E, Davaine J-M, Quillard T, Brion R, Laperine O, Guyomarch B, et al. Остеопротегерин, перициты и костноподобная кальцификация сосудов связаны со стабильностью каротидных бляшек. ПЛОС ОДИН . (2014) 9:e107642. doi: 10.1371/journal.pone.0107642
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
82.Киртон Дж.П., Уилкинсон Ф.Л., Кэнфилд А.Е., Александр М.Ю. Дексаметазон подавляет молекулы-ингибиторы кальцификации и ускоряет остеогенную дифференцировку сосудистых перицитов: значение для сосудистой кальцификации. Circ Res . (2006) 98:1264–72. doi: 10.1161/01.RES.0000223056.68892.8b
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
83. Collett G, Wood A, Alexander MY, Varnum BC, Boot-Handford RP, Ohanian V, et al. Рецепторная тирозинкиназа Axl модулирует остеогенную дифференцировку перицитов. Circ Res . (2003) 92:1123–9. doi: 10.1161/01.RES.0000074881.56564.46
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
84. Yamagishi S, Fujimori H, Yonekura H, Tanaka N, Yamamoto H. Конечные продукты гликирования ускоряют кальцификацию перицитов микрососудов. Biochem Biophys Res Commun . (1999) 258:353–7. doi: 10.1006/bbrc.1999.0625
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
85. Canfield AE, Doherty MJ, Wood AC, Farrington C, Ashton B, Begum N, et al.Роль перицитов в кальцификации сосудов: обзор. Z Кардиол . (2000) 89 (Приложение 2): 20–7. дои: 10.1007/s003
0096
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
86. Шор А.М., Аллен Т.Д., Кэнфилд А.Е., Слоан П., Шор С.Л. Перициты, полученные из микроциркуляторного русла сетчатки, подвергаются кальцификации in vitro . J Cell Sci . (1990) 97:449–61.
Реферат PubMed | Академия Google
88. Шао Дж.С., Ченг С.Л., Пингстерхаус Дж.М., Чарльтон-Качигян Н., Лоуи А.П., Таулер Д.А.Msx2 способствует кальцификации сердечно-сосудистой системы путем активации паракринных сигналов Wnt. J Clin Investig . (2005) 115:1210–20. дои: 10.1172/JCI24140
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
89. Симионеску А., Симионеску Д.Т., Вявахаре Н.Р. Остеогенные ответы в фибробластах, активированных продуктами деградации эластина и трансформирующим фактором роста-бета1: роль миофибробластов в кальцификации сосудов. Ам Дж. Патол . (2007) 171:116–23. дои: 10.2353/ajpath.2007.060930
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
90. Ватанабэ Ю., Судзуки М., Ояма Ю., Кусано Э., Тамба К., Иимура О. и соавт. Клеточный компонент кальцификации сосудов. Фибробласты необходимы для отложения кальция в культивируемых клетках. Нефрон . (2002) 92:840–5. дои: 10.1159/000065461
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
91. Таулер Д.А., Ченг С.Л., Крчма К., Берманн А., Шао Дж.С., Лай С.Ф.TNFR1-активированные реактивные окислительные сигналы активируют программы остеогенного Msx2 в миофибробластах аорты. Эндокринология . (2012) 153:3897–910. doi: 10.1210/en.2012-1216
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
92. Suyama T, Hatta M, Hata S, Ishikawa H, Yamazaki J. Дифференциация дермальных мезенхимальных клеток крыс и кальцификация в трехмерных культурах. Tissue Eng Regen Med . (2016) 13: 527–37. doi: 10.1007/s13770-016-9124-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
93.Ляо Дж., Чен С., Ли И., Гэ З., Дуань Х., Цзоу И. и др. Перенос костномозговых мезенхимальных стволовых клеток влияет на ремоделирование сосудов и кальцификацию после баллонной травмы у крыс с гиперлипидемией. Дж Биомед Биотехнолог . (2012) 2012: 165296. дои: 10.1155/2012/165296
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
94. Kramann R, Kunter U, Brandenburg VM, Leisten I, Ehling J, Klinkhammer BM, et al. Остеогенез гетеротопически трансплантированных мезенхимальных стромальных клеток в крысиных моделях хронического заболевания почек. J Шахтер по кости Res . (2013) 28:2523–34. doi: 10.1002/jbmr.1994
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
95. Лещинская А., О’Доэрти А., Фаррелл Э., Пиндьякова Дж., О’Брайен Ф.Дж., О’Брайен Т. и соавт. Дифференцировка сосудистых стволовых клеток способствует эктопической кальцификации атеросклеротической бляшки. Стволовые клетки . (2016) 34:913–23. doi: 10.1002/стел.2315
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
96.Wang W, Li C, Pang L, Shi C, Guo F, Chen A, et al. Мезенхимальные стволовые клетки, рекрутированные активным TGFβ, способствуют остеогенной кальцификации сосудов. Стволовые клетки Dev . (2014) 23:1392–404. doi: 10.1089/scd.2013.0528
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
97. Wang S, Tong M, Hu S, Chen X. Биоактивное вещество, секретируемое МСК, замедляет кальцификацию гладкомышечных клеток аортальных сосудов мышей. Биомед Рез Инт . (2018) 2018: 6053567. дои: 10.1155/2018/6053567
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
98. Wang S, Hu S, Wang J, Liu Y, Zhao R, Tong M, et al. Кондиционированная среда из мезенхимальных стволовых клеток, полученных из костного мозга, ингибирует кальцификацию сосудов посредством блокады сигнального пути BMP2-Smad1/5/8. Резистентность стволовых клеток . (2018) 9:160. doi: 10.1186/s13287-018-0894-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
99. Cianciolo G, La Manna G, Della Bella E, Cappuccilli ML, Angelini ML, Dormi A, et al.Влияние терапии активатором рецептора витамина D на экспрессию рецептора витамина D и остеокальцина в циркулирующих эндотелиальных клетках-предшественниках у пациентов, находящихся на гемодиализе. Очиститель крови . (2013) 35:187–95. дои: 10.1159/000347102
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
100. Zhang H, Wang LJ, Si DL, Wang C, Yang JC, Jiang P, et al. Корреляция между остеокальцин-позитивными эндотелиальными клетками-предшественниками и точечной кальцификацией у пациентов с ишемической болезнью сердца. Clin Exp Pharmacol Physiol . (2015) 42:734–9. дои: 10.1111/1440-1681.12366
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
101. Дин Л., Веццани Б., Хан Н., Су Дж., Сюй Л., Ян Г. и другие. Экспрессия CD10 идентифицирует подмножество периваскулярных клеток-предшественников человека с высоким потенциалом пролиферации и кальцификации. Стволовые клетки . (2019) 38: 261–75. doi: 10.1002/стел.3112
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
102.Kramann R, Goettsch C, Wongboonsin J, Iwata H, Schneider RK, Kuppe C, et al. Адвентициальные МСК-подобные клетки являются предшественниками гладкомышечных клеток сосудов и вызывают кальцификацию сосудов при хроническом заболевании почек. Стволовая клетка . (2016) 19: 628–42. doi: 10.1016/j.stem.2016.08.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
103. Чо Х.Дж., Ли Дж.В., Чо Х.Дж., Ли К.С., Ким Х.С. Идентификация взрослых мезодермальных клеток-предшественников и иерархия атеросклеротической сосудистой кальцификации. Стволовые клетки . (2018) 36:1075–96. doi: 10.1002/стел.2814
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
104. Li R, Mittelstein D, Lee J, Fang K, Majumdar R, Tintut Y, et al. Динамическая модель дестабилизации кальцифицирующих узелков в ответ на действие матриксных металлопротеиназ, индуцированных моноцитами и окисленными липидами. Am J Physiol Cell Physiol . (2012) 302:C658–65. doi: 10.1152/ajpcell.00313.2011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
105.Яо Ю., Уотсон А.Д., Джи С., Бострём К.И. Белок теплового шока 70 усиливает передачу сигналов морфогенетическим белком-4 сосудистой кости путем связывания белка Gla матрикса. Циркуляционный рез. . (2009) 105:575–84. doi: 10.1161/CIRCRESAHA.109.202333
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
106. Li R, Mittelstein D, Kam W, Pakbin P, Du Y, Tintut Y, et al. Атмосферные ультрадисперсные частицы способствуют кальцификации сосудов через сигнальный путь NF-kappaB. Am J Physiol Cell Physiol .(2013) 304:C362–9. doi: 10.1152/ajpcell.00322.2012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
107. Radcliff K, Tang TB, Lim J, Zhang Z, Abedin M, Demer LL, et al. Инсулиноподобный фактор роста-I регулирует пролиферацию и дифференцировку остеобластов кальцифицирующих сосудистых клеток через пути протеинкиназы, регулируемой внеклеточным сигналом, и фосфатидилинозитол-3-киназы. Circ Res . (2005) 96:398–400. doi: 10.1161/01.RES.0000157671.47477.71
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
108. Abedin M, Lim J, Tang TB, Park D, Demer LL, Tintut Y. Жирные кислоты N-3 ингибируют кальцификацию сосудов через p38-митоген-активируемую протеинкиназу и рецептор-гамма-рецептор, активируемый пролифератором пероксисом. Circ Res . (2006) 98:727–9. doi: 10.1161/01.RES.0000216009.68958.e6
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
110. Oksala N, Levula M, Pelto-Huikko M, Kytomaki L, Soini JT, Salenius J, et al.Карбоангидразы II и XII активируются в остеокластоподобных клетках в прогрессирующих атеросклеротических бляшках человека – исследование сосудов Тампере. Энн Мед . (2010) 42:360–70. дои: 10.3109/07853890.2010.486408
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
111. Itou T, Maldonado N, Yamada I, Goettsch C, Matsumoto J, Aikawa M, et al. Цистатионин-гамма-лиаза ускоряет дифференцировку остеокластов: идентификация нового регулятора остеокластогенеза с помощью протеомного анализа. Артериосклеры Тромб Васк Биол . (2014) 34:626–34. doi: 10.1161/ATVBAHA.113.302576
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
112. Мазьер С., Луве Л., Гомила С., Камель С., Масси З., Мазьер Дж. К. Окисленный липопротеин низкой плотности снижает Rankl-индуцированную дифференцировку остеокластов путем ингибирования передачи сигналов Rankl. J Cell Physiol . (2009) 221:572–8. doi: 10.1002/jcp.21886
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
113.Lei Y, Iwashita M, Choi J, Aikawa M, Aikawa E. N-ацетилглюкозамин-1-фосфаттрансфераза подавляет лизосомальные гидролазы в дисфункциональных остеокластах: потенциальный механизм кальцификации сосудов. J Cardiovasc Dev Dis . (2015) 2:31–47. doi: 10.3390/jcdd2020031
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
114. Barinda AJ, Ikeda K, Hirata KI, Emoto N. Макрофаги высоко экспрессируют карбоангидразу 2 и играют важную роль в деминерализации эктопической кальцификации. Кобе J Med Sci . (2017) 63: E45–50.
Реферат PubMed | Академия Google
115. Tan L, Wang Z, Li Y. Модели кроликов дают представление о биологическом процессе, связанном с формированием кости, при атеросклеротической кальцификации сосудов. Biochem Biophys Res Commun . (2018) 496:1369–75. doi: 10.1016/j.bbrc.2018.02.035
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
116. Byon CH, Sun Y, Chen J, Yuan K, Mao X, Heath JM, et al. Активатор рецептора лиганда ядерного фактора kappaB, регулируемый Runx2, в кальцифицирующих гладкомышечных клетках способствует миграции и остеокластической дифференцировке макрофагов. Артериосклеры Тромб Васк Биол . (2011) 31:1387–96. doi: 10.1161/ATVBAHA.110.222547
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
117. Hodroge A, Trecherel E, Cornu M, Darwiche W, Mansour A, Ait-Mohand K, et al. Олигогалактуроновая кислота ингибирует кальцификацию сосудов по двум механизмам: ингибирование остеогенного превращения гладкомышечных клеток сосудов и взаимодействие с коллагеном. Артериосклеры Тромб Васк Биол . (2017) 37:1391–401. дои: 10.1161/АТВБАХА.117.309513
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
118. Shi Y, Lu W, Hou Y, Fu K, Gan F, Liu J. Фактор роста фибробластов 21 улучшает кальцификацию сосудов путем ингибирования остеогенного перехода у крыс, получавших витамин D3 плюс никотин. Biochem Biophys Res Commun . (2018) 495:2448–55. doi: 10.1016/j.bbrc.2017.10.115
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
119. Сапкота М., Шреста С.К., Ян М., Пак Ю.Р., Со Ю.Алоэ-эмодин ингибирует остеогенную дифференцировку и кальцификацию гладкомышечных клеток сосудов мышей. Евро J Pharmacol . (2019) 865:172772. doi: 10.1016/j.ejphar.2019.172772
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
120. Chinetti-Gbaguidi G, Daoudi M, Rosa M, Vinod M, Louvet L, Copin C, et al. Альтернативные макрофаги человека заселяют кальцифицированные области атеросклеротических поражений и демонстрируют нарушенную RANKL-индуцированную активность резорбции кости остеокластами. Circ Res . (2017) 121:19–30. doi: 10.1161/CIRCRESAHA.116.310262
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
121. Guo Y, Bao S, Guo W, Diao Z, Wang L, Han X, et al. Экзосомы, полученные из мезенхимальных стволовых клеток костного мозга, облегчают индуцированную высоким содержанием фосфора кальцификацию гладкомышечных клеток сосудов путем модификации профилей микроРНК. Функция Integr Genomics . (2019) 19: 633–43. doi: 10.1007/s10142-019-00669-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
122.Zhu M, Fang X, Zhou S, Li W, Guan S. Косвенное совместное культивирование гладкомышечных клеток сосудов с мезенхимальными стволовыми клетками костного мозга ингибирует кальцификацию сосудов и подавляет сигнальные пути Wnt. Мол Мед Реп . (2016) 13:5141–8. doi: 10.3892/mmr.2016.5182
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
123. Yokote S, Katsuoka Y, Yamada A, Ohkido I, Yokoo T. Влияние трансплантации мезенхимальных стволовых клеток, полученных из жировой ткани, на кальцификацию сосудов у крыс с аденин-индуцированным заболеванием почек.
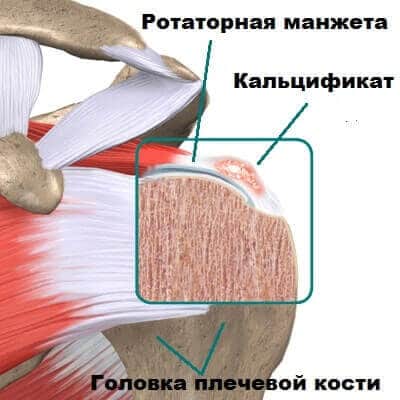



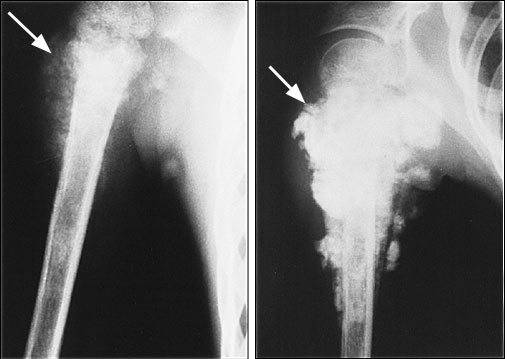
 015; α2AP ASO p = 0,017). Кроме того, истощение запасов ингибитора плазмина (α2AP ASO ), но не лечение аналогом пирофосфата, также значительно способствовало регенерации миоцитов (измеряемой по разрешению некроза; p = 0,018) по сравнению с мышами Plg +/– .
015; α2AP ASO p = 0,017). Кроме того, истощение запасов ингибитора плазмина (α2AP ASO ), но не лечение аналогом пирофосфата, также значительно способствовало регенерации миоцитов (измеряемой по разрешению некроза; p = 0,018) по сравнению с мышами Plg +/– .