Тестостерон (Т) | Новая диагностика
Срок выполнения, дней: 1
Код исследования: A117
У мужчин тестостерон практически полностью синтезируется клетками Лейдига в семенниках. Секреция тестостерона регулируется лютеинизирующим гормоном (ЛГ) и подвержена эффекту отрицательной обратной связи на уровне гипоталамуса. Тестостерон обеспечивает развитие вторичных половых признаков у мужчин и служит для подержания функции простаты и семенных пузырьков. Большая часть тестостерона в кровотоке связана с белками-носителями (ГСПГ = глобулин, связывающий половые гормоны). У женщин небольшое количество тестостерона формируется в яичниках. В физиологических концентрациях андрогены не оказывают особого влияния на женщин. Повышенный уровень синтеза тестостерона у женщин может привести к маскулинизации (в зависимости от уровня повышения). Измерение концентрации тестостерона у женщин используется при диагностике андрогенного синдрома (AGS), поликистозе яичников (синдром Штейна – Левенталя), при подозрении на рак яичников, рак надпочечников, гиперплазию надпочечников или овариальную недостаточность. Определение уровня тестостерона у мужчин применяется при подозрении на сниженный уровень выработки тестостерона, например, при гипогонадизме, лечении эстрогенами, хромосомных абберациях (как в случае с синдромом Клайнфелтера) и циррозе печени. Тестостерон оказывает анаболические эффекты на мышечную ткань, способствует созреванию костной ткани, стимулирует образование кожного сала железами кожи, участвует в регуляции синтеза липопротеидов печенью, модулирует синтез b-эндорфинов (“гормонов радости”), инсулина. У мужчин уровень тестостерона повышается в пубертатном периоде и сохраняется на высоком уровне, в среднем, до 60 лет. Уровень гормона в плазме крови колеблется в течение суток. Максимум концентрации наблюдается в утренние часы, минимум – в вечерние. Осенью концентрация тестостерона повышается. У женщин максимальная концентрация тестостерона определяется в лютеиновой фазе и в период овуляции. У беременных женщин концентрация тестостерона нарастает к III триместру, превышая почти в 3 раза концентрацию у небеременных женщин.
Определение уровня тестостерона у мужчин применяется при подозрении на сниженный уровень выработки тестостерона, например, при гипогонадизме, лечении эстрогенами, хромосомных абберациях (как в случае с синдромом Клайнфелтера) и циррозе печени. Тестостерон оказывает анаболические эффекты на мышечную ткань, способствует созреванию костной ткани, стимулирует образование кожного сала железами кожи, участвует в регуляции синтеза липопротеидов печенью, модулирует синтез b-эндорфинов (“гормонов радости”), инсулина. У мужчин уровень тестостерона повышается в пубертатном периоде и сохраняется на высоком уровне, в среднем, до 60 лет. Уровень гормона в плазме крови колеблется в течение суток. Максимум концентрации наблюдается в утренние часы, минимум – в вечерние. Осенью концентрация тестостерона повышается. У женщин максимальная концентрация тестостерона определяется в лютеиновой фазе и в период овуляции. У беременных женщин концентрация тестостерона нарастает к III триместру, превышая почти в 3 раза концентрацию у небеременных женщин. В период менопаузы концентрация тестостерона снижается.
В период менопаузы концентрация тестостерона снижается.
Подготовка пациента: Накануне исследования необходимо исключить физические нагрузки (спортивные тренировки) и курение. У женщин анализ производится на 6 – 7 день менструального цикла, если другие сроки не указаны лечащим врачом.
Ограничения: У пациентов, получающих лечение высокими дозами биотина (> 5 мг/день), следует брать пробы не раньше чем через 8 (восемь) часов после последнего введения биотина. В редких случаях возможна интерференция из-за чрезвычайно высокого титра антител к аналит-специфичным антителам, стрептавидину или рутению. Состав тест-системы позволяет свести к минимуму эти эффекты. Было обнаружено сильное взаимодействие с Нандролоном (МНН (международное незапатентованное название), ВОЗ). Не исследовать образцы пациентов, проходящих лечение Нандролоном. В редких случаях повышенные уровни тестостерона наблюдаются у пациентов женского пола с хронической почечной недостаточностью (ХПН).
Неправдоподобно завышенные значения тестостерона у женщин необходимо подтверждать с помощью экстракционного метода или утвержденного метода совместного использования жидкостной хроматографии/масс-спектрометрии.
Материал: Сбор сыворотки должен производиться с использованием стандартных пробирок для образцов или с помощью пробирок с разделяющим гелем. Li-гепарин, K2 и K3-ЭДТК плазма.
Стабильность пробы: 1 день при температуре 2-8 °C и один месяц при температуре – 20 °C. Замораживать только один раз.
Метод: электрохемилюминесцентный.
Анализатор: Сobas e411.
Тест – система: Testosterone II Roche Diagnostics (Германия).
Референсные значения (норма):
| Тестостерон, нмоль/л | Мужчины: до 1 года | 0,42 – 0,72 |
| 1 – 6 лет | 0,1 – 1,12 | |
| 7 – 12 лет | 0,1 – 2,37 | |
| 13 – 17 лет | 0,98 – 38,5 | |
| 17 – 50 лет | 8,64 – 29,0 | |
| Старше 50 лет | 6,68 — 25,7 | |
| Женщины: до 50 лет | 0,20 –1,65 | |
| старше 50 лет | 0,09 — 1,50 | |
| Беременность 1 нед 2 нед 3 нед 4 нед 5 нед 6 нед 7 нед 8 нед 9 нед 10 нед 11 нед 12 нед 13 нед 14 нед 15 нед 16 нед 17 нед 18 нед 19 нед 20 нед 21 нед 22 нед 23 нед 24 нед 25 нед 26 нед 27 нед 28 нед 29 нед 30 нед 31 нед 32 нед 33 нед 34 нед 35 нед 36 нед 37 нед 38 нед 39 нед 40 нед | 3,6 – 5,1 4,2 – 5,6 4,6 – 6,0 4,8 – 6,2 4,8 – 6,3 4,9 – 6,4 4,9 – 6,4 4,9 – 6,4 4,9 – 6,4 4,9 – 6,4 4,9 – 6,4 4,9 – 6,4 4,9 – 6,4 4,9 – 6,4 5 – 6,5 5 – 6,6 5,1 – 6,7 5,3 – 6,8 5,6 – 7,0 6,0 – 7,2 6,7 – 7,4 6,8 – 7,6 7,2 – 7,8 7,4 – 8,0 7,6 – 8,2 7,8 – 8,4 8,2 – 8,6 8,7 – 9,2 9 – 9,6 9,1 – 9,9 9,2 – 10,17 9,3 -10,35 9,3 – 10,53 9,3 – 10,62 9,3 – 10,71 9,3 – 10,71 9,3 – 10,8 9,3 – 10,8 9,3 – 10,8 9,3 – 10,8 |
Коэффициенты пересчета:
нг/мл x 3.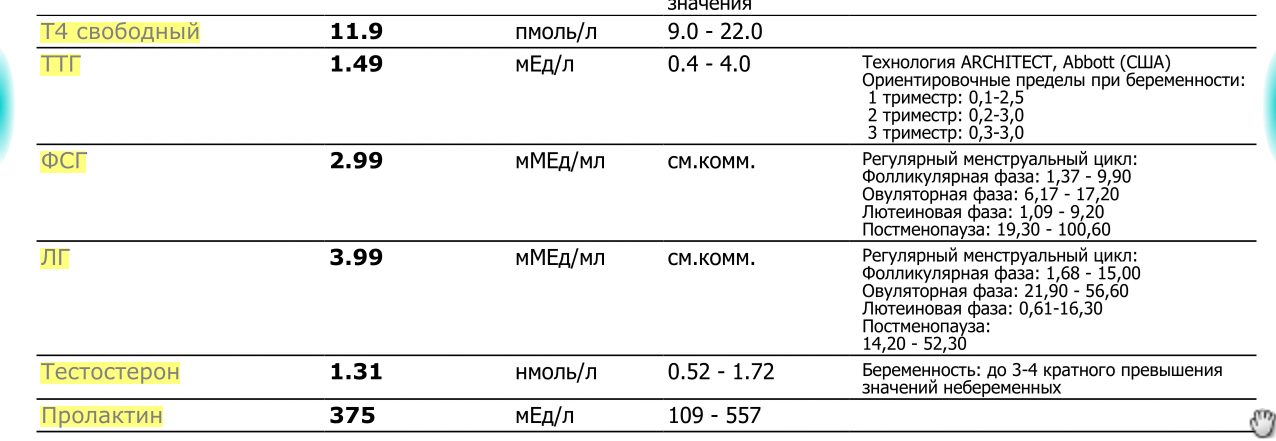 47 = нмоль/л;
47 = нмоль/л;
нг/мл x 100 = нг/дл;
нмоль/л x 0.288 = нг/мл.
Основные показания к назначению анализа:
У мужчин:
1. Первичный гипогонадизм;
2. Гипопитуитаризм;
3. Синдром Клайнфельтера;
4. Синдром Дауна;
5. Задержка полового созревания;
6. Эректильная дисфункция;
7. Бесплодие;
8. Лечение эстрогеном;
9. Цирроз печени;
10. Клиническое подозрение на избыток андрогена (опухоли коры надпочечников, раннее половое созревание).
У женщин:
1. Гирсутизм;
2. Ановуляция;
3. Аменорея;
4. Вирильный синдром;
5. Синдром поликистоза яичников;
6. Вирилизирующие опухоли яичника;
7. Опухоли коры надпочечников.
Интерпретация результатов: необходимо избегать сравнения результатов, полученных путем нескольких различных методов и в различные фазы менструального цикла, так как они могут существенно отличаться.
Повышенный уровень:
1. Гирсутизм;
2. Вирилизирующая опухоль надпочечников;
3. Синдром поликистозных яичников;
4. Резистентность к андрогенам.
Сниженный уровень:
1. Гипогонадизм;
2. Эректильная дисфункция;
3. Болезнь Альцгеймера;
4. Терапия антидепрессантами;
5. Дефицит цитохрома Р450.
как и где сдавать, описание, нормы, расшифровка результатов
Тестостерон — главный половой гормон мужчин, однако он вырабатывается и у женщин — правда, не в столь значительных количествах. Этот гормон выполняет ряд важнейших функций, в частности — регулирует мужскую фертильность и отвечает за половое созревание. Изменение уровня этого гормона и у женщин, и у мужчин может говорить о ряде серьезных нарушений, поэтому анализ на тестостерон представителям обоих полов назначают достаточно часто.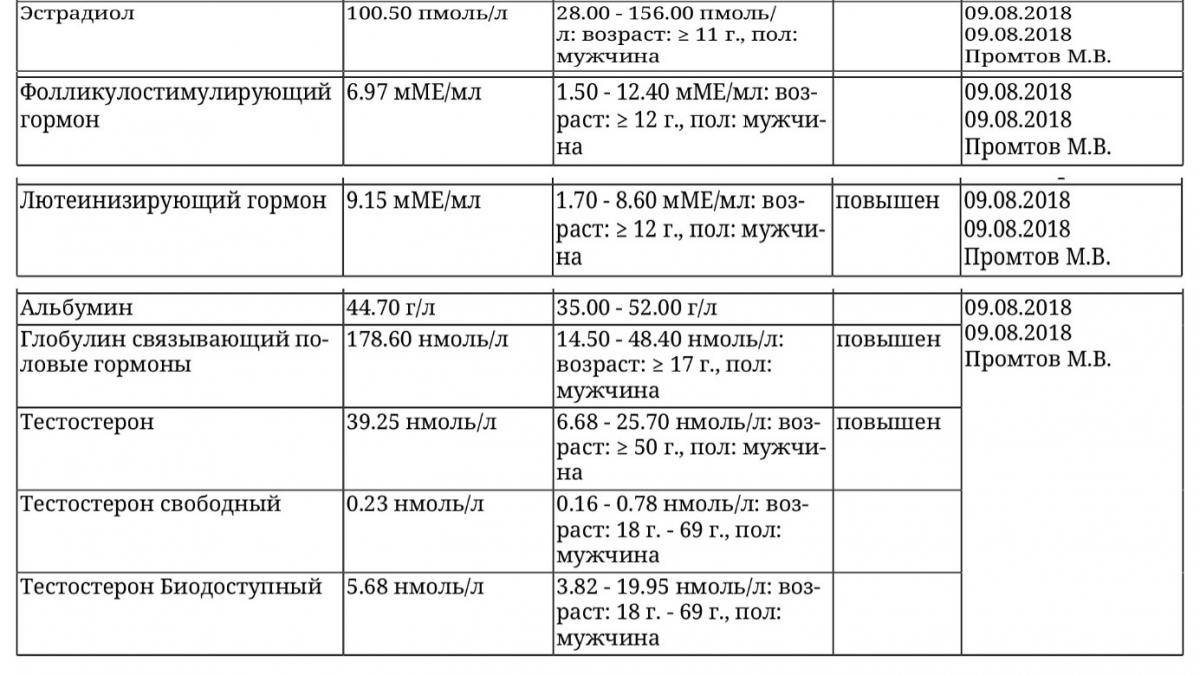
Что такое тестостерон и когда необходимо сдать кровь на анализ уровня гормона
У мужчин тестостерон вырабатывается в семенниках, у женщин — в яичниках и коре надпочечников. Тестостерон отвечает за развитие вторичных половых признаков и нормальное функционирование половой системы, синтез белка и настроение, а также за рост костей и мышц (в подростковом возрасте).
В крови тестостерон присутствует в свободном и связанном с белками состоянии. Лишь около 2% приходится на свободный тестостерон. 44% тестостерона в человеческом организме связано с глобулином (ГСПГ), а 54% — с альбумином или другими белками.
Как правило, для начала врач назначает проведение анализа на общий тестостерон, и если будет обнаружено отклонение от нормы, направляет на анализ на ГСПГ.
Показаниями для проведения анализа на тестостерон являются:
- бесплодие;
- опухоли надпочечников;
- ожирение;
- остеопороз;
- угревая сыпь;
- у мужчин: эректильная дисфункция, гипогонадизм, снижение либидо, хронический простатит, остеопороз, синдром Клайнфельтера;
- у женщин: нарушения менструального цикла, маточные кровотечения, невынашивание беременности, поликистоз яичников, адреногенитальный синдром, опухоли яичников, эндометриоз.
Подготовка к сдаче крови
Обычно направление на анализ тестостерона дает гинеколог, андролог, эндокринолог или репродуктолог. Чтобы результаты анализа на уровень тестостерона были точными, нужно заранее подготовиться к исследованию.
Чтобы результаты анализа на уровень тестостерона были точными, нужно заранее подготовиться к исследованию.
Нельзя сдавать кровь на тестостерон в течение суток после УЗИ, флюорографии или рентгена, а также физиотерапевтических процедур и ректального обследования. Врача следует предупредить, если вы принимаете какие-либо гормональные препараты, включая оральные контрацептивы и препараты для местного применения — например, гели и мази. Если речь не идет о сохранении здоровья и отмена препарата не грозит серьезными проблемами, прием этих средств лучше временно приостановить. Сдавать кровь на тестостерон можно через 2 недели после прекращения приема гормональных средств.
За сутки до сдачи анализа рекомендовано воздержаться от любых физических нагрузок, употребления спиртного и курения, а также жирной пищи. Кровь на тестостерон сдается строго натощак, утром (до 11 часов) — именно в этот период уровень тестостерона самый высокий.
Женщины должны сдавать кровь на тестостерон примерно на 6–7 день менструального цикла.
Процедура забора биоматериала
Для проведения анализа на тестостерон берется кровь из вены. Забор крови осуществляется квалифицированным специалистом в лаборатории. Для этого используется одноразовый шприц. Обычно пациент не испытывает никаких неприятных ощущений, поскольку объем крови, необходимой для проведения данного исследования, очень невелик.
Интерпретация результатов анализа крови на тестостерон
Принцип расшифровки результатов анализа почти всегда заключается в сравнении данных анализа пациента с референсными величинами, то есть нормой. Стоит иметь в виду, что единицы измерения в разных клиниках варьируются. Так уровень тестостерона может приводиться в нмоль/л, нг/мл, пг/мл.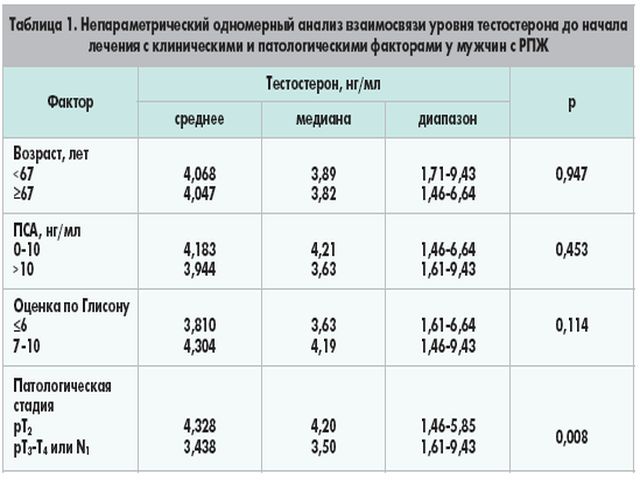
Обычно в бланках результатов анализа указываются нормативные величины в используемых клиникой единицах измерения, что позволяет пациенту сделать предварительный вывод о результатах анализа. Однако стоит понимать, что не всегда отклонение от нормы является следствием патологических процессов. Имеют место и физиологические колебания. Например, максимальная концентрация андрогенов (в том числе тестостерона) наблюдается ранним утром, после чего уровень начинает снижаться, достигая минимума в вечерние часы. Имеет место и циркадный ритм синтеза тестостерона: весной уровень этого гормона максимален, а зимой минимален. Кратковременные скачки концентрации могут наблюдаться по причине стресса, депрессии, после обильного приема пищи, серьезной физической нагрузки (что приводит к кратковременному повышению уровня тестостерона в крови). Такие колебания являются нормой.
Норма содержания тестостерона у женщин и мужчин
Нормальные показатели тестостерона в сыворотке крови изменяются в разных возрастных группах:
- мальчики/мужчины до 18 лет: от 0,2 нмоль/л до 37,67 нмоль/л;
- мужчины от 18 до 50 лет: от 5,76 нмоль/л до 30,43 нмоль/л;
- мужчины старше 50 лет: от 5,41–19,54 нмоль/л;
- девочки/женщины до 18 лет: от 0 до 4,73 нмоль/л;
- женщины старше 18 лет: 0,31–3,78 нмоль/л;
- беременные: 3–4-кратное увеличение нормы содержания гормона;
- женщины в период постменопаузы: 0,42–4,51 нмоль/л.

Уровень гормона повышен
Иногда высокий тестостерон не говорит о наличии серьезных патологий. У женщин ГСПГ повышается при приеме оральных контрацептивов и во время беременности. У обоих полов наблюдается высокий ГСПГ в случаях приема лекарств от эпилепсии и при гипертиреоидизме. Чаще всего повышенный уровень тестостерона сигнализирует о проблемах со здоровьем.
У женщин высокий тестостерон может указывать на генетические нарушения, гиперфункцию коры надпочечников, опухоли и другие патологии яичников, миому матки, эндометриоз, нарушения в работе гипофиза.
У мужчин повышенный тестостерон говорит о заболеваниях печени, раке простаты, гиперплазии коры надпочечников, заболеваниях, при которых организм теряет восприимчивость к андрогенам, cиндроме Рейфенштейна (мужской псевдогермафродитизм), опухолях гипофиза. Тестостерон повышается и при приеме стероидов.
Тестостерон повышается и при приеме стероидов.
Уровень гормона понижен
У мужчин снижение уровня тестостерона может быть связано с возрастными изменениями, и это вполне вписывается в норму. Но если уровень значительно понижен в сравнении со средними показателями определенной возрастной группы, это может указывать на наличие цирроза печени, гормонального дисбаланса, сахарного диабета, дисфункции яичек, заболеваний гипоталамуса и гипофиза. Пониженный уровень ГСПГ наблюдается также при ожирении, гипотиреоидизме и избытке андрогенов. Следует также отметить, что к понижению тестостерона может привести нездоровый образ жизни: курение, прием алкоголя и наркотиков, увлечение вредной едой, а также ослабление организма после болезни и длительное воздержание. У больных с синдромом Дауна тоже часто отмечается нехватка тестостерона.
Для женщин недостаток тестостерона — не столь грозный знак. Обычно уровень этого гормона заметно снижается с началом менопаузы. Но слишком низкий тестостерон может также говорить о почечной недостаточности. Кроме того, прием некоторых медикаментов может вызвать понижение уровня этого гормона — в первую очередь это относится к глюкокортикоидам, опиоидам и кетоконазолу.
Обычно уровень этого гормона заметно снижается с началом менопаузы. Но слишком низкий тестостерон может также говорить о почечной недостаточности. Кроме того, прием некоторых медикаментов может вызвать понижение уровня этого гормона — в первую очередь это относится к глюкокортикоидам, опиоидам и кетоконазолу.
В нашем организме, как и в природе вообще, все сбалансированно. И изменения в любую сторону — явный признак проблем со здоровьем или недостатков образа жизни. Более того, сам по себе дефицит или избыток тестостерона может очень сильно испортить здоровье. Слишком высокий уровень этого гормона приводит к появлению угрей и облысению, психологическим расстройствам вплоть до депрессии с суицидальными мыслями, бесплодию, заболеваниям сердца и сосудов, половым расстройствам.
Нехватка тестостерона также опасна — она чревата сердечно-сосудистыми заболеваниями, развитием ожирения и других эндокринных нарушений, остеопорозом, различными психоэмоциональными расстройствами и проблемами в половой сфере.
Анализ крови на уровень тестостерона — точный диагностический метод, который позволит доктору определить корень проблемы и назначить правильное лечение.
Раздел для практикующего врача, назначающего лечение, наглядно демонстрирующий применение новейших научных разработок в области медицины. Статьи носят рекомендательный характер, сочетая в себе практическую информацию и научные обзоры.
Автор: В.И. Аверина, к.м.н., ФМБЦ им. А.И.Бурназяна ФМБА России
Несмотря на многообразие подходов к лечению акне терапевтическими и косметическими средствами, проблема эта не исчерпана, напротив, в современных социально-экономических условиях она требует избирательного и максимально эффективного решения. Успех лечения зависит от опыта врача, его профессионального мышления, понимания механизмов заболевания.
Акне – это полиморфное мультифакторное заболевание волосяных фолликулов и сальных желез, возникающее в результате гиперпродукции сала, фолликулярного гиперкератоза, воспаления, дисбаланса липидов, некоторых половых гормонов и генетической предрасположенности.
Кожа является эндокринным органом, зеркалом метаболизма половых стероидных гормонов, действие которых осуществляется через специфические андрогенные RP. Андрогены усиливают дифференцировку и митотическую активность клеток эпидермиса, именно свободный тестостерон овариального происхождения, дегидроэпиандростерон и андростендион надпочечникового происхождения стимулируют секрецию кожного сала и величину сальных желез. Учитывая вышесказанное, пациента с диагнозом акне целесообразно комплексно обследовать на дерматологический и эндокринологический статус.
Аналогичным эффектом обладает прогестерон, который усиливает секрецию сальных желез за счет андрогенной и антиэстрогенной активности. Прогестерон является предшественником тестостерона, эстрогенов и адренокортикостероидов. Дисбаланс гормонального равновесия у пациентов с акне можно выразить в виде соотношения андрогены/эстрогены, где увеличение числителя и уменьшение знаменателя соответствует клинике акне. В связи с этим накануне менструации у здоровых женщин в результате действия прогестерона усиливается секрет кожного сала и появляются элементы акне.
Изменения функциональной активности эндокринной системы у здоровых лиц в разные периоды пубертата имеют свои особенности. На каждом этапе развития происходит последовательное включение и функционирование желез внутренней секреции, гормонов и биологически активных веществ. Они находятся в тесном взаимодействии с синтезом тестостерона (Т) и секс-стероидом, связывающим глобулин (ССГ), секретируемый гепатоцитами. Кроме того, меняются механизмы центральной регуляции гипоталамо-гипофизарной системы, что отражается на секреции половых стероидных гормонов.
Гиперсекреция кожного сала является следствием высокого уровня андрогенов и повышенной чувствительности к ним СЖ.
Если накануне менструации высокий уровень андрогенов в крови женщин соответствует физиологической норме, то в пубертатный период у пациентов с акне уровень андрогенов превышает уровень эстрогенов значительнее, чем у здоровых лиц. Уровень тестостерона и дегидротестостерона в 10–35 раз выше, чем у здоровых людей, причем у мужчин выше, чем у женщин. Повышенная активность α-редуктазы переводит свободный тестостерон в дегидротестостерон – основной гормон, стимулирующий гиперсекрецию сальной железы.
Повышенная активность α-редуктазы переводит свободный тестостерон в дегидротестостерон – основной гормон, стимулирующий гиперсекрецию сальной железы.
Маркерами скрытой гиперандрогении у лиц мужского пола являются повышение не общего тестостерона, а его свободной фракции и снижение ПССГ (Н.Е.Кушлинский, В.А.Самсонов, С.А.Масюкова, И.В.Саламова; 1996).
У женщин инициаторами дисфункций в сальном фолликуле являются андрогены надпочечников. В формировании участвует несколько механизмов: гипоталамо-гипофизарный, гонадный, надпочечниковый.
По результатам исследования основных гормонов гипофиза, яичников, надпочечников пациенток с клинической картиной акне можно разделить на следующие группы с доминирующим генетическим фактором: гиперандрогения преимущественно овариального генеза; гиперандрогения с умеренной гиперпролактинемией и вовлечением надпочечников; преимущественно с гиперпролактинемией; преимущественно с надпочечниковым пулом андрогенов.
Признаком гиперпролактинемии является повышенный уровень пролактинов или нормальный, но при соотношении ЛГ к ФСГ менее единицы.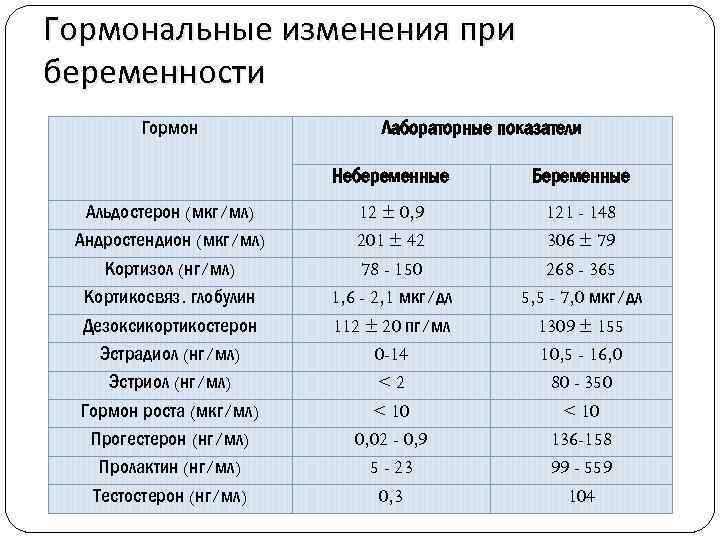 В случае скрытой пролактинемии за счет синтеза АТ к пролактину усиление синтеза ПРЛ подавляет синтез ЛГ.
В случае скрытой пролактинемии за счет синтеза АТ к пролактину усиление синтеза ПРЛ подавляет синтез ЛГ.
В случае гиперандрогении овариального генеза приблизительно в 12% случаев происходит повышение уровня ЛГ. Соотношение ЛГ к ФСГ менее 1,5–2. Уровень тестостерона часто повышен, при УЗИ более чем в 50% случаев выявлены множественные дисфункциональные кисты в яичниках без склерозирования белочной оболочки.
У пациентов с гиперпролактинемией и вовлечением надпочечников уровень пролактина умеренно повышен или нормальный. Индекс соотношения ЛГ к ФСГ менее единицы. Отмечается небольшое повышение уровня дегидроэпиандростерона сульфата. При УЗИ у пациенток этой группы замечены единичные кисты в яичниках приблизительно в 15% случаев. В группе больных преимущественно с гиперпролактинемией – небольшое повышение ПРЛ (иногда норма), индекс соотношения ЛГ к ФСГ менее единицы. У пациенток преимущественно с надпочечниковым пулом андрогенов наблюдается некоторое повышение дегидроэпиандростерона сульфата по сравнению со здоровыми пациентками.
Таким образом, угревая болезнь – андрогензависимое состояние кожи. Изменение состояния гонад, гипофиза, надпочечников, определяет патологическую секрецию уровня андрогенов. Инсулин усиливает андрогенизацию за счет стимуляции синтеза ЛГ гипофиза у пациенток с синдромом поликистоза яичников. У больных с угревой болезнью было замечено незначительное, но стабильное повышение уровня инсулина, индекс соотношения ЛГ к ФСГ менее единицы и умеренная пролактинемия.
Так как в основе патогенеза угревой болезни лежит повышенное выделение кожного сала и определенные иммунные процессы, именно состояние иммунитета привлекает внимание и является недостаточно изученным. В результате исследования установлено, что общее количество лейкоцитов, лимфоцитов, СД20+, СД8+-клеток не отличается от показателей контрольной группы. Содержание СД3+ и СД4+-лимфоцитов ниже контрольного уровня. Уровень клеток с маркером апоптоза (СД95+-лимфоцитов) значительно повышен у больных преимущественно с тяжелым течением заболевания. При слегка повышенном количестве сегментоядерных клеток отмечается значительное снижение их фагоцитарной активности и интенсивности фагоцитоза. При этом показатели гуморального иммунитета не изменены.
При слегка повышенном количестве сегментоядерных клеток отмечается значительное снижение их фагоцитарной активности и интенсивности фагоцитоза. При этом показатели гуморального иммунитета не изменены.
В связи с этим необходимо помнить, что и в тонком кишечнике, а также на всем протяжении толстого кишечника существуют лимфатические фолликулы. Обилие лимфатических узлов первого порядка, прилегающих к брыжейке, второго порядка, сопровождающих аорту и полую вену, восходят вдоль пищевода, трахеи в грудной лимфатический проток, далее образуют общий коллектор, который выполняет функцию общего регулятора – очистителя. Т-клеточный иммунитет организма находится в прямой связи с эвакуаторной функцией кишечника. Состояние микрофлоры кишечника при этом играет определенную роль. Наиболее резкие изменения микрофлоры кишечника присущи всем стадиям угревой болезни. Полученные данные свидетельствуют о существенном изменении иммунного статуса у больных с акне.
Необходимо помнить, что цинк играет немалую роль в развитии акне. Снижение цинка в сыворотке крове коррелирует с тяжестью заболевания (С.А.Колесниченко, 1998). По мнению многих авторов, растворимые соли цинка обладают антибактериальным, антиандрогенным действием за счет блокирования 5-α-редуктазы.
Снижение цинка в сыворотке крове коррелирует с тяжестью заболевания (С.А.Колесниченко, 1998). По мнению многих авторов, растворимые соли цинка обладают антибактериальным, антиандрогенным действием за счет блокирования 5-α-редуктазы.
По данным В.Н.Мордовцева, акне относят к наследственным заболеваниям по аллейным генам, детерминирующим функциональную способность сальных желез, гормонов, что определяет у одних пациентов физиологические акне, у других – развитие тяжелых форм болезни.
Клиническая картина
Различают невоспалительные и воспалительные клинические формы акне. При невоспалительной форме определяются закрытые или открытые комедоны. При этом микрокомедоны являются предшественниками закрытых и открытых форм. Воспалительные элементы разделяют на поверхностные (папулы и пустулы) и глубокие (узлы, кисты, глубокие пустулы). Степень выраженности процесса, симметричность распространения высыпаний позволяют оценить тяжесть заболевания.
Терапия
У пациентов с тяжелой степенью акне (при выраженном дермальном воспалении, гнойном расплавлении дермы) показано назначение системной монотерапии изотретиноином с четким подбором кумулятивной дозы. Это единственный препарат, влияющий на все звенья патогенеза угревой болезни. Изотретиноин, редуцируя сальные железы, уменьшает выработку кожного сала, комедонов, угнетает рост P. acne.
Это единственный препарат, влияющий на все звенья патогенеза угревой болезни. Изотретиноин, редуцируя сальные железы, уменьшает выработку кожного сала, комедонов, угнетает рост P. acne.
К системным препаратам, уменьшающим секрецию кожного сала, относят эстрогены, андрогены, которые назначают женщинам при неэффективности антибиотикотерапии. Системные кортикостероиды применяют при надпочечниковой гиперандрогении. Лечение длится 6–8 месяцев – до достижения стойкой ремиссии.
Антибактериальная терапия по-прежнему актуальна при выраженном воспалительном процессе. Р. acne высокочувствительны к антибиотикам, однако не все антибиотики способны проникать в фолликулы сальных желез.
Известно, что наиболее эффективны Доксициклин, Амоксициллин, Вильпрафен. При выраженных нагноительных процессах с кистозными формами принята сочетанная терапия из антибиотиков и кортикостероидов, а также наружное применение антибактериальных мазей (бензоила пероксид, клиндамициновая) продолжительностью до 2–4 месяцев.
Акне легкой и средней тяжести характеризуется наличием невоспалительных комедональных форм и поверхностных воспалительных папулезно-пустулезных форм.
На сегодняшний день наиболее эффективными противоугревыми средствами для местного применения являются ретиноиды, которые способны вызывать специфический биологический ответ в результате связывания и активации рецепторов ретиноевой кислоты. Препараты устраняют комедоны, уменьшают продукцию кожного сала. Вызывают сухость кожи, эритему. При длительном лечении (до 4 месяцев) количество комедонов снижается на 2/3. К ретиноидам 3-го поколения, предназначенным для местной терапии акне, относят адапален, представляющий собой производное нафтойной кислоты с ретиноидоподобным действием.
Адапален обладает противовоспалительным, комедонолитическим действием, нормализует процессы кератинизации и дифференцировки кератиноцитов. Терапевтический эффект отмечается через 4–6 недель. В России адапален зарегистрирован под названием Дифферин® (Galderma, Швейцария), который выпускается в виде 0,1%-ного геля на водной основе и 0,1%-ного крема. При выборе лекарственной формы следует помнить, что эффективность действия препарата определяется взаимосвязями в системе «препарат – основа – кожа». Именно правильное увлажнение рогового слоя значительно усиливает проникновение веществ. Необходимо соблюдать режим дозирования. Гель и крем бережно, без особого усилия наносят на пораженные участки кожи 1 раз в день на ночь на чистую сухую кожу. Дифферин — высокоэффективный препарат патогенетического действия, его применение не приводит к моментальным результатам. Об отсутствии быстрого визуального эффекта врач обязан сообщать пациенту во избежание отказа от лечения. В среднем курс лечения составляет до 12 недель, для этого требуется не менее 30 г препарата в форме геля или крема (при нанесении препарата только на область лица). Терапевтический эффект развивается после 4–8 недель лечения, стойкое улучшение — после 3-месячного курса. Такая длительная терапия не только наиболее рациональна и эффективна, но и предотвращает формирование постакне.
При выборе лекарственной формы следует помнить, что эффективность действия препарата определяется взаимосвязями в системе «препарат – основа – кожа». Именно правильное увлажнение рогового слоя значительно усиливает проникновение веществ. Необходимо соблюдать режим дозирования. Гель и крем бережно, без особого усилия наносят на пораженные участки кожи 1 раз в день на ночь на чистую сухую кожу. Дифферин — высокоэффективный препарат патогенетического действия, его применение не приводит к моментальным результатам. Об отсутствии быстрого визуального эффекта врач обязан сообщать пациенту во избежание отказа от лечения. В среднем курс лечения составляет до 12 недель, для этого требуется не менее 30 г препарата в форме геля или крема (при нанесении препарата только на область лица). Терапевтический эффект развивается после 4–8 недель лечения, стойкое улучшение — после 3-месячного курса. Такая длительная терапия не только наиболее рациональна и эффективна, но и предотвращает формирование постакне.
Дифферин сохраняет лечебное действие в комбинации с местными антибактериальными противоугревыми средствами (эритромицин, клиндамицин, бензоила пероксид) [3, 6, 10, 12]. Это расширяет возможности его применения даже при обилии пустулезных элементов. При наличии папулезно-пустулезных элементов целесообразно применение Дифферина в комбинации с препаратом антибактериального действия — Базироном АС.
В нем сочетаются свойства эффективного лекарства – бензоила пероксида (БПО), действующего на основные патогенетические звенья акне, и удобного в применении косметического средства благодаря инновационной гидрогелевой основе – глицерин-акрилатного кополимера (acrylates copolymer-АС). БПО является мощным окислителем и при контакте с клеточной мембраной бактерий оказывает выраженное бактерицидное действие. Образующаяся при разрушении БПО бензойная кислота действует бактериостатически. Бензойная кислота не накапливается в тканях, не обладает системным действием и в неизмененном виде выводится с мочой. Противовоспалительное действие БПО обусловлено разрушением СЖК и инактивацией свободнорадикальных форм кислорода в очаге воспаления. Комедонолитическое действие связано с тем, что БПО является по химической структуре перекисью (т.е. сильным окислителем), которая разрушает структуры комедона. С этим же связано отбеливающее действие препарата, что приводит к обесцвечиванию поствоспалительных гиперпигментированных пятен и рубцов.
Противовоспалительное действие БПО обусловлено разрушением СЖК и инактивацией свободнорадикальных форм кислорода в очаге воспаления. Комедонолитическое действие связано с тем, что БПО является по химической структуре перекисью (т.е. сильным окислителем), которая разрушает структуры комедона. С этим же связано отбеливающее действие препарата, что приводит к обесцвечиванию поствоспалительных гиперпигментированных пятен и рубцов.
Акрилатный кополимер основы активно адсорбирует кожное сало, уменьшая явления себореи и жирный блеск кожи на 40%. Постепенное высвобождение глицерина из гидрогелевой основы обеспечивает смягчение и увлажнение кожи, уравновешивая раздражающий эффект БПО. Препарат эффективно воздействует на P. acnes и Staphylococcus epidermidis – основную патогенную микрофлору, которая высеивается у пациентов с акне, не вызывает микробную резистентность, что позволяет использовать его длительно.
По данным профессора Е.Р.Аравийской, все современные наружные препараты для лечения акне следует применять длительно. Исследование, проведенное в СПбГМУ им. акад. И.П.Павлова, показало, что стойкий позитивный эффект при использовании бензоила пероксида (Базирон) и адапалена (Дифферин) возможен лишь при постоянном применении в течение 4–6 месяцев. Это обусловлено тем, что подобные препараты должны воздействовать на кожу в течение нескольких сроков обновления эпителиального пласта, а средняя продолжительность обновления эпителия кожи составляет 28 дней.
Исследование, проведенное в СПбГМУ им. акад. И.П.Павлова, показало, что стойкий позитивный эффект при использовании бензоила пероксида (Базирон) и адапалена (Дифферин) возможен лишь при постоянном применении в течение 4–6 месяцев. Это обусловлено тем, что подобные препараты должны воздействовать на кожу в течение нескольких сроков обновления эпителиального пласта, а средняя продолжительность обновления эпителия кожи составляет 28 дней.
Для наружного применения также используются клиндамицин, тетрациклин, эритромицин, фузидиевая кислота, мупироцин, которые обладают способностью проникать через неповрежденную кожу, обеспечивают быстрый эффект при стафилококковых поражениях.
Применение гиалуроновой кислоты вызывает пристальный интерес. Она обладает антибактериальными свойствами (благодаря содержанию цинка гиалуроната) и регенерирующими (как мукополисахарид, содержащийся в дерме). Для лечения акне используется гель цинка гиалуроната (В.Н.Мордовцев и соавт., 2001).
Таким образом, грамотный, продуманный комплексный терапевтический подход к лечению акне приводит не только к быстрому и стойкому результату, но и значительно улучшает социальную адаптацию и качество жизни пациентов.
Литература
1. .Данилова А.А., Шеклакова М.Н. Акне // Рос. мед. журн. – 2001; 9(11): 452–456.
2. .Масюкова С.А., Ахтямов С.Н. Акне: Проблема и решение // Консилиум медикум. – 2002; 4(5): 217–223.
3. Воронова О.А., Скидан Н.И. Препараты фузидиевой кислоты в современной клинической практике врача дерматовенеролога // Вопросы диагностики и терапии дерматозов. – 2001. – 28 с.
4. Юцковская Я.А., Таран М.Г., Дворянинова И.Е. Принципы наружного лечения акне в сочетании с аппаратными методами воздействия // Эксперим. и клин. дерматокосметология. – 2012; 3: 20–27.
5. .Оковитый С.В., Ивкин Д.Ю. Мупироцин: Клиническое применение. – 2011; 4: 8–13.
6. Сазыкпна Л.Н., Альбанова Н.И. Клиническая активность различных лекарственных форм ретиноидов при обыкновенных угрях // Рос. журн. кожн. и вен. бол. – 2004; 2: 63–69.
7. Кунгуров Н.В., Кохан М.М., Курилко О.Н. Угревая болезнь как медико-социальная проблема юношества // Урал. мед. журн. – 2004; 3.
мед. журн. – 2004; 3.
8. Кицюк О.Ф. Изучение иммунного статуса у больных угревой болезнью // Тезисы докладов Всеросс. конф. дерматовенерологов. «Современные направления диагностики, лечения и профилактики ИППП и дерматозов». – 2004; 1: 18 с.
9. Рудых Н.М., Филатова Т.Б., Олейникова Ю.В. Типы нарушения гормонального статуса у женщин, больных угревой болезнью // Тезисы докладов Всеросс. конф. дерматовенерологов. «Современные направления диагностики, лечения и профилактики ИППП и дерматозов». – 2004; 1: 39 с.
10. Рудых Н.М., Филиппова Т.Б., Олейникова Ю.В., Сапего О.В. Исследование уровня инсулинемии и профиля секреции гонадотропных гормонов гипофиза у больных угревой болезнью // Тезисы докладов Всеросс. конф. дерматовенерологов. «Современные направления диагностики, лечения и профилактики ИППП и дерматозов». – 2004; 1: 39 с.
11. Волкова Е.Н. Лечащий врач. — 2007. — №4. — С. 21–28.
12. Волкова Е.Н., Осипова Н.К. Рос. журн. кож. и вен. бол. — 2009. — №5. — С. 53–58.
кож. и вен. бол. — 2009. — №5. — С. 53–58.
13. Волкова Е.Н., Осипова Н.К. Клин. дерматол. и венерол. — 2010. — №2. — С. 72–77.
14. Гущина Н.С., Корчевая Т.А. Рус. мед. журн. — 2005. — Т.13, №7. — С. 482–485.
15. Орлова Н.А. Клин. дерматол. и венерол. — 2003. — №4. — С. 53–56.
16. Самгин М. А., Монахов С. А. // Вест. дерматол. и венерол. — 2003. — № 4. — С. 37—39.
17. Самгин М. А., Монахов С. А. // Рос. журн. кож. и вен. болезней. — 2005. — № 3. — С. 55—64.
18. Самгин М. А., Монахов С. А. // Рос. журн. кож. и вен. болезней. — 2006. — № 6. — С. 85—87.
19. Data on file. Galderma Laboratories, Ins. Medical Departament. — 1994.
20. Eady E. A., Farmery M. R, Ross J. I. et al. // Br. J. Dermatol. — 1994. — Vol. 131. — P. 331—336.
21. Michel S., Jomard A., Demarschez. // Br. J. Dermatol. — 1998. — Vol. 139 (suppl. 52). — P. 3—7.
22. Swinyer L. J., Baker M. D, Swinyer T. A., Mills O. H. Jr. // Br. J. Dermatol. — 1988. — Vol. 119, N 5. — P. 615—622.
D, Swinyer T. A., Mills O. H. Jr. // Br. J. Dermatol. — 1988. — Vol. 119, N 5. — P. 615—622.
23. Потекаев Н.Н., Белоусова Т.А. Опыт применения геля Базирон АС в терапии фасциальных и экстрафасциальных проявлений акне // Дерматология. – 2008. – №2. – С. 9–12.
Свободный тестостерон – Клиника Здоровье 365 г. Екатеринбург
Свободный тестостерон – основной и наиболее активный андроген, вырабатываемый клетками Лейдига семенников у мужчин, а у женщин – корой надпочечников и яичниками. Является продуктом периферического метаболизма. Тестостерон находится в крови в свободном (1-2%) и связанном (с SHBG и альбумином) виде. В тканях, на которые направлено его действие, он превращается в более активный дигидротестостерон (ДГТ). Конверсия тестостерона завершается в печени превращением в 17-кетостероиды. Тестостерон на стадии внутриутробного развития участвует в дифференциации половых органов у мужчин, а в период полового созревания – отвечает за развитие вторичных половых признаков. Является необходимым гормоном для поддержания нормальной функции половых органов. Уровень тестостерона имеет диагностическое значение при следующих патологиях: синдром Клайнфельтера и другие хромосомные заболевания, гипопитуитаризм, ферментативные нарушения синтеза андрогенов, гирсутизм и вирилизация у женщин, андрогенсекретирующие опухоли яичников и надпочечников.
Является необходимым гормоном для поддержания нормальной функции половых органов. Уровень тестостерона имеет диагностическое значение при следующих патологиях: синдром Клайнфельтера и другие хромосомные заболевания, гипопитуитаризм, ферментативные нарушения синтеза андрогенов, гирсутизм и вирилизация у женщин, андрогенсекретирующие опухоли яичников и надпочечников.
Примерно 60% тестостерона крови в норме связано с высокоаффинным белком SHBG (глобулин, связывающий половые гормоны), другая часть связана с альбумином. Уровень свободного тестостерона в сыворотке крови составляет 1-2% и абсолютно не зависит от транспортного белка. Процент связывания гормона с SHBG у мужчин несколько ниже, чем у женщин. Свободный и связанный с альбумином тестостерон обладают биологической активностью, в то время как SHBG эффективно ингибирует активность гормона. Примерно половина тестостерона крови превращается в печени в андростерон, этиохоланолон и эпиандростерон, являющиеся относительно слабыми андрогенами. Также в некоторых тканях тестостерон превращается в относительно сильный андроген – дигидротестостерон.
Также в некоторых тканях тестостерон превращается в относительно сильный андроген – дигидротестостерон.
Определение свободной фракции тестостерона предложено как способ выявления биологически активного гормона. У женщин уровень свободного тестостерона повышается при гирсутизме с наличием или отсутствием поликистоза яичника. При тех ситуациях, когда SHBG часто повышен (например, гипертиреоидизм, состояние гиперэстрагении, в том числе беременность, прием пероральных контрацептивов, а также введение противоэпилептических средств) или снижен (например, гипотиреоидизм, избыток андрогенов, ожирение), измерение свободного тестостерона может быть более целесообразным, чем измерение общего тестостерона. В пожилом возрасте у мужчин возрастает концентрация SHBG (связывающего половые гормоны глобулина), и происходит снижение свободного тестостерона в плазме.
Андростендион
Андростендион — стероидный гормон, синтезируется в надпочечниках и половых железах (яичках и яичниках).
Обладает андрогенным и анаболическим действием, является основным предшественником в биосинтезе тестостерона и эстрона. Андрогенное действие андростендиона значительно слабее, чем у тестостерона.
Андростендион преобразуется в эстрогены, главным образом в яичниках, но также и в жировой ткани. Возможно преобразование андростендиона в тестостерон, но в норме у женщин оно незначительно. Усиление продукции тестостерона из андростендиона, например, при наличии андрогенпродуцирующей опухоли, часто приводит к гирсутизму (оволосение у женщин по мужскому типу) и вирильности (появление мужских черт у женщин).
Концентрация андростендиона в крови постепенно растет, начиная примерно с 7 лет жизни, а после 30 лет плавно снижается. Во время пубертата у мальчиков уровень андростендиона существенно возрастает за два года до значительного повышения тестостерона в крови.
Для андростендиона характерен суточный ритм секреции (максимум его концентрации наблюдается в сыворотке крови в утренние часы) подвержен циклическим изменениям, связанным с менструальным циклом, с максимумом в середине цикла. У женщин секреция и скорость образования андростендиона выше, чем тестостерона. При беременности концентрация андростендиона в крови повышается.
У женщин секреция и скорость образования андростендиона выше, чем тестостерона. При беременности концентрация андростендиона в крови повышается.
Андростендион исследуется в комплексе с другими гормонами (тестостерон, свободный тестостерон, ДЭА-С) при диагностике и контроле терапии гиперандрогенных состояний, в том числе, для контроля лечения глюкокортикоидами врожденной гиперплазии надпочечников.
При наблюдении за лечением андрогенитального синдрома андростендион является самым точным показателем среди андрогенов.
Международный олимпийский комитет внес андростендион в список допинговых веществ и таким образом запретил спортсменам его употребление. Андростендион в высоких дозах вызывает рост мышечной массы. Но при длительном приеме этого гормона усиливается влияние эндокринной системы на яички, и они начинают атрофироваться («за ненадобностью» их функции). Побочными эффектами приема андростендиона также являются снижение полового влечения у мужчин, увеличение и набухание грудных желез и др.
Показания к проведению исследования
- Диагностика и контроль терапии гиперандрогенных состояний
- Диагностика нерегулярного менструального цикла
- Задержка сексуального развития
Уровни андростендиона в норме
(данные значения могут варьировать в зависимости от используемых тест-систем и приборов)
- мужчины — 0.91−3.00 нг/мл
- женщины — 0.57−2.63 нг/мл
Повышение уровня андростендиона
- Врожденная гиперплазия надпочечников
- Поликистоз яичников
- Гирсутизм
- Вирилизующие опухоли надпочечников или яичников
- Гиперплазия стромы яичника или опухоль яичника
- Стромальный гипертекоз яичников
- Синдром Кушинга
- Эктопическая продукция АКТГ опухолью
- Остеопороз у женщин
Понижение значений
- Надпочечниковая недостаточность
- Недостаточность яичников
- Серповидноклеточная анемия
Материал для исследования: кровь из вены
Подготовка к анализу
Условия подготовки и день, в который нужно сдать кровь определяются лечащим врачом. Если нет специальных рекомендаций, кровь для этого исследования сдается на 1−10 день менструального цикла.
Если нет специальных рекомендаций, кровь для этого исследования сдается на 1−10 день менструального цикла.
Накануне исследования исключить физические нагрузки (спортивные тренировки).
Кровь рекомендуется сдавать в утренние часы, натощак.
При сдаче крови необходимо сообщить медсестре о приёме препаратов, влияющих на уровень гормонов в крови.
Сроки готовности:
10 рабочих дней
Методы исследования: иммуноферментный анализ (ИФА)
Тестостерон свободный, включает определение тестостерона общего и свободного, ГСПГ (SHBG), расчет индекса свободных андрогенов в Москве недорого
Тестостерон свободный, включает определение тестостерона общего и свободного, ГСПГ (SHBG), расчет индекса свободных андрогенов
В состав данного исследования входит: 06.02.011 Тестостерон общий; 06.02.014 Глобулин связывающий половые гормоны (ГСПГ, SHBG).
Тестостерон — это половой гормон, при этом большая его часть, циркулирующая в крови, связана с транспортными белками, и только небольшая часть — это свободный тестостерон, который является биологически активной фракцией гормона. Анализ на свободный тестостерон более информативный, чем анализ на общий, поскольку эта форма не связана с концентрацией глобулина, участвующего в связывании половых гормонов, а значит, и не зависит от его колебаний.
Анализ на свободный тестостерон более информативный, чем анализ на общий, поскольку эта форма не связана с концентрацией глобулина, участвующего в связывании половых гормонов, а значит, и не зависит от его колебаний.
ГСПГ — это специфичный белок, который связывает такие половые гормоны как эстрадиол, дигидротестостерон и тестостерон. Благодаря ему они переносятся в кровь в неактивной форме. Этот вид белка синтезируется в печени, от его концентрации в крови зависит развитие заболеваний печени и щитовидной железы, а также резкое увеличение веса.
Кому необходимо сдать кровь на анализ?
Анализ на свободный тестостерон может назначаться как мужчинам, так и женщинам. У мужчин показаниями для данного исследования считается ранее половое созревание или, наоборот, задержка развития вторичных половых признаков, импотенция, снижение сексуальной функции и пониженное либидо. Также анализ назначают при диагностике бесплодия, подозрениях на гипогонадизм, андропаузу, остеопороз.
Для женщин показаниями к проведению данного теста считаются нарушения в регулярности менструального цикла, подозрения на бесплодие, появление признаков маскулинизации, угревая сыпь. Анализ также может быть назначен новорожденным при наличии неоднозначных половых признаков.
Интерпретация результатов
Для проведения анализа на SHBG-гормон необходимо произвести забор венозной крови. Забор биологического материала проводится утром до приема пищи. За сутки до исследования не рекомендуется употреблять алкоголь и жирную пищу, а также курить и интенсивно заниматься спортом.
Результаты анализа имеют количественное выражение. Кроме выявленного уровня концентрации в крови свободного тестостерона указываются показатели нормы. Они различаются в зависимости от пола и возраста. Повышенный уровень тестостерона у мужчин и женщин является признаком ряда заболеваний. Пониженный тестостерон принимается во внимание только у мужчин, он может говорить о ряде нарушений, у женщин пониженные показатели во внимание не принимаются.
ОБЩИЕ ПРАВИЛА ПОДГОТОВКИ К АНАЛИЗАМ КРОВИ
Кровь берется из вены. Необходимо соблюдать общие рекомендации:
- кровь сдается утром натощак или не ранее, чем через 2–4 часа после приема пищи;
- допускается употребление воды без газа;
- накануне анализа следует отказаться от алкоголя, исключить физическое и эмоциональное перенапряжение;
- отказаться от курения за 30 минут до исследования;
- не стоит сдавать кровь в период приема медикаментов, если врач не назначил иное.
Все про тестостерон | Норма тестостерона
Всем нам нравятся сильные и мужественные мужчины. Но что делает мужчину мужчиной, а женщину — женщиной? Гормоны. И разница в основных гормонах между мужчинами и женщинами на самом деле совсем небольшая.
Вместе со специалистом по профилактической медицине Екатериной Степановой Sputnik продолжает изучать самые важные показатели нашего здоровья.
Разница всего в одном атоме
Если сравнивать графическую формулу тестостерона — основного мужского полового гормона, с графической формулой эстрогена — основного женского полового гормона, разница между ними всего лишь в одном атоме водорода и двух энергетических связях! Практически одинаковые молекулы, и разница эта очень тонкая и нестабильная.
В мужском организме, как и в женском, присутствуют эти два гормона одновременно, но в разных количествах. Понятно, что в мужском организме больше тестостерона, но между тестостероном и эстрогеном постоянно происходит взаимодействие. Каждую минуту у мужчины вырабатывается порядка 11 миллионов молекул тестостерона, но если по какой-то причине произойдет присоединение к этой молекуле атома водорода, тестостерон переходит в эстроген. Если таких превращений много — мужчина перестает быть мужчиной.
Кардинально зарождается это, как ни странно, сначала на психологическом, потом на эмоциональном и интеллектуальном уровнях, и лишь в последнюю очередь проявляется на физическом, когда начинаются изменения вторичных половых признаков в сторону деградации. Но, безусловно, для таких изменений должны быть определенные условия.
Как беречь тестостерон
До 10 лет мальчики и девочки отличаются только анатомически, половыми органами.
Мужчина начинает развиваться с момента полового созревания (12 лет): идет развитие гормонального фона, в частности основного полового гормона тестостерона, и благодаря ему формируются вторичные половые признаки: начинается оволосение по мужскому типу лица и тела, изменение голоса, формирование костно-мышечной и жировой ткани. В норме тестостерон контролирует объем жировой прослойки, поэтому здоровые мужчины с хорошими показателями тестостерона не склонны к ожирению. Если мальчик имеет лишний вес, к этому нельзя относиться халатно. Если после коррекции питания и физических нагрузок вес не уходит — необходимо обратиться к эндокринологу, чтоб не пропустить снижение уровня или неправильную выработку тестостерона.
В норме тестостерон контролирует объем жировой прослойки, поэтому здоровые мужчины с хорошими показателями тестостерона не склонны к ожирению. Если мальчик имеет лишний вес, к этому нельзя относиться халатно. Если после коррекции питания и физических нагрузок вес не уходит — необходимо обратиться к эндокринологу, чтоб не пропустить снижение уровня или неправильную выработку тестостерона.
К 16-18 годам тестостерон формирует мужские качества, и от его количества зависят мужские характеристики.
Вырабатывается тестостерон в парном органе — яичках. Это единственный орган мужского организма, который вынесен наружу. И это неспроста — температура в яичках в норме должна быть на 3,3 градуса ниже, чем в целом в организме.
Заботиться о формировании и сохранности тестостерона в мужском организме нужно с самого начала, с раннего детства мамам, а потом и самим мужчинам на протяжении всей жизни. Ведь от этого гормона во многом зависит качество жизни.
С момента рождения ребенка мамы должны контролировать время пребывания мальчика в памперсе. Ведь в нем создается эффект термобани, температура может колебаться в районе 43-45°С, и ношение памперса 24 часа в сутки может нанести непоправимый вред яичкам и даже стать причиной бесплодия. И понятно, что мальчик не должен ходить в памперсах до двух лет, потому что к физиологической проблеме может присоединиться и психологическая.
Ведь в нем создается эффект термобани, температура может колебаться в районе 43-45°С, и ношение памперса 24 часа в сутки может нанести непоправимый вред яичкам и даже стать причиной бесплодия. И понятно, что мальчик не должен ходить в памперсах до двух лет, потому что к физиологической проблеме может присоединиться и психологическая.
Берегите тестостерон
Механизм выработки тестостерона довольно сложный. Сигнал для выработки тестостерона поступает из командно-контролируемой зоны головного мозга. После сложных взаимодействий гипофиза и гипоталамуса дается команда яичкам на выработку тестостерона. От того, насколько слаженной будет эта совместная работа, зависит благополучие одного из основных половых гормонов мужчины.
Родителям нужно быть начеку с раннего активного возраста мальчика. Ведь дети такие непоседы! Важно уберечь ребенка от травм головы или яичек. При любой жалобе на головную боль, головокружение, резь при мочеиспускании или боли в паху и животе нужно подробно расспросить ребенка, не было ли травмы. Если травма была, необходимо срочно обратиться к врачу-травматологу, неврологу или урологу-андрологу. Тестостерон обладает очень важными функциями, он отвечает за:
Если травма была, необходимо срочно обратиться к врачу-травматологу, неврологу или урологу-андрологу. Тестостерон обладает очень важными функциями, он отвечает за:
- стрессоустойчивость;
- вторичные половые признаки;
- определяет мышечную и жировую массу тела;
- устойчивость к физическим и психологическим нагрузкам;
- мужскую силу и выносливость как способность к длительной тяжелой физической работе;
- агрессию от умеренной до сильной — это биологический признак защиты;
- отсутствие слезливости;
- сексуальную активность;
- чувство ценности мужской дружбы и здоровые амбиции.
В каждом мужчине живет самец, поэтому переживать и беречь он будет всегда самое дорогое, что у него есть: голову и потенцию.
Что может привести к снижению уровня тестостерона?
Причин множество, и связаны они с разными аспектами образа жизни.
Стресс. Группой австрийских и швейцарских ученых было доказано, что финансовые проблемы или непогашенный кредит снижают уровень тестостерона на 15-20% и держат его стабильно низким до полного положительного разрешения финансовой ситуации. Вообще, любые длительные стрессы и нервные перегрузки ведут к значительному снижению тестостерона. Это отрегулировано природой с момента рождения человека. В период стресса продуцируются в большом количестве соответственно гормоны стресса кортизол и адреналин. Для организма это состояние войны, и весь его функционал в этот период на пике своих возможностей, тут, как говорится, не до размножения, поэтому в этот период уровень тестостерона снижается. Возможны только кратковременные скачки вверх для регуляции общих процессов в организме.
Вообще, любые длительные стрессы и нервные перегрузки ведут к значительному снижению тестостерона. Это отрегулировано природой с момента рождения человека. В период стресса продуцируются в большом количестве соответственно гормоны стресса кортизол и адреналин. Для организма это состояние войны, и весь его функционал в этот период на пике своих возможностей, тут, как говорится, не до размножения, поэтому в этот период уровень тестостерона снижается. Возможны только кратковременные скачки вверх для регуляции общих процессов в организме.
Алкоголь. Первые 5 минут небольшое его количество действительно повышает тестостерон, но в течение 25 минут тестостерон приходит в норму и затем начинает резко и устойчиво падать. В США ученые провели негуманный эксперимент и выяснили — чтобы полностью прекратить выработку тестостерона, мужчине нужно сильно выпивать в течение 3 месяцев и прибавить в весе 20 кг. При таком состоянии здоровья начнут меняться вторичные половые признаки.
Еда. Особенно опасна любовь к сладкому. Высокий уровень глюкозы в крови сокращает выработку тестостерона, так как инсулин противоборствует основному мужскому половому гормону.
Мясо, произведенное в промышленных условиях, содержит женские половые гормоны, способствующие набору массы животного или птицы. Попадая в организм мужчины, они угнетают выработку тестостерона.
То же самое можно сказать и о продуктах, содержащих сою. Она содержит фитоэстрогены.
Не стоит пить много молока с высокой жирностью. Нужно понимать, что корова вырабатывает молоко не для человека, а для вскармливания своего теленка, поэтому с молоком передает ему свои гормоны и фитоэстрогены для поддержания иммунитета.
Без вариантов надо исключать из рациона фастфуд и копчености.
Болезни, травмы, низкая физическая активность. Вирусы, бактерии, заболевания, передающиеся половым путем, нерегулярный секс, травмы головы, позвоночника, яичек, любое снижение или отсутствие физической активности (физическая активность усиливает кровоснабжение в органах малого таза мужчины) — все это неизменно ведет к снижению уровня тестостерона.
Медикаменты. Доказано, что некоторые лекарства снижают уровень тестостерона, например, препараты, содержащие атропин, противоязвенные препараты.
Артериальное давление и проблемы с сосудами. Повышение артериального давления на 15-20 миллиметров ртутного столба значительно снижает уровень тестостерона, как и атеросклероз, ишемия. Во время эрекции объем крови, проходящей через половой член, увеличивается в 6 раз, и кровь идет под давлением. Чтобы сохранить свои сосуды, организм снижает тестостерон и, соответственно, либидо. Иначе страсть может обернуться инсультом, инфарктом и т. д. Любое снижение кровенаполнения полового члена при контакте — повод проверить состояние сосудов, в первую очередь коронарных.
Повышенный пульс. Если число сердечных сокращений более 80 — снижается уровень тестостерона. Срабатывает защитный механизм, чтобы снять напряжение с сердца. Ведь оно и так работает с перегрузкой, и ни к чему создавать ему дополнительные трудности.
Билирубин. Норма — 20 мкмоль/литр. Если его уровень поднимается до 25 и выше, то идет значительное снижение тестостерона. В этот механизм включается печень. Она является главным утилизатором токсинов и в частности регулирует уровень опасного для мужчины фермента ароматазы. Ароматаза способствует присоединению одного атома водорода к молекуле тестостерона, после чего он переходит в эстроген. Ароматазы в организме мужчины должно быть минимальное количество.
Кстати, мужчинам надо быть осторожными с употреблением грейпфрутов — они способствуют повышению ароматазы в крови.
Нарушение работы почек. Контрольным показателем здесь является количество выделяемой мочи. Если мужчина выделяет менее 1 литра мочи в сутки, уровень тестостерона снижается на 15%. В норме взрослый мужчина должен потреблять не менее 30 мл чистой воды из расчета на 1 килограмм веса и выделять не менее 2 литров мочи в сутки. С мочой выводятся не только токсины, но и лишние гормоны стресса (кортизол и адреналин), которые напрямую блокируют выработку тестостерона.
На уровень тестостерона может влиять и ношение тесного синтетического нижнего белья, мобильных телефонов в кармане брюк и особенно нахождение планшетов и ноутбуков на коленях.
При езде на велосипеде нужно подбирать специальное мужское анатомическое седло, чтобы исключить травмы мышц промежности и яичек. Уровень тестостерона снижает и вдыхание вредных испарений (бензин, фенолы, табак, краски).
©
Pixabay
Если ваш мужчина стал слишком ленив, пора проверить уровень тестостерона в крови
Если мужчина улегся на диван
Первым звоночком снижения уровня тестостерона, как правило, является то, что мужчина укладывается на диван и не хочет ничего делать. Тестостерон — это всегда активность: умственная, физическая, половая!
Более серьезным сигналом является набор веса, в частности отложение жира по женскому типу. Официально установлено, что талия мужчины не должна превышать 92-94 см. Этот показатель напрямую связан с уровнем тестостерона. Ведь висцеральный и абдоминальный жир вырабатывают гормон лептин — один из основных врагов тестостерона. Нормальный уровень тестостерона препятствует набору веса, так как способствует его переработке в энергию в мышцах, поэтому любая физическая активность должна быть верным спутником мужчины.
Ведь висцеральный и абдоминальный жир вырабатывают гормон лептин — один из основных врагов тестостерона. Нормальный уровень тестостерона препятствует набору веса, так как способствует его переработке в энергию в мышцах, поэтому любая физическая активность должна быть верным спутником мужчины.
Тестостерон — хранитель всего в мужском организме. Благодаря ему опорно-двигательный аппарат сохраняет свое здоровье. Посредством тестостерона кальций усваивается костной тканью. У женщин эту функцию выполняет эстроген.
Как контролировать уровень тестостерона?
Кровь на тестостерон надо сдавать натощак и утром. В ранние часы идет максимальная выработка тестостерона. Делается забор крови на общий тестостерон и глобулин, связывающий половой гормон. Они работают всегда в паре. Расшифровать эти показатели может только врач-уролог, потому что иногда тестостерон в организме может быть не в активной фазе, какое бы количество его ни было, и не иметь своей эффективности.
Нормальный уровень тестостерона — 12-35 нмоль/литр. Пик его выработки приходится на 25-30 лет. С 30-летнего возраста у всех мужчин уровень тестостерона начинает снижаться на 1-2% ежегодно.
Пик его выработки приходится на 25-30 лет. С 30-летнего возраста у всех мужчин уровень тестостерона начинает снижаться на 1-2% ежегодно.
Доказано, что если в 25 лет уровень тестостерона был 35 нмоль/литр, то при нормальном течении жизни мужчине хватит этого запаса на всю жизнь, и это физиологическое падение не очень скажется на его активности и мужской силе. А вот если в 25 лет у мужчины были показатели в районе 12 нмоль/литр, стоит держать свой образ жизни и состояние здоровья под контролем.
Если показатель в молодом возрасте ниже 12 нмоль/литр, это расценивается как дефект и называется гипогонадизм.
К сожалению, статистика такова, что на сегодняшний день мужской фактор бесплодия начинает опережать женский.
В природе все находится в балансе, и есть множество факторов, повышающих уровень тестостерона: от еды до увлечений.
Американские ученые установили, что ссора с женой, когда мужчина прав, повышает уровень тестостерона на 35%, а последующий примирительный секс добавляет еще 45%.
Но лидером по стабильному повышению тестостерона и его удержанию на высоких цифрах 50-55% является покупка автомобиля и запчастей к нему, покупка гаджетов и спорт. У каждого пола свои радости.
Ну и самый беспроигрышный фактор, повышающий тестостерон — продемонстрировать достоинства женщине, и чтобы она всю эту мускулинность оценила по достоинству.
Милые дамы и мамы, в ваших руках мужское счастье! Хвалите и цените мужчин. Все в этой жизни мужчина делает ради женщины, поэтому обоюдная забота друг о друге отблагодарит вас совместным здоровьем, гармонией и благополучием.
Читайте также:
Свободный тестостерон отражает нарушения обмена веществ, а также нарушения функции яичников у женщин с субфертильной олигоменореей
Общие сведения . Диагностика синдрома поликистозных яичников (СПКЯ) основана на овуляторной дисфункции, данных УЗИ яичников и избытке андрогенов. Общий тестостерон часто используется для определения избытка андрогенов, но тестостерон в основном связан с глобулином, связывающим половые гормоны (SHBG), и альбумином. Только 1-2% небелкового тестостерона (так называемый свободный тестостерон) является биологически активным и отвечает за действие андрогенов.Более того, автоматические иммуноанализы, которые часто используются для измерения женского тестостерона, неточны. Цель . Чтобы оценить клиническую применимость жидкостной хроматографии и тандемной масс-спектрометрии, измеряли тестостерон и вычисляли свободный тестостерон у женщин с субфертильным статусом, посещающих клинику репродуктологии с олигоменореей и подозрением на СПКЯ. Методы. Были оценены гормональные и метаболические параметры, проведено УЗИ яичников. Общий тестостерон измеряли с помощью тандемной жидкостной хроматографии и масс-спектрометрии.Свободный тестостерон рассчитывали из общего тестостерона и SHBG. Результаты . В исследование были включены шестьдесят шесть женщин. Общий тестостерон был связан с объемом яичников и количеством антральных фолликулов, но не с метаболическими параметрами. Однако ГСПГ и рассчитанный свободный тестостерон были связаны как с УЗИ яичников, так и с метаболическими параметрами, такими как ИМТ и инсулинорезистентность.
Только 1-2% небелкового тестостерона (так называемый свободный тестостерон) является биологически активным и отвечает за действие андрогенов.Более того, автоматические иммуноанализы, которые часто используются для измерения женского тестостерона, неточны. Цель . Чтобы оценить клиническую применимость жидкостной хроматографии и тандемной масс-спектрометрии, измеряли тестостерон и вычисляли свободный тестостерон у женщин с субфертильным статусом, посещающих клинику репродуктологии с олигоменореей и подозрением на СПКЯ. Методы. Были оценены гормональные и метаболические параметры, проведено УЗИ яичников. Общий тестостерон измеряли с помощью тандемной жидкостной хроматографии и масс-спектрометрии.Свободный тестостерон рассчитывали из общего тестостерона и SHBG. Результаты . В исследование были включены шестьдесят шесть женщин. Общий тестостерон был связан с объемом яичников и количеством антральных фолликулов, но не с метаболическими параметрами. Однако ГСПГ и рассчитанный свободный тестостерон были связаны как с УЗИ яичников, так и с метаболическими параметрами, такими как ИМТ и инсулинорезистентность. Выводы . Оценка ГСПГ и свободного тестостерона важна для оценки избытка андрогенов у женщин с недостаточной фертильностью с овуляторной дисфункцией и подозрением на СПКЯ, поскольку он отражает нарушения как яичников, так и метаболизма.
Выводы . Оценка ГСПГ и свободного тестостерона важна для оценки избытка андрогенов у женщин с недостаточной фертильностью с овуляторной дисфункцией и подозрением на СПКЯ, поскольку он отражает нарушения как яичников, так и метаболизма.
1. Введение
Синдром поликистозных яичников (СПКЯ) очень часто встречается у женщин с недостаточной фертильностью и олигоменореей [1–3]. Диагностика СПКЯ основана на «Роттердамских критериях»: наличие как минимум двух из следующих состояний: овуляторная дисфункция, морфология поликистозных яичников (PCOM) на УЗИ или избыток андрогенов [4]. Хотя эти критерии используются очень часто, они имеют важные ограничения. Из-за улучшенного ультразвукового исследования PCOM часто присутствует, в том числе у женщин, которые обычно ездят на велосипеде, без других признаков PCOS.Кроме того, эти диагностические критерии не принимают во внимание метаболические параметры, и пациенты с явно разными метаболическими характеристиками диагностируются под общим термином СПКЯ [5, 6].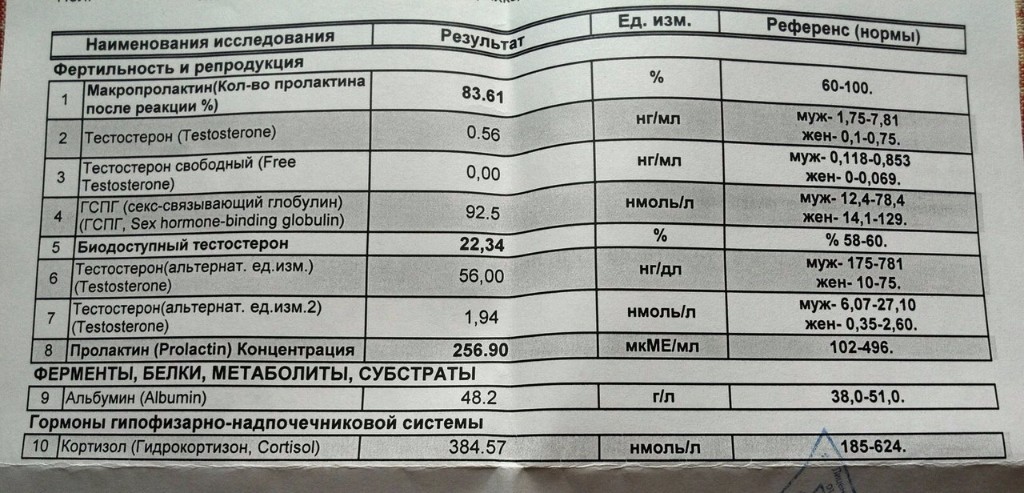
Диагностика избытка андрогенов у женщин также может быть сложной задачей, поскольку его можно оценить либо клинически (гирсутизм или угри), либо биохимически, либо и то, и другое [2, 4]. Остается неясным, какие андрогены следует измерять для оценки биохимической гиперандрогенемии у женщин с подозрением на СПКЯ [7]. В клинической практике часто используется общий тестостерон (общий тестостерон), но измерение общего тестостерона у женщин с помощью автоматических иммуноанализов (IA) часто неточно.Поэтому вместо ИА в качестве метода выбора для точного измерения низких уровней тестостерона у женщин была предложена жидкостная хроматография-тандемная масс-спектрометрия (ЖХ-МС / МС) [8–11]. Кроме того, андростендион (A4), стероидный предшественник тестостерона, был предложен в качестве маркера избытка андрогенов у пациентов с СПКЯ, особенно при выявлении пациентов с СПКЯ с более высоким метаболическим риском [12].
Кроме того, тестостерон в основном связан с глобулином, связывающим половые гормоны (SHBG), и альбумином. Лишь небольшая часть (1-2%) циркулирует в виде свободного тестостерона, не связанного с белками (свободный Т), и только свободная фракция Т может проникать в клетку и проявлять андрогенную активность [13].
Лишь небольшая часть (1-2%) циркулирует в виде свободного тестостерона, не связанного с белками (свободный Т), и только свободная фракция Т может проникать в клетку и проявлять андрогенную активность [13].
В недавнем обзоре передовой практики свободный тестостерон был предложен в качестве наиболее чувствительного маркера для диагностики избытка андрогенов [10], а равновесный диализ – в качестве предпочтительного метода измерения. Однако этот метод доступен только в ограниченном количестве справочных лабораторий [10, 14]. Вместо прямого измерения свободного Т можно использовать вычисленный свободный Т для определения гиперандрогенемии у пациентов с СПКЯ [9, 10].Эти расчеты неизбежно требуют точного измерения общего T и SHBG [2]. К счастью, при использовании общего T, измеренного с помощью LC-MS / MS, наблюдается отличная корреляция между вычисленным свободным T и измеренным свободным T у женщин, и вычисленный свободный T можно использовать для оценки андрогенного статуса у женщин [9, 10, 15] .
Однако на сегодняшний день лишь ограниченное количество исследований изучали клинические корреляты этих недавно появившихся измерений ЖХ-МС / МС при оценке женского андрогенного статуса.В частности, использование общих Т, А4 и свободного Т, измеренных ЖХ-МС / МС (рассчитанных на основе общего Т ЖХ-МС / МС), не очень хорошо известно при диагностике СПКЯ. Тем не менее, точная диагностика гиперандрогении важна, поскольку женщины с избытком андрогенов подвергаются повышенному риску развития диабета 2 типа и метаболического синдрома [16].
В этом исследовании мы оценили клиническую полезность использования современной технологии ЖХ-МС / МС для измерения половых стероидов у женщин с низким фертильным статусом с олигоменореей и подозрением на СПКЯ.Кроме того, была проанализирована связь между общим и свободным тестостероном и параметрами метаболизма и яичников.
2. Методы
2.1. Испытуемые
97 женщин с олиго- или аменореей (продолжительность цикла> 38 дней) были набраны в центре репродуктивной медицины Левена. Все женщины были обследованы на беременность и врожденную гиперплазию надпочечников (дефицит 21-гидроксилазы). Женщины, принимавшие оральные контрацептивы, были исключены. Субъекты с гиперпролактинемией (), впервые диагностированным диабетом 2 типа (), активным заболеванием щитовидной железы (), гипоталамической аменореей (лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ) ниже нижних границ референсных интервалов (<2.4 Ед / л для ЛГ и <3,5 Е / л для ФСГ),) или преждевременной недостаточности яичников (ФСГ> 12 Е / л) () были исключены. Кроме того, 3 женщины были исключены из-за овуляторной (ЛГ> 40 Ед / л) или лютеиновой крови (прогестерон> 1,5 мк г / л). У 22 женщин не было доступной сыворотки для дополнительных измерений половых стероидов, и эти женщины также были исключены, оставив 66 женщин в выборке исследования (дополнительный рисунок 1).
Все женщины были обследованы на беременность и врожденную гиперплазию надпочечников (дефицит 21-гидроксилазы). Женщины, принимавшие оральные контрацептивы, были исключены. Субъекты с гиперпролактинемией (), впервые диагностированным диабетом 2 типа (), активным заболеванием щитовидной железы (), гипоталамической аменореей (лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ) ниже нижних границ референсных интервалов (<2.4 Ед / л для ЛГ и <3,5 Е / л для ФСГ),) или преждевременной недостаточности яичников (ФСГ> 12 Е / л) () были исключены. Кроме того, 3 женщины были исключены из-за овуляторной (ЛГ> 40 Ед / л) или лютеиновой крови (прогестерон> 1,5 мк г / л). У 22 женщин не было доступной сыворотки для дополнительных измерений половых стероидов, и эти женщины также были исключены, оставив 66 женщин в выборке исследования (дополнительный рисунок 1).
Протокол исследования был одобрен местным советом по этике университетских больниц Лёвена.Все пациенты дали письменное информированное согласие.
2.2. Клиническая оценка
При включении у всех пациентов регистрировались вес, рост, окружность талии и артериальное давление. ИМТ рассчитывался исходя из веса и роста. Гирсутизм оценивался по упрощенной шкале Ферримана-Галлвея, и пациенты были классифицированы с гирсутизмом, если эта оценка была ≥3 [17]. Акне было самооценкой. Пациенты с ИМТ <25 кг / м 2 были классифицированы как имеющие нормальный ИМТ; пациенты с ИМТ от 25 до 29.9 человек были классифицированы как пациенты с избыточным весом, а пациенты с ИМТ ≥ 30 – с ожирением.
2.3. Измерения половых стероидов с помощью жидкостной хроматографии и тандемной масс-спектрометрии.
Эстрадиол (E2) и эстрон (E1) измеряли с помощью LC-MS / MS, как описано ранее [18]. Общие T и A4 были измерены с помощью недавно разработанного метода ЖХ-МС / МС. Подробности метода описаны в дополнительных материалах. Свободный тестостерон рассчитывали по формуле Вермёлена [19]. Измерения ЖХ-МС / МС сравнивали с первоначально сообщенными значениями с помощью прямого иммуноанализа (Diasorin Gamma Coat) для A4 и электрохемилюминесцентного иммуноанализа (ECLIA) на платформе Modular E (Roche Diagnostics) для общего T для всех пациентов, если таковые имеются в медицинских записях ( ).
2.4. Другие лабораторные измерения
ЛГ, ФСГ, прогестерон, ГСПГ, тиреотропный гормон (ТТГ), дегидроэпиандростерон сульфат (ДГЭАС) и инсулин натощак измерялись с помощью ECLIA (Modular E170 от Roche Diagnostics). Антимюллеров гормон (AMH) определяли с помощью иммуноферментного анализа (ELISA) (Beckman Coulter Gen II). Глюкозу натощак, общий холестерин, холестерин ЛПВП и триглицериды измеряли колориметрическим методом (Cobas c702 от Roche Diagnostics).Холестерин ЛПНП рассчитывали из общего холестерина, холестерина ЛПВП и триглицеридов по формуле Фридевальда [20]. Отношение ЛГ / ФСГ рассчитывали путем деления концентрации ЛГ в Ед / л на концентрацию ФСГ в Ед / л. Инсулинорезистентность рассчитывалась с использованием обновленной модели гомеостаза оценки инсулинорезистентности (HOMA-IR) [21].
2,5. Ультразвук яичников
Двухмерное УЗИ влагалища было выполнено опытным гинекологом (Voluson E8, GE Healthcare).Для обоих яичников подсчитывали количество антральных фолликулов (AFC), на основании чего рассчитывали среднее значение AFC [22].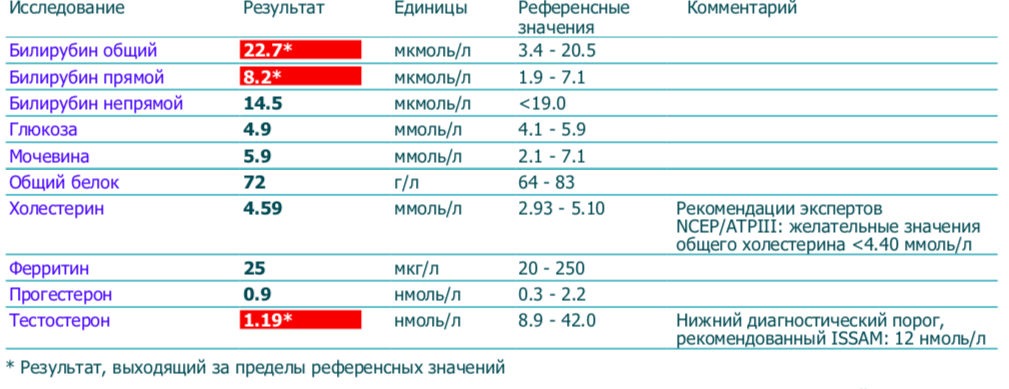 Для обоих яичников был рассчитан объем яичника (OV) (0,5 × длина × ширина × толщина). Также был рассчитан средний объем левого и правого яичника. Кроме того, регистрировалась локализация фолликула (случайная, периферическая или и то, и другое) и размер фолликула (однородный или неравномерный).
Для обоих яичников был рассчитан объем яичника (OV) (0,5 × длина × ширина × толщина). Также был рассчитан средний объем левого и правого яичника. Кроме того, регистрировалась локализация фолликула (случайная, периферическая или и то, и другое) и размер фолликула (однородный или неравномерный).
Тринадцать пациентов с доминантным фолликулом, желтым телом, геморрагической кистой, хирургическим вмешательством на яичниках или тератомой в анамнезе были дополнительно исключены при оценке ультразвуковых параметров.Пациенты были классифицированы как имеющие СПКОМ, если у них было ≥12 антральных фолликулов (2–9 мм в диаметре) в обоих яичниках и / или объем яичников> 10 мл в одном или двух яичниках [4, 23].
2.6. Синдром поликистозных яичников (СПКЯ) Определение
Синдром поликистозных яичников определялся по Роттердамским критериям: наличие, по крайней мере, двух из следующих критериев: овуляторная дисфункция, СПКЯ или биохимический избыток андрогенов [4]. PCOM был определен, как описано выше. Для избытка андрогенов общий T> 41 нг / дл или свободный T> 0.49 нг / дл использовалось в качестве отсечки [15].
Для избытка андрогенов общий T> 41 нг / дл или свободный T> 0.49 нг / дл использовалось в качестве отсечки [15].
2.7. Статистический анализ
Рейтинг Спирмена использовался для оценки корреляции между гормональными измерениями. Линейная или логистическая регрессия (без поправок и с поправкой на возраст и ИМТ) использовалась для оценки связи между андрогенами, ГСПГ, метаболическими и ультразвуковыми параметрами. Пирсона использовали для оценки корреляции между результатами ЖХ-МС / МС и иммуноанализа и параметрами ультразвука. считался статистически значимым. Все анализы были выполнены с использованием STATA версии 13 (Stata Corp).
3. Результаты
Возраст, гормональные, метаболические и яичниковые параметры пациентов представлены в таблице 1. Корреляции между различными гормональными измерениями показаны в таблице 2. Как и ожидалось, общий T, A4 и свободный T сильно коррелировали. друг с другом. Кроме того, E2 коррелировал с общим T и A4, тогда как E1 также коррелировал со свободным T. Соотношение LH и LH / FSH было связано с общим и свободным T и A4. Кроме того, измерения андрогенов ЖХ-МС / МС показали лучшую корреляцию с данными УЗИ, чем измерения иммуноанализа (AFC и объем яичников; и 0.51 для общего Т ЖХ-МС / МС; и 0,41 для общего Т иммуноанализа; и 0,58 для ЖХ-МС / МС A4; и 0,56 для радиоиммуноанализа A4, данные не показаны).
Соотношение LH и LH / FSH было связано с общим и свободным T и A4. Кроме того, измерения андрогенов ЖХ-МС / МС показали лучшую корреляцию с данными УЗИ, чем измерения иммуноанализа (AFC и объем яичников; и 0.51 для общего Т ЖХ-МС / МС; и 0,41 для общего Т иммуноанализа; и 0,58 для ЖХ-МС / МС A4; и 0,56 для радиоиммуноанализа A4, данные не показаны).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Для Параметры УЗИ и определение СПКЯ: дополнительно исключены 13 пациентов (см. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Данные представлены какпосле коррекции Бонферрони. Total T: общий тестостерон; A4: андростендион; свободный T: рассчитанный свободный тестостерон; SHBG: глобулин, связывающий половые гормоны; E2: эстрадиол; E1: эстрон; ЛГ: лютеинизирующий гормон; ФСГ: фолликулостимулирующий гормон. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Взаимосвязи между андрогенами, ГСПГ, метаболическими и ультразвуковыми параметрами показаны в Таблице 3. Общий T, A4 и свободный T точно отражают объем яичников и AFC у пациентов с олигоменореей и субфертильностью, независимо от ИМТ.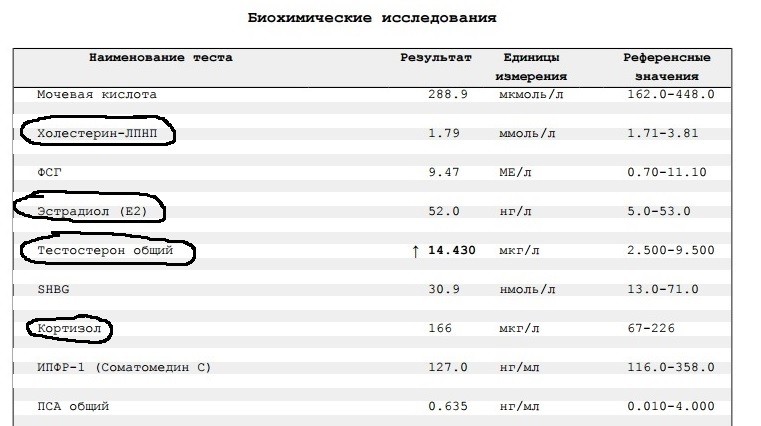 Ни общий тестостерон, ни А4 не были связаны с ИМТ, инсулином или инсулинорезистентностью. Напротив, увеличение свободного T или снижение концентрации SHBG были связаны с более высоким ИМТ, а также с более высокими уровнями инсулина и инсулинорезистентностью, но эта связь исчезла после корректировки на ИМТ. После поправки на возраст и ИМТ общий тестостерон был связан с общим холестерином и холестерином ЛПНП. После поправок на возраст и ИМТ не было значимой связи между измерениями свободного тестостерона и липидов.
Ни общий тестостерон, ни А4 не были связаны с ИМТ, инсулином или инсулинорезистентностью. Напротив, увеличение свободного T или снижение концентрации SHBG были связаны с более высоким ИМТ, а также с более высокими уровнями инсулина и инсулинорезистентностью, но эта связь исчезла после корректировки на ИМТ. После поправки на возраст и ИМТ общий тестостерон был связан с общим холестерином и холестерином ЛПНП. После поправок на возраст и ИМТ не было значимой связи между измерениями свободного тестостерона и липидов.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Линейная регрессия с поправками на возраст и ИМТ. Данные представлены в виде коэффициентов с 95% доверительным интервалом на увеличение стандартного отклонения андрогенов / ГСПГ. ,,. Т: тестостерон; A4: андростендион; SHBG: глобулин, связывающий половые гормоны; ИМТ: индекс массы тела; HOMA-IR: оценка модели гомеостаза инсулинорезистентности; АМГ: антимюллеров гормон; AFC: количество антральных фолликулов. Данные представлены в виде коэффициентов с 95% доверительным интервалом на увеличение стандартного отклонения андрогенов / ГСПГ. ,,. Т: тестостерон; A4: андростендион; SHBG: глобулин, связывающий половые гормоны; ИМТ: индекс массы тела; HOMA-IR: оценка модели гомеостаза инсулинорезистентности; АМГ: антимюллеров гормон; AFC: количество антральных фолликулов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Тридцать семь женщин (56%) имели нормальный свободный T (≤0,49 нг / дл), а 29 женщин (44%) имели высокий свободный T (> 0,49 нг / дл) (Таблица 4). Уровни общего T, A4, LH и LH / FSH были выше у женщин с высоким уровнем свободного T, тогда как SHBG был ниже. Все наблюдаемые различия остались значительными после поправки на возраст и ИМТ (Таблица 4). Женщины с высоким уровнем свободного тестостерона имели более высокий ИМТ, имели более высокий уровень инсулина и были более инсулинорезистентными. Однако связь между свободным тестостероном и инсулином или HOMA-IR исчезла после поправки на возраст и ИМТ.Кроме того, пациенты с высоким уровнем свободного тестостерона имели более высокий уровень АМГ, более высокий средний объем яичников и увеличенное количество антральных фолликулов, также с поправкой на возраст и ИМТ (таблица 4). В дополнительной таблице 1 такие же сравнения были сделаны между женщинами с нормальным общим T (≤41 нг / дл) и высоким общим T (> 41 нг / дл).
В дополнительной таблице 1 такие же сравнения были сделаны между женщинами с нормальным общим T (≤41 нг / дл) и высоким общим T (> 41 нг / дл).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Данные представлены как среднее (стандартное отклонение) для непрерывные переменные или как (процент) для категориальных переменных.Для оценки различий между группами использовалась линейная или логистическая регрессия (без поправок, с поправкой на возраст и ИМТ). Total T: общий тестостерон; A4: андростендион; свободный T: рассчитанный свободный тестостерон; SHBG: глобулин, связывающий половые гормоны; E2: эстрадиол; E1: эстрон; ЛГ: лютеинизирующий гормон; ФСГ: фолликулостимулирующий гормон; HOMA-IR: оценка модели гомеостаза инсулинорезистентности; AFC: количество антральных фолликулов; PCOM: морфология поликистозных яичников. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4. Обсуждение
В нашем исследовании общий T, A4 и свободный T близко отражали объем яичников и AFC у олигоменореальных субфертильных пациенток с подозрением на СПКЯ.Однако ни общий тестостерон, ни А4 не были связаны с ИМТ, инсулином или инсулинорезистентностью. Напротив, увеличение концентрации свободного Т было связано с более высоким ИМТ, а также с более высокими уровнями инсулина и инсулинорезистентностью [24], но эта связь исчезла после корректировки на ИМТ.
Эту связь между свободным тестостероном и параметрами метаболизма можно, по крайней мере частично, объяснить влиянием ИМТ на уровни SHBG. Как и ожидалось, ГСПГ обратно пропорционально связан с ИМТ, и хорошо известно, что уровни ГСПГ снижаются при ожирении как у мужчин, так и у женщин.У женщин связанное с ожирением снижение SHBG сопровождается более высоким уровнем свободного T. В отличие от мужчин с ожирением, у которых снижение SHBG сопровождается уменьшением общего T, тогда как свободный T остается нормальным или незначительно снижается [ 25, 26].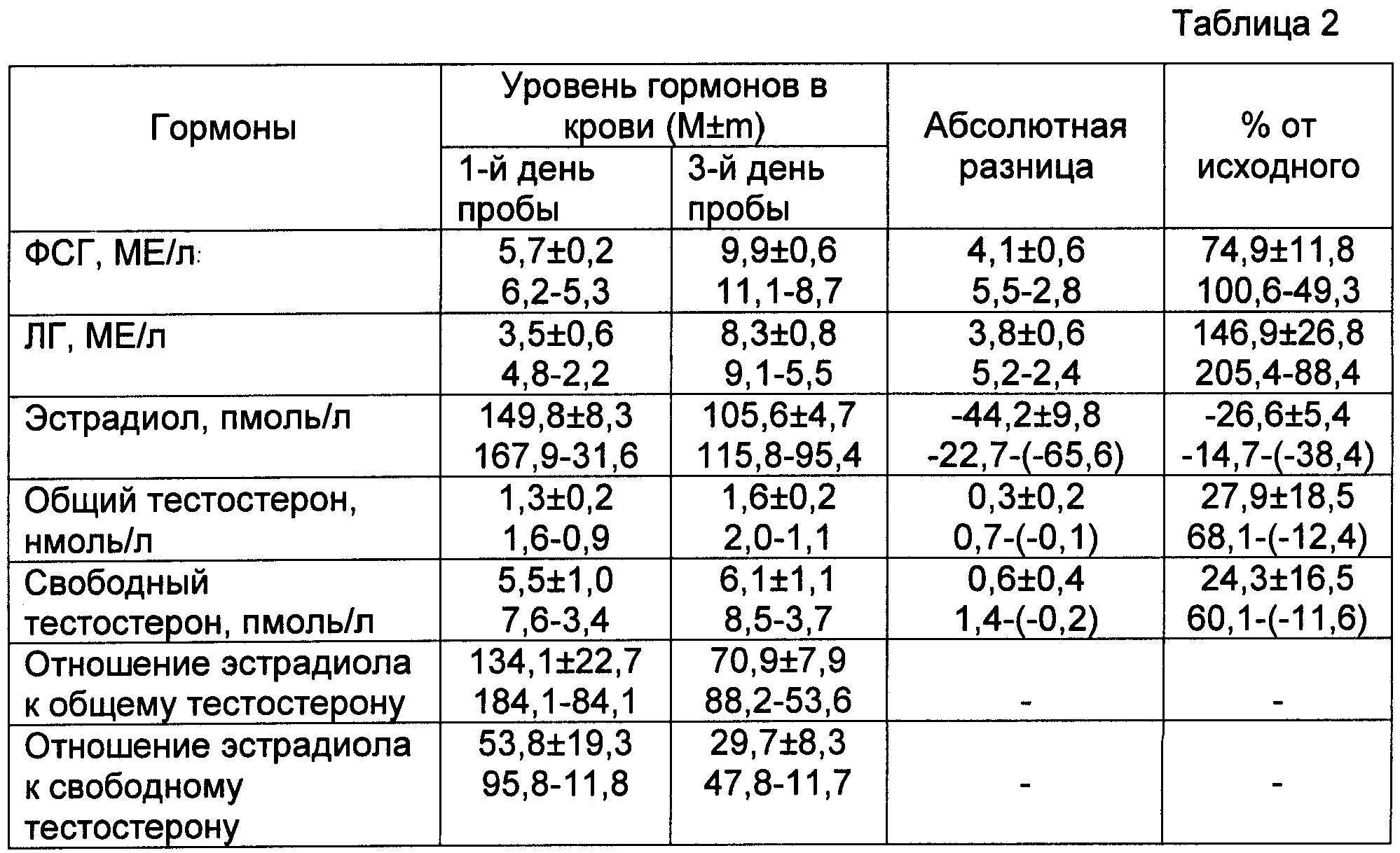 Кроме того, уровни SHBG у женщин в два-три раза выше, чем у мужчин, как и количество незанятых сайтов связывания стероидов SHBG (до 80% у женщин по сравнению с 45% у мужчин) [27, 28]. Следовательно, буферная способность половых стероидов ГСПГ выше у женщин, чем у мужчин, и основная функция ГСПГ у женщин – защита от высоких уровней свободных андрогенов [29].Таким образом, когда уровни SHBG снижаются с увеличением ИМТ, эта буферная способность нарушается, что в конечном итоге приводит к увеличению концентрации свободного Т и избытку андрогенов. Поэтому вполне вероятно, что даже незначительные изменения биологической доступности андрогенов могут иметь клинические последствия для женщин.
Кроме того, уровни SHBG у женщин в два-три раза выше, чем у мужчин, как и количество незанятых сайтов связывания стероидов SHBG (до 80% у женщин по сравнению с 45% у мужчин) [27, 28]. Следовательно, буферная способность половых стероидов ГСПГ выше у женщин, чем у мужчин, и основная функция ГСПГ у женщин – защита от высоких уровней свободных андрогенов [29].Таким образом, когда уровни SHBG снижаются с увеличением ИМТ, эта буферная способность нарушается, что в конечном итоге приводит к увеличению концентрации свободного Т и избытку андрогенов. Поэтому вполне вероятно, что даже незначительные изменения биологической доступности андрогенов могут иметь клинические последствия для женщин.
Кроме того, свободный T положительно коррелировал с соотношением ЛГ и ЛГ / ФСГ, а женщины с высоким уровнем свободного Т имеют более высокий уровень ЛГ и более высокое соотношение ЛГ / ФСГ по сравнению с женщинами с нормальным свободным Т, независимо от ИМТ.Избыток андрогенов может нарушить регуляцию функции оси гипоталамус-гипофиз-яичники, нарушая нормальную частоту пульса ГнРГ. В результате продукция ЛГ гипофизом увеличивается, в то время как ФСГ остается неадекватно низким, что в конечном итоге препятствует циклической выработке эстрадиола и прогестерона яичниками [30]. Таким образом, олигоменорея и овуляторная дисфункция могут быть ранними клиническими признаками избытка андрогенов. Более того, женщины с высоким уровнем свободного тестостерона имели более высокий уровень АМГ, больший объем яичников и более высокую АЧХ, независимо от ИМТ. Таким образом, женщины с высоким уровнем свободного тестостерона имеют многочисленные характеристики СПКЯ: яичниковые аспекты (увеличение АМГ, а также ультразвуковые признаки), гормональные аспекты (более высокое соотношение ЛГ / ФСГ), а также метаболические аспекты (ИМТ, уровни инсулина и инсулина. сопротивление).Аналогичный анализ для женщин с высоким уровнем общего тестостерона показал незначительные нескорректированные значения метаболических параметров (ИМТ, уровни инсулина и инсулинорезистентность; 0,639 и 0,632 соответственно).
В результате продукция ЛГ гипофизом увеличивается, в то время как ФСГ остается неадекватно низким, что в конечном итоге препятствует циклической выработке эстрадиола и прогестерона яичниками [30]. Таким образом, олигоменорея и овуляторная дисфункция могут быть ранними клиническими признаками избытка андрогенов. Более того, женщины с высоким уровнем свободного тестостерона имели более высокий уровень АМГ, больший объем яичников и более высокую АЧХ, независимо от ИМТ. Таким образом, женщины с высоким уровнем свободного тестостерона имеют многочисленные характеристики СПКЯ: яичниковые аспекты (увеличение АМГ, а также ультразвуковые признаки), гормональные аспекты (более высокое соотношение ЛГ / ФСГ), а также метаболические аспекты (ИМТ, уровни инсулина и инсулина. сопротивление).Аналогичный анализ для женщин с высоким уровнем общего тестостерона показал незначительные нескорректированные значения метаболических параметров (ИМТ, уровни инсулина и инсулинорезистентность; 0,639 и 0,632 соответственно).
У нашего исследования есть несколько сильных сторон. Все половые стероиды были измерены чувствительным методом LC-MS / MS, подходящим для точного измерения низких концентраций тестостерона у женщин. Согласно литературным данным [11, 15], результаты прямого иммуноанализа неверно классифицировали почти 1 из 4 пациентов по сравнению с измерениями ЖХ-МС / МС, отражая неидеальную корреляцию для общего T, а также для A4 (Пирсона и 0.68, соответственно). Это также подтверждает использование проверенных методов ЖХ-МС / МС при оценке женщин на предмет биохимической гиперандрогенемии [15, 31]. Кроме того, не требуется обширная предварительная обработка образцов, требуется только 200 мкл л сыворотки; поэтому наш метод ЖХ-МС / МС применим для измерения общих Т и А4 в повседневной клинической практике. Кроме того, всем пациентам строго выполнялось ультразвуковое исследование яичников, а наблюдения регистрировались стандартизированным способом. Кроме того, регистрировался широкий спектр гормональных и метаболических показателей.
Однако следует учитывать некоторые ограничения. Наша выборка исследования относительно небольшая, и в нее были включены только пациенты с олигоменореей, обратившиеся в университетский центр репродуктивной медицины. Хотя 45% пациентов имеют избыточный вес или ожирение, у большинства пациентов метаболический профиль благоприятный. Поэтому наши результаты нуждаются в подтверждении на других группах пациентов. Из-за перекрестного и наблюдательного дизайна исследования мы не можем различать причину и следствие.
В заключение, оценка ГСПГ и свободного тестостерона важна для оценки избытка андрогенов у субфертильных женщин с овуляторной дисфункцией и подозрением на СПКЯ, поскольку он отражает нарушения как яичников, так и метаболизма.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов. Лоран М. Р. – сотрудник Исследовательского фонда Фландрии (FWO). Вермеерш П. – старший клинический исследователь Исследовательского фонда Фландрии (FWO).
Вклад авторов
Антонио Л.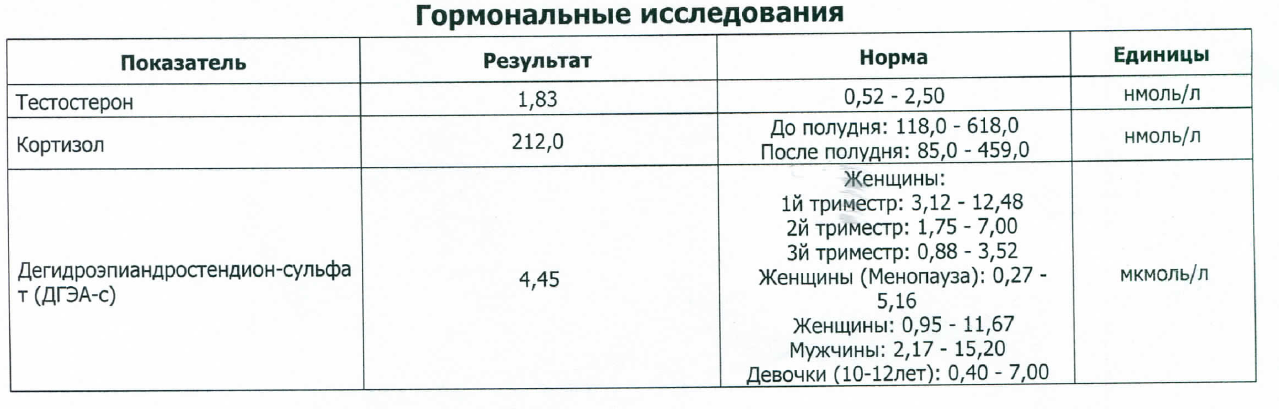 и Пауэлс С. внесли равный вклад в эту работу, а также Вермерш П. и Вандершуерен Д. внесли равный вклад в эту работу.
и Пауэлс С. внесли равный вклад в эту работу, а также Вермерш П. и Вандершуерен Д. внесли равный вклад в эту работу.
Благодарности
Авторы благодарят всех женщин, принявших участие в исследовании.Авторы благодарят своих координаторов исследования Катю Сервес и Мириам Велкенхейзен. Авторы благодарят Неле Пирсман за измерения половых стероидов. Эта работа была поддержана грантом Фонда научных исследований Фландрии (FWO-Vlaanderen Grant No. G085413N) и исследовательским грантом Левенского университета (KU Leuven GOA / 15/017). Пауэлс С. был поддержан Фондом клинических исследований университетской больницы Лёвена.
Дополнительные материалы
Дополнительный рисунок 1: блок-схема участников.Дополнительный текст: подробное описание метода жидкостной хроматографии и тандемной масс-спектрометрии для определения общего тестостерона и андростендиона в сыворотке крови. Дополнительная таблица 1: сравнение нормального и высокого общего тестостерона. (Дополнительные материалы)
Лабораторные исследования, визуализация, другие тесты
Adashi EY. Климактерический яичник как функциональная железа, вырабатывающая андрогены, управляемая гонадотропинами. Fertil Steril . 1994 июл.62 (1): 20-7. [Медлайн].
Гупта М., Чиа SY. Гормоны яичников: структура, биосинтез, функция, механизм действия и лабораторная диагностика. Т. Фальконе и У. Херд. Клиническая репродуктивная медицина и хирургия . Филадельфия, Пенсильвания: Mosby Inc .; 2007. 22.
.
Дэвисон С.Л., Белл Р.Андрогенная физиология. Semin Reprod Med . 2006 24 апреля (2): 71-7. [Медлайн]. [Полный текст].
Schiffer L, Kempegowda P, Arlt W, O’Reilly MW. МЕХАНИЗМЫ В ЭНДОКРИНОЛОГИИ: половая диморфная роль андрогенов в метаболических заболеваниях человека. Eur J Endocrinol . 2017 Сентябрь 177 (3): R125-43. [Медлайн]. [Полный текст].
МЕХАНИЗМЫ В ЭНДОКРИНОЛОГИИ: половая диморфная роль андрогенов в метаболических заболеваниях человека. Eur J Endocrinol . 2017 Сентябрь 177 (3): R125-43. [Медлайн]. [Полный текст].
Baulieu EE. Нейростероиды: новая функция мозга. Психонейроэндокринология . 1998 ноя.23 (8): 963-87. [Медлайн].
Hogervorst E, Matthews FE, Brayne C. Связаны ли оптимальные уровни тестостерона с лучшей когнитивной функцией у здоровых пожилых женщин и мужчин ?. Biochim Biophys Acta . 2010 Октябрь 1800 (10): 1145-52. [Медлайн].
Appelt H, Strauss B. Влияние лечения антиандрогенами на сексуальность женщин с гиперандрогенизмом. Psychother Psychosom . 1984. 42 (1-4): 177-81. [Медлайн].
Buster JE, Kingsberg SA, Aguirre O, Brown C, Breaux JG, Buch A, et al. Пластырь с тестостероном для снижения сексуального желания у женщин в период менопаузы после хирургического вмешательства: рандомизированное исследование. Акушерский гинекол . 2005 Май. 105 (5, Пет. 1): 944-52. [Медлайн].
Пластырь с тестостероном для снижения сексуального желания у женщин в период менопаузы после хирургического вмешательства: рандомизированное исследование. Акушерский гинекол . 2005 Май. 105 (5, Пет. 1): 944-52. [Медлайн].
Слменда С, Лонгкоп С, Павлин М., Хуэй С., Джонстон С.С. Половые стероиды, костная масса и потеря костной массы. Проспективное исследование женщин в пре-, пери- и постменопаузе. Дж. Клин Инвест . 1996, 1 января. 97 (1): 14-21. [Медлайн]. [Полный текст].
Dimitrakakis C, Zhou J, Wang J, Belanger A, LaBrie F, Cheng C и др.Физиологическая роль тестостерона в ограничении эстрогенной стимуляции груди. Менопауза . 2003 июл-авг. 10 (4): 292-8. [Медлайн].
Андерсон К.Е., Селлерс ТА, Чен П.Л., Рич СС, Хонг КП, Фолсом АР. Связь синдрома Штейна-Левенталя с заболеваемостью постменопаузальным раком груди в большом проспективном исследовании женщин в Айове. Рак . 1997 г. 1. 79 (3): 494-9. [Медлайн].
Рак . 1997 г. 1. 79 (3): 494-9. [Медлайн].
Хофлинг М., Хиршберг А.Л., Скуг Л., Тани Э., Хагерстрем Т., фон Шульц Б.Тестостерон подавляет индуцированную эстрогеном / прогестагеном пролиферацию клеток груди у женщин в постменопаузе. Менопауза . 2007 март-апрель. 14 (2): 183-90. [Медлайн].
Bulun SE, Mahendroo MS, Simpson ER. Амплификация с помощью полимеразной цепной реакции не позволяет обнаружить транскрипты ароматазы цитохрома P450 в нормальном эндометрии или децидуальной оболочке человека. Дж. Клин Эндокринол Метаб . 1993 июн. 76 (6): 1458-63. [Медлайн].
Такерман Э.М., Окон М.А., Ли Т., Лэрд С.М.Оказывают ли андрогены прямое влияние на функцию эндометрия? Исследование in vitro. Fertil Steril . 2000 Октябрь, 74 (4): 771-9. [Медлайн].
Ehrmann DA, Schneider DJ, Sobel BE, Cavaghan MK, Imperial J, Rosenfield RL, et al.Троглитазон улучшает нарушение действия инсулина, секрецию инсулина, стероидогенез яичников и фибринолиз у женщин с синдромом поликистозных яичников. Дж. Клин Эндокринол Метаб . 1997 июл.82 (7): 2108-16. [Медлайн].
Holte J, Gennarelli G, Wide L, Lithell H, Berne C. Высокая распространенность поликистозных яичников и связанных с ними клинических, эндокринных и метаболических особенностей у женщин с ранее перенесенным гестационным сахарным диабетом. Дж. Клин Эндокринол Метаб .1998 апр. 83 (4): 1143-50. [Медлайн].
Eckardstein A, Wu FC. Тестостерон и атеросклероз. Growth Horm IGF Res . 13 августа 2003 г., приложение A: S72-84. [Медлайн].
Somani N, Harrison S, Bergfeld WF. Клиническая оценка гирсутизма. Дерматол Тер . 2008 сентябрь-октябрь. 21 (5): 376-91. [Медлайн].
Консенсус по лечению бесплодия, связанного с синдромом поликистозных яичников. Репродукция Человека . 2008 23 марта (3): 462-77. [Медлайн].
Йилдиз Б.О., Болур С., Вудс К., Мур А., Аззиз Р. Визуальная оценка гирсутизма. Обновление Hum Reprod . 2010 январь-февраль. 16 (1): 51-64. [Медлайн]. [Полный текст].
16 (1): 51-64. [Медлайн]. [Полный текст].
Лолис М.С., Боу В.П., Шалита АР. Акне и системные заболевания. Med Clin North Am . 2009 ноябрь 93 (6): 1161-81. [Медлайн].
Uysal G, Sahin Y, Unluhizarci K, et al. Акне – признак нарушения избытка андрогенов или нет? Eur J Obstet Gynecol Reprod Biol . 2017 Апрель 211: 21-5. [Медлайн].
Эльхассан Ю.С., Идковяк Дж., Смит К. и др. Причины, закономерности и серьезность избытка андрогенов у 1205 последовательно набранных женщин. Дж. Клин Эндокринол Метаб . 2018 г. 1. 103 (3): 1214-23.[Медлайн]. [Полный текст].
Boyd-Woschinko G, Kushner H, Falkner B. Избыток андрогенов связан с инсулинорезистентностью и развитием диабета у афроамериканских женщин. J Cardiometab Syndr . Осень 2007 г. 2 (4): 254-9. [Медлайн].
Осень 2007 г. 2 (4): 254-9. [Медлайн].
Кулури О., Конвей Г.С. Систематический обзор часто используемых медицинских методов лечения гирсутизма у женщин. Clin Endocrinol (Oxf) . 2008 май. 68 (5): 800-5. [Медлайн].
Пересмотренный консенсус 2003 г. по диагностическим критериям и долгосрочным рискам для здоровья, связанным с синдромом поликистозных яичников (СПКЯ). Репродукция Человека . 2004 19 января (1): 41-7. [Медлайн].
Уиллис С.К., Мэтью Х.М., Вайз Л.А. и др. Менструальный цикл и гирсутизм, о котором сообщают сами люди, по модифицированной шкале Ферримана-Галлвея: перекрестное исследование. Eur J Obstet Gynecol Reprod Biol . 2020 6 марта. 248: 137-43. [Медлайн].
Mehta A, Matwijiw I., Taylor PJ, Salamon EA, Kredentser JV, Faiman C. Следует ли измерять уровни андрогенов у гирсутированных женщин с нормальным менструальным циклом? Инт Дж Фертил . 1992 ноябрь-декабрь. 37 (6): 354-7. [Медлайн].
Следует ли измерять уровни андрогенов у гирсутированных женщин с нормальным менструальным циклом? Инт Дж Фертил . 1992 ноябрь-декабрь. 37 (6): 354-7. [Медлайн].
Монкада Э. Семейное исследование гирсутизма. Дж. Клин Эндокринол Метаб . 1970, 31 ноября (5): 556-64. [Медлайн].
Govind A, Obhrai MS, Clayton RN. Поликистоз яичников наследуется по аутосомно-доминантному признаку: анализ синдрома поликистозных яичников 29 и 10 контрольных семей. Дж. Клин Эндокринол Метаб . 1999, январь 84 (1): 38-43. [Медлайн].
Lowenstein EJ.Диагностика и лечение дерматологических проявлений синдрома поликистозных яичников. Дерматол Тер . 2006 июль-авг. 19 (4): 210-23. [Медлайн].
Paschou SA, Palioura E, Ioannidis D, et al. Гиперандрогения надпочечников не ухудшает инсулинорезистентность и липидный профиль у женщин с СПКЯ. Endocr Connect . 2017 6 ноября (8): 601-6. [Медлайн]. [Полный текст].
Endocr Connect . 2017 6 ноября (8): 601-6. [Медлайн]. [Полный текст].
Ferriman D, Gallwey JD. Клиническая оценка роста волос на теле у женщин. Дж. Клин Эндокринол Метаб . 1961, 21 ноября: 1440-7. [Медлайн].
Села Е., Робертсон С., Раш К., Куста Е., Уайт Д.М., Уилсон Н. и др. Распространенность поликистоза яичников у женщин с андрогенной алопецией. Eur J Endocrinol . 2003 ноябрь 149 (5): 439-42. [Медлайн].
Kahana M, Grossman E, Feinstein A, Ronnen M, Cohen M, Millet MS. Метки на коже: кожный маркер сахарного диабета. Acta Derm Venereol . 1987 г.67 (2): 175-7. [Медлайн].
Фрэнкс С. Синдром поликистозных яичников. N Engl J Med . 1995, 28 сентября. 333 (13): 853-61. [Медлайн].
Аззиз Р., Санчес Л.А., Кнохенхауэр Е.С. и др.Избыток андрогенов у женщин: опыт более 1000 пациентов подряд. Дж. Клин Эндокринол Метаб . 2004 Февраль 89 (2): 453-62. [Медлайн].
Деннеди М.С., Смит Д., О’Ши Д., МакКенна Т.Дж. Обследование пациентов с атипичной или тяжелой гиперандрогенемией, включая андроген-секретирующую тератому яичника. Eur J Endocrinol . 2010 Февраль 162 (2): 213-20. [Медлайн].
Bahri Khomami M, Boyle JA, Tay CT, et al. Синдром поликистозных яичников и неблагоприятные исходы беременности: текущее состояние знаний, проблемы и потенциальные последствия для практики. Clin Endocrinol (Oxf) . 2018 20 февраля. [Medline]. [Полный текст].
Clin Endocrinol (Oxf) . 2018 20 февраля. [Medline]. [Полный текст].
Кармина Э., Лобо РА. Синдром поликистозных яичников (СПКЯ): возможно, наиболее распространенная эндокринопатия связана со значительной заболеваемостью у женщин. Дж. Клин Эндокринол Метаб . 1999 июн. 84 (6): 1897-9. [Медлайн].
Ландей М., Хуанг А., Аззиз Р. Степень гиперинсулинемии, независимо от уровня андрогенов, является важным фактором, определяющим тяжесть гирсутизма при СПКЯ. Fertil Steril . 2009 август 92 (2): 643-7. [Медлайн].
Ibanez L., Oberfield SE, Witchel S, et al. Новости международного консорциума: патофизиология, диагностика и лечение синдрома поликистозных яичников в подростковом возрасте. Horm Res Paediatr . 2017. 88 (6): 371-95. [Медлайн]. [Полный текст].
Рудницка Э., Куницки М., Сучта К., Мачура П., Грымович М., Смоларчик Р. Воспалительные маркеры у женщин с синдромом поликистозных яичников. Биомед Рес Инт . 2020. 2020: 40
. [Медлайн]. [Полный текст].
Escobar-Morreale HF, Roldan-Martin MB. Диабет 1 типа и синдром поликистозных яичников: систематический обзор и метаанализ. Уход за диабетом . 2016 Апрель 39 (4): 639-48. [Медлайн].
Flier JS, Eastman RC, Minaker KL, Matteson D, Rowe JW.Черный акантоз у тучных женщин с гиперандрогенизмом. Характеристика инсулинорезистентного состояния, отличного от синдромов типа A и B. Диабет . 1985 Февраль 34 (2): 101-7. [Медлайн].
[Медлайн].
Барбьери Р.Л., Райан К.Дж. Гиперандрогения, инсулинорезистентность и синдром черного акантоза: распространенная эндокринопатия с отчетливыми патофизиологическими особенностями. Am J Obstet Gynecol . 1983, 1 сентября. 147 (1): 90-101. [Медлайн].
Легро RS.Инсулинорезистентность при синдроме поликистозных яичников: лечение фенотипа без генотипа. Эндокринол клеток Mol . 1998 25 октября. 145 (1-2): 103-10. [Медлайн].
Barth JH, Jenkins M, Belchetz PE. Гипертекоз яичников, диабет и гипертермия у женщин в постменопаузе. Clin Endocrinol (Oxf) . 1997 Февраль 46 (2): 123-8. [Медлайн].
Лобо РА. Гиперандрогенизм яичников и опухоли, продуцирующие андрогены. Endocrinol Metab Clin North Am .1991 г., 20 (4): 773-805.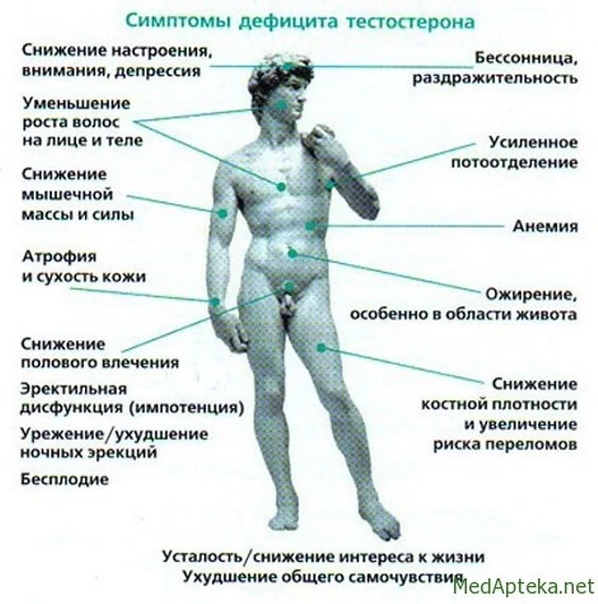 [Медлайн].
[Медлайн].
Speiser PW, белый ПК. Врожденная гиперплазия надпочечников. N Engl J Med . 2003 21 августа. 349 (8): 776-88. [Медлайн].
Аззиз Р., Дьюайли Д., Овербах Д. Клинический обзор 56: Неклассическая гиперплазия надпочечников: современные концепции. Дж. Клин Эндокринол Метаб . 1994 Апрель 78 (4): 810-5. [Медлайн].
Kamrath C, Wettstaedt L, Boettcher C, Hartmann MF, Wudy SA.Избыток андрогенов связан с повышенным содержанием 11-оксигенированных андрогенов у леченных детей с врожденной гиперплазией надпочечников. Дж. Стероид Биохим Мол Биол . 2018 Апрель 178: 221-8. [Медлайн].
Хоулетт Т.А., Рис Л.Х., Бессер Г.М. Синдром Кушинга. Clin Endocrinol Metab . 1985, 14 ноября (4): 911-45. [Медлайн].
Орт DN. Синдром Кушинга. N Engl J Med . 1995 23 марта. 332 (12): 791-803. [Медлайн].
Derksen J, Nagesser SK, Meinders AE, Haak HR, van de Velde CJ. Выявление вирилизирующих опухолей надпочечников у женщин с волосяным покровом. N Engl J Med . 1994, 13 октября. 331 (15): 968-73. [Медлайн].
Latronico AC, Chrousos GP. Большой личный опыт: опухоли надпочечников. Дж. Клин Эндокринол Метаб . 1997 Май. 82 (5): 1317-24. [Медлайн].
Wu CH. Андрогены плазмы, прогестины и пролактин при гирсутизме. Eur J Obstet Gynecol Reprod Biol . 1982 Сентябрь 13 (6): 377-87. [Медлайн].
Eur J Obstet Gynecol Reprod Biol . 1982 Сентябрь 13 (6): 377-87. [Медлайн].
Hagag P, Hertzianu I, Ben-Shlomo A, Weiss M. Подавление андрогенов и клиническое улучшение с помощью агонистов дофамина у женщин с гиперандрогенно-гиперпролактинемией. J Reprod Med . 2001 июл. 46 (7): 678-84.[Медлайн].
Канова Н., Бичикова М. Гиперандрогенные состояния при беременности. Physiol Res . 2011. 60 (2): 243-52. [Медлайн].
Мартин К.А., Чанг Р.Дж., Эрманн Д.А., Ибанез Л., Лобо Р.А., Розенфилд Р.Л. и др. Оценка и лечение гирсутизма у женщин в пременопаузе: руководство по клинической практике эндокринного общества. Дж. Клин Эндокринол Метаб . 2008 апр. 93 (4): 1105-20. [Медлайн].
Оценка и лечение избытка андрогенов. Fertil Steril . 2006 ноябрь 86 (5 приложение 1): S241-7. [Медлайн].
2006 ноябрь 86 (5 приложение 1): S241-7. [Медлайн].
Escobar-Morreale HF, Carmina E, Dewailly D, et al. Эпидемиология, диагностика и лечение гирсутизма: согласованное заявление Общества избытка андрогенов и синдрома поликистозных яичников. Обновление Hum Reprod . 2012 марта 18 (2): 146-70. [Медлайн].
[Рекомендации] Технический бюллетень ACOG. Оценка и лечение волосяного покрова. Int J Gynaecol Obstet .Июнь. 49: 341-6. [Медлайн].
Хоффман Д.И., Клове К, Лобо РА. Распространенность и значение повышенного уровня дегидроэпиандростерона сульфата у ановуляторных женщин. Fertil Steril . 1984 июл.42 (1): 76-81. [Медлайн].
Хантер М.Х., Карек П.Дж. Оценка и лечение женщин с гирсутизмом. Am Fam Physician . 15 июня 2003 г. 67 (12): 2565-72. [Медлайн].
67 (12): 2565-72. [Медлайн].
Аззиз Р., Хинкапи Л.А., Кнохенхауэр ES, Дьюайли Д., Фокс Л., Ботинки Л. Р..Скрининг на неклассическую гиперплазию надпочечников с дефицитом 21-гидроксилазы среди гиперандрогенных женщин: проспективное исследование. Fertil Steril . 1999 Ноябрь 72 (5): 915-25. [Медлайн].
Benacerraf BR, Finkler NJ, Wojciechowski C, Knapp RC. Сонографическая точность в диагностике новообразований яичников. J Reprod Med . 1990 Май. 35 (5): 491-5. [Медлайн].
Блейк М.А., Холалкере Н.С., Боланд Г.В. Методы визуализации для характеристики поражения надпочечников. Радиол Клин Норт Ам . 2008, январь, 46 (1): 65-78, vi. [Медлайн].
Заявление о позиции Американской ассоциации клинических эндокринологов по метаболическим и сердечно-сосудистым последствиям синдрома поликистозных яичников. Endocr Pract . 2005 март-апрель. 11 (2): 126-34. [Медлайн].
Endocr Pract . 2005 март-апрель. 11 (2): 126-34. [Медлайн].
Salley KE, Wickham EP, Cheang KI, Essah PA, Karjane NW, Nestler JE. Непереносимость глюкозы при синдроме поликистозных яичников – позиция Общества избытка андрогенов. Дж. Клин Эндокринол Метаб . 2007 декабрь 92 (12): 4546-56. [Медлайн].
Отчет Международного экспертного комитета о роли анализа A1C в диагностике диабета. Уход за диабетом . 2009 Июль 32 (7): 1327-34. [Медлайн]. [Полный текст].
Mortada R, Comerford K, Kallail KJ, Karakas SE. Полезность гемоглобина-A1C у недиабетических женщин с синдромом поликистозных яичников. Endocr Pract . 2013 март-апрель. 19 (2): 284-9.[Медлайн].
Челик С., Абали Р., Басту Е., Тасдемир Н., Тасдемир Ю. Г., Гул А. Оценка распространенности нарушенной толерантности к глюкозе с гемоглобином A1c и пероральным тестом толерантности к глюкозе у 252 турецких женщин с синдромом поликистозных яичников: проспективное контролируемое исследование. Репродукция Человека . 2013 Апрель 28 (4): 1062-8. [Медлайн].
Оценка распространенности нарушенной толерантности к глюкозе с гемоглобином A1c и пероральным тестом толерантности к глюкозе у 252 турецких женщин с синдромом поликистозных яичников: проспективное контролируемое исследование. Репродукция Человека . 2013 Апрель 28 (4): 1062-8. [Медлайн].
Kim JJ, Choi YM, Cho YM, Jung HS, Chae SJ, Hwang KR, et al. Распространенность повышенного уровня гликированного гемоглобина у женщин с синдромом поликистозных яичников. Репродукция Человека . 2012 май. 27 (5): 1439-44. [Медлайн].
Waldstreicher J, Santoro NF, Hall JE, Filicori M, Crowley WF Jr. Гиперфункция гипоталамо-гипофизарной оси у женщин с поликистозом яичников: косвенные доказательства частичной десенсибилизации гонадотрофов. Дж. Клин Эндокринол Метаб . 1988, январь, 66 (1): 165-72. [Медлайн].
Шененбергер DW, Utecht LM. Удаление нежелательных волос на лице. Am Fam Physician . 2002 15 ноября. 66 (10): 1907-11. [Медлайн].
Christ JP, Falcone T. Бариатрическая хирургия улучшает гиперандрогенизм, нарушения менструального цикла и метаболическую дисфункцию у женщин с синдромом поликистозных яичников (СПКЯ). Obes Surg . 2 марта 2018 г. [Medline].
Паскуали Р., Антенуччи Д., Казимирри Ф., Вентуроли С., Парадизи Р., Фаббри Р. и др.Клиническая и гормональная характеристика женщин с аменореей и ожирением и гиперандрогенией до и после похудания. Дж. Клин Эндокринол Метаб . 1989, январь, 68 (1): 173-9. [Медлайн].
1989, январь, 68 (1): 173-9. [Медлайн].
Пейт Р.Р., Пратт М., Блэр С.Н., Хаскелл В.Л., Масера Калифорния, Бушар С. и др. Физическая активность и общественное здоровье. Рекомендация Центров по контролю и профилактике заболеваний и Американского колледжа спортивной медицины. JAMA . 1995 г., 1. 273 (5): 402-7. [Медлайн].
Кларк А.М., Торнли Б., Томлинсон Л., Галлетли С., Норман Р.Дж.Снижение веса у женщин с ожирением и бесплодием приводит к улучшению репродуктивного результата при всех формах лечения бесплодия. Репродукция Человека . 1998 июн. 13 (6): 1502-5. [Медлайн].
Лундгрен Дж.А., Ким С.Х., Берт Солорзано С.М., Маккартни С.Р., Маршалл Дж. Подавление прогестероном частоты пульса лютеинизирующего гормона у девочек-подростков с гиперандрогенизмом: эффекты метформина. Дж. Клин Эндокринол Метаб . 2018 1 января. 103 (1): 263-70. [Медлайн]. [Полный текст].
2018 1 января. 103 (1): 263-70. [Медлайн]. [Полный текст].
Камминг, округ Колумбия, Ян Дж. К., Rebar RW, Yen SS. Лечение гирсутизма спиронолактоном. JAMA . 5 марта 1982 г. 247 (9): 1295-8. [Медлайн].
Board JA, Rosenberg SM, Smeltzer JS. Спиронолактон и эстроген-прогестиновая терапия гирсутизма. South Med J . 1987 Апрель 80 (4): 483-6. [Медлайн].
Cusan L, Dupont A, Gomez JL, Tremblay RR, Labrie F. Сравнение флутамида и спиронолактона при лечении гирсутизма: рандомизированное контролируемое исследование. Fertil Steril . 1994 г., 61 (2): 281-7. [Медлайн].
Van der Spuy ZM, le Roux PA. Ципротерона ацетат при гирсутизме. Кокрановская база данных Syst Rev . 2003. CD001125. [Медлайн].
Fulghesu AM, Melis F, Murru G, Canu E, Melis GB.Очень низкие дозы флутамида при лечении гиперандрогении. Гинекол Эндокринол . 2017 6. 1-5 ноября. [Медлайн].
Wong IL, Morris RS, Chang L, Spahn MA, Stanczyk FZ, Lobo RA. Проспективное рандомизированное исследование по сравнению финастерида и спиронолактона в лечении женщин с гирсутизмом. Дж. Клин Эндокринол Метаб . 1995 Январь 80 (1): 233-8. [Медлайн].
Erenus M, Yücelten D, Durmusoglu F, Gürbüz O. Сравнение финастерида и спиронолактона при лечении идиопатического гирсутизма. Fertil Steril . 1997 декабрь 68 (6): 1000-3. [Медлайн].
[Медлайн].
Эриксон Г.Ф., Магоффин Д.А., Дайер К.А., Хофедитц С. Клетки, продуцирующие андрогены яичников: обзор взаимосвязей структура / функция. Endocr Ред. . 1985 Лето. 6 (3): 371-99. [Медлайн].
Nestler JE, Powers LP, Matt DW, Steingold KA, Plymate SR, Rittmaster RS и др. Прямое влияние гиперинсулинемии на сывороточные уровни глобулина, связывающего половые гормоны, у тучных женщин с синдромом поликистозных яичников. Дж. Клин Эндокринол Метаб . 1991, январь 72 (1): 83-9. [Медлайн].
Эрманн Д.А., Каваган М.К., Империал Дж., Стурис Дж., Розенфилд Р.Л., Полонский К.С. Влияние метформина на секрецию инсулина, действие инсулина и стероидогенез яичников у женщин с синдромом поликистозных яичников. Дж. Клин Эндокринол Метаб . 1997 февраль 82 (2): 524-30. [Медлайн].
Паскуали Р., Гамбинери А., Бискотти Д., Висеннати В., Гальярди Л., Колитта Д. и др. Влияние длительного лечения метформином, добавленным к гипокалорийной диете, на состав тела, распределение жира, уровни андрогенов и инсулина у женщин с абдоминальным ожирением с синдромом поликистозных яичников и без него. Дж. Клин Эндокринол Метаб . 2000 августа 85 (8): 2767-74. [Медлайн].
Sturrock ND, Lannon B, Fay TN.Метформин не усиливает индукцию овуляции при синдроме поликистозных яичников, резистентных к кломифену, в клинической практике. Br J Clin Pharmacol .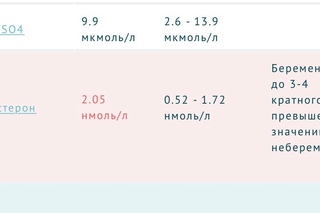 2002 май. 53 (5): 469-73. [Медлайн].
2002 май. 53 (5): 469-73. [Медлайн].
Костелло М., Шреста Б., Иден Дж., Сджоблом П., Джонсон Н. Сенсибилизирующие к инсулину препараты по сравнению с комбинированными пероральными противозачаточными таблетками при гирсутизме, угрях и риске диабета, сердечно-сосудистых заболеваний и рака эндометрия при синдроме поликистозных яичников. Кокрановская база данных Syst Rev .2007 24 января. CD005552. [Медлайн].
Cosma M, Swiglo BA, Flynn DN, Kurtz DM, Labella ML, Mullan RJ, et al. Клинический обзор: Сенсибилизаторы инсулина для лечения гирсутизма: систематический обзор и метаанализ рандомизированных контролируемых исследований. Дж. Клин Эндокринол Метаб . 2008 апр. 93 (4): 1135-42. [Медлайн].
Высокий уровень эндогенного тестостерона увеличивает риск диабета 2 типа среди молодых здоровых женщин
Источник / раскрытие информации
Опубликовано:
Раскрытие информации:
Авторы не сообщают о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.
Подписаться
Нам не удалось обработать ваш запрос.Пожалуйста, повторите попытку позже. Если проблема не исчезнет, обратитесь по адресу [email protected].
Вернуться в Healio
Джон Джар løv Rasmussen
Высокие уровни эндогенного общего и циркулирующего свободного тестостерона в плазме связаны с увеличением в 2-7 раз риска развития диабета 2 типа у молодых здоровых женщин без сопутствующих заболеваний, согласно результатам большого ретроспективного исследования, опубликованного в журнале Journal of the Endocrine Общество.
«Результаты этого исследования показывают, что высокие уровни тестостерона в плазме могут играть роль в патогенезе диабета 2 типа у женщин», – сказал Йон Ярлов Расмуссен, доктор медицинских наук, , специалист-регистратор и научный сотрудник отделения эндокринологии. Rigshospitalet в Копенгагене, Дания, сказал Healio. «Заболеваемость диабетом 2 типа в исследовании была довольно низкой, но результаты свидетельствуют о том, что скрининг на диабет 2 типа среди женщин с более высоким уровнем тестостерона в плазме может быть полезным, даже среди молодых женщин без установленных сопутствующих заболеваний, таких как поликистоз. синдром яичников.”
В ретроспективном исследовании Расмуссен и его коллеги проанализировали данные 8 876 здоровых женщин (средний возраст 38,5 лет), которые предоставили образцы крови для измерения тестостерона в плазме, дегидроэпиандростерон-сульфата (ДГЭАС), дигидротестостерона (ДГТ) и глобулина, связывающего половые гормоны (ГСПГ).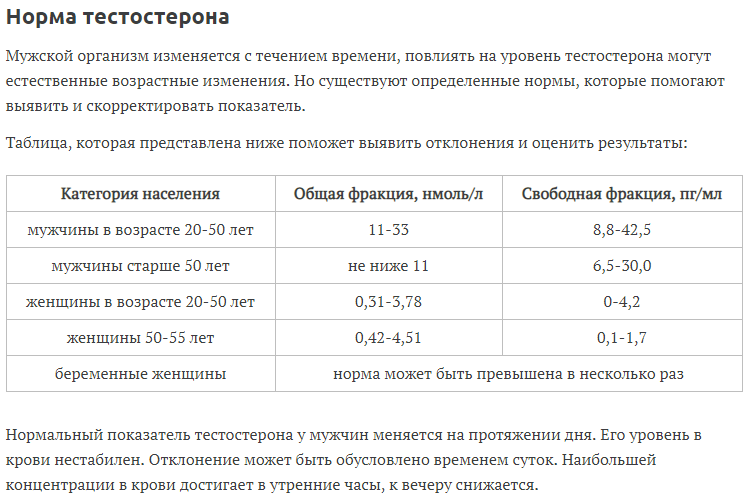 ) в период с января 2007 года по декабрь 2015 года. Исследователи проанализировали андрогены с помощью тандемной жидкостной хроматографии с масс-спектрометрией. Исследователи использовали модели регрессии Пуассона для расчета коэффициентов заболеваемости диабетом 2 типа во время среднего периода наблюдения, равного 8.1 год, стратифицированный по квартилям андрогенов.
) в период с января 2007 года по декабрь 2015 года. Исследователи проанализировали андрогены с помощью тандемной жидкостной хроматографии с масс-спектрометрией. Исследователи использовали модели регрессии Пуассона для расчета коэффициентов заболеваемости диабетом 2 типа во время среднего периода наблюдения, равного 8.1 год, стратифицированный по квартилям андрогенов.
За 69 728 человеко-лет 69 женщин получили диагноз диабета 2 типа.
Высокие уровни эндогенного общего и циркулирующего свободного тестостерона в плазме крови связаны с двукратным-семикратным повышением риска развития диабета 2 типа у молодых, здоровых женщин без сопутствующих заболеваний.
Исследователи обнаружили, что женщины с наивысшими квартилями общего тестостерона плазмы и рассчитанного свободного тестостерона были более склонны к развитию диабета 2 типа во время наблюдения, чем у женщин.женщины в самом низком квартиле с IRR 1,97 (95% ДИ, 1,01–3,85) и 7,32 (95% ДИ, 2,84–18,83), соответственно. Уровни SHBG были обратно связаны с диабетом 2 типа, тогда как DHEAS и DHT не были связаны с диабетом 2 типа. Результаты сохранились после поправки на возраст, SHGB в плазме и социально-экономические факторы.
Уровни SHBG были обратно связаны с диабетом 2 типа, тогда как DHEAS и DHT не были связаны с диабетом 2 типа. Результаты сохранились после поправки на возраст, SHGB в плазме и социально-экономические факторы.
Исследователи отметили ограниченную информацию о составе тела и ИМТ женщин, проанализированных для исследования.
«Интересно, что недавнее исследование показало, что эндогенные андрогены обратно пропорциональны ИМТ у здоровых женщин», – пишут исследователи.«В соответствии с этим мы отметили, что уровень ГСПГ в плазме был самым низким среди женщин в квартиле 1 и самым высоким среди женщин в четвертом квартиле общего тестостерона в плазме. Таким образом, предполагается, что женщины в самом низком квартиле общего тестостерона в плазме могут иметь самые высокие инсулинорезистентность и ИМТ на исходном уровне, в то время как женщины из самого высокого квартиля общего тестостерона в плазме потенциально имеют самые низкие инсулинорезистентность и ИМТ. Соответственно, мы могли недооценить, а не переоценить влияние тестостерона на риск развития диабета 2 типа у женщин. ”- Регина Шаффер
”- Регина Шаффер
ПЕРЕРЫВ СТРАНИЦЫ
Для дополнительной информации:
Jon Jarløv Rasmussen, MD, PhD, можно связаться в отделении эндокринологии Университетской больницы Копенгагена, Rigshospitalet, Ole Maaløes Vej 24, opg. 7562, DK-2200, Дания; электронная почта: [email protected]; Twitter: @ JonRasmussen9.
Раскрытие информации: Авторы не раскрывают существенной финансовой информации.
Перспектива
Вернуться к началу
Сьюзан Дэвис, MBBS, FRACP, PhD, FAHMS
Это исследование убедительно подтверждает необходимость лучшего понимания связи между SHBG и риском диабета 2 типа. Эти данные свидетельствуют о том, что уровни тестостерона не связаны с риском диабета 2 типа у женщин; не было межгрупповых различий среди женщин с уровнем тестостерона в первом, втором и третьем квартилях.Однако риск однозначно снижается для любой женщины в этой когорте с уровнем SHBG выше самого низкого квартиля.
В этом исследовании также отсутствуют данные об ИМТ и статусе курения. У курящих женщин уровень общего тестостерона выше, чем у женщин, которые не курят, а курение связано с риском кардиометаболических заболеваний. Кроме того, в Дании в 2010 году от 15% до 20% женщин курили, и этот процент, возможно, был выше в 2007 году. Кроме того, не было никаких корректировок или комментариев относительно статуса менопаузы.Средний возраст наступления менопаузы составляет 51 год, и у 10% женщин менопауза наступает в возрасте до 45 лет. Менопауза связана с повышенным риском развития диабета 2 типа. Также стоит учесть данные о применении заместительной гормональной терапии, которая увеличивает уровень ГСПГ и снижает уровень тестостерона.
Сьюзан Дэвис, MBBS, FRACP, PhD, FAHMS
Профессор Школы общественного здравоохранения и профилактической медицины
Университет Монаша, Австралия
Раскрытие информации: Дэвис не сообщает о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.
Подписаться
Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже.Если проблема не исчезнет, обратитесь по адресу [email protected].
Вернуться в Healio
Диагностика синдрома поликистозных яичников у подростков
Резюме
Международные специализированные педиатрические сообщества недавно пришли к консенсусу, что в противном случае необъяснимая стойкая гиперандрогенная ановуляция с использованием стандартов, соответствующих возрасту и стадии, является подходящим диагностическим критерием синдрома поликистозных яичников (СПКЯ) в подростки.Цель этого обзора – обобщить эти рекомендации и обсудить их основу и значение. На ановуляцию указывает аномальное маточное кровотечение, которое возникает, когда продолжительность менструального цикла выходит за пределы нормального диапазона или кровотечение чрезмерно: циклы за пределами 19-90 дней всегда являются ненормальными, и большинство из них длится от 21 до 45 дней даже в течение первого постменархеального года. Продолжающиеся нарушения менструального цикла у гиперандрогенного подростка в течение 1 года прогнозируют по крайней мере 50% риск сохранения.Лучше всего на гиперандрогенизм указывает стойкое повышение уровня тестостерона в сыворотке выше норм для взрослых, как определено в надежной справочной лаборатории. Поскольку документирование гиперандрогенемии может быть проблематичным, гирсутизм средней и тяжелой степени является клиническим доказательством гиперандрогении. Умеренно-тяжелые воспалительные обыкновенные угри, не поддающиеся местному лечению, являются показанием для тестирования на гиперандрогенемию. Лечение СПКЯ направлено на симптомы. Циклические эстроген-прогестиновые оральные контрацептивы обычно являются предпочтительным средством лечения первой линии, поскольку они надежно улучшают как менструальные нарушения, так и гиперандрогенизм.Лечение первой линии сопутствующих заболеваний ожирения и инсулинорезистентности – это изменение образа жизни с ограничением калорийности и увеличением физических нагрузок. Метформин в сочетании с модификацией поведения показан при непереносимости глюкозы. Хотя сохранение гиперандрогенной ановуляции в течение ≥2 лет обеспечивает отличие СПКЯ от физиологической ановуляции, раннее обследование рекомендуется для постановки предварительного диагноза, чтобы комбинированное лечение оральными контрацептивами, которое замаскирует диагноз за счет подавления гиперандрогенемии, не откладывалось излишне.
Тестостерон – обзор | Темы ScienceDirect
Патофизиология
Самым важным андрогеном человека является тестостерон. Тестостерон – стероидный гормон, состоящий из 19 атомов углерода (рис. 64.1). Другим известным андрогеном является дегидроэпиандростерон (DHEA), который принадлежит к группе прогормонов, вместе называемых 17-кетостероидами. У взрослых мужчин семенники вырабатывают примерно 7 мг тестостерона в день. 1 У женщин суточная скорость выработки тестостерона составляет примерно 0.25–0,3 мг. 2 У мужчин в надпочечниках вырабатывается дополнительно 0,25 мг тестостерона в день, но количество может варьироваться в зависимости от пациента. 3 У женщин надпочечники обеспечивают примерно 25% суточной выработки тестостерона или около 50–75 мкг / день, вклад яичников составляет 25%, а оставшиеся 50% суточной выработки тестостерона обусловлены периферическим превращением. 2 Остальная часть обсуждения будет посвящена дефициту тестостерона (ДТ) у мужчин и механизмам контроля, связанным с мужской физиологией.
Уровень тестостерона регулируется лютеинизирующим гормоном (ЛГ) передней доли гипофиза. ЛГ стимулирует высвобождение тестостерона из клеток Лейдига в яичках. Производство спермы находится под влиянием фолликулостимулирующего гормона (ФСГ), который также выделяется из передней доли гипофиза. Тестостерон подавляет секрецию ЛГ по отрицательной обратной связи. 1 Уровни тестостерона в плазме соответствуют циркадному ритму, с максимальным пиком ранним утром около 7:00 a.м. и еще один, меньший пик днем около 16:00. 4 Однако пик и низший уровень тестостерона не так драматичны, как у кортизола.
Тестостерон обычно находится в организме связанным с белками, особенно с глобулином, связывающим половые гормоны (SHBG). Тестостерон, связанный с SHBG, измеряется как общий тестостерон (TT). Производство SHBG в печени контролируется рядом гормонов. Заболевания печени, эстроген и гормоны щитовидной железы увеличивают ГСПГ. ГСПГ снижается в ответ на андрогены, инсулинорезистентность и диабет, а также при гипотиреозе. 5 Уровни SHBG в плазме имеют тенденцию к увеличению с возрастом. Доля тестостерона, связанного с ГСПГ, в сыворотке пропорциональна уровню ГСПГ. 5 Это помогает объяснить более быструю скорость снижения свободного тестостерона (свободный T) по сравнению с TT (снижение на 2–3% в год по сравнению с 1–2%, соответственно) после 40 лет.
Диабет, метаболический синдром / инсулинорезистентность, ожирение и гипотиреоз могут привести к ложно низкому уровню TT, несмотря на нормальные уровни свободного тестостерона.Проверка свободного T является более точным тестом у этих людей.
Тестостерон может превращаться в эстрадиол с помощью ароматазы, особенно в жировой ткани, и в дигидротестостерон (DHT) с помощью 5-альфа-редуктазы в специализированных тканях, таких как сальные железы, волосяные фолликулы и ткани простаты (рис. 64.2). Тестостерон регулирует развитие вторичных половых признаков у мужчин. Достаточное количество тестостерона необходимо для нормального либидо, фертильности и потенции у мужчин. Он также может влиять на эритропоэз.Тестостерон оказывает анаболическое действие на мускулатуру и может влиять на поведение и агрессивность. Тестостерон метаболизируется в печени и в основном выводится с мочой. 1
Существует множество клинических проявлений TD, что затрудняет диагностику. Физические симптомы включают снижение минеральной плотности костей, снижение мышечной массы и силы, увеличение жировых отложений или индекса массы тела (ИМТ), гинекомастию, анемию, облысение в подмышечных и половых областях и утомляемость. Психологические симптомы могут включать подавленное настроение, снижение энергии / чувства бодрости или благополучия, снижение уверенности в себе и нарушение познания / памяти.Однако много раз мужчины предъявляют главную жалобу на сексуальную дисфункцию. Сексуальные симптомы включают снижение либидо, эректильную дисфункцию, трудности с достижением оргазма, снижение утренней эрекции и снижение сексуальной активности 6 (вставка 64.1).
Хотя ведутся споры о том, какой уровень ТТ составляет дефицит, большинство экспертов сходятся во мнении, что здоровый диапазон ТТ составляет 300–1050 нг / дл при рассмотрении заместительной терапии тестостероном. 7,8 Данные показывают, что уровни <440 нг / дл связаны с повышенным 10-летним сердечно-сосудистым риском у мужчин среднего и пожилого возраста. 8a Существует общее мнение, что свободный Т или биодоступный Т (свободный Т плюс связанный с альбумином Т) обеспечит лучшую оценку статуса Т; тем не менее, существует озабоченность по поводу надежности этих анализов и общего отсутствия исследований с использованием этих показателей. Имеются данные об отличной корреляции между уровнями тестостерона в слюне и уровнями свободного тестостерона, полученными одновременно. 9 Это может оказаться надежной альтернативой тестированию сыворотки; однако некоторые из тех же проблем, о которых упоминалось ранее, остаются.Для подтверждения диагноза TD следует повторить однократный низкий уровень тестостерона AM.
Большая часть наших текущих данных о нормальных изменениях уровня тестостерона у взрослых, связанных со старением, взяты из Массачусетского исследования старения мужчин (MMAS). В этом исследовании участвовали мужчины более 3 десятилетий. В начале исследования в 1987 г. насчитывалось 1667 участников, а к концу исследования в 2004 г. оставалось 584 участника. Продольные данные выявили в среднем снижение уровня TT на 1-2% в год с более быстрым снижением свободного T из-за увеличения SHBG с возрастом, как обсуждалось ранее. 5,10 Интересно, что скорость снижения варьировалась: уровни TT у некоторых субъектов не снижались с течением времени, а у некоторых участников с возрастом наблюдалось повышение. Средний уровень ТТ в 45 лет составлял приблизительно 540 нг / дл, а к 70 годам он упал приблизительно до 440 нг / дл. 5 По оценкам, распространенность TD составляет около 6–12% среди населения первичной медико-санитарной помощи. 11 Еще одной интересной тенденцией MMAS было независимое от возраста снижение уровня тестостерона за последние 3 десятилетия.Анализ показывает снижение TT на 1% в год. 5 Другими словами, среднее значение TT 60-летнего мужчины в 1988 г. составляло 500 нг / дл по сравнению с примерно 440 нг / дл в 2003 г. Это, по-видимому, согласуется с другими наблюдениями снижения количества сперматозоидов на популяционном уровне. подсчитывает и другие репродуктивные расстройства у мужчин. 12,13
Рак и нарушения обмена веществ, связанные с уровнем тестостерона у обоих полов, но с различиями
Генетически более высокий уровень тестостерона увеличивает риск метаболических заболеваний, таких как диабет 2 типа (СД2), у женщин, но снижает риск у мужчин, согласно результатам исследований ученых Кембриджского и Эксетерского университетов.Результаты крупнейшего на сегодняшний день исследования генетической регуляции уровней половых гормонов также показали, что более высокий уровень тестостерона увеличивает риск рака груди и эндометрия у женщин и рака простаты у мужчин. Коллективные данные показали, что, хотя существует сильный генетический компонент в уровнях циркулирующего тестостерона у мужчин и женщин, задействованные генетические факторы сильно различались между полами.
«Наши результаты дают уникальное представление о влиянии тестостерона на болезнь», – прокомментировала Кэтрин Рут, доктор философии из Университета Эксетера.«В частности, они подчеркивают важность рассмотрения мужчин и женщин отдельно в исследованиях, поскольку мы видели противоположные эффекты тестостерона на диабет». Перри является со-ведущим автором статьи, опубликованной командой в Nature Medicine , которая озаглавлена «Использование генетики человека для понимания влияния тестостерона на болезнь у мужчин и женщин».
Роль тестостерона в заболевании в значительной степени неизвестна, несмотря на сильную эпидемиологическую связь со многими состояниями здоровья и широкое использование добавок тестостерона, пишут авторы.«Предыдущие исследования показали защитные ассоциации с тестостероном при диабете 2 типа (T2D) и связанных с ним метаболических особенностях у мужчин, но вредные ассоциации у женщин». Несмотря на такие указатели, выявить истинную связь между тестостероном и болезнью сложно из-за «путаницы из-за существенного влияния старения и ожирения на концентрацию циркулирующего тестостерона». Более 3% мужчин в США в возрасте 30 лет получали тестостерон в 2013 году, до того как FDA сообщило, что могут быть проблемы с потенциальным сердечно-сосудистым риском, связанные с использованием тестостерона.
Рандомизированные контролируемые испытания продемонстрировали преимущества терапии тестостероном на сексуальную функцию, мышечную массу, мышечную силу и минеральную плотность костей, а также на снижение содержания жира во всем теле и внутрибрюшного жира. Эти эффекты на композицию тела должны предсказывать сопутствующие преимущества при СД2 и кардиометаболических заболеваниях. В отличие от этого, как отметили исследователи, тестостерон, как известно, способствует росту и метастазированию рака простаты, в то время как обсервационные исследования показали, что заместительная терапия тестостероном также может повысить предрасположенность к раку простаты в будущем.«Однако даже в крупнейших испытаниях тестостерона слишком мало случаев СД2, сердечно-сосудистых заболеваний или рака простаты, чтобы предоставить информативные данные об этих рисках», – отметили они. «… Точно так же у женщин экспериментальных доказательств применения тестостерона недостаточно для подтверждения очевидных метаболически вредных связей в обсервационных исследованиях между тестостероном и повышенным ожирением, риском синдрома поликистозных яичников (СПКЯ) и риском других сердечно-сосудистых заболеваний».
Один из подходов к пониманию причинных эффектов предполагаемых факторов риска, таких как уровни тестостерона, на болезнь, – это исследование генетических вариаций, влияющих на их регуляцию, в контексте результатов для здоровья.Для представленного исследования команда использовала данные полногеномных ассоциативных исследований (GWAS) с участием 425 097 участников британского биобанка, чтобы идентифицировать 2571 генетическую вариацию, связанную с различиями в уровнях полового гормона тестостерона и его связывающего белка глобулина, связывающего половые гормоны (SHGB). «После тщательного контроля качества сывороточные уровни SHBG, общего тестостерона и эстрадиола были доступны у 425 097 человек с генетическими данными в британском биобанке… Всего мы идентифицировали 2 571 общегеномную пару значимых признаков-сигналов.”
Исследователи подтвердили свой генетический анализ в дополнительных исследованиях, включая исследование EPIC-Norfolk и Twins UK, и обнаружили высокий уровень согласия с их результатами в британском биобанке. Затем команда применила подход под названием Менделирующая рандомизация (MR), который использует естественные генетические вариации, чтобы помочь понять, являются ли известные связи между уровнем тестостерона и заболеванием причинными, а не корреляционными. «Учитывая отсутствие совпадений между мужчинами и женщинами в вариантах, связанных с половыми гормонами, и возможные различные метаболические эффекты этих гормонов у разных полов, мы сосредоточили анализ на результатах заболеваний, специфичных для пола», – отметила команда.
Результаты их анализа показали, что более высокий уровень тестостерона снижает риск СД2 у мужчин на 14%. «У мужчин мы обнаружили доказательства благотворного влияния более высокого уровня тестостерона на метаболические особенности», – писали они. Напротив, команда обнаружила, что у женщин генетически более высокий уровень тестостерона увеличивает риск диабета 2 типа на 37%, а риск синдрома поликистозных яичников (СПКЯ) увеличивается на 51%. «Несмотря на доказательства положительного влияния общего тестостерона на безжировую массу тела как у женщин, так и у мужчин, тестостерон был связан с рядом неблагоприятных метаболических исходов у женщин», – заявили исследователи.«Мы нашли убедительные доказательства, подтверждающие причинный эффект тестостерона на высокий риск СПКЯ у женщин… МРТ анализы также показали причинный эффект биодоступного тестостерона на более высокий риск СД2 и более высокий уровень инсулина натощак у женщин…».
Кроме того, они обнаружили, что генетически более высокий уровень тестостерона увеличивает риск рака груди и эндометрия у женщин и рака простаты у мужчин. «МРТ-анализы показали, что тестостерон увеличивает риск рака простаты у мужчин… Мы обнаружили доказательства того, что тестостерон увеличивает риск развития эстроген-положительного, но не ER-отрицательного рака груди… Были также доказательства защитного эффекта SHBG в отношении риска рак эндометрия у женщин, который был постоянным на всех моделях, но повышающий риск эффект SHBG на ER [рецептор эстрогена] -отрицательный рак молочной железы.”
Старший автор совместного исследования Джон Перри, доктор философии, из отдела эпидемиологии MRC Кембриджского университета, далее прокомментировал: «Наши выводы о том, что генетически более высокий уровень тестостерона увеличивает риск СПКЯ у женщин, важны для понимания роли тестостерона в его происхождении. этого общего расстройства, а не просто следствие этого состояния. Аналогичным образом, у мужчин для лечения рака простаты широко используются препараты, снижающие уровень тестостерона, но до сих пор было неясно, защищает ли более низкий уровень тестостерона от развития рака простаты.Наши результаты показывают, насколько полезны генетические методы, такие как менделевская рандомизация, для понимания рисков и преимуществ гормональной терапии ».
Исследователи говорят, что их результаты подчеркивают важность анализа с учетом пола, как для обнаружения генетических вариантов черт половых гормонов, так и для анализа последующих эффектов. «В заключение, наши результаты дают уникальное представление о влиянии тестостерона на болезнь и подчеркивают важность анализа риска заболевания с учетом пола», – написали они.
Исследователи также отметили, что аналогичные крупномасштабные данные о сердечно-сосудистых заболеваниях с разбивкой по полу еще не доступны, но будут «критически важны» для понимания более широкого кардиометаболического влияния тестостерона. «Следовательно, хотя результаты, касающиеся неблагоприятных метаболических эффектов тестостерона у женщин, могут использоваться в клинической практике, преждевременно делать выводы о более широких полезных метаболических эффектах у мужчин», – заявили они. «Необходимо с осторожностью использовать наши результаты для оправдания использования добавок тестостерона, пока мы не сможем провести аналогичные исследования тестостерона с другими заболеваниями, особенно с сердечно-сосудистыми заболеваниями», – признала Рут.
Тестостерон, всего, ЖХ / МС-МС »Патологические лаборатории» Медицинский колледж »Университет Флориды
Дополнительная информация:
UFHPL Epic, код заказа: LAB2044
Тестостерон – основной андроген у мужчин. 2,3 Производство тестостерона мужскими яичками стимулируется лютеинизирующим гормоном (ЛГ), который вырабатывается гипофизом. Секреция ЛГ, в свою очередь, подавляется посредством отрицательной обратной связи повышенными концентрациями тестостерона и его метаболитов.Большая часть тестостерона у мужчин вырабатывается клетками Лейдига семенников и секретируется в семенные канальцы, где он образует комплекс с белком, вырабатываемым клетками Сертоли. Это приводит к высоким локальным уровням тестостерона, которые необходимы для нормального производства спермы.
Снижение выработки тестостерона – одна из многих потенциальных причин бесплодия у мужчин. 3,4 Низкие концентрации тестостерона могут быть вызваны недостаточностью яичек (первичный гипогонадизм) или неадекватной стимуляцией гонадотропинами гипофиза (вторичный гипогонадизм).Несколько врожденных состояний (например, синдром Клайнфельтера, синдром Каллмана, синдром Прадера-Вилли) могут привести к снижению выработки тестостерона. Уровень тестостерона также может снижаться в результате повреждения яичек, вызванного алкоголизмом, физическими травмами, вирусными заболеваниями (например, паротитом) и при некоторых злокачественных новообразованиях.
Референсный диапазон тестостерона для взрослых мужчин был установлен Бхасином и его коллегами в выборке здоровых молодых мужчин на уровне общины из Фрамингемского исследования сердца, поколение 3,5 Референсная группа включала только мужчин моложе 40 лет, у которых отсутствие в анамнезе сердечно-сосудистых заболеваний, диабета, ожирения, гипертонии, рака или гиперхолестеринемии. 5 Это исследование показало, что мужчины всех возрастов, у которых уровень тестостерона <348 нг / дл, чаще страдали от симптомов, связанных с дефицитом андрогенов, чем мужчины с более высоким уровнем тестостерона в сыворотке крови. 5
С возрастом у мужчин происходят значительные физиологические изменения, отчасти из-за постепенного снижения уровня тестостерона. 6,7 Принято считать, что основной причиной возрастного снижения выработки тестостерона является недостаточность яичек, хотя снижение выработки гонадотропина может играть определенную роль. 8 К 75 годам средний уровень тестостерона у мужчин падает до 65% от среднего уровня у молодых людей. «Андропауза» – это термин, который использовался для обозначения совокупности симптомов, связанных с возрастным снижением выработки тестостерона у мужчин. 8,9 Поскольку мужчины с гипогонадизмом часто имеют высокие уровни SHBG, рекомендуется измерение свободного (или биодоступного) тестостерона, когда общий уровень тестостерона в норме у мужчин с симптомами дефицита андрогенов. 4
У женщин вырабатывается гораздо меньшее количество тестостерона и дигидротестостерона, чем у мужчин. 3,4 Более слабые андрогены надпочечников и молекулы предшественников яичников, в том числе андростендион, ДГЭА и сульфат ДГЭА, могут иметь значительные андрогенные эффекты у женщин. Яичники и надпочечники вырабатывают некоторое количество тестостерона, но большая часть тестостерона у женщин образуется в результате периферического преобразования других стероидов. Часто первым признаком избытка тестостерона у женщин является рост волос по мужскому типу, который называется гирсутизмом. 3,10,11 Следует отметить, что у некоторых женщин рост волос подобен тому, который вызван повышенным уровнем тестостерона из-за расовых или генетических причин, а не из-за чрезмерного количества андрогенов. Измерение тестостерона может помочь отличить расовые или генетические причины гирсутизма от аномальной патологии, особенно у женщин со смешанным этническим происхождением. Женщины с повышенным уровнем тестостерона также могут испытывать вирилизацию с такими симптомами, как увеличение мышечной массы, перераспределение жировых отложений, увеличение клитора, огрубение голоса, прыщи и повышенное потоотделение.Эти женщины также могут страдать от андрогенной алопеции, женского эквивалента облысения по мужскому типу.
У многих женщин с медленно прогрессирующими андрогенными симптомами диагностируется синдром поликистозных яичников (СПКЯ). 11 – 14 СПКЯ является относительно распространенным заболеванием, которым страдают примерно шесть процентов женщин репродуктивного возраста. 2 Женщины с этим комплексным синдромом испытывают симптомы избытка андрогенов, связанные с нарушениями менструального цикла и бесплодием. Хроническая ановуляция у пациентов с СПКЯ увеличивает риск развития рака эндометрия.Женщины с СПКЯ часто имеют избыточный вес и склонны к инсулинорезистентности, что подвергает их повышенному риску развития сахарного диабета 2 типа. 2,12 Ожирение и инсулинорезистентность могут привести к черному акантозу, состоянию кожи, которое характеризуется гиперпигментированными бархатистыми бляшками на складках тела. 2 Нарушения липидов, включая пониженный уровень холестерина липопротеинов высокой плотности и повышенный уровень триглицеридов, а также нарушение фибринолиза, наблюдаются у женщин с СПКЯ.12,14 Сердечно-сосудистые заболевания более распространены, и женщины с СПКЯ имеют значительно повышенный риск инфаркта миокарда. 12,14
Сноски
- Rosner W, Auchus RJ, Azziz R, et al, «Полезность, ограничения и подводные камни при измерении тестостерона: заявление эндокринного общества», J Clin Endocrinol Metab , 2007, 92 (2): 405-13. PubMed 170
- Исмаил А.А., Астли П., Берр В.А. и др., «Роль измерения тестостерона в исследовании андрогенных заболеваний», Ann Clin Biochem , 1986, 23 (Pt 2): 113-34.PubMed 3532913
- Гроновски AM, Ландау-Левин М., «Репродуктивная эндокринная функция», Учебник клинической химии Титца , 3-е изд., Burtis CA, Ashwood ER, eds, Philadelphia, PA: WB Saunders Co, 1999, 1601-41.
- Петак С.М., Баскин Х.Дж., Бергман Д.А. и др., «Рекомендации AACE по клинической практике для оценки и лечения гипогонадизма у взрослых пациентов мужского пола», Endocrinol Pract , 1996, 2: 440-53.
- Бхасин С., Пенцина М., Джасуджа Г.К. и др. «Референсные диапазоны для тестостерона у мужчин, полученные с помощью тандемной масс-спектрометрии с жидкостной хроматографией, в выборке здоровых молодых людей без ожирения на базе сообщества в исследовании сердца Фрамингема и примененные к трем географически различающимся когортам , “ J Clin Endocrinol Metab , 2011, 96 (8): 2430-9.PubMed 21697255
- Leifke E, Gorenoi V, Wichers C и др., «Возрастные изменения сывороточных половых гормонов, инсулиноподобного фактора роста-1 и уровней глобулина, связывающего половые гормоны, у мужчин: перекрестные данные из когорты здоровых мужчин», ” Clin Endocrinol , 2000, 53 (6): 689-95.PubMed 11155090
- Basaria S, Dobs AS, «Гипогонадизм и заместительная терапия андрогенами у пожилых мужчин», Am J Med , 2001, 110 (7): 563-72.PubMed 11343670
- Bain J, «Андропауза.Заместительная терапия тестостероном для стареющих мужчин », Can Fam Physician , 2001, 47: 91-7.PubMed 11212438
- Bhasin S, Bagatell CJ, Bremner WJ и др., «Проблемы замены тестостерона у пожилых мужчин», J Clin Endocrinol Metab , 1998, 83: 3435-48.PubMed 9768643
- Эрманн Д.А., Барнс Р.Б., Розенфилд Р.Л., «Гиперандрогенизм, гирсутизм и синдром поликистозных яичников», Эндокринология , 4-е изд., ДеГрут Л.Дж., Джеймсон Дж. Л., ред., Филадельфия, Пенсильвания: WB Saunders Co, 2001, 2122-37.
- Барт Дж. Х., «Исследования по оценке и ведению пациентов с гирсутизмом», Curr Opin Obstet Gynecol , 1997, 9 (3): 187-92.PubMed 03
- Хантер М. Х., Стерретт Дж. Дж., «Синдром поликистозных яичников: это не просто бесплодие», Am Fam Physician , 2000, 62 (5): 1079-88, 1090.PubMed 10997532
- Лобо Р.А., Кармина Э., «Важность диагностики синдрома поликистозных яичников», Ann Intern Med , 2000, 132 (12): 989-93.PubMed 10858183
- Чанг В.Й., Кнохенхауэр ES, Бартолуччи А.А. и др., «Фенотипический спектр синдрома поликистозных яичников: клиническая и биохимическая характеристика трех основных клинических подгрупп», Fetil Steril , 2005, 83: 1717-23.PubMed 15950641
Использование:
Этот тест обеспечивает чувствительность и специфичность, необходимые для оценки низкого уровня тестостерона у женщин, детей, подростков и мужчин с гипогонадизмом. 1
Ограничения
Наркотики, включая андрогены и стероиды, могут снижать уровень тестостерона. Мужчины с запущенным раком простаты часто получают лекарства, снижающие уровень тестостерона. У женщин, получающих эстроген, может быть повышенный уровень тестостерона.Противосудорожные препараты, барбитураты и кломифен могут вызывать повышение уровня тестостерона.
.

 4)
4) 4 (40,6)
4 (40,6) Методы).Total T: общий тестостерон; A4: андростендион; E2: эстрадиол; E1: эстрон; свободный T: рассчитанный свободный тестостерон; SHBG: глобулин, связывающий половые гормоны; ЛГ: лютеинизирующий гормон; ФСГ: фолликулостимулирующий гормон; DHEAS: сульфат дегидроэпиандростерона; АМГ: антимюллеров гормон; ИМТ: индекс массы тела; HOMA-IR: оценка модели гомеостаза инсулинорезистентности; PCOM: морфология поликистозных яичников.
Методы).Total T: общий тестостерон; A4: андростендион; E2: эстрадиол; E1: эстрон; свободный T: рассчитанный свободный тестостерон; SHBG: глобулин, связывающий половые гормоны; ЛГ: лютеинизирующий гормон; ФСГ: фолликулостимулирующий гормон; DHEAS: сульфат дегидроэпиандростерона; АМГ: антимюллеров гормон; ИМТ: индекс массы тела; HOMA-IR: оценка модели гомеостаза инсулинорезистентности; PCOM: морфология поликистозных яичников. 60
60  16, −1,61)
16, −1,61)  08
08 01)
01) 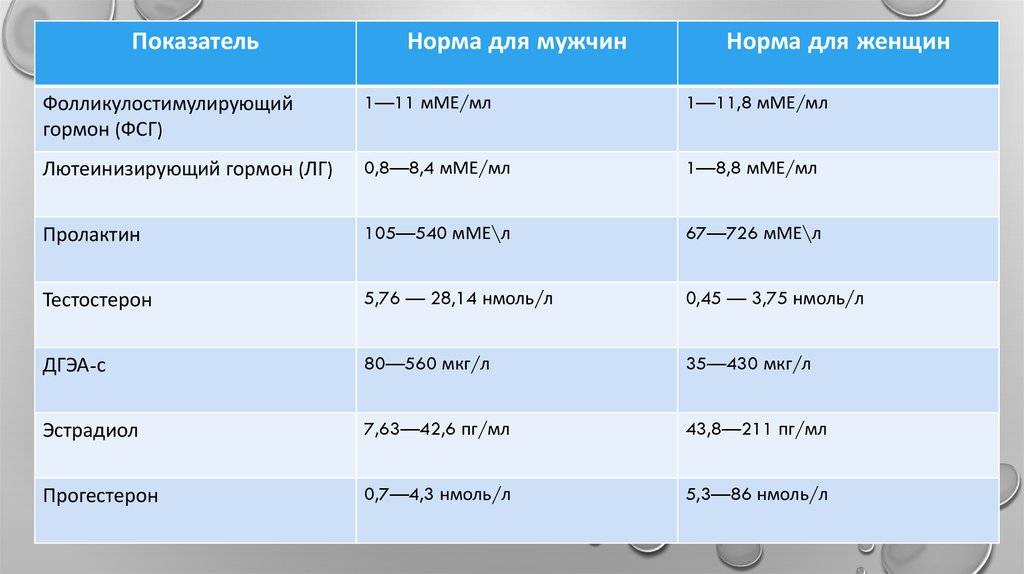 15
15 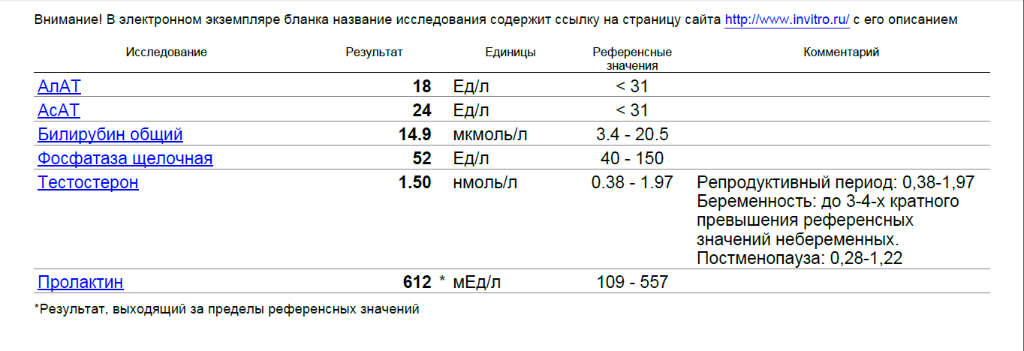 3 (14,7)
3 (14,7)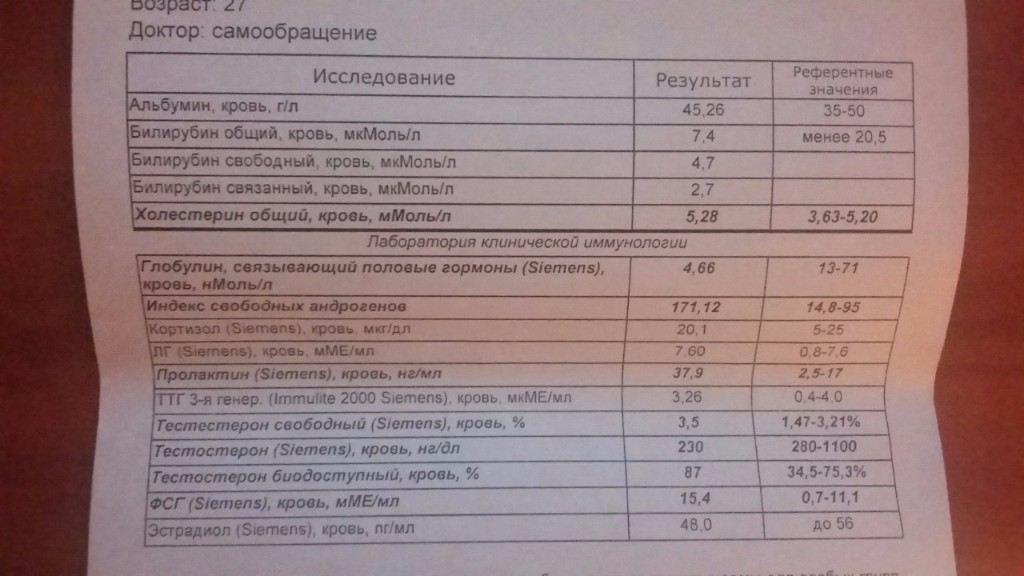 8 (8,0)
8 (8,0) 007
007