Лечение межреберной невралгии – лечение в Медлайн в Кемерово
Межреберная невралгия — сдавливание межреберных нервов, характеризующееся постоянной или приступообразной колющей болью в грудной клетке в области ребер, которая усиливается при движении, кашле, чихании, физической нагрузке, глубоком дыхании.
К возможным причинам невралгии относятся травмы грудной клетки, переохлаждения и простуда, заболевания позвоночника, остеохондроз, возрастные изменения в сосудах. Чаще всего невралгия встречается у старшего поколения.
Межреберная невралгия, лечение которой не проводится, способна прогрессировать и сопровождаться невыносимыми непрерывными болями, затрудняющими движение и полноценный образ жизни. Поэтому при первых признаках невралгии как можно раньше обращайтесь за помощью к специалисту.
Лечение межреберной невралгии
Лечение межреберной невралгии в медицинском центре “Медлайн” Кемерово осуществляется высококвалифицированным неврологом, который, исходя из индивидуальных особенностей течения и степени сложности заболевания, предложит курс терапии. Использование современных медикаментов для обезболивания и снятия напряжения, витамины группы.
Использование современных медикаментов для обезболивания и снятия напряжения, витамины группы.
Лечение межреберной невралгии достаточно длительно, но при комплексном подходе и следовании советам специалиста заболевание не даст о себе знать в дальнейшем. При запущенных состояниях прибегают к хирургическому вмешательству. Однако в большинстве случаев щадящий курс лечения очень эффективен.
Межреберная невралгия, дав о себе знать однажды, неизбежно будет рецидивировать. Поэтому помощь квалифицированного специалиста здесь просто необходима, чтобы жить полноценной жизнью здорового человека.
Профилактика межреберной невралгии
- Старайтесь не переохлаждаться.
- Укрепляйте иммунитет, предупреждайте простудные заболевания.
- Регулярно делайте легкую гимнастику, будьте физически активны.
- Своевременно проводите лечение сосудов, внутренних органов, заболеваний опорно-двигательного аппарата и инфекций.

- Лучше, конечно, заболевание предотвратить, чем потом долго лечить, но если, все же, начала беспокоить межреберная невралгия, обращайтесь к неврологу незамедлительно. Благодаря своевременной и комплексной терапии будут восстановлены нарушенные функции проблемной области, улучшится работа сосудов и тканевый обмен.
Если вам нужен грамотный, опытный и высококвалифицированный невролог — приходите в медицинский центр «Медлайн” Кемерово. Запишитесь на приём к неврологу в Кемерово прямо сейчас на сайте онлайн или по телефону 8 (3842) 49-20-70!
Межреберная невралгия симптомы и лечение – невралгия нерва
Невралгия – это очень распространенное заболевание, которое характеризуется приступами боли в виде так называемых «прострелов». Боль может быть нестерпимой или тупой, жгучей или ноющей. Она может быть локализована на любом участке тела, на котором проходит какой-либо нерв – седалищный, тройничный и т.д. Очень распространено такое заболевание, как межреберная невралгия.
Время начала приступа боли непредсказуемо. Обычные обезболивающие могут не помогать пациентам с невралгией, что может спровоцировать вынужденную утрату трудоспособности пациента.
Факторы, способствующие появлению межреберной невралгии и других ее разновидностей
Без выявления причин, повлекших за собой развитие данного заболевания, невозможно назначить эффективное лечение невралгии. Врачи-неврологи выделяют ряд причин, по которым оно появляется:
- интоксикация организма ядами, алкоголем, фармпрепаратами, солями тяжелых металлов и т.д.;
- различные травмы;
- инфекции, затрагивающие волокна нервных стволов;
- воспаления;
- сильное переохлаждение;
- длительное пребывание в стрессовом состоянии, работа «на износ».
В некоторых случаях невралгия может быть одним из осложнений какой-либо патологии сердечно-сосудистой или нервной системы, а также нарушения обменных процессов в организме.Для лечения такой разновидности невралгии необходимо устранить ее первопричину и все внимание уделить лечению основного заболевания.
Разновидности и симптомы невралгии
То, как проявляется невралгия нерва, зависит прежде всего от локализации того нерва, который поражен болезнью. Если это тройничный нерв, то симптом невралгии – сильная боль в области лица, если межреберный – то боль будет ощущаться в груди. Выделяют три разновидности невралгии:
- межреберная невралгия – проявляется приступообразной или непроходящей опоясывающей болью. Боль усиливается в момент физической нагрузки, а также при кашле, чихании или вскрике;
- невралгия тройничного нерва, о которой свидетельствует острая приступообразная боль, локализованная согласно прохождения этого нерва – обычно, на лице. Чаще всего встречается у представительниц прекрасного пола старше 50 лет, однако неврологи отмечают, что эта разновидность невралгии стремительно «молодеет»;
- вертеброгенная, вызывающая оглушающую боль по ходу корешка спинномозгового нерва.
 Чаще всего бывает спровоцирована длительным пребыванием на холоде, травмой или таким заболеванием, как остеохондроз.
Чаще всего бывает спровоцирована длительным пребыванием на холоде, травмой или таким заболеванием, как остеохондроз.
Диагностика и лечение невралгии в «ОН КЛИНИК в Рязани»
Выявление и лечение невралгии находится в сфере компетенции специалистов отделения неврологии. Работающие в нашем медицинском центре неврологи быстро диагностируют данное заболевание и назначают эффективную схему его лечения.
Вначале доктор собирает анамнез заболевания в ходе очной консультации. Отталкиваясь от объективных показателей и жалоб больного, он может направить последнего на обследование, включающее в себя инструментальные методы диагностики и сдаваемые в лабораторию анализы. В нашем медицинском центре – одна из лучших в городе лабораторий, которая оснащена по последнему слову медицинской техники.
После того, как поставлен диагноз «Невралгия», назначается комплексное лечение. Фармпрепараты врач назначает в зависимости от того, что спровоцировало возникновение заболевания, а также от его симптоматики. Среди лекарств могут быть анальгетики и противовоспалительные средства, препараты для улучшения функции нервных волокон, которые вводятся внутривенно и внутримышечно, а также витамины группы В. Такой курс лечения в сопровождении массажа или физиотерапии быстро избавляет пациента от всех симптомов невралгии.
Среди лекарств могут быть анальгетики и противовоспалительные средства, препараты для улучшения функции нервных волокон, которые вводятся внутривенно и внутримышечно, а также витамины группы В. Такой курс лечения в сопровождении массажа или физиотерапии быстро избавляет пациента от всех симптомов невралгии.
Специалисты нашего отделения неврологии рекомендуют следующие меры профилактики невралгии:
- заниматься спортом на регулярной основе, но без фанатизма – избегать чрезмерных физических нагрузок;
- придерживаться здорового образа жизни и правильного питания;
- избегать сквозняков и переохлаждения в целом;
- не «вариться» в стрессе, уделять достаточное внимание душевному спокойствию.
Если имеются заболевания, которые могут привести к развитию невралгии, то следует заблаговременно пролечить их. Например, следует избавиться от всех вялотекущих инфекций и воспалительных процессов в организме.
Интересует цена лечения невралгии в «ОН КЛИНИК в Рязани»? Позвоните нам и запишитесь на прием!
Лечение невралгии – лицевого нерва, тройничного нерва, межреберной невралгии – причины, симптомы, диагностика, профилактика – +7 (495) 120-02-05
Невралгические заболевания встречаются почти у каждого 200-го человека. Это, преимущественно, женщины от 40 лет. Однако заболевание может встречаться и у людей более раннего возраста. Вы уверены, что не входите в группу риска? Тогда это статья для вас и тех, кто уже знает, насколько невралгия мешает жить!
Невралгия — «боль в нерве» (греч.) — это заболевание, которое вызвано поражением отрезков периферических нервов, но эти поражения не носят структурный характер. Наиболее выраженным симптомом является сильная боль в зоне поражения нерва. Как правило, это место, где нервы расположены в узких отверстиях и каналах.
Поскольку межреберная невралгия — наиболее часто встречающаяся форма заболевания, остановимся на ней подробнее.
Симптомы
- острая или давящая боль в области ребер, которая может усиливаться при кашле, чихании или резких движениях
- боль в области сердца, поясницы, под лопаткой
- онемение кожи в зоне поражения нерва
- подергивание мышц
- побледнение или, наоборот, покраснение кожи
- чрезмерное потоотделение.
Невралгия или боль в сердце?
Межреберную невралгию часто путают с сердечной болью. Если в случае с межреберной невралгией боль становится сильнее при вдохе или выдохе, а также движении туловища, то при стенокардии боль в сердце не изменяется. Она может сопровождаться ростом или падением давления. При межреберной невралгии человеку бывает даже сложно вздохнуть и, как правило, он ощущает эту боль локально, только на одной стороне грудной клетки.
При межреберной невралгии болевые ощущения могут быть как постоянными, так и носить периодический характер в течение 3-6 недель.
Лечение межреберной невралгии
- Антивирусные препараты,
- мази с содержанием антибиотиков,
- анальгетики в сочетании с антигистаминными препаратами,
- в случае острой необходимости, антидепрессанты или даже транквилизаторы.

На основании ваших жалоб врач-невролог диагностирует заболевание. Для того чтобы выявить невралгию, может понадобиться проведение дополнительных исследований в целях исключения других заболеваний. К таким исследованиям относятся: общие анализы, МРТ и компьютерная томография.
Лечить невралгию самостоятельно ни в коем случае нельзя! Только врач может назначить вам соответствующее лечение, которое может включать:
- обезболивающие и противовоспалительные препараты
- витаминные инъекции (группа В)
- иглоукалывание.
- физиотерапию
- противосудорожные препараты (в случае поражения тройничного нерва).
Отлично зарекомендовали себя такие методы лечения невралгии, как гомеопатия, психотерапия, массаж. Хирургическое вмешательство используется в крайне редких случаях.
Если вам поставили диагноз «невралгия», вам необходимо соблюдать режим покоя в период лечения. Нужно также исключить интенсивное освещение в комнате, где вы проживаете, иначе это может уcилить болевой синдром.
Если вы не хотите допустить развитие этого крайне неприятного заболевания, позаботьтесь о своевременной профилактике.
- Не переохлаждайтесь и избегайте сквозняков.
- Обеспечьте себе регулярные физические нагрузки.
- Питайтесь правильно и сбалансированно.
- Принимайте витамины группы В.
- Если у вас имеются хронические и инфекционные заболевания, займитесь их лечением.
- Откажитесь от вредных привычек и придерживайтесь здорового образа жизни.
исследований, изучающих роль повреждения межреберных нервов в хронической боли после торакальной хирургии | Европейский журнал кардио-торакальной хирургии
1 Введение
Сообщения в литературе показывают, что распространенность хронической боли после торакальной хирургии составляет 9–80% для торакотомии и 5–33% для торакоскопической хирургии с видеосвязью [1–14]. На распространенность может влиять ряд факторов. На восприятие пациентами послеоперационной боли может влиять стиль объяснения операции и пребывание в стационаре, которое готовит пациента к операции.На это могут повлиять различия в интраоперационной технике, методе анестезии, методе послеоперационной анальгезии и опыте оперирующего хирурга. Особое значение имеет то, как авторы определили хроническую боль, как долго после операции она была оценена, и как данные были собраны, проанализированы и представлены. В некоторых исследованиях также сообщалось о влиянии боли на жизнь пациентов и о том, как она ограничивает их повседневную активность [1–3]. Хроническая боль после торакальной операции, несомненно, является серьезной проблемой, требующей дальнейшего изучения.
На восприятие пациентами послеоперационной боли может влиять стиль объяснения операции и пребывание в стационаре, которое готовит пациента к операции.На это могут повлиять различия в интраоперационной технике, методе анестезии, методе послеоперационной анальгезии и опыте оперирующего хирурга. Особое значение имеет то, как авторы определили хроническую боль, как долго после операции она была оценена, и как данные были собраны, проанализированы и представлены. В некоторых исследованиях также сообщалось о влиянии боли на жизнь пациентов и о том, как она ограничивает их повседневную активность [1–3]. Хроническая боль после торакальной операции, несомненно, является серьезной проблемой, требующей дальнейшего изучения.
Причина хронической боли не установлена. Исследование показало, что высокий уровень немедленной послеоперационной боли связан с увеличением вероятности хронической боли, что позволяет предположить, что это процесс, который начинается примерно во время операции, а не вторичен по отношению к заживлению тканей [4].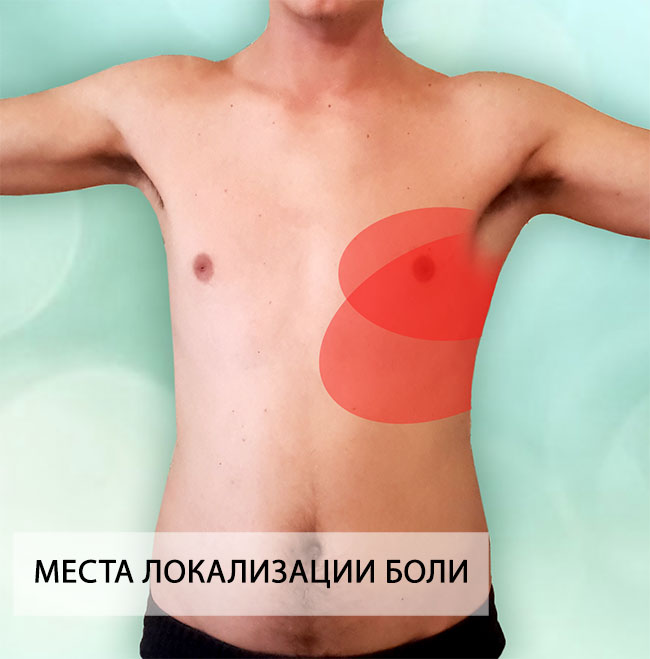 Роджерс описывает множество возможных причин боли после торакальной операции [15]. Имеются данные, позволяющие предположить, что хроническая боль возникает в результате повреждения нерва во время операции: исследования показали повреждение межреберных нервов, демонстрируя потерю межреберной проводимости во время операции, а потеря абдоминальных рефлексов после торакальной операции связана с болью [16,17]. .На сильный нейропатический компонент также указывает хроническая боль, которая часто сопровождается ненормальными кожными ощущениями и часто лечится антидепрессантами и антипсихотиками, а не опиатами.
Роджерс описывает множество возможных причин боли после торакальной операции [15]. Имеются данные, позволяющие предположить, что хроническая боль возникает в результате повреждения нерва во время операции: исследования показали повреждение межреберных нервов, демонстрируя потерю межреберной проводимости во время операции, а потеря абдоминальных рефлексов после торакальной операции связана с болью [16,17]. .На сильный нейропатический компонент также указывает хроническая боль, которая часто сопровождается ненормальными кожными ощущениями и часто лечится антидепрессантами и антипсихотиками, а не опиатами.
Наша цель состояла в том, чтобы исследовать распространенность повреждения нерва во время торакальной хирургии и его связь с хронической болью. Мы также исследовали интраоперационные факторы, которые могут повлиять на повреждение нервов и хроническую боль.
2 Метод и материалы
Исследование проводилось в отделении торакальной хирургии городской больницы Ноттингема и длилось с декабря 2004 г. по сентябрь 2005 г.До начала исследования было получено одобрение местного этического комитета.
по сентябрь 2005 г.До начала исследования было получено одобрение местного этического комитета.
2.1 Отбор и набор пациентов
Пациенты были отобраны из плановых операционных списков для плановой торакотомии или тораколапаротомии. Из одного операционного списка был изучен только один подходящий пациент. Составление списка производилось независимо от этого исследования. Для исследования был выбран соответствующий критериям пациент, который был первым в операционном списке. Дети (до 18 лет) в исследовании не участвовали.Пациенты были исключены, если у них была предыдущая травма грудной стенки, такая как множественные переломы ребер или предыдущая операция на грудной стенке, включающая торакотомию или VATS (грудная хирургия с использованием видео) из-за возможности существующего повреждения межреберного нерва. Пациенты также были исключены, если у них было известное неврологическое заболевание с периферическими проявлениями, включая невропатию, связанную с диабетом, потому что их заболевание могло затруднить интерпретацию измерений нервной функции. Существовал потенциальный риск того, что оборудование, используемое для стимуляции межреберных нервов, могло повлиять на медицинские устройства с батарейным питанием, и поэтому пациенты с кардиостимулятором, дефибриллятором сердца или кохлеарными имплантатами были исключены.
Существовал потенциальный риск того, что оборудование, используемое для стимуляции межреберных нервов, могло повлиять на медицинские устройства с батарейным питанием, и поэтому пациенты с кардиостимулятором, дефибриллятором сердца или кохлеарными имплантатами были исключены.
Отказ от согласия исключил пациента из исследования. Пациенты были приглашены для участия в исследовании в клинике предварительного обследования или при поступлении в палату. Исследование было объяснено устно и предоставлен информационный лист. Письменное информированное согласие получалось всегда.
2.2 Предоперационная оценка
Перед операцией пациенты заполняли анкету по боли: Краткую анкету МакГилла о боли (SF-MPQ), которая состоит из трех шкал боли: словесные дескрипторы со шкалой интенсивности (оценка боли 1, максимум 45), визуальная аналоговая шкала (боль оценка 2, результаты представлены в виде пропорции) и общая оценка интенсивности (оценка боли 3, диапазон 0–5) [18]. Также был заполнен опросник по больничной шкале тревожности и депрессии (HADS) с максимальным баллом 42 [19–22]. Мы попытались измерить функцию межреберных нервов у полностью сознательных участников до операции с использованием магнитного стимулятора нервов (магстим). Катушку нервного стимулятора накладывали перпендикулярно коже над проксимальной областью межреберного нерва латеральнее тела позвонка. Два кожных кнопочных электрода помещали на переднюю часть грудной клетки над дистальной частью межреберной мышцы и использовали для регистрации вызванных мышцами потенциалов (МВП).Контрольный кожный электрод размещали на контралатеральном крае грудины. Магстим доставил короткий магнитный импульс, который возбудил межреберный нерв, который, в свою очередь, стимулировал межреберную мышцу, и записал МВП. Пациент чувствовал сокращение мышц, хотя это никогда не доставляло дискомфорта. Для обеспечения точной доставки импульса и измерения МВП использовали нервный стимулятор / записывающее устройство (Neurosign 800, Magstim Company, Whitland, Carmarthenshire).
Также был заполнен опросник по больничной шкале тревожности и депрессии (HADS) с максимальным баллом 42 [19–22]. Мы попытались измерить функцию межреберных нервов у полностью сознательных участников до операции с использованием магнитного стимулятора нервов (магстим). Катушку нервного стимулятора накладывали перпендикулярно коже над проксимальной областью межреберного нерва латеральнее тела позвонка. Два кожных кнопочных электрода помещали на переднюю часть грудной клетки над дистальной частью межреберной мышцы и использовали для регистрации вызванных мышцами потенциалов (МВП).Контрольный кожный электрод размещали на контралатеральном крае грудины. Магстим доставил короткий магнитный импульс, который возбудил межреберный нерв, который, в свою очередь, стимулировал межреберную мышцу, и записал МВП. Пациент чувствовал сокращение мышц, хотя это никогда не доставляло дискомфорта. Для обеспечения точной доставки импульса и измерения МВП использовали нервный стимулятор / записывающее устройство (Neurosign 800, Magstim Company, Whitland, Carmarthenshire).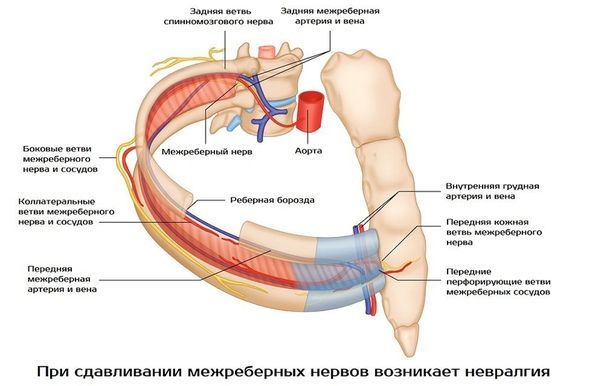
2.3 Интраоперационная оценка
Исследования проводимости межреберных нервов во время операции были выполнены на основе метода, описанного Роджерсом [17]. Под общей анестезией, с обнаженными ребрами и межреберными мышцами, использовался ручной монополярный зонд электрического нервостимулятора для возбуждения межреберного нерва сбоку от мышцы, выпрямляющей позвоночник. Заземляющий электрод помещали в мышцу, выпрямляющую позвоночник. Пара записывающих игольчатых электродов, установленных на расстоянии 1 см друг от друга на прямоугольном ручном зажиме с резиновым покрытием, была вставлена в самую переднюю часть соответствующей межреберной мышцы, и были записаны MEP.Электрод сравнения помещали в переднюю зубчатую мышцу. Стимул увеличивали с 3,5 мА (с шириной импульса 300 мкс) до максимального значения 10 мВ, пока не был достигнут сверхмаксимальный стимул, а затем регистрировали MEP. Задержка между стимулом и МВП была вычислена, а скорость рассчитана путем деления расстояния между стимулирующим зондом и записывающими электродами на время ожидания. Измерение нервной проводимости проводилось в каждом из межреберных промежутков, один и два выше межреберного разреза и один и два пространства ниже разреза.Измерения проводились на четырех этапах операции: (i) перед разрезом межреберного мышечного пространства; (ii) после разреза межреберной мышцы, но до введения реберного ретрактора; (iii) после резекции легкого или пищевода сразу после удаления реберного ретрактора; (iv) после закрытия межреберного промежутка. Хирург не видел результатов измерений МВП, хотя мог видеть, подергивается ли межреберная мышца заметно или нет. Эти измерения увеличили продолжительность операции на 10–20 мин.
Измерение нервной проводимости проводилось в каждом из межреберных промежутков, один и два выше межреберного разреза и один и два пространства ниже разреза.Измерения проводились на четырех этапах операции: (i) перед разрезом межреберного мышечного пространства; (ii) после разреза межреберной мышцы, но до введения реберного ретрактора; (iii) после резекции легкого или пищевода сразу после удаления реберного ретрактора; (iv) после закрытия межреберного промежутка. Хирург не видел результатов измерений МВП, хотя мог видеть, подергивается ли межреберная мышца заметно или нет. Эти измерения увеличили продолжительность операции на 10–20 мин.
Для проведения этих исследований межреберной нервной проводимости метод анестезии должен был быть изменен, чтобы уменьшить вариации факторов, которые могут влиять на нервную проводимость, и предотвратить полную блокаду нервно-мышечного соединения. Контролируют центральную и периферическую температуры, и пациента охлаждают или согревают снаружи, чтобы поддерживать температуру межреберных нервов как можно более стабильной. Для индукции анестезии применяли болюс ремифентанила 1 мкг / кг и пропофол 1,5–2,5 мг / кг.Анестезия поддерживалась десфлуараном (минимальная альвеолярная концентрация 1,0–1,3) и внутривенной инфузией ремифентанила. Релаксация достигалась с помощью атракурия: болюс 0,5 мг / кг с последующей инфузией, которая была отрегулирована так, чтобы поддерживать минимум два зрительных подергивания аддуктора pollicis при стимуляции локтевого нерва по схеме «последовательность четырех» (TOF). Немедленное послеоперационное обезболивание обеспечивалось эпидуральной инфузией местного анестетика и опиата или паравертебральной инфузией местного анестетика с внутривенной инфузией морфина под контролем пациента (PCA), хотя до последнего измерения нервной проводимости местный анестетик не вводился.
Для индукции анестезии применяли болюс ремифентанила 1 мкг / кг и пропофол 1,5–2,5 мг / кг.Анестезия поддерживалась десфлуараном (минимальная альвеолярная концентрация 1,0–1,3) и внутривенной инфузией ремифентанила. Релаксация достигалась с помощью атракурия: болюс 0,5 мг / кг с последующей инфузией, которая была отрегулирована так, чтобы поддерживать минимум два зрительных подергивания аддуктора pollicis при стимуляции локтевого нерва по схеме «последовательность четырех» (TOF). Немедленное послеоперационное обезболивание обеспечивалось эпидуральной инфузией местного анестетика и опиата или паравертебральной инфузией местного анестетика с внутривенной инфузией морфина под контролем пациента (PCA), хотя до последнего измерения нервной проводимости местный анестетик не вводился.
Операции выполнялись одной из трех команд, каждая из которых возглавлялась консультантом (консультанты A, B, C). Для резекций легких все использовали аналогичные заднебоковые разрезы кожи при торакотомии, разделяли широчайшую мышцу спины и подходили через 5-е или 6-е пространство. Консультанты B и C всегда входили в плевральную полость через субпериостальную резекцию ребра и закрывали межреберное пространство непрерывным межреберным швом. Консультант А вошел с помощью диатермии вдоль верхней границы ребра без резекции ребра и ушил тремя узловыми швами, проходившими по верхней границе ребра выше и ниже нижней границы, но выше межреберного пучка, ребра ниже ( «перикостальное» закрытие).Для операций на пищеводе консультант B использовал разрез торакотомии с френотомией, а консультанты A и C использовали разрез тораколапаротомии без резекции ребер. В каждом случае регистрировали максимальное распространение ребер при торакотомии и продолжительность нахождения ретрактора на месте.
Консультанты B и C всегда входили в плевральную полость через субпериостальную резекцию ребра и закрывали межреберное пространство непрерывным межреберным швом. Консультант А вошел с помощью диатермии вдоль верхней границы ребра без резекции ребра и ушил тремя узловыми швами, проходившими по верхней границе ребра выше и ниже нижней границы, но выше межреберного пучка, ребра ниже ( «перикостальное» закрытие).Для операций на пищеводе консультант B использовал разрез торакотомии с френотомией, а консультанты A и C использовали разрез тораколапаротомии без резекции ребер. В каждом случае регистрировали максимальное распространение ребер при торакотомии и продолжительность нахождения ретрактора на месте.
Пациенты были не осведомлены о результатах интраоперационных исследований нервной проводимости.
2,4 Послеоперационный осмотр
Во время 6-недельного амбулаторного обзора участники заполнили анкету SF-MPQ по боли.В то время их грудную стенку исследовали на предмет ощущения укола булавкой вокруг хирургической раны и мест дренажа. Эта область была отмечена чернилами и начерчена на бумаге, где она была измерена с помощью бумаги с линиями сетки 1 мм и 1 см. Если пациенты не могли посетить базовую больницу (в Ноттингеме), им отправляли анкету о боли и включали вопрос, в котором им предлагалось подтвердить или нет наличие измененного ощущения кожи или онемения вокруг рубца.
Эта область была отмечена чернилами и начерчена на бумаге, где она была измерена с помощью бумаги с линиями сетки 1 мм и 1 см. Если пациенты не могли посетить базовую больницу (в Ноттингеме), им отправляли анкету о боли и включали вопрос, в котором им предлагалось подтвердить или нет наличие измененного ощущения кожи или онемения вокруг рубца.
При трехмесячном амбулаторном обследовании анкетирование боли и обследование были повторены, как и психологический опросник HADS.Почтовый контакт был установлен с не участниками.
2.5 Статистика
Анализ данных проводился с использованием статистического пакета SPSS. Одномерный анализ выполняли с использованием критерия хи-квадрат ( × 2 ) и независимого T -теста в зависимости от ситуации.
3 Результаты
Изначально было набрано 50 пациентов. Семнадцать человек были потеряны из-за технических трудностей с получением показаний во время операции, отзыва согласия после операции и смерти. Интраоперационные проблемы представляли собой полную нервно-мышечную блокаду, часто несмотря на наличие двух подергиваний от последовательности из четырех стимулов, слишком низкую температуру пациента и недостаточное время для завершения измерений. Данные 33 пациентов были проанализированы для включения в исследование. Их характеристики показаны в Таблице 1. Оценка боли до операции 2 была значительно выше нуля (среднее значение 4,2), потому что она включала боль типа расстройства желудка и любой дискомфорт, который воспринимался как вызванный раком, такой как «стеснение в груди» или плеврит.Непрерывные данные представлены как среднее значение и стандартное отклонение, а категориальные данные – как доля исследуемой группы. Из 24 пациентов с первичной карциномой легкого 16 были выполнены лобэктомия, 5 – пневмонэктомия, 2 – рукавная лобэктомия и 1 – исследовательская. Когда использовались три дренажа, два имели размер 28-36FG, но третий всегда был мягким сливом 19FG.
Интраоперационные проблемы представляли собой полную нервно-мышечную блокаду, часто несмотря на наличие двух подергиваний от последовательности из четырех стимулов, слишком низкую температуру пациента и недостаточное время для завершения измерений. Данные 33 пациентов были проанализированы для включения в исследование. Их характеристики показаны в Таблице 1. Оценка боли до операции 2 была значительно выше нуля (среднее значение 4,2), потому что она включала боль типа расстройства желудка и любой дискомфорт, который воспринимался как вызванный раком, такой как «стеснение в груди» или плеврит.Непрерывные данные представлены как среднее значение и стандартное отклонение, а категориальные данные – как доля исследуемой группы. Из 24 пациентов с первичной карциномой легкого 16 были выполнены лобэктомия, 5 – пневмонэктомия, 2 – рукавная лобэктомия и 1 – исследовательская. Когда использовались три дренажа, два имели размер 28-36FG, но третий всегда был мягким сливом 19FG.
Таблица 1
Характеристики пациентов и результаты исследования
Таблица 1
Характеристики пациентов и результаты исследования
3.
 1 Предоперационная электромагнитная стимуляция (магстим)
1 Предоперационная электромагнитная стимуляция (магстим)
Хотя были получены некоторые отличные записи, многие записи не поддаются интерпретации. Если бы мы повторили измерения у пациентов после операции, как планировалось, мы не смогли бы определить, что какие-либо изменения в записанных MEP были вызваны повреждением нервов, а не отклонениями в методе измерения. Поэтому от этой техники отказались.
3.2 Интраоперационное исследование межреберных нервов
Не было обнаружено повреждений нерва после торакотомии или тораколапаротомии, но до введения ретрактора, за исключением одного нерва у одного пациента.Общее интраоперационное повреждение нервов – это доля всех нервов, исследованных у всех испытуемых, которые не смогли провести импульсы по своей длине и вызвать сокращение межреберных мышц. Количество нервов, поврежденных после закрытия межреберного промежутка, для каждого человека показывает примерно нормальное распределение (рис. 1). Исследования проводимости показали, что повреждение нерва возникает либо в виде дискретной блокады только на участке ретрактора, но проводится с обеих сторон от этой точки, либо не проходит по всей длине нерва.Анализ этих паттернов повреждения нервов был исследован путем сравнения этих двух групп, за исключением тех, у которых после закрытия нервов было больше повреждений. Нервы, поврежденные по всей длине ( n = 5), связаны со значительно более длительным временем ретрактора (среднее 141 против 95 минут, p = 0,04) по сравнению с нервами с дискретными блоками ( n = 10), хотя есть нет связи с оценкой боли, онемением или анальгезией. Анализы, сравнивающие нервы с последующим повреждением нервов в результате закрытия межреберного промежутка ( n = 7) с теми, у которых не было такого повреждения ( n = 25), не показали значительной связи с оценкой боли, онемением или применением анальгезии.«Онемение» представляет собой любое ненормальное кожное ощущение, а не только снижение или отсутствие ощущения.
1). Исследования проводимости показали, что повреждение нерва возникает либо в виде дискретной блокады только на участке ретрактора, но проводится с обеих сторон от этой точки, либо не проходит по всей длине нерва.Анализ этих паттернов повреждения нервов был исследован путем сравнения этих двух групп, за исключением тех, у которых после закрытия нервов было больше повреждений. Нервы, поврежденные по всей длине ( n = 5), связаны со значительно более длительным временем ретрактора (среднее 141 против 95 минут, p = 0,04) по сравнению с нервами с дискретными блоками ( n = 10), хотя есть нет связи с оценкой боли, онемением или анальгезией. Анализы, сравнивающие нервы с последующим повреждением нервов в результате закрытия межреберного промежутка ( n = 7) с теми, у которых не было такого повреждения ( n = 25), не показали значительной связи с оценкой боли, онемением или применением анальгезии.«Онемение» представляет собой любое ненормальное кожное ощущение, а не только снижение или отсутствие ощущения. Хотя зарегистрированные случаи онемения через 6 недель и 3 месяца одинаковы (18 из 26 участников для обоих), измеренная область аномальных ощущений у 20 испытуемых, которые оценивались в оба раза, обычно сокращается (рис. 2). Использование анальгезии и все показатели боли снижаются со временем, как и средний показатель HADS.
Хотя зарегистрированные случаи онемения через 6 недель и 3 месяца одинаковы (18 из 26 участников для обоих), измеренная область аномальных ощущений у 20 испытуемых, которые оценивались в оба раза, обычно сокращается (рис. 2). Использование анальгезии и все показатели боли снижаются со временем, как и средний показатель HADS.
Рис. 1
Количество поврежденных нервов после закрытия межреберного промежутка.
Рис. 1
Количество поврежденных нервов после закрытия межреберного промежутка.
Рис. 2
Измеренная область аномальной кожной чувствительности («онемения») через 6 недель и 3 месяца после операции ( n = 20).
Рис. 2
Измеренная область аномальной кожной чувствительности («онемения») через 6 недель и 3 месяца после операции ( n = 20).
Для исследования факторов, которые могут предсказать повреждение межреберных нервов, был проведен анализ сравнения тех, у кого были повреждены от нуля до двух нервов ( n = 23), с теми, у которых было повреждено от трех до четырех нервов ( n = 10). Результаты выражены в виде средних значений для непрерывных данных и пропорций для категориальных с p -значениями (значимость дана как p <0,05) (Таблица 2). Это показывает, что повреждение нервов незначительно связано с большинством факторов, за исключением техники закрытия межреберного промежутка: прерывистые перикостальные швы связаны с 78% группы с низким повреждением нервов, но только с 40% с группой с высоким повреждением нервов ( p = 0,03). Хотя торакотомия связана с большим повреждением нервов, это несущественно.
Результаты выражены в виде средних значений для непрерывных данных и пропорций для категориальных с p -значениями (значимость дана как p <0,05) (Таблица 2). Это показывает, что повреждение нервов незначительно связано с большинством факторов, за исключением техники закрытия межреберного промежутка: прерывистые перикостальные швы связаны с 78% группы с низким повреждением нервов, но только с 40% с группой с высоким повреждением нервов ( p = 0,03). Хотя торакотомия связана с большим повреждением нервов, это несущественно.
Таблица 2
Факторы прогнозирования интраоперационного повреждения нервов
Таблица 2
Факторы прогнозирования интраоперационного повреждения нервов
Были проведены анализы, чтобы попытаться определить факторы, связанные с хронической болью, с использованием шкалы боли 3 в SF- MPQ как определяющий фактор для определения наличия хронической боли (Таблица 3). Это показывает, что наличие хронической боли не связано с большинством факторов, включая количество поврежденных межреберных нервов.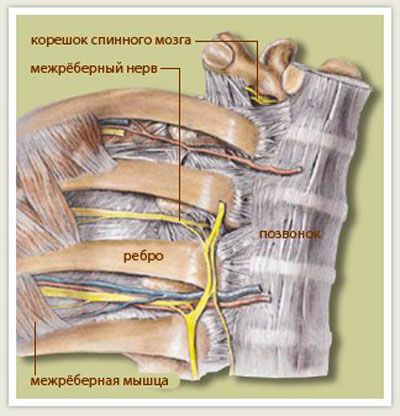 Единственными факторами, которые достоверно предсказывают хроническую боль, являются более высокий балл боли перед операцией 1 ( p = 0,05) и более высокий балл боли после операции через 6 недель ( p = 0,008, 0,001 и 0,002 для баллов 1, 2 и 3. , соответственно). Хроническая боль также в значительной степени связана с более высокими показателями HADS после операции ( p = 0,008), но не до операции. Не было никакой связи между болью и количеством дренажей, размером дренажей или количеством межреберных промежутков, через которые они были помещены.
Единственными факторами, которые достоверно предсказывают хроническую боль, являются более высокий балл боли перед операцией 1 ( p = 0,05) и более высокий балл боли после операции через 6 недель ( p = 0,008, 0,001 и 0,002 для баллов 1, 2 и 3. , соответственно). Хроническая боль также в значительной степени связана с более высокими показателями HADS после операции ( p = 0,008), но не до операции. Не было никакой связи между болью и количеством дренажей, размером дренажей или количеством межреберных промежутков, через которые они были помещены.
Таблица 3
Прогностические факторы и ассоциации для хронической боли через 3 месяца после операции
Таблица 3
Прогностические факторы и ассоциации для хронической боли через 3 месяца после операции
Факторы, которые могут быть связаны с наличием аномальных кожных ощущения через 3 месяца после операции были проанализированы (Таблица 4). Это показывает, что большинство факторов, включая количество нервов, поврежденных во время операции, существенно не связаны с «онемением».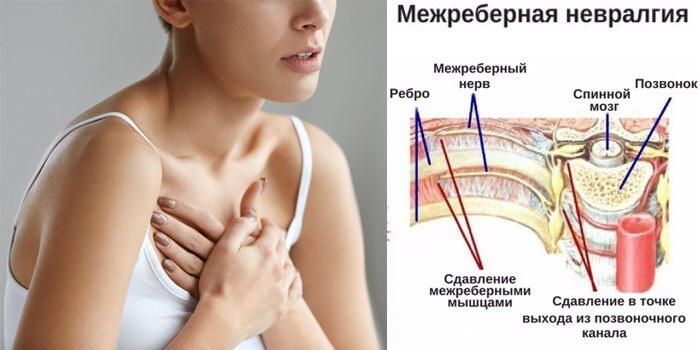 Однако наличие перелома ребра является единственным фактором, связанным с отсутствием онемения ( p = 0,006), а онемение через 6 недель после операции действительно предсказывает его наличие через 3 месяца ( p <0,001).
Однако наличие перелома ребра является единственным фактором, связанным с отсутствием онемения ( p = 0,006), а онемение через 6 недель после операции действительно предсказывает его наличие через 3 месяца ( p <0,001).
Таблица 4
Факторы прогнозирования наличия онемения через 3 месяца
Таблица 4
Факторы прогнозирования наличия онемения через 3 месяца
4 Обсуждение
Целью данного исследования было изучить роль повреждения межреберного нерва в развитии хронической боли после торакотомии.Толчком послужило исследование Rogers et al. [17], которые продемонстрировали повреждение межреберных нервов во время грудных операций, хотя о связи с последующей хронической болью не сообщалось. В нашем исследовании участвовали только выборные пациенты, так как эти запланированные операции дадут пациенту достаточно времени, чтобы решить, участвовать или нет. Использование предоперационной оценки боли и психологических показателей позволило нам проанализировать, повлияли ли ранее существовавшие симптомы со стороны грудной клетки, чувство тревоги или депрессии на развитие хронической боли.
Вызывает разочарование то, что исследования нервной проводимости магстим (магнитный стимулятор) в этих условиях не были достаточно точными, чтобы их можно было использовать на практике. Несоответствие показаний было вызвано трудностями как с поиском корешка межреберного нерва для стимуляции, так и с размещением записывающих электродов для записи. Точное размещение кожных электродов-пуговиц над соответствующей передней межреберной мышцей иногда было невозможно, потому что жир, ткань груди и грудная мышца затрудняли идентификацию соответствующего межреберного промежутка, а это означало, что мы не были уверены, были ли показания от межреберной мышцы, которая, как мы думали, производила MEP или другие мышцы грудной стенки.Не было видимых подергиваний отдельных межреберных мышц, что, возможно, помогло определить активность. Если бы этот метод был успешным, он мог бы послужить отличным исходным измерением до воздействия любых анестетиков, и его можно было бы повторить в амбулаторных условиях для проверки и последующего наблюдения за интраоперационными исследованиями нервов.
Интраоперационные исследования должны были опираться на активное сотрудничество анестезиологов, чтобы следовать определенному протоколу.Для оценки степени расслабления очень полагались на два подергивания после стимуляции приводящей мышцы по принципу “последовательность четырех” (TOF). Однако в некоторых случаях это оказалось неточным: у некоторых пациентов наблюдался кашлевой рефлекс, несмотря на отсутствие подергиваний TOF, а у некоторых была полная грудная блокада, несмотря на три или четыре подергивания TOF. Эта трудность отражается в большом количестве пациентов, которых мы не смогли изучить. Тестирование способности межреберных нервов проводить импульсы ограничивалось обнажением ребер и межреберных мышц.Хотя мы были уверены в функции нервов в операционном поле, мы не смогли проверить более проксимальные или дистальные аспекты нерва вне поля зрения, которые могут быть повреждены из-за тракционной травмы. Таким образом, мы можем недооценивать степень повреждения нервов. Хотя в некоторых случаях было показано, что с момента удаления ретрактора до завершения закрытия межреберного промежутка было повреждено больше нервов (шесть в группе перикостального закрытия и три в группе закрытия межреберных мышц), были также некоторые случаи, когда проводимость нервов нарушалась. восстановились за тот же период (по два от каждой закрытой группы).Это может быть связано с разрешением повреждения нерва или ослаблением нервно-мышечного релаксанта. Если некоторые или все нервы со временем восстанавливаются, что вполне вероятно, то интраоперационные исследования будут переоценивать степень стойкого повреждения нерва. Определенные типы повреждений нервов, например, из-за закрытия, могут вызвать долговременное повреждение, тогда как другие типы – нет.
восстановились за тот же период (по два от каждой закрытой группы).Это может быть связано с разрешением повреждения нерва или ослаблением нервно-мышечного релаксанта. Если некоторые или все нервы со временем восстанавливаются, что вполне вероятно, то интраоперационные исследования будут переоценивать степень стойкого повреждения нерва. Определенные типы повреждений нервов, например, из-за закрытия, могут вызвать долговременное повреждение, тогда как другие типы – нет.
В идеале, как можно больше аспектов операционной техники должны контролироваться, а некоторые аспекты рандомизированы между группами.В этом исследовании были задействованы три хирурга и их стажеры, чьи методы тонко или более очевидно различаются почти для каждого аспекта каждой операции. Следовательно, хотя мы измерили некоторые аспекты операции, которые могут повлиять на функцию межреберного нерва, существует огромное количество непроверенных переменных.
Обнаружение двух моделей повреждения нерва интересно, особенно с учетом связи с временем ретрактора. Это может представлять собой два различных механизма повреждения: прямое давление на нерв ретрактором, вызывающее незаметную точку травмы, которая может развиться относительно быстро, в то время как тракция нерва вызывает гораздо более медленное начало травмы, затрагивающей весь нерв, вероятно, из-за ишемии постоянно растянутых тканей.Последствия этих различных моделей травм неясны, поскольку нет значительной связи с результатами, которые мы измерили. Ожидается, что со временем снизятся показатели использования анальгезии и боли, так же как и уменьшение площади аномальной кожной чувствительности, поскольку соседние здоровые кожные сенсорные нервы вторгаются в поврежденную область.
Это может представлять собой два различных механизма повреждения: прямое давление на нерв ретрактором, вызывающее незаметную точку травмы, которая может развиться относительно быстро, в то время как тракция нерва вызывает гораздо более медленное начало травмы, затрагивающей весь нерв, вероятно, из-за ишемии постоянно растянутых тканей.Последствия этих различных моделей травм неясны, поскольку нет значительной связи с результатами, которые мы измерили. Ожидается, что со временем снизятся показатели использования анальгезии и боли, так же как и уменьшение площади аномальной кожной чувствительности, поскольку соседние здоровые кожные сенсорные нервы вторгаются в поврежденную область.
Мы ожидали, что увеличенный ИМТ, торакотомия, увеличенное распространение ретрактора и увеличенное время ретрактора значительно увеличат частоту повреждения межреберных нервов, хотя это не было подтверждено нашим исследованием.Хотя торакотомия вызвала большее повреждение нервов по сравнению с тораколапаротомией, это не было значительным. Как это ни парадоксально, увеличение времени ретрактора, по-видимому, уменьшает повреждение нерва, что авторы не могут объяснить. Техника, используемая хирургом А (диатермия вдоль верхней части ребра и использование узловых перикостальных швов для закрытия), по-видимому, приводит к менее заметному повреждению нерва во время операции и может представлять собой лучший метод. Однако какой бы метод ни использовался, повреждение нерва, вызванное закрытием, не повлияло на какие-либо измеренные результаты.
Как это ни парадоксально, увеличение времени ретрактора, по-видимому, уменьшает повреждение нерва, что авторы не могут объяснить. Техника, используемая хирургом А (диатермия вдоль верхней части ребра и использование узловых перикостальных швов для закрытия), по-видимому, приводит к менее заметному повреждению нерва во время операции и может представлять собой лучший метод. Однако какой бы метод ни использовался, повреждение нерва, вызванное закрытием, не повлияло на какие-либо измеренные результаты.
Хотя шкала боли 3 SF-MPQ использовалась для определения хронической боли через 3 месяца, результаты анализов с использованием других шкал боли были очень похожими. Результаты исследования не подтвердили наши ожидания о том, что повреждение межреберного нерва может быть связано с хронической болью. Это может быть связано с тем, что наши интраоперационные измерения не показали долгосрочного повреждения межреберного нерва, как описано выше, или потому, что некоторые повреждения нервов вызывают только безболезненное онемение, а не болевой синдром, или потому, что существует отдельная, более значимая причина хронического боль, отличная от травмы межреберного нерва. Связь хронической боли со значительно более высокой оценкой боли перед операцией 1 предполагает, что ранее существовавшая боль может увеличить риск развития послеоперационной боли. Это может быть следствием психологической обусловленности или сенсибилизации ноцицептивной системы на уровне позвоночника, что приводит к гиперчувствительности и феномену, известному как «закручивание», как описано Эрдеком [23]. Связь хронической боли со значительно более высокими показателями HAD после операции демонстрирует тесную связь между состояниями хронической боли и тревогой / депрессией и является ожидаемым открытием.Более ранние высокие показатели боли (через 6 недель), связанные с хронической болью, подтверждают результаты предыдущих исследований [4]. Это может быть важно, когда речь идет о более раннем лечении боли после торакотомии. Эквивалентная частота онемения через 3 месяца для обеих групп боли и отсутствия боли удивительна и позволяет предположить, что повреждение сенсорных нервов (на межреберном или кожном уровне), обнаруженное таким образом, не связано с болевыми синдромами.
Связь хронической боли со значительно более высокой оценкой боли перед операцией 1 предполагает, что ранее существовавшая боль может увеличить риск развития послеоперационной боли. Это может быть следствием психологической обусловленности или сенсибилизации ноцицептивной системы на уровне позвоночника, что приводит к гиперчувствительности и феномену, известному как «закручивание», как описано Эрдеком [23]. Связь хронической боли со значительно более высокими показателями HAD после операции демонстрирует тесную связь между состояниями хронической боли и тревогой / депрессией и является ожидаемым открытием.Более ранние высокие показатели боли (через 6 недель), связанные с хронической болью, подтверждают результаты предыдущих исследований [4]. Это может быть важно, когда речь идет о более раннем лечении боли после торакотомии. Эквивалентная частота онемения через 3 месяца для обеих групп боли и отсутствия боли удивительна и позволяет предположить, что повреждение сенсорных нервов (на межреберном или кожном уровне), обнаруженное таким образом, не связано с болевыми синдромами. Анализ факторов, которые могут предсказать изменение кожных ощущений через 3 месяца, снова демонстрирует отсутствие связи с нашими интраоперационными исследованиями нервов, что было неожиданным.Более низкий ИМТ и отсутствие переломов ребер в группе онемения авторы не могут объяснить. В этом исследовании не предпринималась попытка измерить степень повреждения париетальной плевры, которая может быть фактором, способствующим возникновению предоперационной боли из-за воспаления или инфильтрации, а также послеоперационной боли, вызванной интраоперационной травмой.
Анализ факторов, которые могут предсказать изменение кожных ощущений через 3 месяца, снова демонстрирует отсутствие связи с нашими интраоперационными исследованиями нервов, что было неожиданным.Более низкий ИМТ и отсутствие переломов ребер в группе онемения авторы не могут объяснить. В этом исследовании не предпринималась попытка измерить степень повреждения париетальной плевры, которая может быть фактором, способствующим возникновению предоперационной боли из-за воспаления или инфильтрации, а также послеоперационной боли, вызванной интраоперационной травмой.
В будущих исследованиях можно будет выяснить, приводят ли попытки уменьшить специфические паттерны повреждения межреберных нервов во время операции к уменьшению хронической боли.Дискретное точечное повреждение ретрактора на нерв может быть уменьшено путем изменения конструкции ретрактора для увеличения площади и, следовательно, уменьшения давления при контакте с сосудисто-нервным пучком. Повреждение всего нерва из-за тракционной травмы может быть уменьшено путем регулярного отпускания ретрактора по прошествии определенного периода времени, чтобы обеспечить свободный ток оксигенированной крови через ткани под напряжением.
5 Заключение
Причина хронической боли после торакальной хирургии не установлена, хотя некоторые опубликованные отчеты подтверждают роль повреждения межреберных нервов.Наше исследование выявило две различные модели повреждения нервов, а также продемонстрировало различия между хирургическими методами. Торакотомия с резекцией ребра привела к более заметному повреждению нерва, чем диатермия вдоль верхней части ребра и перикостального закрытия. Тем не менее, повреждение межреберного нерва во время операции не связано с хронической болью или изменением кожных ощущений через 3 месяца после операции, что позволяет предположить, что либо степень интраоперационного повреждения нерва не указывает на долгосрочное повреждение нерва, либо что есть является более серьезной причиной хронической боли, чем повреждение межреберного нерва.
Спасибо торакальным анестезиологам К. Алагесану, Н. Оконкво, Р. Николсу, П. Уэйку, Х. Скиннеру, М. Левитту, Крису Хови из Магстима за предоставление оборудования для нервной проводимости и П. Чоудхари из нейрофизиологии.
Чоудхари из нейрофизиологии.
Список литературы
[1],,.
Хронические последствия после торакоскопических процедур по поводу доброкачественных заболеваний
,
Eur J Cardiothorac Surg
,
2000
, vol.
17
(стр.
687
–
690
) [2],,.
Хроническая боль после торакальной операции: повторное исследование
,
Acta Anaesthesiol Scand
,
1999
, vol.
43
(стр.
563
–
567
) [3],,,,,,,.
Частота парестезии грудной стенки после видеоассистированной торакальной хирургии по поводу первичного спонтанного пневмоторакса
,
Eur J Cardiothorac Surg
,
2004
, vol.
25
(стр.
1054
–
1058
) [4],,,.
Острая боль после торакальной хирургии позволяет прогнозировать длительную боль после торакотомии
,
Clin J Pain
,
1996
, vol.
12
(1)
(стр.
50
–
55
) [5].
Распространенность хронической боли после резекции легочной артерии с помощью торакотомии или торакальной хирургии с помощью видеорекламы
,
J Thorac Cardiovasc Surg
,
1994
, vol.
107
(4)
(стр.
1079
–
1086
) [6],,,,,.
Торакотомия и торакоскопия: послеоперационная функция легких, боли и жалобы на грудную стенку
,
Eur J Cardiothorac Surg
,
1997
, vol.
12
(стр.
82
–
87
) [7],,,,.
Видеоторакоскопическое иссечение пузырей и абразия плевры для лечения первичного спонтанного пневмоторакса: отдаленные результаты
,
Ann Thorac Surg
,
2003
, vol.
75
(стр.
960
–
965
) [8],,,,.
Исследование эффективности плевродеза при спонтанном пневмотораксе при торакоскопической хирургии с помощью видеосъемки
,
Ann Thorac Surg
,
2001
, vol.
71
(стр.
452
–
454
) [9],,,,,,,.
Различия в острой и хронической заболеваемости между мышечно-щадящей и стандартной боковой торакотомией
,
J Thorac Cardiovasc Surg
,
1996
, vol.
112
(5)
(стр.
1346
–
1350
) [10],,,,,,.
Качество жизни после резекции рака легкого: видеоассистированная торакальная хирургия в сравнении с торакотомией
,
Chest
,
2002
, vol.
122
(2)
(стр.
584
–
589
) [11],,,.
Частота возникновения хронической боли после малоинвазивных операций по поводу спонтанного пневмоторакса.
,
евро J Cardiothorac Surg
,
2001
, т.
19
(стр.
355
–
359
) [12],,,,,.
Ранние и отдаленные жалобы после торакоскопической хирургии с использованием видео: оценка у 173 пациентов
,
евро J Cardiothorac Surg
,
2000
, vol.
18
(стр.
7
–
11
) [13],,,.
Длительная боль после торакотомии
,
Грудная клетка
,
1991
, т.
99
(стр.
270
–
274
) [14],,,.
Хроническая постторакотомная боль
,
J Cardiovasc Surg
,
1994
, vol.
35
(s)
(стр.
161
–
164
) [15],.
Хирургические аспекты боли после торакотомии
,
Eur J Cardiothorac Surg
,
2000
, vol.
18
(стр.
711
–
716
) [16],,,,,,,.
Послеоперационная боль и поверхностные брюшные рефлексы после заднебоковой торакотомии
,
Ann Thorac Surg
,
1997
, vol.
64
(стр.
207
–
210
) [17],,.
Первые результаты нейрофизиологической оценки повреждения межреберного нерва во время торакотомии
,
Eur J Cardiothorac Surg
,
2002
, vol.
21
(стр.
298
–
301
) [18].
Опросник боли МакГилла: основные свойства и методы оценки.
,
Боль
,
1975
, т.
1
(3)
(стр.
277
–
299
) [19],.
Больничная шкала тревожности и депрессии
,
Acta Psychiatr Scand
,
1983
, vol.
67
(стр.
361
–
370
) [20].
Международный опыт использования больничной шкалы тревожности и депрессии – обзор данных валидации и клинических результатов
,
J Psychosom Res
,
1997
, vol.
42
(1)
(стр.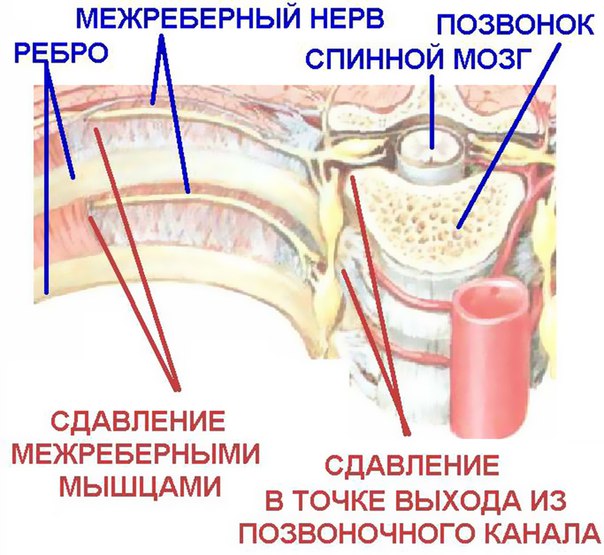
17
–
41
) [21],,,.
Действительность Госпитальной шкалы тревожности и депрессии: обновленный обзор литературы
,
J Psychosom Res
,
2002
, vol.
52
(2)
(стр.
69
–
77
) [22].
Больничная шкала тревожности и депрессии
,
Health Quality Life Outcomes
,
2003
, vol.
1
стр.
29
[23],.
Хроническая боль и торакальная хирургия
,
Thorac Surg Clin
,
2005
, vol.
15
(стр.
123
–
130
)
© 2006 Elsevier Science B.V.
Elsevier Science B.V.
Гавайи Холистическая акупунктура Велнес-центр Гонолулу Неврологические заболевания
«Я так счастлив и благодарен за открытие доктора Глории Мартин. Я какое-то время искал доктора-натуропата / акупунктуриста в районе Кай на Гавайях и хотел бы знать о ней давным-давно – но лучше поздно, чем никогда! У меня хроническая спина. проблемы в течение примерно 12 лет из-за прошлой травмы, и за эти годы обратились к такому множеству разных врачей, включая остеопатов, мануальных терапевтов, терапевтов, физиотерапевтов, массажистов, терапевтов по триггерной точке, иглотерапевтов и т. д.- но ни одно лечение не длилось больше нескольких дней. Тем не менее, недавно доктор Мартин провел несколько процедур, которые избавили меня от боли в течение нескольких недель, прежде чем мне потребовалось новое лечение! Это самый продолжительный период отсутствия болей в спине, и я с нетерпением жду полного выздоровления, которое, как я знаю, уже происходит. Она одаренный целитель и мастер во многих смыслах и мой особенный «ангел»! Добрая, заботливая и приземленная – НЕВЕРОЯТНЫЙ Доктор !!! »
д.- но ни одно лечение не длилось больше нескольких дней. Тем не менее, недавно доктор Мартин провел несколько процедур, которые избавили меня от боли в течение нескольких недель, прежде чем мне потребовалось новое лечение! Это самый продолжительный период отсутствия болей в спине, и я с нетерпением жду полного выздоровления, которое, как я знаю, уже происходит. Она одаренный целитель и мастер во многих смыслах и мой особенный «ангел»! Добрая, заботливая и приземленная – НЕВЕРОЯТНЫЙ Доктор !!! »
Эллен
«Абсолютно изменивший жизнь! Уже 4 месяца я страдаю от необъяснимого зуда в левом плече и локте.Анализ крови не дал ответов, стероидный крем ничего не дал, лед был единственным решением (Интернет поставил мне диагноз брахиорадиальный зуд без известного лечения или окончательной причины).
Несколько месяцев я спал с пакетами льда на руке, перебирая по 4 пакета за ночь. Это был зуд, как дьявол. Я был готов оторвать руку от терки для сыра! Я решил попробовать иглоукалывание, поскольку никакая западная медицина не работает. Глория абсолютно не заботилась обо мне. Я провел 4 сеанса с интервалом примерно в неделю каждое, и каждый раз после этого я начинал возвращать мне жизнь.Зуд стал реже или его легче было успокоить, ночь или две без льда, и я поражен и сверх БЛАГОДАРНОСТИ сказать, что я четыре дня и ночи без зуда и без льда. Я бы на 100% рекомендовал Глорию. Запись на прием очень проста, очень дружелюбный персонал, очень индивидуальный план атаки. Моя страховка не покрывает акупунктуру, но она стоила каждого ПЕННИ! »
Глория абсолютно не заботилась обо мне. Я провел 4 сеанса с интервалом примерно в неделю каждое, и каждый раз после этого я начинал возвращать мне жизнь.Зуд стал реже или его легче было успокоить, ночь или две без льда, и я поражен и сверх БЛАГОДАРНОСТИ сказать, что я четыре дня и ночи без зуда и без льда. Я бы на 100% рекомендовал Глорию. Запись на прием очень проста, очень дружелюбный персонал, очень индивидуальный план атаки. Моя страховка не покрывает акупунктуру, но она стоила каждого ПЕННИ! »
Наташа
«Сколько людей могут сказать, что нашли КОЗЮ в определенной области / практике? (Я, я, я !! – машет рукой в воздухе) Я ВЕРЮ ДР.МАРТИН – КОЗЕРА АКУПУНКТУРЫ И МАССАЖА !! Прежде всего, жена искала доктора поблизости, который мог бы помочь мне с моими болями в плече / шее / спине и мигренью. Она искала через Yelp, BBB и т.д. Наконец через Yelp мы нашли доктора Мартина с рейтингом 5 звезд. Я действительно ненавижу иглы, но в тот момент был готов попробовать что угодно, потому что боль была настолько сильной. После первой процедуры я почувствовал, что давление в шее / плечах значительно уменьшилось. Теперь я вижу ее хотя бы раз в 2 недели для обслуживания.Мои мигрени редки и редки. Раньше это было несколько раз в месяц. Она использует китайскую медицину и знает свое дело (она занимается этим уже 35 лет), и она Хаоле (также известная как европеоид). После первого приема вы можете записаться на прием онлайн. Мы любим ее, потому что она хорошо делает то, что делает. Она действительно заботится о том, чтобы вас поправить “.
После первой процедуры я почувствовал, что давление в шее / плечах значительно уменьшилось. Теперь я вижу ее хотя бы раз в 2 недели для обслуживания.Мои мигрени редки и редки. Раньше это было несколько раз в месяц. Она использует китайскую медицину и знает свое дело (она занимается этим уже 35 лет), и она Хаоле (также известная как европеоид). После первого приема вы можете записаться на прием онлайн. Мы любим ее, потому что она хорошо делает то, что делает. Она действительно заботится о том, чтобы вас поправить “.
Анита
«Доктор Глория Мартин – чуткая заботливая и нежная целительница. Я пришла к ней в ужасном состоянии и вышла, чувствуя себя намного лучше и оптимистично оценивая свой прогноз.Я очень рекомендую “.
Лесли
«Я так благодарен, что нашел доктора Глорию Мартин. Она потрясающая! У меня была хроническая боль в коленях, и после первого визита мое колено почувствовало себя намного лучше, после второго визита я чувствую, что мне сделали замену колена. боль ушла. Теперь она работает с другими частями моего тела. Да, я разваливаюсь на части, лол. Старость. Глория очень знающая, добрая, заботливая и профессиональная, с отличным чувством юмора. Безусловно, ЛУЧШИЙ акупунктурист в мире. .Как и другие рецензенты, она – настоящий одаренный целитель. Я перфекционист по натуре и не стал бы рекомендовать никого, в кого не верил полностью. Так что, если вы ищете акупунктуриста, возьмите трубку и назначьте встречу, вы не будете разочарованы. Я так рад, что сделал это ».
боль ушла. Теперь она работает с другими частями моего тела. Да, я разваливаюсь на части, лол. Старость. Глория очень знающая, добрая, заботливая и профессиональная, с отличным чувством юмора. Безусловно, ЛУЧШИЙ акупунктурист в мире. .Как и другие рецензенты, она – настоящий одаренный целитель. Я перфекционист по натуре и не стал бы рекомендовать никого, в кого не верил полностью. Так что, если вы ищете акупунктуриста, возьмите трубку и назначьте встречу, вы не будете разочарованы. Я так рад, что сделал это ».
J.S.
«Обожаю это место! Глория очень знающая, находчивая и мудрая. Она всегда в хорошем настроении и расслаблена. Она великолепно помогала мне в процессе исцеления от автомобильной аварии, в результате которой у меня были травмы шеи и поясницы.Она видит меня в автокатастрофе Geico без вины, и они сделали мой опыт очень легким, расслабляющим, исцеляющим и приятным. Вместе с физиотерапией я вижу большие улучшения, и я чувствую себя прекрасно каждый раз, когда прекращаю лечение.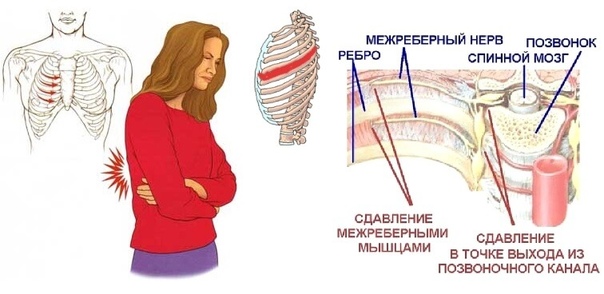 Спасибо, Глория! »
Спасибо, Глория! »
Яна
Неврология и интервенционное обезболивание
Неврологические состояния могут мешать вашей жизни. Страдаете ли вы повторяющимися головными болями, судорогами, нейродегенеративными заболеваниями или другими состояниями, наша цель – предложить лучший доступный уход, чтобы вы могли жить своей жизнью в полной мере.
Кроме того, непреодолимая боль может не только мешать вашей жизни, но и вызывать страх и разочарование при поиске лекарства. Мы предлагаем различные методы и процедуры по обезболиванию, которые помогут вам избавиться от боли.
В Hunt Regional Medical Partners мы лечим следующие заболевания:
- Головные боли
- Боль в спине и шее
- Невропатии (нервная боль, вызывающая онемение и покалывание, диабетические невропатии, запястный канал и т. Д.)
- Изъятия
- Ход
- Проблемы с памятью
- Рассеянный склероз
- Болезнь мышц
- Региональная боль (грудь, живот / таз и конечности)
- Боль в суставах и мышцах
Мы также предлагаем множество обезболивающих, в том числе:
Головные боли
- Нервные блоки при головной боли
- Ботокс от мигрени или спастичности
- Внутривенная инфузионная терапия при трудноизлечимой головной боли
- Впрыск в сустав ВНЧС
Боль в спине и шее
- Эпидуральные инъекции стероидов
- Каудальная инъекция с / без эпидурального катетера
- Трансофраминальная или селективная блокада нервных корешков при боли, подобной ишиасу
- Блокада средней ветви и радиочастотная абляция
- Инъекция сустава SI и радиочастотная абляция
- Стимулятор спинного мозга
суставов и опорно-двигательного аппарата
- Инъекции в суставы под рентгеноскопией или ультразвуком
- Нервные блоки при трудноизлечимой боли в суставах
- Боль в связках и сухожилиях
- Инъекции в триггерные точки
- Пролотерапия, PRP терапия
Раковая боль
- Рак головы и шеи
- Рак брюшной полости и таза
RSD (CRPS: комплексный региональный болевой синдром)
- Процедуры симпатической блокады
- Стимулятор спинного мозга
Региональная боль
- Боль в груди и межреберная невралгия
- Процедуры при боли в животе
- Тазовая боль
- Боль в конечностях
Компрессионные переломы позвонков
- Вертебропластика / кифопластика при остеоартрозе или переломах, связанных с раком
Стимулятор спинного мозга
- Пробный и постоянный имплантат для лечения боли в спине и шее, синдром неудачной спины, CRPS
Интратекальный насос
- Раковая боль
- Спастичность
- Неустранимая боль в позвоночнике
М. Эяд Зонджи, доктор медицины, имеет сертификат Совета по неврологии и интервенционной медицине боли. Если вы хотите назначить встречу с ним, обратитесь в наш офис.
Эяд Зонджи, доктор медицины, имеет сертификат Совета по неврологии и интервенционной медицине боли. Если вы хотите назначить встречу с ним, обратитесь в наш офис.
Неврологическая клиника в Гринвилле
4211 Бульвар Джо Рэмси, Люкс 100
Гринвилл, Техас 75402
Телефон: (903) 408-7990
Лучшие врачи по лечению межреберной невралгии в Индии
Ваш врач – лучший врач в Индии? Поиск Наш полный список врачей в Индии. Ведущие мировые специалисты-медики ждут, чтобы вам помочь.Найдите лучших врачей в Индии – от онкологов до педиатров, от кардиологов до неврологов, от дерматологов до хирургов. Вы сами решаете, кто входит в список лучших врачей Индии.
Врачи в Индии обеспечивают лечение мирового класса по доступной цене, высококвалифицированные и обученные в соответствующей области медицины. Большинство индийских врачей имеют сертификаты и квалификацию в известных медицинских учреждениях США, Германии, Канады и Великобритании.
Индийские врачи стремятся сочетать высочайшие стандарты медицинского мастерства и лучший сервис, чтобы обеспечить своим пациентам наилучшее медицинское обслуживание.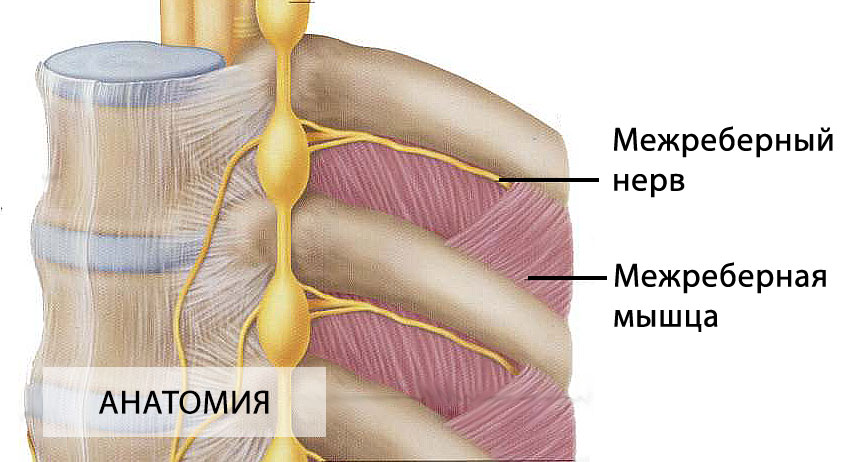 Их цель – предложить хирургическое вмешательство с максимальной осторожностью и минимально инвазивными вариантами, когда это возможно.
Их цель – предложить хирургическое вмешательство с максимальной осторожностью и минимально инвазивными вариантами, когда это возможно.
В Индии есть несколько направлений медицинского туризма (например, Ченнаи, Гоа, Мумбаи, Ахмедабад и Дели) благодаря высокому качеству лечения, низкой стоимости и лучшему опыту. В стране работают одни из ведущих хирургов и врачей, которые знают толк в предоставлении безопасных и излечимых процедур.
У нас есть полная информация, чтобы вы могли найти лучшего врача в Индии. После исследования позвоните по указанному номеру телефона, чтобы записаться на прием.Если мы пропустили какого-либо врача, нажмите здесь, чтобы отправить информацию, или попросите врача зарегистрироваться, чтобы пациенты могли воспользоваться его / ее услугами.
Надеемся, вы найдете лучшего врача и получите качественную помощь. Если вам нужно личное руководство, чтобы найти подходящего врача в Индии, свяжитесь с нами или задайте вопрос, используя службу «Спросите врача», и мы будем рады вам помочь.
Чтобы выбрать из лучших врачей Индии, мы рекомендуем вам обратить внимание на их опыт, удовлетворенность пациентов, рекомендации коллег, уровень образования и участие в исследованиях и бумажных презентациях.
Вот несколько важных ссылок для вашей информации:
Подробнее »
Опоясывающий лишай и постгерпетическая невралгия – Институт Эйнсворта
Блокада межреберного нерва – Эта процедура эффективна не только для лечения симптомов ПГН, но и для установления диагноза вовлеченного сегмента позвоночника. Межреберный нерв лежит под ребром и является продолжением спинномозгового нерва на том же уровне. Обычно это делается под контролем ультразвука. Ваш врач вводит небольшую иглу вдоль межреберного нерва на пути высыпания опоясывающего лишая.Введя небольшое количество местного анестетика (иногда с добавлением кортизона), можно получить сильное облегчение боли.
Блокада симпатического нерва – Они могут обеспечить кратковременное обезболивание. В зависимости от области тела, пораженной ПГН, могут применяться различные симпатические блокады – блокада звездчатого ганглия, поясничная симпатическая блокада или клиновидно-небная блокада. Исследования показали, что эти процедуры более эффективны, если их выполнять в течение 2 месяцев с момента появления боли.
В зависимости от области тела, пораженной ПГН, могут применяться различные симпатические блокады – блокада звездчатого ганглия, поясничная симпатическая блокада или клиновидно-небная блокада. Исследования показали, что эти процедуры более эффективны, если их выполнять в течение 2 месяцев с момента появления боли.
Блокада тройничного нерва – В редких случаях опоясывающий лишай (и впоследствии ПГН) может возникнуть на лице из-за распространения вируса по тройничному нерву. Эта процедура включает введение небольшого количества местного анестетика в пораженную ветвь тройничного нерва, чтобы прервать цикл хронической боли. При правильном выполнении боль будет немедленным и значительным.
Невролиз и абляция – В случаях, когда инъекция дает только временное облегчение, можно использовать невролиз или нейроабляцию для увеличения продолжительности.Можно использовать несколько различных методов:
- Радиочастотная абляция (RFA) – Радиоволны воздействуют на нерв или сплетение, предотвращая передачу боли.

- Криоабляция – Подобно РЧА, однако, вместо радиоволн применяется холодная температура.
- Chemodenervation – Предпосылка та же, что и криоаблация и RFA, в том, что цель состоит в том, чтобы предотвратить передачу боли нервом или сплетением; Вместо того, чтобы прикладывать механическое напряжение к нерву посредством радиоволн или низких температур, вводятся небольшие количества спирта или фенола, чтобы заблокировать способность нерва передавать сигнал.
Внутривенная инфузионная терапия – Все более популярная процедура для лечения различных болевых синдромов, а также депрессии и тревоги. Пациентов подключают к капельнице и внутривенно вводят специальные лекарства. Настой может занять всего 30 минут.
Стимуляция спинного мозга (SCS) – Это обычно выполняемая процедура при различных болевых синдромах. SCS использует технологию, аналогичную технологии кардиостимуляторов, при которой небольшие электроды помещаются в эпидуральное пространство рядом со спинным мозгом. Эти электроды создают небольшой электрический ток по спинному мозгу, который мешает передаче сигналов боли. В случае PHN, SCS, как было показано, уменьшает боль и улучшает работу 82% пациентов. [16]
Эти электроды создают небольшой электрический ток по спинному мозгу, который мешает передаче сигналов боли. В случае PHN, SCS, как было показано, уменьшает боль и улучшает работу 82% пациентов. [16]
Стимуляция DRG – Стимуляция DRG (также известная как стимуляция ганглиев дорсального корня) – это самое современное лечение боли, доступное в Соединенных Штатах. Клиническое исследование (ACCURATE Study) зафиксировало беспрецедентное уменьшение боли и общие успехи, которых никогда раньше не было.Процедура почти идентична традиционной стимуляции спинного мозга, за исключением специальной системы Axium ™ (доступной исключительно через St. Jude Medical ™), которая обеспечивает изолированную стимуляцию только DRG. Даже если в прошлом вам не удавалось провести традиционную стимуляцию спинного мозга, статистика показывает, что стимуляция DRG все равно будет работать! [17]
Стимуляция периферических нервов – Предпосылка аналогична SCS, но отведения помещаются на пораженный нерв – в случае PN электрод помещают на половом нерве.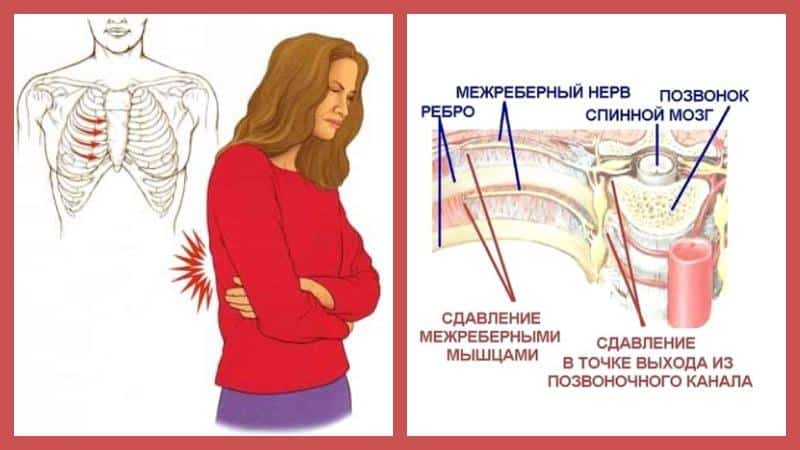 [18]
[18]
Интратекальный насос – Небольшой катетер помещается в субарахноидальное пространство (сразу под эпидуральным пространством), и чрезвычайно небольшое количество лекарства медленно доставляется непосредственно по спинному мозгу. Это позволяет вашему врачу назначить те же лекарства, которые вы могли бы принимать перорально для облегчения боли, но в меньшей дозе, что уменьшило бы побочные эффекты.
ДИАБЕТИЧЕСКИЕ НЕЙРОПАТИИ: ТИПЫ, ДИАГНОСТИКА И ВЕДЕНИЕ
Хотя с годами значительный прорыв в нашем понимании диабетической невропатии был сделан как неврологами, так и диабетологами, в последнее время (в Великобритании) именно диабетологи взяли на себя основные клиническая роль в диагностике и лечении наиболее распространенной невропатии в западном мире.Поэтому может случиться так, что направление пациентов с диабетической невропатией из диабетической клиники происходит только в том случае, если есть невролог, проявляющий особый интерес, или если требуется помощь в отношении конкретной проблемы, такой как атипичная клиническая картина или контроль боли. Это создает риск того, что те, кто занимается неврологией, в конечном итоге получат несколько искаженное представление о спектре диабетических невропатий. Другая ситуация, когда неврологи сталкиваются с диабетической невропатией, – это когда у пациента обнаруживается диабет в ходе исследования периферической невропатии.
Это создает риск того, что те, кто занимается неврологией, в конечном итоге получат несколько искаженное представление о спектре диабетических невропатий. Другая ситуация, когда неврологи сталкиваются с диабетической невропатией, – это когда у пациента обнаруживается диабет в ходе исследования периферической невропатии.
ДИАГНОСТИКА САХАРНОГО ДИАБЕТА
Диагноз сахарного диабета (СД) ставится на основании сочетания типичных симптомов – похудания, жажды, слабости и утомляемости – с постоянно повышенным уровнем глюкозы в крови (таблица 1). Глюкозурия и повышенные значения HbA1 сами по себе не используются для диагностики сахарного диабета.
Таблица 1
Биохимическая диагностика сахарного диабета
КЛАССИФИКАЦИЯ ДИАБЕТИЧЕСКИХ НЕВРОПАТИЙ
На основе модификации классификации, предложенной PK Thomas, можно идентифицировать ряд различных синдромов (таблица 2).
Таблица 2
Классификация диабетических невропатий
Гипергликемическая нейропатия
Покалывание, боль или гиперестезия в стопах давно описаны у пациентов с впервые диагностированным СД или у пациентов с очень плохим гликемическим контролем, что является феноменом гипергликемической невропатии. Симптомы и замедление нервной проводимости быстро устраняются за счет улучшения контроля глюкозы.
Диабетическая симметричная дистальная полинейропатия с вегетативной нейропатией
Это наиболее распространенная диабетическая невропатия, характеризующаяся дистальным распределением сенсорных и моторных симптомов и признаков в зависимости от длины. Поскольку вегетативное поражение возникает у многих пациентов с диабетической симметричной дистальной полинейропатией (ДСДП) и составляет важную часть клинического комплекса, лучше всего рассматривать оба этих заболевания вместе.
Весьма вероятно, что к тому времени, когда будет поставлен диагноз DSDP, у пациента с диабетом 1 или 2 типа будет продолжительный период (иногда на несколько лет) аномального метаболизма глюкозы.Это особенно характерно для пациентов с СД 2 типа, у которых обычно «обнаруживают» диабет при появлении симптомов и признаков невропатии. Также стоит помнить, что обычно обнаруживаются доказательства ретинопатии или нефропатии в любом случае DSDP – независимо от того, установлен ли новый диагноз или установлен давно.
У некоторых пациентов с DSDP симптомы отсутствуют, но наиболее частыми жалобами являются покалывание, жужжание или покалывание в стопах, которые также могут ощущаться стянутыми, горячими или холодными.Симптомы часто, но не всегда, симметричны по распределению. Пациент может жаловаться на онемение или «будто ноги у меня ватные». Боли в стопах часто усиливаются ночью, хотя это явление не является уникальным для DSDP.
Клинические признаки
Кардинальный признак – отсутствие голеностопных рефлексов (таблица 3).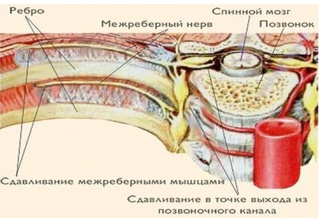 Без этого сложно поставить диагноз DSDP. Потеря коленных рефлексов происходит примерно в двух третях случаев, но потеря любых рефлексов верхних конечностей происходит только у четверти пациентов с DSDP.Мышечная слабость обычно умеренная и ограничивается стопами, в основном в области общего малоберцового нерва и более явно поражает длинный разгибатель большого пальца и короткий разгибатель пальцев по сравнению с тыльным сгибанием и выворотом. Можно увидеть слабость проксимальных отделов ног, но это, вместе с наличием значительной слабости верхних конечностей, должно вызывать подозрение в отношении альтернативного диагноза, и только после отрицательного результата соответствующих исследований в этих случаях можно поставить диагноз DSDP.
Без этого сложно поставить диагноз DSDP. Потеря коленных рефлексов происходит примерно в двух третях случаев, но потеря любых рефлексов верхних конечностей происходит только у четверти пациентов с DSDP.Мышечная слабость обычно умеренная и ограничивается стопами, в основном в области общего малоберцового нерва и более явно поражает длинный разгибатель большого пальца и короткий разгибатель пальцев по сравнению с тыльным сгибанием и выворотом. Можно увидеть слабость проксимальных отделов ног, но это, вместе с наличием значительной слабости верхних конечностей, должно вызывать подозрение в отношении альтернативного диагноза, и только после отрицательного результата соответствующих исследований в этих случаях можно поставить диагноз DSDP.
Таблица 3
Клиническая оценка диабетической симметричной дистальной полинейропатии (DSDP)
Расстройство чувствительности – очень распространенное явление. Чаще всего страдает чувство вибрации в пальцах ног. Укол булавкой, температура и ощущение легкого прикосновения теряются при раздаче носков или чулок, и если при раздаче перчаток наблюдается потеря чувствительности верхних конечностей, уровень поражения ног должен достигать середины бедра. Если нет, поищите другое объяснение потери чувствительности верхних конечностей.Проверить ощущение глубокой боли можно, надавив на ноготь большого пальца руки рукояткой молоточка для надколенника. Любая потеря чувствительности подвергает диабетическую стопу риску образования язв. Основываясь на относительной потере сенсорных модальностей, можно произвольно разделить невропатию на «тип крупных волокон» (преобладающая потеря вибрации, легкого прикосновения и ощущений положения суставов) и «тип мелких волокон» (преобладающая потеря боли и температуры). но эти подгруппы необычны и представляют собой оба конца континуума DSDP.
Укол булавкой, температура и ощущение легкого прикосновения теряются при раздаче носков или чулок, и если при раздаче перчаток наблюдается потеря чувствительности верхних конечностей, уровень поражения ног должен достигать середины бедра. Если нет, поищите другое объяснение потери чувствительности верхних конечностей.Проверить ощущение глубокой боли можно, надавив на ноготь большого пальца руки рукояткой молоточка для надколенника. Любая потеря чувствительности подвергает диабетическую стопу риску образования язв. Основываясь на относительной потере сенсорных модальностей, можно произвольно разделить невропатию на «тип крупных волокон» (преобладающая потеря вибрации, легкого прикосновения и ощущений положения суставов) и «тип мелких волокон» (преобладающая потеря боли и температуры). но эти подгруппы необычны и представляют собой оба конца континуума DSDP.
В более тяжелых случаях потеря чувствительности может распространяться на туловище, первоначально затрагивая переднюю грудную / брюшную стенку в виде «нагрудника», и может распространяться латерально вокруг туловища.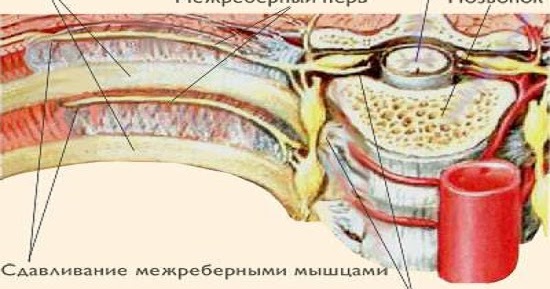
Клинически значимая симптоматическая вегетативная нейропатия встречается относительно редко, но специфические тесты вегетативной функции показывают отклонения у 97% пациентов с DSDP. Если у пациента с диабетом имеется выраженная вегетативная нейропатия, но только очень легкая форма DSDP или отсутствие дистальной полинейропатии, подумайте о другой причине вегетативных нарушений.
Что следует учитывать при дифференциальной диагностике?
Хотя диабет является распространенным заболеванием, существует вероятность, что у дистальной невропатии может быть другая причина. Достаточно тщательного сбора анамнеза (алкоголь, семейный анамнез нейропатии, наркотиков и т. Д.) И нескольких основных анализов крови (таблица 4), чтобы подтвердить диагноз DSDP.
Таблица 4
Анализы крови пациента с DSDP
Какие атипичные признаки могут указывать на альтернативную или дополнительную невропатию?
Тяжелая вегетативная нейропатия с легкой формой DSDP : следует учитывать амилоидную невропатию, которая может вызвать невропатию мелких волокон со спонтанными болями, но при этом характерны вегетативные особенности.
 Клинические признаки семейного и несемейного амилоидоза будут очень похожи
Клинические признаки семейного и несемейного амилоидоза будут очень похожиБыстро прогрессирующий моторный компонент : При выраженной слабости следует учитывать возможность наложенной хронической воспалительной демиелинизирующей полинейропатии (ХВДП). Есть некоторые свидетельства того, что ХВДП может быть более распространенным у пациентов с диабетом, чем у населения в целом. Могут быть полезны исследования нервной проводимости. Белок CSF будет повышен как в CIDP, так и в DSPD, но наличие олигоклональных полос указывает на CIDP.
Болезненные варианты DSDP
Хотя неясно, является ли один из двух описанных ниже синдромов отдельными сущностями или просто частью спектра болезненного DSDP, важно знать об их существовании.
Инсулиновый неврит
Тяжелая болезненная сенсорная нейропатия может наблюдаться в связи с ужесточением контроля уровня глюкозы. Это можно увидеть при попытке улучшить контроль уровня глюкозы у пациента, который уже начал принимать инсулин, или у пациентов, впервые начинающих принимать инсулин.Боль часто трудно контролировать, и, как и при других болезненных синдромах диабетической нейропатии, она усиливается ночью. Клинические признаки нередко минимальны или даже отсутствуют. Исследования нервной проводимости могут быть нормальными.
Это можно увидеть при попытке улучшить контроль уровня глюкозы у пациента, который уже начал принимать инсулин, или у пациентов, впервые начинающих принимать инсулин.Боль часто трудно контролировать, и, как и при других болезненных синдромах диабетической нейропатии, она усиливается ночью. Клинические признаки нередко минимальны или даже отсутствуют. Исследования нервной проводимости могут быть нормальными.
Обычно выздоровление занимает до 12 месяцев.
Острая болезненная невропатия с сильной потерей веса
Первоначально получившее название «диабетическая невропатическая кахексия», это необычное состояние возникает преимущественно у пациентов мужского пола с плохо контролируемым диабетом 1 типа.У женщин, которые пытаются контролировать свой диабет путем отказа от еды и становятся анорексичными, также развивается аналогичная болезненная невропатия. Ярко выраженное похудание – ключевая особенность. Боль в дистальном отделе нижних конечностей сильная, с жжением и стеснением в стопах.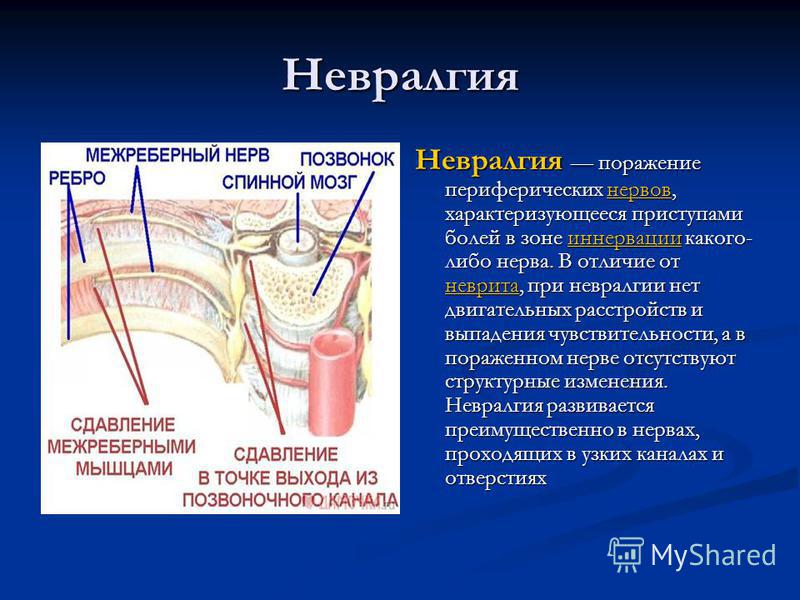 Депрессия – не редкость.
Депрессия – не редкость.
Потеря веса драматическая, и когда масса тела стабилизируется – обычно после периода улучшения контроля глюкозы с помощью инсулина – боль начинает уменьшаться. Улучшение может занять до 12 месяцев и еще 1-2 года для восстановления массы тела до нормального состояния и полного исчезновения боли.
Сводка
Развитие DSDP чаще встречается у людей с давним диабетом, у мужчин высокого роста. Это обычно, если не всегда, связано с ретинопатией и / или нефропатией. У пациента с СД, у которого развились симптомы и признаки дистальной полинейропатии, проверьте анализы крови, указанные в таблице 4, и, если все они в норме, диагноз DSDP является надежным. Исследования нервной проводимости мало что добавляют.
При наличии атипичных клинических признаков потребуются дальнейшие исследования, включая исследования нервной проводимости, и можно также рассмотреть возможность биопсии нерва (и мышцы) (таблица 5).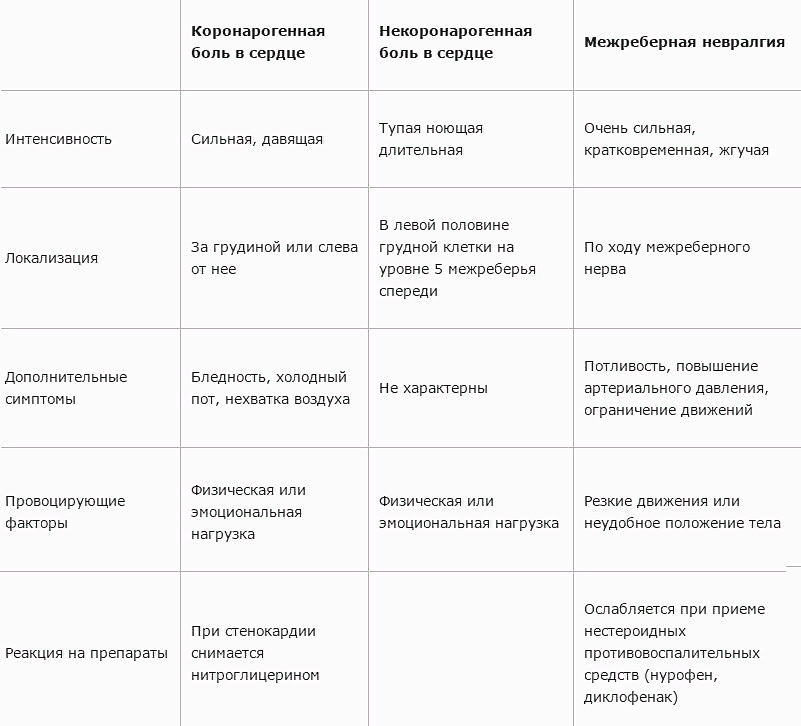
Таблица 5
Когда следует запросить исследование нервной проводимости и рассмотреть возможность биопсии нерва у диабетика с дистальной полинейропатией?
Этиология
Еще предстоит пройти долгий путь, прежде чем мы сможем сформулировать объединяющую гипотезу патогенеза DSDP. От экспериментальной диабетической невропатии был обнаружен широкий спектр метаболических изменений с некоторыми взаимосвязанными факторами (таблица 6).Тот факт, что ни одно из этих метаболических нарушений не воспроизводит патологические изменения, наблюдаемые в DSDP человека, стимулировал поиск сосудистой этиологии.
Таблица 6
Патогенез диабетической симметричной дистальной полинейропатии (DSDP)
Многие вопросы остаются без ответа, особенно те, которые касаются того, как метаболические изменения в нерве диабетического пациента могут предрасполагать его к повреждению сосудов. Когда мы будем ближе к ответу, можно будет начать поиск более конкретных эффективных методов лечения.
Когда мы будем ближе к ответу, можно будет начать поиск более конкретных эффективных методов лечения.
Лечение
Строгий контроль уровня глюкозы с момента постановки диагноза СД – важнейший аспект лечения. Это было ясно продемонстрировано при СД I типа, где жесткий гликемический контроль снижает риск развития ДСДП на 69% через пять лет. То же самое еще не было показано для СД 2 типа, но можно подозревать аналогичные результаты. Однажды установленная DSDP необратима и медленно прогрессирует. На этом этапе строгий контроль уровня глюкозы не дает клинически значимого улучшения с точки зрения пациента, несмотря на умеренное улучшение в исследованиях порога вибрации и нервной проводимости.
На основе исследований, которые выявили метаболические нарушения, были изучены различные потенциальные методы лечения, например, ингибиторы альдозоредуктазы, добавки мио-инозита, α-липоевая кислота и введение фактора роста нервов, но ни один из них не оказал достаточного влияния на DSDP. быть одобренным в качестве конкретного длительного лечения. Трансплантация поджелудочной железы приносит реальную пользу только тем, у кого развитая почечная недостаточность и которым может быть проведена комбинированная трансплантация почки и поджелудочной железы, несмотря на исследования, которые показали, что трансплантация поджелудочной железы может остановить прогрессирование DSDP.
быть одобренным в качестве конкретного длительного лечения. Трансплантация поджелудочной железы приносит реальную пользу только тем, у кого развитая почечная недостаточность и которым может быть проведена комбинированная трансплантация почки и поджелудочной железы, несмотря на исследования, которые показали, что трансплантация поджелудочной железы может остановить прогрессирование DSDP.
Лечению боли, связанной с DSDP, в последнее десятилетие уделялось значительное внимание, но это все еще представляет собой один из самых сложных аспектов лечения, поскольку не существует единого эффективного лечения. Список одобренных лекарств увеличивается, но часто он основан на данных краткосрочных испытаний – например, на внутривенное введение α-липоевой кислоты, которой была предоставлена лицензия на использование при болезненном DSDP в Германии, но не в Великобритании.
При таком разнообразии доступных лекарств лучший способ подойти к лечению боли при DSDP – это иметь последовательность предпочтительных лекарств (часто диктуемых личным опытом) и, где возможно, придерживаться монотерапии (таблица 7). Хотя употребление опиатов часто осуждается, они действительно играют роль там, где антидепрессанты и противосудорожные препараты не работают или обеспечивают лишь умеренное обезболивание. Трамадол (до 400 мг / день) – лучший опиат, с которого можно начать, и при определенных обстоятельствах может потребоваться морфин.
Хотя употребление опиатов часто осуждается, они действительно играют роль там, где антидепрессанты и противосудорожные препараты не работают или обеспечивают лишь умеренное обезболивание. Трамадол (до 400 мг / день) – лучший опиат, с которого можно начать, и при определенных обстоятельствах может потребоваться морфин.
Таблица 7
Лечение болезненного DSDP
ФОКУСНЫЕ И МНОГОФОКАЛЬНЫЕ НЕВРОПАТИИ
Эту группу невропатий не следует рассматривать изолированно, поскольку они часто сосуществуют с DSDP.Однако их этиология, вероятно, будет различаться, при этом фокальные и мультифокальные невропатии имеют выраженный сосудистый компонент или компрессионную этиологию, в отличие от преобладающего метаболического компонента в DSDP.
Черепные невропатии
Паралич шестого нерва, связанный с диабетом, встречается у пожилых пациентов и не представляет большой диагностической дилеммы. Начало внезапное и обычно безболезненное. Полное выздоровление в подавляющем большинстве случаев происходит в течение 3-5 месяцев.Детальные исследования требуются редко.
Начало внезапное и обычно безболезненное. Полное выздоровление в подавляющем большинстве случаев происходит в течение 3-5 месяцев.Детальные исследования требуются редко.
Паралич третьего нерва встречается не так часто, как паралич шестого нерва, но опять же, как правило, наблюдается у пациентов старше 50 лет, у большинства из которых есть доказательства DSDP. В 50% случаев начало связано с ретроорбитальной болью, которая может сохраняться в течение нескольких дней. Ключевой особенностью является то, что паралич щадит зрачок, возможно, потому, что зрачковые волокна III-го нерва расположены на внешних слоях пучка, и ишемия имеет тенденцию поражать центр пучка.
Хотя паралич III-го нерва, спасающий зрачок, возникает из-за аневризмы задней соединительной артерии очень редко, поскольку такая возможность существует, рекомендуется визуализация (магнитно-резонансная / компьютерная томографическая ангиография). При диабетическом параличе III-го нерва визуализация обычно является нормальной, хотя было высказано предположение, что небольшие инфаркты мезэнцефалии могут быть альтернативным объяснением. Никакого специального лечения не требуется, кроме призматической помощи при диплопии, когда птоз восстанавливается.Полное разрешение обычно происходит в течение 3–6 месяцев.
Никакого специального лечения не требуется, кроме призматической помощи при диплопии, когда птоз восстанавливается.Полное разрешение обычно происходит в течение 3–6 месяцев.
Мононевропатии конечностей
Диабетические нервы, по-видимому, более подвержены компрессионному повреждению, хотя, почему именно это так, не совсем понятно. Лечение невропатии защемления (синдром запястного канала, локтевая нейропатия или обычная малоберцовая нейропатия) должно проводиться в соответствии с теми же рекомендациями, что и у пациентов, не страдающих диабетом (см. Fuller, p ii20). Если компрессия нерва вызывает проблемы с точки зрения симптомов, особенно если имеется связанная с этим мышечная слабость, необходима декомпрессия.Результаты декомпрессивной хирургии не так хороши, как у пациентов, не страдающих диабетом.
Диабетическая стволовая радикулоневропатия
Это явление наблюдается у диабетиков как 1, так и 2 типа, обычно в среднем или пожилом возрасте.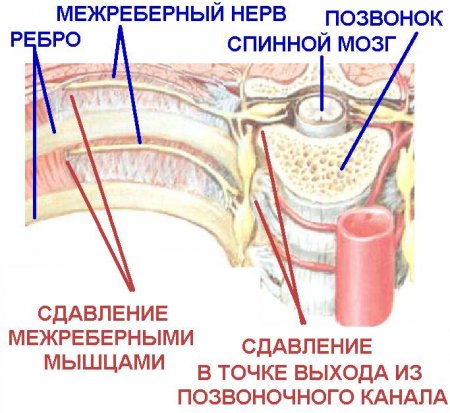 Основные характеристики представлены в таблице 8. Диагноз ставится на основании клинических данных, но признаки денервации могут быть обнаружены в брюшной стенке, межреберных или параспинальных мышцах в той области, где возникла боль и / или потеря чувствительности.Внезапное начало и спонтанное выздоровление предполагают сосудистую этиологию, но нельзя исключить «воспалительную» этиологию, поскольку она может сосуществовать с диабетической пояснично-крестцовой невропатией радикулоплексуса (см. Ниже).
Основные характеристики представлены в таблице 8. Диагноз ставится на основании клинических данных, но признаки денервации могут быть обнаружены в брюшной стенке, межреберных или параспинальных мышцах в той области, где возникла боль и / или потеря чувствительности.Внезапное начало и спонтанное выздоровление предполагают сосудистую этиологию, но нельзя исключить «воспалительную» этиологию, поскольку она может сосуществовать с диабетической пояснично-крестцовой невропатией радикулоплексуса (см. Ниже).
Таблица 8
Диабетическая стволовая радикулоневропатия: особенности клиники
Управление включает в себя контроль боли; местный капсаицин полезен, если пораженный участок небольшой и хорошо локализован. Обычно полное выздоровление занимает несколько месяцев.
Диабетическая пояснично-крестцовая радикулоплексическая нейропатия (синдром Брунса-Гарланда)
Это клиническое заболевание, ранее называвшееся диабетической амиотрофией, имело множество других названий.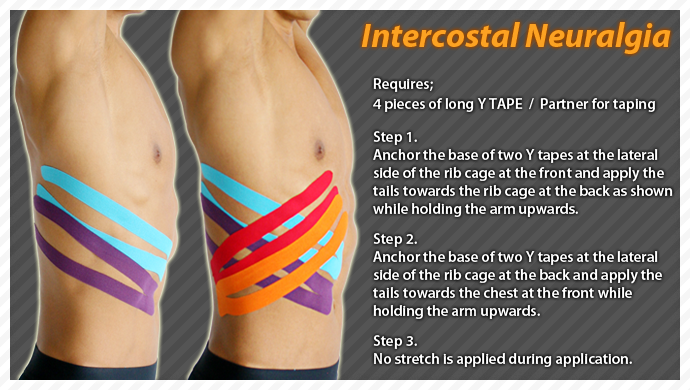 Самая последняя попытка определить это состояние в некоторой степени затруднительна для повседневного клинического использования, и может быть проще использовать эпоним «синдром Брунса-Гарланда» (в честь Брунса, который впервые описал синдром в 1890 году, и Гарленда, который открыл его заново, и ввел термин «амиотрофия»).Чаще всего встречается у пожилых пациентов с СД 2 типа и редко встречается у пациентов с СД 1 типа.
Самая последняя попытка определить это состояние в некоторой степени затруднительна для повседневного клинического использования, и может быть проще использовать эпоним «синдром Брунса-Гарланда» (в честь Брунса, который впервые описал синдром в 1890 году, и Гарленда, который открыл его заново, и ввел термин «амиотрофия»).Чаще всего встречается у пожилых пациентов с СД 2 типа и редко встречается у пациентов с СД 1 типа.
Клинические признаки представлены в таблице 9. Развитие симптомов может быть весьма разнообразным и может прогрессировать до генерализованного пареза нижних конечностей («диабетическая параплегия»). Клинически неотличимый синдром возникает у пациентов без диабета.
Таблица 9
Диабетическая пояснично-крестцовая радикулоплексическая нейропатия (синдром Брунса-Гарланда): клинические особенности и исследования
Основной дифференциальный диагноз, который следует учитывать, – это инфильтративное злокачественное новообразование таза, особенно при значительной потере веса и односторонней слабости. Подобную картину можно рассматривать как осложнение лучевой терапии. Если нет боли, связанной с прогрессирующей асимметричной слабостью ног, диагноз, скорее всего, будет ХВДП.
Подобную картину можно рассматривать как осложнение лучевой терапии. Если нет боли, связанной с прогрессирующей асимметричной слабостью ног, диагноз, скорее всего, будет ХВДП.
Приведены предлагаемые исследования (таблица 9). Нейрофизиология полезна, но исследование спинномозговой жидкости и биопсию нерва следует рассматривать только в том случае, если рассматривается альтернативный диагноз. Исследование биопсии нервов показало признаки микроваскулита и эндоневральной воспалительной инфильтрации, но эти данные не влияют на лечение.Неясно, являются ли эти воспалительные изменения первичными или вторичными по отношению к возможному ишемическому повреждению.
По-видимому, реже встречается нейропатия плечевого радикулоплексуса, связанная с синдромом Брунса-Гарланда у пациентов с диабетом.
Первоначально лечение сосредоточено на обезболивании (таблица 8). Это может быть сложно и часто требует опиатов. Физиотерапия и ортопедическая оценка полезны в отдельных, часто более тяжелых случаях.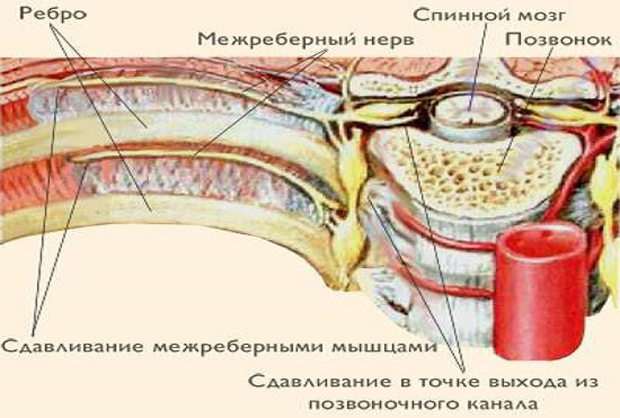 Хотя предполагаемым патогенным механизмом является воспалительное изменение в нерве или эпиневриальных сосудах, не установлено, играет ли иммуносупрессия (стероиды или внутривенный иммуноглобулин) какую-либо роль в лечении синдрома, который в конечном итоге самопроизвольно восстанавливается, хотя и может быть неполным. у ряда больных.
Хотя предполагаемым патогенным механизмом является воспалительное изменение в нерве или эпиневриальных сосудах, не установлено, играет ли иммуносупрессия (стероиды или внутривенный иммуноглобулин) какую-либо роль в лечении синдрома, который в конечном итоге самопроизвольно восстанавливается, хотя и может быть неполным. у ряда больных.
Стимуляция периферических нервов при нейропатической боли
Стимуляция периферических нервов (ПНС) – это уникальный метод нейромодуляции, который быстро набирает популярность в различных клинических условиях.Несмотря на свою простую природу, этот метод долгое время рассматривался как «пасынок» в области нейромодуляции, ставя в центр внимания более распространенные методы стимуляции спинного мозга (SCS) и более элегантные подходы к глубокой стимуляции мозга (DBS). Интересно, что главное теоретическое объяснение нейромодулирующего лечения боли, «теория контроля ворот» Мелзака и Уолла 1 , было впервые проиллюстрировано на примере ПНС, когда смелые исследователи смогли подавить восприятие боли с помощью собственной электрической стимуляции. подглазничные нервы с помощью электродов, вводимых через кожу. 2
подглазничные нервы с помощью электродов, вводимых через кожу. 2
С момента своего появления в конце 1960-х годов система PNS прошла несколько стадий развития. 3 Хотя было много центров энтузиазма и клинических серий, описывающих использование ПНС при различных состояниях невропатической боли, этот метод не стал популярным более 30 лет. Сложность процедур PNS с необходимостью обнажить целевой нерв и закрепить стимулирующий электрод, а также непредсказуемость результатов PNS, а также отсутствие специального и одобренного оборудования для PNS привели к тому, что они не получили широкого распространения.Однако даже в 1970-х и 1980-х годах несколько больших серий показали полезность ПНС в лечении нейропатических болевых синдромов, включая хроническую боль, связанную с повреждением периферических нервов, и комплексные региональные болевые синдромы. 4–9
Ситуация изменилась в конце 1990-х годов, когда Вайнер и Рид описали чрескожный доступ к ПНС. 10 Простота и элегантность хирургической процедуры, которая не требовала значительного воздействия для достижения прямого контакта между нервом и электродом, а вместо этого позволяла помещать электрод рядом с нервом, который нужно стимулировать, произвела революцию в этой области.Среди прочего, внедрение чрескожного доступа дало возможность использовать ПНС специалистам по боли, имеющим опыт анестезии или физиотерапии, тогда как в прошлом этот метод был доступен только нейрохирургам, ортопедам и пластическим хирургам, которые чувствовали себя комфортно при обнажении и иссечении периферических сосудов. нервы.
10 Простота и элегантность хирургической процедуры, которая не требовала значительного воздействия для достижения прямого контакта между нервом и электродом, а вместо этого позволяла помещать электрод рядом с нервом, который нужно стимулировать, произвела революцию в этой области.Среди прочего, внедрение чрескожного доступа дало возможность использовать ПНС специалистам по боли, имеющим опыт анестезии или физиотерапии, тогда как в прошлом этот метод был доступен только нейрохирургам, ортопедам и пластическим хирургам, которые чувствовали себя комфортно при обнажении и иссечении периферических сосудов. нервы.
Определение стимуляции периферических нервов
ПНС в чистом смысле слова традиционно относится к модальности, при которой электрические импульсы доставляются непосредственно к периферическому нерву.В прошлом это включало хирургическое исследование нерва и размещение электродной решетки непосредственно на нем – с использованием либо плоской лопатки, которая касалась нерва или отделялась от него тонким фасциальным слоем, либо спирального электрода, который можно было обернуть вокруг нерва. нервный ствол. Независимо от интерфейса электрод / нерв, принцип PNS остается неизменным, и когда применяется стимуляция, парестезии (приятное ощущение, описываемое как покалывание или тепло) ощущаются в распределении сенсорного представления стимулированного нерва.
нервный ствол. Независимо от интерфейса электрод / нерв, принцип PNS остается неизменным, и когда применяется стимуляция, парестезии (приятное ощущение, описываемое как покалывание или тепло) ощущаются в распределении сенсорного представления стимулированного нерва.
Аналогичным образом, современные применения ПНС в лечении боли вызывают парестезии в дистальных областях тела, которые представляют собой сенсорное покрытие нерва. Лучшими примерами такого принципа может быть стимуляция затылочных нервов, когда парестезии ощущаются на всем пути к макушке черепа или лобной линии роста волос, а электрод расположен над краниоцервикальным переходом, или стимуляция подглазничного нерва, вызывающая парестезии. в верхних зубах и верхней губе, когда электрод перемещается рядом с подглазничным отверстием.В отличие от истинной ПНС, недавно введенные концепции подкожной нейромодуляции, 11 подкожная периферическая нейростимуляция (SPNS), 12 стимуляция периферического нервного поля (PNFS), 13 периферическая подкожная нейростимуляция (PSNS), 14 и Стимуляция периферического подкожного поля (PSFS) 15 относится к стимуляции меньших нервов или даже нервных окончаний, при этом парестезии ощущаются в непосредственной близости от самого электрода. Поскольку эти концепции (PNS и PNFS / SPNS / PSNS / PSFS) могут в некоторой степени совпадать, и поскольку ни одна из них в настоящее время не имеет одобрения регулирующих органов в США (европейское одобрение было получено в 2010 году двумя разными компаниями), существует определенный элемент. путаницы в литературе относительно терминологии. Этот вопрос уже рассматривался в многочисленных публикациях 16–18 , но продолжает оставаться предметом разногласий на профессиональных конференциях, поскольку не существует единого мнения о том, где проводить черту (и нужно ли ее проводить) между ними. два подхода.
Поскольку эти концепции (PNS и PNFS / SPNS / PSNS / PSFS) могут в некоторой степени совпадать, и поскольку ни одна из них в настоящее время не имеет одобрения регулирующих органов в США (европейское одобрение было получено в 2010 году двумя разными компаниями), существует определенный элемент. путаницы в литературе относительно терминологии. Этот вопрос уже рассматривался в многочисленных публикациях 16–18 , но продолжает оставаться предметом разногласий на профессиональных конференциях, поскольку не существует единого мнения о том, где проводить черту (и нужно ли ее проводить) между ними. два подхода.
Механизм действия
Интересно, что, несмотря на долгую историю клинического применения ПНС, механизм его действия остается довольно неясным. 19 Оригинальное объяснение, являющееся краеугольным камнем теории боли при контроле ворот, постулировало, что антеградная (ортодромная) стимуляция не ноцицептивных нервных волокон Aβ приводит к активации тех же интернейронов в поверхностных слоях (пластинки Rexed 2 и 3) дорсальный рог спинного мозга, которые участвуют в обработке и передаче ноцицептивной информации, доставляемой периферическими нервными волокнами Aβ и C. Такая безболезненная стимуляция, обеспечиваемая ПНС, подавляет интернейроны и прерывает или снижает передачу болевых сигналов. 1 Дополнительные модификации полувековой теории усилили ее за счет более сложных возбуждающих и тормозных взаимодействий, но общий принцип остается тем же. 20 Другое возможное объяснение сочетает в себе электрические и нейрогуморальные эффекты стимуляции, поскольку периферическая стимуляция может изменять локальные концентрации важных химических веществ, таких как нейротрансмиттеры и эндорфины, и усиливать местный кровоток, который может способствовать возникновению хронической боли. 5,19
Такая безболезненная стимуляция, обеспечиваемая ПНС, подавляет интернейроны и прерывает или снижает передачу болевых сигналов. 1 Дополнительные модификации полувековой теории усилили ее за счет более сложных возбуждающих и тормозных взаимодействий, но общий принцип остается тем же. 20 Другое возможное объяснение сочетает в себе электрические и нейрогуморальные эффекты стимуляции, поскольку периферическая стимуляция может изменять локальные концентрации важных химических веществ, таких как нейротрансмиттеры и эндорфины, и усиливать местный кровоток, который может способствовать возникновению хронической боли. 5,19
В дополнение к этому, ПНС может напрямую изменять возбудимость периферических нервных волокон. 21 Недавнее экспериментальное исследование на людях-добровольцах показало, что прямая стимуляция периферического нерва подавляет нейротрансмиссию, о чем свидетельствуют повышенные пороги ноцицептивной стимуляции. 22 Однако механизм подавления боли, вероятно, будет более сложным, чем простое периферическое и спинномозговое торможение. Множественные нейровизуализационные исследования убедительно указывают на наличие центральных механизмов действия ПНС.Они включают как подавление активности в мозговых цепях, обрабатывающих боль, так и активацию тех областей, которые участвуют в нисходящей системе контроля и модуляции боли. 23
Множественные нейровизуализационные исследования убедительно указывают на наличие центральных механизмов действия ПНС.Они включают как подавление активности в мозговых цепях, обрабатывающих боль, так и активацию тех областей, которые участвуют в нисходящей системе контроля и модуляции боли. 23
Общие показания
Тот простой факт, что периферическая нервная система снабжает все тело человека, означает применимость подхода PNS практически к каждому локализованному болевому синдрому. На протяжении многих лет ПНС успешно применялась для лечения боли как в верхних, так и в нижних конечностях, 24 в туловище, включая нижнюю часть спины, живот и паховую область, в грудной стенке спереди и сзади (после стернотомии) боль и межреберные невралгии), 25,26 и в краниофациальной области. 10,27–29
Первоначальное использование ПНС было направлено на пациентов с болезненными периферическими невропатиями конечностей, в основном из-за травматического повреждения нерва, который впоследствии был выбран в качестве мишени для стимуляции. Это привело к принятию ПНС в лечении хронической боли из-за послеоперационной нейропатии или невропатии, а также сложных региональных болевых синдромов, как типа 1 (ранее известная как рефлекторная симпатическая дистрофия), так и 2 (каузалгия). 30–36 Хроничность и тяжесть боли, а также неэффективность менее инвазивных подходов были признаны необходимыми критериями при отборе пациентов.С самого начала стало ясно, что лучше всего реагируют на ПНС те пациенты, у которых боль опосредована в первую очередь сенсорными нервами, поскольку смешанные и преимущественно двигательные нервы плохо переносят ПНС, поскольку двигательные явления, вызванные стимуляцией, предотвращают увеличение амплитуды, необходимое для подавления боли. . 8
Это привело к принятию ПНС в лечении хронической боли из-за послеоперационной нейропатии или невропатии, а также сложных региональных болевых синдромов, как типа 1 (ранее известная как рефлекторная симпатическая дистрофия), так и 2 (каузалгия). 30–36 Хроничность и тяжесть боли, а также неэффективность менее инвазивных подходов были признаны необходимыми критериями при отборе пациентов.С самого начала стало ясно, что лучше всего реагируют на ПНС те пациенты, у которых боль опосредована в первую очередь сенсорными нервами, поскольку смешанные и преимущественно двигательные нервы плохо переносят ПНС, поскольку двигательные явления, вызванные стимуляцией, предотвращают увеличение амплитуды, необходимое для подавления боли. . 8
Эти основные периферические нервы традиционно подвергались хирургическому вмешательству не только из-за их глубокого расположения в мягких тканях, но и из-за частой близости сосудистых структур.Вопрос о локализации нервных стволов и разграничении прилегающих сосудистых структур был решен с введением ультразвукового контроля во время чрескожного введения электродов ПНС. 37,38 Возрождение открытой хирургии для очень специфических случаев боли из-за повреждения периферических нервов – вызванных наличием постампутационных неврином – ожидается с разработкой новой специализированной системы PNS со специальными электродами в форме манжеты. который сейчас проходит клинические испытания (неопубликованные данные).
37,38 Возрождение открытой хирургии для очень специфических случаев боли из-за повреждения периферических нервов – вызванных наличием постампутационных неврином – ожидается с разработкой новой специализированной системы PNS со специальными электродами в форме манжеты. который сейчас проходит клинические испытания (неопубликованные данные).
При лечении хронической боли в конечностях открытый хирургический доступ остается «золотым стандартом» в достижении периферических нервов, о чем свидетельствуют недавно опубликованные большие серии клинических исследований из Израиля и Австралии 35,36 и уникально длительное наблюдение. в группе пациентов, которым имплантировали в 1980-х годах в Бельгии. 39 В данном случае чрескожный доступ только начинает получать признание, о чем свидетельствуют отдельные отчеты с использованием PNS как на верхних 40,41 , так и на нижних 37,38,42 конечностях.Хроническая невропатическая боль в шее, груди, животе, пояснице и тазу успешно лечится с помощью PNS и PNFS. Имеются опубликованные отчеты об использовании PNS / PNFS при локальной боли в шее; 14,15 Боль в грудной стенке из-за межреберной невралгии 43 и после стернотомии, 44 торакотомия, 45 перелом лопатки, 46 и грудная миелопатия; 47 брюшная 13,48 и паховая 49 боль; Боль в пояснице – с использованием чрескожных электродов, имплантированных близко к области боли, 12,50 чрескожных электродов, имплантированных далеко друг от друга (так называемая концепция «перекрестного разговора»), 51 комбинация эпидуральной анестезии. и периферийные электроды, 25,52 и лопастные электроды; 53 и тазовая боль и кокцигодиния. 54
Имеются опубликованные отчеты об использовании PNS / PNFS при локальной боли в шее; 14,15 Боль в грудной стенке из-за межреберной невралгии 43 и после стернотомии, 44 торакотомия, 45 перелом лопатки, 46 и грудная миелопатия; 47 брюшная 13,48 и паховая 49 боль; Боль в пояснице – с использованием чрескожных электродов, имплантированных близко к области боли, 12,50 чрескожных электродов, имплантированных далеко друг от друга (так называемая концепция «перекрестного разговора»), 51 комбинация эпидуральной анестезии. и периферийные электроды, 25,52 и лопастные электроды; 53 и тазовая боль и кокцигодиния. 54
Боль в пояснице, являющаяся наиболее распространенным из синдромов туловищной боли, была предметом недавнего многоцентрового исследования результатов, проведенного в общенациональном масштабе в Австрии. 55 В этом исследовании клинические исходы 111 пациентов с очаговой нераковой болью были ретроспективно проанализированы в течение как минимум трех месяцев после постоянной имплантации. Шестьдесят шесть из этих 111 пациентов страдали либо болью в пояснице, либо болью в спине с болью в ногах из-за синдрома неудачной операции на спине; остальные страдали от боли в шее, постгерпетической невралгии, боли в грудной клетке, головной боли напряжения и лицевой боли.Общее уменьшение боли составило более 50% (снижение с 8,2 до 4,0 по числовой шкале от 0 до 10) для всей группы. В дополнение к этому в группе стимулированных пациентов наблюдалось стойкое снижение потребности в анальгетиках. 55 Несмотря на ретроспективный характер этого исследования и 24% наблюдаемых осложнений, 55 его результаты, наряду с другим исследованием, в котором изучалась эффективность комбинированных SCS и PNFS в лечении боли в пояснице и ногах в серии 20 последовательных пациентов, 52 позволили Medtronic получить знак Conformité Européenne (CE) за свою 16-электродную полностью имплантируемую систему для чрескожной доставки PNS для лечения хронической боли в спине в мае 2011 года.
Шестьдесят шесть из этих 111 пациентов страдали либо болью в пояснице, либо болью в спине с болью в ногах из-за синдрома неудачной операции на спине; остальные страдали от боли в шее, постгерпетической невралгии, боли в грудной клетке, головной боли напряжения и лицевой боли.Общее уменьшение боли составило более 50% (снижение с 8,2 до 4,0 по числовой шкале от 0 до 10) для всей группы. В дополнение к этому в группе стимулированных пациентов наблюдалось стойкое снижение потребности в анальгетиках. 55 Несмотря на ретроспективный характер этого исследования и 24% наблюдаемых осложнений, 55 его результаты, наряду с другим исследованием, в котором изучалась эффективность комбинированных SCS и PNFS в лечении боли в пояснице и ногах в серии 20 последовательных пациентов, 52 позволили Medtronic получить знак Conformité Européenne (CE) за свою 16-электродную полностью имплантируемую систему для чрескожной доставки PNS для лечения хронической боли в спине в мае 2011 года.
Неудивительно, что значительный сдвиг в показаниях для ПНС совпал с введением техник чрескожного введения, когда лечение черепно-лицевых болевых синдромов стало поддающимся вмешательству ПНС. До этого обнажение ветвей тройничного нерва 56 и затылочных нервов 7,9,27 , обеспечивающих сенсорное питание области головы и лица, было технически сложной задачей. Но когда установка электрода стала такой же простой, как введение направляющей иглы в эпифасциальную плоскость 10, многие центры начали использовать чрескожную ПНС для лечения всех видов нейропатической боли в черепно-лицевой области. 57–61 В основном из отдельных сообщений были изучены различные показания, такие как супраорбитальная невралгия, подглазничная нейропатическая боль, постгерпетическая невралгия в распределении глазного нерва и затылочная боль, вызванная послеоперационной невромой. На основании этого опыта были собраны и представлены более крупные серии пациентов. Они включали невралгию тройничного нерва, 62–64 затылочную невралгию, лечившуюся чрескожными 65 и лопастными электродами, 66–68 и, наконец, хронические цервикогенные головные боли и мигрени.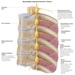 29,66,69–72
29,66,69–72
Использование PNS для лечения мигрени, которое началось с публикации Popeney and Aló. 69 немедленно привлекло внимание как имплантирующего сообщества, так и производителей устройств, поскольку распространенность мигрени и процент трудноизлечимых с медицинской точки зрения случаев делают это показание потенциально большим, чем все другие текущие показания вместе (за исключением другого потенциального показания ПНС – боли в пояснице). Впоследствии все три крупные компании в области нейромодуляции (Medtronic Neuromodulation, Миннеаполис, Миннесота; St Jude Neuromodulation, Плано, Техас; и Boston Scientific Neuromodulation, Валенсия, Калифорния) начали проспективные контролируемые исследования, изучающие возможность и эффективность стимуляции затылочного нерва в лечении трудноизлечимых заболеваний. мигрени. 73–75 Результаты всех трех исследований в целом были положительными, и, в конце концов, PNS была одобрена для лечения трудноизлечимой мигрени в Европе (на момент написания статьи St Jude Medical получила одобрение European CE Mark для своего продукта GenesisTM. система нейростимуляции для ПНС затылочных нервов для управления болью и инвалидностью, связанной с трудноизлечимой хронической мигренью).
система нейростимуляции для ПНС затылочных нервов для управления болью и инвалидностью, связанной с трудноизлечимой хронической мигренью).
В дополнение к затылочной ПНС, мигрени успешно лечили с помощью комбинации надглазничных и затылочных электродов 76,77 и, в последнее время, с помощью двусторонней стимуляции ушно-височного нерва. 78 Обоснование здесь состоит в том, что стимуляция оказывается наиболее эффективной, когда применяется к области максимальной боли, и поэтому некоторым пациентам будет больше пользы от индивидуального подхода к установке электродов ПНС, поскольку локализация головной боли у страдающих мигренью имеет тенденцию включать различные части. головы.
Менее распространенными, но, возможно, даже более устойчивыми к лечению и определенно более инвалидизирующими в целом состояниями, которые лечатся с помощью ПНС, являются кластерные головные боли и континуальная гемикрания.Обе эти категории боли успешно лечились с помощью стимуляции затылочного нерва, 79–84 супраорбитальной ПНС, 85, стимуляции блуждающего нерва, 86 и, в последнее время, стимуляции клиновидно-небных ганглиев. 87 Здесь ПНС может быть менее инвазивной. альтернатива ранее введенному гипоталамическому DBS и, возможно, послужит первым шагом в нейромодулирующем лечении, оставляя DBS в качестве варианта для неудач PNS.
87 Здесь ПНС может быть менее инвазивной. альтернатива ранее введенному гипоталамическому DBS и, возможно, послужит первым шагом в нейромодулирующем лечении, оставляя DBS в качестве варианта для неудач PNS.
Наконец, последним и, возможно, самым неожиданным показанием ПНС для лечения боли стала диффузная боль при фибромиалгии. 88,89 Здесь, в первой группе из 12 пациентов, удовлетворяющих критериям фибромиалгии, была имплантирована затылочная ПНС для контроля затылочной головной боли – и, помимо улучшения тяжести головной боли, у пациентов было обнаружено значительное улучшение показателей телесная боль, депрессия, усталость и качество жизни. 88 После этого успеха в предполагаемой неконтролируемой когорте та же группа исследователей имплантировала еще 11 пациентам с фибромиалгией, а затем стимулировала их перекрестным способом, контролируемым плацебо. 90 Результаты этого исследования показали, что девяти из 11 пациентов была выполнена постоянная имплантация и что через шесть месяцев наблюдения наблюдалось общее снижение боли на 45% и значительное уменьшение количества положительных триггерных точек и общий балл по опроснику воздействия фибромиалгии, что позволяет авторам заключить, что результаты исходного проспективного исследования были подтверждены плацебо-контролируемым образом. 90
90
Технические детали и осложнения
Самая привлекательная часть подхода PNS – его низкая инвазивность.Вместо того, чтобы вводить электроды в мозг пациента или над ним, как при DBS или стимуляции моторной коры, или в спинальное эпидуральное пространство, как при SCS или стимуляции нервных корешков, весь массив электродов располагается в непосредственной близости от стимулируемого периферического нерва. В случае PNFS электрод вводится подкожно в области максимальной боли. Такой подход неизбежно приводит к повышению безопасности – и, хотя есть много отчетов, описывающих различные осложнения, возникающие при использовании процедур PNS и PNFS, 91–95 большинство этих осложнений незначительны и не представляют угрозы для жизни. или неврологическая функция оперированного пациента.
На самом деле, наиболее вероятной причиной более высокого уровня осложнений ПНС является отсутствие специального оборудования, поскольку ПНС для лечения хронической боли в основном выполняется с помощью устройств, разработанных и проданных для применения в СКС. 95 Тем не менее, стоит упомянуть, что пациентов следует регулярно информировать о том, что их системы PNS могут работать со сбоями, компоненты оборудования могут быть сломаны или отключены, они могут разъедать кожу и / или инфицироваться, а электроды могут вызывать мышечные спазмы или мигрировать из своего оптимального местоположения, что требует перепрограммирования или изменения положения.Похоже, что некоторые из этих осложнений можно разрешить без дополнительной операции, но даже в тех случаях, когда операция необходима для ревизии, замены или удаления пораженного устройства, ее можно безопасно провести в амбулаторных условиях с минимальной болезненностью, если таковая имеется. .
95 Тем не менее, стоит упомянуть, что пациентов следует регулярно информировать о том, что их системы PNS могут работать со сбоями, компоненты оборудования могут быть сломаны или отключены, они могут разъедать кожу и / или инфицироваться, а электроды могут вызывать мышечные спазмы или мигрировать из своего оптимального местоположения, что требует перепрограммирования или изменения положения.Похоже, что некоторые из этих осложнений можно разрешить без дополнительной операции, но даже в тех случаях, когда операция необходима для ревизии, замены или удаления пораженного устройства, ее можно безопасно провести в амбулаторных условиях с минимальной болезненностью, если таковая имеется. .
Большинство используемых сегодня чрескожных электродов имеют четыре или восемь цилиндрических контактов, расположенных вдоль одного проволочного вывода. Ожидается, что в будущем количество контактов вырастет до 12 или даже 16, что увеличит длину потенциальных целей стимуляции.Эти чрескожные электроды могут быть имплантированы через иглу, которая вводится под кожу в эпифасциальной плоскости. Лопастные электроды больше и, как правило, более стабильны; здесь плоские металлические контакты (четыре, восемь или 16 на электрод) расположены на твердой пластиковой основе, которая изолирует окружающие ткани. Среди их преимуществ – меньшая частота миграции и однонаправленный характер стимуляции, которая направляет электрические сигналы на стимулируемый нерв и от соседних чувствительных тканей.Эти электроды, однако, обычно требуют открытого хирургического воздействия на нерв или стимулируемую область; их также труднее удалить, если такое удаление потребуется в будущем.
Лопастные электроды больше и, как правило, более стабильны; здесь плоские металлические контакты (четыре, восемь или 16 на электрод) расположены на твердой пластиковой основе, которая изолирует окружающие ткани. Среди их преимуществ – меньшая частота миграции и однонаправленный характер стимуляции, которая направляет электрические сигналы на стимулируемый нерв и от соседних чувствительных тканей.Эти электроды, однако, обычно требуют открытого хирургического воздействия на нерв или стимулируемую область; их также труднее удалить, если такое удаление потребуется в будущем.
Подобно процедуре SCS, PNS и PNFS начинаются с тщательного отбора пациентов и обязательной (в большинстве практик) психологической оценки. Заключительным этапом перед имплантацией постоянного устройства является пробная стимуляция, когда временные электроды вставляются и проверяются на эффективность и побочные эффекты. Такое испытание обычно длится от трех до семи дней, хотя в некоторых центрах, особенно в европейских странах, оно может длиться до двух месяцев. В течение испытательного периода пациенты определяют преимущества стимуляции, помогая им оценить ожидания и определить, оправдана ли постоянная имплантация. На протяжении всего испытания пациенты остаются подключенными к внешнему устройству для скрининга, которое обладает большинством функций стимуляции, которая будет осуществляться имплантированным генератором в случае успеха испытания. В конце этого испытания временные электроды удаляются (если испытание не удается) или заменяются постоянными (если испытание прошло успешно).Постоянные электроды PNS / PNFS закрепляются на месте, а затем туннелируются к имплантируемому генератору импульсов (IPG), который обычно размещается на некотором расстоянии от стимулируемой области. Устройство IPG может иметь первичный элемент или быть перезаряжаемым – эта возможность подзарядки позволяет уменьшить объем устройства и продлить срок его службы, но обычно стоит немного дороже и требует активного участия / обслуживания со стороны пациента, который должен подзарядить IPG на регулярной основе.
В течение испытательного периода пациенты определяют преимущества стимуляции, помогая им оценить ожидания и определить, оправдана ли постоянная имплантация. На протяжении всего испытания пациенты остаются подключенными к внешнему устройству для скрининга, которое обладает большинством функций стимуляции, которая будет осуществляться имплантированным генератором в случае успеха испытания. В конце этого испытания временные электроды удаляются (если испытание не удается) или заменяются постоянными (если испытание прошло успешно).Постоянные электроды PNS / PNFS закрепляются на месте, а затем туннелируются к имплантируемому генератору импульсов (IPG), который обычно размещается на некотором расстоянии от стимулируемой области. Устройство IPG может иметь первичный элемент или быть перезаряжаемым – эта возможность подзарядки позволяет уменьшить объем устройства и продлить срок его службы, но обычно стоит немного дороже и требует активного участия / обслуживания со стороны пациента, который должен подзарядить IPG на регулярной основе. Сегодня на рынке представлено множество устройств и комбинаций оборудования, позволяющих имплантерам предлагать индивидуальные наборы электродов и генераторов в зависимости от местоположения боли, требований к стимуляции, характеристик пациента и т. Д. 95
Сегодня на рынке представлено множество устройств и комбинаций оборудования, позволяющих имплантерам предлагать индивидуальные наборы электродов и генераторов в зависимости от местоположения боли, требований к стимуляции, характеристик пациента и т. Д. 95
Перспективы развития
Похоже, что сегодня ПНС является наиболее быстрорастущей областью нейромодуляции. 96 В связи с недавним одобрением PNS в Европе для лечения хронической боли в пояснице и трудноизлечимой мигрени ожидается, что клинический интерес к этому методу будет продолжать расти. Среди прочего, это вселяет надежду на то, что теперь появятся некоторые столь необходимые объективные доказательства, которые определяют истинную эффективность ПНС, а также лучшие показания и наиболее подходящие параметры стимуляции.Сопутствующая исследовательская деятельность также может пролить свет на механизм действия ПНС, что затем приведет к дальнейшей индивидуализации лечения и, таким образом, к оптимизации ближайших и долгосрочных результатов. Более того, среди важных вопросов, которые остаются открытыми, стоит вопрос о рентабельности PNS, поскольку высокая стоимость имплантированных устройств должна быть оправдана с учетом постоянных усилий по сдерживанию расходов на здравоохранение.
Более того, среди важных вопросов, которые остаются открытыми, стоит вопрос о рентабельности PNS, поскольку высокая стоимость имплантированных устройств должна быть оправдана с учетом постоянных усилий по сдерживанию расходов на здравоохранение.
Что касается прогресса в самой области PNS, похоже, что он будет продолжаться во всех трех направлениях – новые показания, новые цели и новые устройства – каждое из которых заслуживает отдельной статьи из-за неограниченных возможностей, которые представляют эти направления.Одним из основных поворотных моментов в этом процессе станет официальное одобрение всего подхода через его одобрение регулирующими органами не только в Европе, но и во всем мире, особенно в США, которые сегодня представляют собой крупнейший рынок нейромодуляции. Такое одобрение позволит имплантологам использовать одобренные устройства по утвержденным показаниям – вместо того, чтобы делать это «не по назначению» – и в то же время даст производителям устройств возможность продавать эти устройства и поддерживать обучение по их рациональному использованию.

 Для лечения такой разновидности невралгии необходимо устранить ее первопричину и все внимание уделить лечению основного заболевания.
Для лечения такой разновидности невралгии необходимо устранить ее первопричину и все внимание уделить лечению основного заболевания.
 Чаще всего бывает спровоцирована длительным пребыванием на холоде, травмой или таким заболеванием, как остеохондроз.
Чаще всего бывает спровоцирована длительным пребыванием на холоде, травмой или таким заболеванием, как остеохондроз.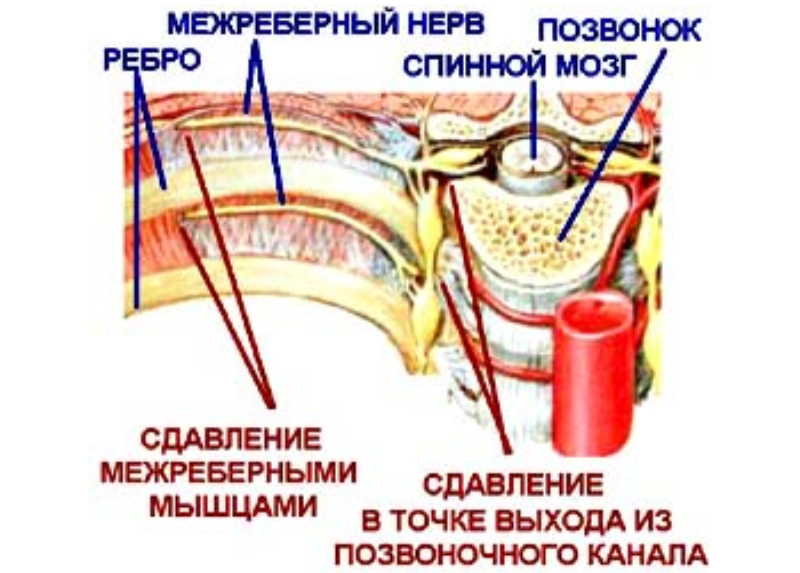

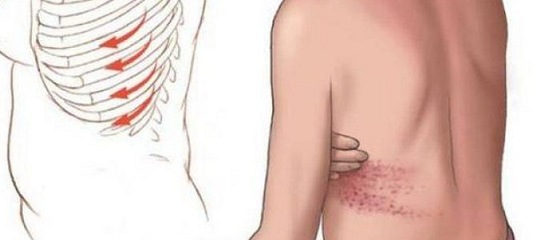 Клинические признаки семейного и несемейного амилоидоза будут очень похожи
Клинические признаки семейного и несемейного амилоидоза будут очень похожи