2 процентный раствор соды как приготовить: У малыша молочница полости рта. содовый раствор при лечении молочницы., быстрое средство от молочницы кандид для полости рта для детей
Молочница или по-научному кандидоз слизистых оболочек, у малышей чаще всего поражает полость рта. На слизистой щек и внутренней поверхности губ появляется белый налет в виде створоженного молока (белые комочки «творога», которые достаточно плохо снимаются, или белые пятнышки). Так же налет может появиться на верхнем небе и языке. Обычно страдают дети в возрасте от 1 месяца до полугода.
Вызывается заболевание грибком рода Кандида. Кандиды в норме живут на слизистой оболочке, но никак себя не проявляют. Они начинают «поднимать голову» при снижении общего иммунитета у ребенка и при пересушенности слизистых оболочек. Другими словами, молочница может возникнуть у малыша после перенесенного заболевания (чаще после лечения антибиотиками), когда иммунитет ослаблен борьбой с основным возбудителем. А так же она возникает если в помещении, где живет малыш, все время жарко и душно, воздух плохо увлажнен или если с ребеночком мало гуляют.
А так же она возникает если в помещении, где живет малыш, все время жарко и душно, воздух плохо увлажнен или если с ребеночком мало гуляют.
При молочнице полости рта ребенок испытывает достаточно неприятные ощущения. Это сильный зуд и чувство жжения во рту, у ребенка может значительно снизиться аппетит, ребенок капризничает и тащит в рот ручки и разные предметы, чтобы почесать слизистую рта.
Если ребенок находится на грудном вскармилвании, он может начать отказываться от груди.
Если не лечить молочницу, она распространится на всю полость рта и причинит много беспокойства вашему малышу. Более того, при поражении слизистой оболочки грибками ее защитный барьер снижается и может присоединиться вторичная инфекция. Поэтому лечение нужно начинать как можно раньше, когда вы заметили первые признаки молочницы.
Помочь в этой ситуации достаточно просто и быстро.
Самое простое и доступное средство при молочнице полости рта это содовый раствор (мой опыт использования положительный, помогает хорошо). Наберитесь терпения и приступайте.
Наберитесь терпения и приступайте.
Разведите чайную ложку пищевой соды в стакане кипяченой воды. Намотайте на палец кусочек марли (бинтик), смоченной в содовом растворе и протирайте полость рта ребенка (широкими «мазками» несколько раз меняя марлю на новую).Постарайтесь удалить весь налет! Иногда при снятии белого налета слизистая может немного кровоточить. Чтобы ребенок открыл ротик, большим пальцем свободной руки немного нажмите на подбородочек, и удерживайте его в таком положении. Хорошо обработайте щечную поверхность и внутреннюю поверхность верхней и нижней губ, небо и спинку языка. Процедуру нужно проводить проводить после каждого кормления ребенка! На ночь максимально сократить возможные кормления.
Принцип — «промыть» слизистую от остатков пищи. Даже если ребенок сосал молоко, на слизистой после этого все равно остается питательная среда для грибков. Протирая полость рта, вы не только лишаете грибки питания, но и подавляете их рост, потому что они не любят щелочную среду. А содовый раствор — щелочной. Если вы все делаете правильно, молочница «убежит „от вашего малыша уже через 3-4 дня. Нопротирания нужно продолжить еще в течении нескольких дней, поскольку недолеченная молочница возвращается.
А содовый раствор — щелочной. Если вы все делаете правильно, молочница «убежит „от вашего малыша уже через 3-4 дня. Нопротирания нужно продолжить еще в течении нескольких дней, поскольку недолеченная молочница возвращается.
Существуют и другие способы лечения молочницы. О них я могу сообщить лишь известные мне сведения, но опыта использования этих методов у меня нет. Это и применение меда ( мед разводят водой и протирают полость рта — необходимо помнить, что мед часто вызывает аллергию), и специальные лекарственные (противогрибковые) препараты. Противогрибковые препараты назначаются врачом, после осмотра вашего ребенка и принятия решения о необходимости назначения таких препаратов. Среди них капли кандид, нистатиновые, различные гели.
Об использовании пенициллина, для протирания полости рта: пенициллин — антибиотик и на грибки не действует! Если вы неуверены в чем-то, не занимайтесь самолечением, проконсультируйтесь с врачом.
Помните так же и о том, что для успешного лечения молочницы необходимо хорошо проветривать помещение, увлажнять воздух в комнате и больше гулять. Ребенок должен получать полноценное питание и витамины.
Ребенок должен получать полноценное питание и витамины.
Желаю здоровья вашему малышу и Вам!
кальцинированная и пищевая сода против росы, обработка содой с мылом и опрыскивание другими растворами с содой
Мучнистая роса – это грибковое заболевание, которым страдают многие виды растений. Данный недуг можно распознать по появлению на культуре белого налета. Больному представителю флоры потребуется оказать срочную помощь, в противном случае болезнь может усугубиться, став причиной гибели растения.
Особенности
Нередко садоводы замечают, что на цветах, сливе и других растениях появился серо-белый налет. Именно он свидетельствует о том, что на участке есть мучнистая роса. Этот опасный недуг можно победить химическими препаратами и народными средствами. В борьбе с заболеванием поможет сода, которая относится к безопасным и общедоступным веществам.
В борьбе с заболеванием поможет сода, которая относится к безопасным и общедоступным веществам.
Сода используется для лечения многих болезней растений, в том числе и мучнистой росы. Этим уникальным средством можно эффективно обеззаразить поверхность.
Такой продукт не наносит никакого вреда представителям флоры, поэтому относится к категории безопасных.
Сода необходима для уничтожения грибка, очистки растения, а также сохранения его здоровья. После воздействия соды на грибок последний не выживает. О том, что мучнистая роса побеждена, свидетельствует исчезновение белого налета.
Вот основные характеристики соды:
- простота использования;
- высокая эффективность;
- обеззараживающее действие;
- абсолютная безопасность для растений.
Как приготовить раствор?
Против мучнистой росы может использоваться как кальцинированная, так и пищевая сода. Как показывает практика, оба продукта дают хороший результат. Кальцинированная сода может быть опасной для представителей флоры, поэтому ею пользуются реже. При высокой концентрации продукта в растворе могут погибнуть не только цветы, но и овощи.
Как показывает практика, оба продукта дают хороший результат. Кальцинированная сода может быть опасной для представителей флоры, поэтому ею пользуются реже. При высокой концентрации продукта в растворе могут погибнуть не только цветы, но и овощи.
Питьевую соду стоит разводить в количестве 1-2 столовых ложек на 1000 мл воды. Кальцинированную соду можно развести в количестве 0,5 чайной ложки на 1 литр воды.
Высокая эффективность в борьбе с грибковым недугом наблюдается после орошения растений раствором соды с мылом.
Рецепт приготовления мыльно-содового раствора следующий:
- 4500 мл воды смешивают со столовой ложкой соды;
- в приготовленное средство вводят чайную ложку жидкого мыла;
- тщательно перемешивают все составляющие.
После приготовления раствор может использоваться по назначению несколько раз на сезон. Такой компонент, как жидкое мыло, способствует ускорению уничтожения мучнистой росы. После обработки культура обеззараживается, а грибок пропадает гораздо быстрее, нежели без добавления мыла. Содовый раствор с мылом предотвращает заражение садовых и огородных культур в последующем, а также отпугивает вредителей.
Такой компонент, как жидкое мыло, способствует ускорению уничтожения мучнистой росы. После обработки культура обеззараживается, а грибок пропадает гораздо быстрее, нежели без добавления мыла. Содовый раствор с мылом предотвращает заражение садовых и огородных культур в последующем, а также отпугивает вредителей.
Чтобы избавиться от мучнистой росы, иных вирусных и грибковых недугов на огурцах, смородине и других культурах, стоит воспользоваться рецептом содового раствора с йодом, мылом и препаратом «НВ-101».
На 10 л воды потребуется соблюдать следующие пропорции ингредиентов:
- 2 столовые ложки пищевой соды;
- 5 мл «Бетадина»;
- 2 столовые ложки жидкого мыла;
- 10 капель «НВ-101».
В качестве альтернативы «Бетадину» может использоваться обычный аптечный йод.
Таким «коктейлем» опрыскивают листву, стебли, плоды пораженных растений. Специалисты настоятельно не рекомендуют обрабатывать культуры во время их цветения.
Как применять?
Перед тем как начать обработку культуры от мучнистой росы при помощи соды, рекомендуется выполнить следующие действия.
- Сорвать с культуры всю пораженную листву и цветоносы. Если же болеет куст, то ему потребуется тотальная обрезка кроны, а также зачистка некоторых частей растения. В этом случае желательно уничтожить как можно больше веток и листьев, чтобы недуг не распространялся на здоровую растительность.

- Заменить верхний почвенный слой на участке или в контейнере, так как в нем могут находиться колонии грибковой инфекции.
- Осуществить опрыскивание культур. Не стоит забывать о поливе грунта лекарственными препаратами.
Обработку растительности содовым раствором стоит производить с правильной периодичностью, а именно: несколько раз за сезон. Компоненты должны быть хорошо перемешаны. Специалисты рекомендуют обрабатывать культуры, пользуясь садовым опрыскивателем.
Если распылитель отсутствует, то обработать кусты можно обычным веником. Последний требуется намочить в растворе и равномерно оросить культуру, включая стебель, листву, грунт около растения.
Оптимальным временем для проведения лечения является вечер либо раннее утро. Так лекарство на листве сохранится дольше. Помимо этого, лучше выбирать день, когда на улице стоит сухая погода, в противном случае избыток влаги может навредить и без того слабому представителю флоры.
Результат процедуры можно будет заметить уже через пару суток. Если на зеленых частях растения останутся очаги инфекции, то опрыскивание содой потребуется повторить.
О борьбе с мучнистой росой смотрите далее.
Сода от мучнистой росы | Дача
28 июля 2017
ditim Главная страница » Смотрим Просмотров:
6,702
От мучнистой росы страдают многие растения: крыжовник, смородина, огурцы, виноград, кабачки, лук, розы и другие. Проявляется это грибковое заболевание в виде белого налета на листьях и плодах. Распространению мучнистой росы способствуют погодные условия (пасмурная и влажная погода), плохая проветриваемость (например, в теплице), чрезмерный полив, тень. Поскольку лето в наших краях выдалось холодное и дождливое, вот такую «красоту» мы обнаружили в конце июля на листьях черной смородины.
Проявляется это грибковое заболевание в виде белого налета на листьях и плодах. Распространению мучнистой росы способствуют погодные условия (пасмурная и влажная погода), плохая проветриваемость (например, в теплице), чрезмерный полив, тень. Поскольку лето в наших краях выдалось холодное и дождливое, вот такую «красоту» мы обнаружили в конце июля на листьях черной смородины.
Белый налет «облепил» листья только с одной стороны куста. Ягоды как раз начали созревать и для того, чтобы защитить их от мучнистой росы, стали искать средства борьбы с противным заболеванием. Оказалось, самое популярное народное средство от мучнистой росы — обычная пищевая сода. В этой статье мы собрали несколько рецептов приготовления содовых растворов. Берем на заметку 😉
Мучнистая роса на смородине и крыжовнике
Автор одного из видеороликов на youtube делится проверенным на собственном опыте средством борьбы с мучнистой росой на крыжовнике и черной смородине: содовый раствор. Для его приготовления потребуется: 2 ст.ложки пищевой соды (с небольшой горкой), 1 ст.ложка моющего средства для мытья посуды (для прилипания), 2 литра воды.
Для его приготовления потребуется: 2 ст.ложки пищевой соды (с небольшой горкой), 1 ст.ложка моющего средства для мытья посуды (для прилипания), 2 литра воды.
Рецепт:
В 2 литрах воды растворить 2 ст. ложки пищевой соды с небольшой горкой, 1 ст. ложку моющего средства для мытья посуды. Все хорошо перемешать и перелить раствор в пульверизатор или садовый опрыскиватель «Жук». Если нет опрыскивателя, можно распылить раствор веником, по старинке.
Пропорция на 10 литров: 10 ст. ложек пищевой соды и 2 ст. ложки моющего средства.
Вместо моющего средства в качестве «прилипателя» можно использовать растительное масло. Но минус его в том, что смыть его со стенок опрыскивателя будет проблематично. Проще использовать моющее средство или хоз.мыло. Автор также говорит, что можно и вовсе обойтись без «прилипателя», но тогда раствор меньше задержится на листьях, пораженных мучнистой росой. А это значит — обработка окажется менее эффективной.
Обработку лучше всего проводить рано утром или вечером, чтобы солнце быстро не высушило раствор на листьях. прыскиать повторно рекомендуют через 3-5 дней до полного уничтожения гриба.
прыскиать повторно рекомендуют через 3-5 дней до полного уничтожения гриба.
Мучнистая роса на огурцах
Автор другого видеоролика дает рецепт для опрыскивания огурцов, пораженных мучнистой росой. Средство может быть использовано как для профилактики, так и ситуации, когда заболевание уже дало о себе знать.
В качестве ингредиентов используется только вода, пищевая сода и хоз. мыло в качестве «прилипателя». В теплой воде растворяют 3 ст. ложки соды. Хозяйственное мыло (50 г) нужно размягчить заранее в отдельной емкости и потом уже добавить в воду. Все хорошо перемешивают и при помощи опрыскивателя или пульверизатора распыляют средство по огуречным листьям.
Действие: Сода имеет мощные антимикробные свойства, противостоит вредителям и грибковым заболеваниям, повышает урожайность и улучшает вкус плодов.
Обработку можно проводить 1 раз в 10-15 дней для профилактики. А если признаки ярко выражены, то поможет 6-кратная обработка, 1 раз в 7 дней. Опрыскивать, пока признаки болезни не исчезнут. Эта рекомендация именно для огурцов. Сказано также, что при опрыскивании нужно соблюдать принцип умеренности, концентрация не должна быть слишком высокой.
Эта рекомендация именно для огурцов. Сказано также, что при опрыскивании нужно соблюдать принцип умеренности, концентрация не должна быть слишком высокой.
В другом источнике пропорция для опрыскивания огурцов увеличена до 1 ст. ложки на 1,5 литра воды. Получается, что на 10 литров можно класть 6-7 ложек.
В третьем источнике берут на 10 литров 5 ст. л. соды и 20 грамм мыла — для профилактики мучнистой росы. Первое опрыскивание проводят перед цветением, а потом 3-4 раза с интервалом в 7-10 дней.
Кальцинированная сода
В рецептах от мучнистой росы используется не только пищевая, но и кальцинированная сода. От тли, гнили и мучнистой росы готовят такой раствор:
В отдельной емкости с водой смешивают кальцинированную соду (2 ст. ложки без горки), 10 мл йода (1 ч.ложка), 2 ст. ложки жидкого мыла или моющего средства. Затем такой концентрат выливают в ведро воды (10 литров). Полученным раствором опрыскивают листья розы, черной смородины, крыжовника от вредителей и грибковых заболеваний.
Применяют и раствор без йода: на 10 литров воды 2 ст. ложки кальцинированной соды и 40 г хоз.мыла, натертого на терке.
Похожие статьи
20 необычных способов применения соды и хозяйственного мыла
Всего 20-25 лет назад хозяйственное мыло можно было обнаружить в любом доме. В отличие от стиральных машин, которые сейчас может приобрести практически каждый, мыло было доступнее и несравненно дешевле. В основном им стирали одежду, однако в каждой семье хранились способы нетипичного использования хозяйственного мыла, которые помогали сэкономить бюджет.
То же самое с пищевой содой: её даже сейчас можно найти почти у любой хозяйки в кухонном шкафу. Некоторое время назад сода даже стала популярным мемом в интернете: пользователи удивлялись, что одной пачки может хватать на всю жизнь, и не понимали, где соду вообще используют.
А способов применения соды — как и хозяйственного мыла — масса. В этом материале расскажем, что именно можно делать с этими невероятно функциональными средствами. Вы удивитесь, что мыло и сода – невероятно полезные в быту предметы.
Вы удивитесь, что мыло и сода – невероятно полезные в быту предметы.
Стирка и удаление пятен
Для начала банальное: хозяйственное мыло в компании с содой — отличное средство для стирки и удаления пятен. Для одного килограмма эффективного стирального порошка нужно натереть 150 граммов хозяйственного мыла на мелкой тёрке, добавить 400 граммов кальцинированной соды и 500 граммов пищевой, а также 5-7 капель любого эфирного масла. Полученную массу можно использовать как для ручной, так и для машинной стирки.
Кроме того, перед стиркой можно обработать хозяйственным мылом грязный воротник рубашки, манжеты и область подмышек — всё идеально отстирается.
Средство для мытья посуды
Также на основе хозяйственного мыла можно приготовить хорошее средство для мытья посуды. 25 граммов мыла нужно натереть на мелкой терке и разогреть на водяной бане, в мыльную массу добавить 0,5 литра воды, добавить 4 столовые ложки спирта, ложку спиртового настоя календулы и немного жидкого глицерина. Все ингредиенты следует перемешать, остудить и перелить в бутылку с дозатором.
Все ингредиенты следует перемешать, остудить и перелить в бутылку с дозатором.
Сода как основа маски для лица
Необязательно покупать дорогущие крема и бальзамы для глубокой очистки кожи лица. Более свежей и шелковистой её сделает маска на основе соды.
Например, маска из одной чайной ложки сливок, чайной ложки мёда и соды на кончике ножа удалит отмершие клетки, очистит поры, увлажнит и напитает кожу. Готовую маску наносят на лицо на 10 минут, затем смывают теплой водой.
Также можно сделать маску с овсяной мукой: 100 граммов овсяной муки нужно смешать с одной чайной ложкой соды и разбавить водой до получения густой кашицы. Наносить на 10 минут, потом смыть. Такая маска обладает отшелушивающим и очищающим эффектом, смягчает кожу.
Если у вас сухая или чувствительная кожа, склонность к дерматиту или воспаление — используйте соду с большой осторожностью.
Дезинфекция вещей мылом
Хозяйственное мыло — отличное дезинфицирующее средство. Им можно раз в три месяца обрабатывать расчески, мочалки и другие средства гигиены. Достаточно хорошо намылить предметы и оставить на ночь. Утром вещи нужно тщательно промыть под горячей проточной водой.
Им можно раз в три месяца обрабатывать расчески, мочалки и другие средства гигиены. Достаточно хорошо намылить предметы и оставить на ночь. Утром вещи нужно тщательно промыть под горячей проточной водой.
Мыло уничтожает плесень и грибок
В плохо проветриваемых помещениях стены, углы и вообще любые поверхности часто заражены плесенью. Избавиться от неё поможет хозяйственное мыло: нужно обильно натереть влажную губку мылом и тщательно обработать ей пораженные участки. Это уничтожит плесень и грибок и предотвратит повторное появление.
Чистка кафеля, раковины и ванны
С помощью соды можно обойтись без дорогих чистящих средств. Можно просто использовать соду, как и любое другое моющее средство: на губку следует нанести немного порошка и тщательно протереть поверхность. Остатки нужно смыть водой.
Чистка зеркал
Чтобы зеркало сияло как новое и не запотевало в ванной, можно сухим хозяйственным мылом провести по поверхность и затем тщательно растереть полоски сухими бумажными салфетками или газетой. Просто, быстро, исключительно дёшево.
Просто, быстро, исключительно дёшево.
Сода как пятновыводитель
Пищевая сода в равной пропорции с соком лимона эффективно удаляет пятна. Вино, соки, варенья, травы и другое теперь не угроза одежде и скатерти: нужно нанести густую кашицу из соды и сока лимона на пятно и оставить на полчаса. Затем одежду/скатерть достаточно просто постирать.
Эффективная чистка ковров
5-10 капель эфирного масла на 200 граммов соды — отличная смесь для основательной чистки ковра. Смесь тонким слоем нужно рассыпать по ковру и оставить на 10-12 часов. Затем ковер следует тщательно почистить жесткой щеткой и пропылесосить. И ковёр чистый, и неприятных запахов нет.
Мытье волос и избавление от перхоти
Хозяйственное мыло можно использовать для мытья волос — но только несколько раз в месяц. Это поможет избавиться от перхоти, глубоко очистить кожу головы и укрепить волосы. Не рекомендуется так делать, если волосы слишком сухие и ослабленные: щёлочь в составе мыла может усугубить проблему.
Содовая ванна для бархатной кожи
В ванну можно добавить 300 граммов морской соли, 200 граммов пищевой соды и нескольких капель любого эфирного масла. Принимать такие содовые ванны нужно в течение 20 минут — и кожа станет более упругой и бархатистой.
Мыло от ран и ожогов
Поврежденный участок кожи можно обильно намылить хозяйственным мылом и оставить так на несколько минут. Это поможет обеззаразить рану и ускорить ее заживление. При слабых ожогах мыло поможет снять покраснение и предотвратить появление волдырей.
Мыло и шитьё
Хозяйственное мыло можно использовать вместо мела для пометок на одежде, а также можно натереть им иголку, чтобы улучшить ее скольжение и облегчить процесс зашивания изделий из плотных тканей.
Сода как нейтрализатор запахов
Помойте холодильник содовым раствором (2 ст. ложки на 1 л воды) и оставьте в нем открытую емкость с 2-3 ложками соды — и больше не будет неприятных запахов. Также сода поможет дезодорировать разделочную доску: на мокрую доску нужно насыпать соду: оставить на 10 минут и затем вымыть её под проточной водой.
Также сода поможет дезодорировать разделочную доску: на мокрую доску нужно насыпать соду: оставить на 10 минут и затем вымыть её под проточной водой.
Похожим способом можно нейтрализовать вонь из мусорного ведра: вымойте его содовым раствором и насыпьте на дно немного порошка. Небольшую открытую ёмкость с содой можно оставить и в туалете. При этом нужно менять порошок раз в неделю.
Мыло защитит деревья от грызунов
Старые колготки со стружкой хозяйственного мыла на деревьях отпугнут грызунов, пожирающих кору. И деревья защищены, и животным никакого вреда.
Сода при укусах насекомых
Содовый раствор поможет успокоить зуд после укусов насекомых. Смешиваем 1 чайную ложку соды на 50 мл воды, протираем ватным диском место укуса — профит.
Сода от зубной боли и боли в горле
Содовый раствор (150 мл теплой воды и 1 чайная ложка соды) эффективно поможет справиться с болью в горле или зубной болью. Полоскание раствором несколько раз в день — боль значительно уменьшится.
Полоскание раствором несколько раз в день — боль значительно уменьшится.
Сода и цветы
Чтобы букет свежих цветов простоял в вазе как можно дольше, достаточно добавить в воду соду в пропорции 1 чайная ложка на 1,5 л.
Сода против муравьев
Избавить дом от нашествия муравьёв также можно с помощью соды. Для этого нужно смешать её с солью в пропорции 1:1 и рассыпать в месте, где завелись насекомые.
Сода усилит аромат
Удивительно, но для того, чтобы сделать чай или кофе еще более ароматным, а вкус напитка — насыщенным и мягким, нужно добавить в чашку щепотку соды. Порошок никак не чувствуется, а результат вас удивит.
Фотографии из открытых источников
Сода каустическая – обзор
Действие на алюминий
Воздействие на алюминий равномерное и равномерное. Скорость растворения зависит от концентрации (табл. Д.4.1) и может быть очень высокой: в растворе гидроксида натрия с 0,1 г. л – 1 годовое уменьшение толщины составило бы 7 мм!
л – 1 годовое уменьшение толщины составило бы 7 мм!
Таблица Д.4.1. Скорость растворения 1050 в гидроксида натрия при 20 ° C
| Концентрация (G-1 – 1 | Сбой массы (G-RN -2 · H -1 ) | Скорость растворения (мм·ч −1 ) | |
|---|---|---|---|
| 0.01 | 10,4 | 0,0 | 0,0 |
| 0,1 | 11,4 | 2,2 | 0,001 |
| 1 | 12,4 | 8,5 | 0,003 |
| 10 | 13,2 | 30,0 | 0,01 |
| 50 | 13,7 | 61,5 | 0,02 |
Скорость растворения резко возрастает Погружение куска алюминия в горячий раствор гидроксида натрия представляет реальную опасность разбрызгивания из-за очень сильного выделения газообразного водорода в результате атаки.
Таблица Д.4.2. Скорость растворения 1050 в гидроксиде натрия (MM.H -1 )
| Температура (° C) | Концентрация NaOH (G.1 -1 ) | |||||
|---|---|---|---|---|---|---|
| 20 | 100 | 200 | 300 | 400 | 400 | |
| 30 | ||||||
| 30 | 0,07 | 0,08 | 0,09 | 0.07 | ||
| 50 | 0.10 | 0.24 | 0.35 | 0,36 | 0,31 | |
| 60 | 0,18 | 0,46 | 0,64 | 0,66 | 0,56 | |
| 80 | 0,40 | 1,27 | 1,70 | 1,81 | ||
В целом скорость растворения алюминиевых сплавов даже выше, чем у алюминия марки 1000-й серии.
Растворы гидроксида натрия широко используются для травления перед обработкой поверхности деталей из алюминиевых сплавов.Этот процесс должен осуществляться в строго контролируемых условиях, всегда близких к следующему типовому набору параметров:
- –
Концентрация NaOH: 50 г – л
- –
Температура: 50–60 ° C
- –
- –
- –
- –
- –
Продолжительность кровообращения: 5-10 мин
- –
Промывание с холодной водой
- –
Нейтрализация в растворе с 50% азотной кислотой
Промывка водой
- –
Сушка (дополнительно)
Это травление приводит к уменьшению толщины порядка 0.05 мм при погружении на 10 мин в раствор 50 г⋅л –л .
Большинство травильных ванн основано на гидроксиде натрия (или карбонате натрия). Они содержат ингибиторы для контроля скорости растворения. Силикат натрия эффективно ингибирует коррозию алюминия в растворах гидроксида натрия. Раствор 10 г.л –1 NaOH, содержащий 40 г.л –1 силиката натрия, не разрушает алюминий при погружении не менее 2 ч.
Силикат натрия эффективно ингибирует коррозию алюминия в растворах гидроксида натрия. Раствор 10 г.л –1 NaOH, содержащий 40 г.л –1 силиката натрия, не разрушает алюминий при погружении не менее 2 ч.
Добавление силиката натрия в чистящие растворы на основе карбоната натрия или гидроксида натрия, которые используются в некоторых отраслях пищевой промышленности, позволяет очищать алюминиевое оборудование без воздействия на алюминий.
При отсутствии каких-либо следов влажности гидроксид натрия не оказывает действия на алюминий даже при температуре выше его плавления 318 °C [2]. Тем не менее, малейшие следы влаги провоцируют агрессивное воздействие на алюминий. Например, в эвтектической смеси гидроксида натрия и гидроксида калия скорость растворения составляет 2 мкм⋅м . ч -1 с 1% воды, но 0,40 мм . ч -1 с 8,5% воды [3].
Гидроксид натрия
Что такое гидроксид натрия (NaOH)?
Гидроксид натрия иногда называют едким натром или щелочью. Это обычный ингредиент чистящих средств и мыла.
Это обычный ингредиент чистящих средств и мыла.
При комнатной температуре гидроксид натрия представляет собой белое твердое вещество без запаха. Жидкий гидроксид натрия бесцветен и не имеет запаха. Может бурно реагировать с сильными кислотами и водой. Гидроксид натрия вызывает коррозию. NaOH может вступать в реакцию с влагой воздуха и выделять тепло при растворении. Этого тепла может быть достаточно, чтобы вызвать пожар, если он находится рядом с легковоспламеняющимися материалами.
Гидроксид натрия полезен благодаря своей способности изменять жиры.Он используется для изготовления мыла и в качестве основного ингредиента в бытовых продуктах, таких как жидкие чистящие средства для канализации. Гидроксид натрия обычно продается в чистом виде в виде белых гранул или в виде раствора в воде.
Каковы некоторые области применения гидроксида натрия?
Гидроксид натрия используется в кусковом мыле и моющих средствах. Гидроксид натрия также используется в качестве очистителя канализации для прочистки труб.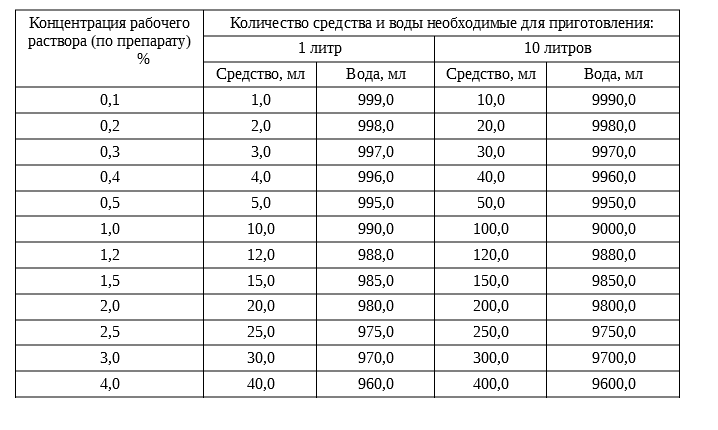
Около 56% производимого гидроксида натрия используется в промышленности, а 25% NaOH используется в бумажной промышленности.Некоторые другие области применения включают производство топливных элементов, обработку продуктов питания, удаление кожуры с овощей для консервирования, отбеливание, очистку канализации, очиститель духовки, мыло, моющее средство, изготовление бумаги, переработку бумаги, переработку алюминиевой руды, оксидное покрытие, обработку хлопчатобумажной ткани, травление. , обезболивающие, антикоагулянты для предотвращения образования тромбов, лекарства, снижающие уровень холестерина, и водоподготовка.
Как вы можете подвергнуться воздействию гидроксида натрия?
В домашних условиях некоторые предметы домашнего обихода, такие как мыло или чистящие средства, содержат гидроксид натрия.Случайное проглатывание или контакт с кожей этих чистящих средств может привести к вредному воздействию.
На некоторых промышленных предприятиях используется гидроксид натрия. Вот некоторые пределы воздействия NaOH на рабочем месте в воздухе.
Вот некоторые пределы воздействия NaOH на рабочем месте в воздухе.
Пределы воздействия воздуха на рабочем месте:
Управление по охране труда и промышленной гигиене: допустимый предел воздействия (PEL)
в воздухе составляет 2 мг/м 3 в среднем за 8-часовую рабочую смену
NIOSH: рекомендуемый предел воздействия (REL) переносимого по воздуху
составляет 2 мг/м 3 , который ни в коем случае нельзя превышать
ACGIH: Пороговое предельное значение
(ПДК) составляет 2 мг/м 3 , которое не должно превышаться в любое время
Как вы можете защитить свою семью от воздействия?
• Соблюдайте все меры предосторожности и инструкции на этикетках продуктов.
• Храните чистящие средства в недоступном для детей месте.
• Храните чистящие средства в оригинальной упаковке.
• Надевайте латексные или нитриловые перчатки при использовании продуктов, содержащих высокие концентрации NaOH.
• Носите одежду с длинными рукавами и штаны, которые не испортятся или не испортятся под действием гидроксида натрия, чтобы защитить кожу. Аккуратно снимите одежду, если она намокнет, чтобы избежать попадания гидроксида натрия на кожу.
Каковы потенциальные вредные последствия воздействия гидроксида натрия?
Гидроксид натрия является потенциально опасным веществом.Это может повредить вам, если оно коснется вашей кожи, если вы выпьете его или вдохнете. Употребление в пищу или питье гидроксида натрия может вызвать сильные ожоги и немедленную рвоту, тошноту, диарею или боль в груди и желудке, а также затруднения при глотании. Поражение рта, горла и желудка происходит немедленно. Вдыхание его может вызвать сильное раздражение верхних дыхательных путей с кашлем, ожогами и затрудненным дыханием.
Вредное воздействие гидроксида натрия зависит от нескольких факторов, включая концентрацию гидроксида натрия, продолжительность воздействия и то, прикасались ли вы к нему, пили или вдыхали. Контакт с очень высокими концентрациями гидроксида натрия может вызвать серьезные ожоги глаз, кожи, пищеварительной системы или легких, что может привести к необратимому повреждению или смерти. Длительный или повторяющийся контакт с кожей может вызвать дерматит. Многократное вдыхание паров гидроксида натрия может привести к необратимому повреждению легких.
Контакт с очень высокими концентрациями гидроксида натрия может вызвать серьезные ожоги глаз, кожи, пищеварительной системы или легких, что может привести к необратимому повреждению или смерти. Длительный или повторяющийся контакт с кожей может вызвать дерматит. Многократное вдыхание паров гидроксида натрия может привести к необратимому повреждению легких.
Первая помощь
В экстренных случаях звоните по номеру 911.
Попадание в глаза
- Промывать глаза водой в течение 30 минут.
- Поднимите верхние и нижние веки.
- Снять контактные линзы.
Контакт с кожей
- Снять загрязненную одежду.
- Промыть водой в течение 15 минут.
Вдыхание
- Удалите человека из зоны воздействия, если это безопасно для вас.
- Если человек не отвечает и не дышит нормально, начните сердечно-легочную реанимацию.

Проглатывание
- НЕ ВЫЗЫВАЙТЕ РВОТУ.
- Никогда не давайте ничего в рот человеку, находящемуся без сознания.
- Если пострадавший находится в полном сознании и у него нет дыхательной недостаточности, дайте ему выпить чашку воды, чтобы разбавить гидроксид натрия.
Обратитесь в токсикологический центр по телефону 1-800-222-1222 для получения дополнительной информации о воздействии гидроксида натрия.
Инциденты с гидроксидом натрия в Теннесси
Еще в 2010-2011 годах гидроксид натрия считался одним из десяти наиболее часто проливаемых или выбрасываемых химических веществ в Теннесси. Около 50% этих разливов и выбросов произошло на складах или во время транспортировки.Около 75% из них произошли по вине человека.
Обращение и хранение
Разливы и чрезвычайные ситуации. Если от сотрудников требуется ликвидировать разливы, они должны быть надлежащим образом обучены и экипированы. Может применяться стандарт OSHA по работе с опасными отходами и реагированию на чрезвычайные ситуации (29 CFR 1910.120).
Может применяться стандарт OSHA по работе с опасными отходами и реагированию на чрезвычайные ситуации (29 CFR 1910.120).
В случае пролития или утечки гидроксида натрия выполните следующие действия:
Эвакуируйте персонал, обезопасьте и контролируйте вход в зону.
Устранить все источники воспламенения.
Для гидроксида натрия в растворе: абсорбируйте жидкости сухим песком, землей или подобным материалом и поместите в герметичные контейнеры для утилизации.
Соберите твердый материал наиболее удобным и безопасным способом и поместите в герметичные контейнеры для утилизации.
ЗАПРЕЩАЕТСЯ использовать воду или какой-либо ВЛАЖНЫЙ МЕТОД для очистки NaOH.
Проветрить и вымыть помещение после завершения уборки.
НЕ смывать в канализацию.
Возможно, потребуется утилизировать гидроксид натрия как опасные отходы.
Гидроксид натрия реагирует с сильными кислотами (соляной, серной или азотной), водой и влагой с быстрым выделением тепла.
Гидроксид натрия реагирует с металлами (алюминием, свинцом, оловом или цинком) с образованием легковоспламеняющегося и взрывоопасного газообразного водорода.
Гидроксид натрия может образовывать чувствительные к удару соли при контакте с азотсодержащими соединениями.
Гидроксид натрия не совместим с окислителями, хлорсодержащими растворителями, аммиаком и органическими материалами.
Хранить в оригинальной, плотно закрытой упаковке в прохладном, хорошо проветриваемом помещении, вдали от воды и влаги.
Гидроксид натрия может разрушать железо, медь, пластик, резину и покрытия.
Титрование гидроксида натрия соляной кислотой | Эксперимент
Вы должны решить, подходит ли этот эксперимент для использования с другими классами, и рассмотреть необходимость предварительного обучения использованию методов, связанных с титрованием (см. Учебные заметки). Дальнейшее здесь предполагает, что учителя оценили класс как способный провести этот эксперимент с бюреткой с разумным ожиданием успеха.
Предполагая, что студенты прошли обучение, практическая работа должна, по возможности, начинаться с аппаратуры, готовой на каждом рабочем месте в лаборатории. Это делается для того, чтобы избежать сбора уязвимой и дорогой стеклянной посуды (бюретки) в переполненном центральном месте.
Показать в полноэкранном режиме
Требуется время
Этап 1
Заполнение бюретки, отмеривание щелочи в колбе и ее титрование до ее нейтрализации занимает около 20 минут, при этом для многих групп возможны фальстарты.На практике не имеет значения, превышается ли конечная точка даже на несколько кубических сантиметров, но цель состоит в том, чтобы найти пропорции для примерно нейтрального раствора.
Этап 2
Приготовление нейтрального раствора без индикатора занимает не более 10 минут.
Этап 3
Выпаривание раствора может занять оставшуюся часть урока до момента, когда раствор можно оставить кристаллизоваться для следующего урока. Наблюдение за испарением растворов может быть утомительным для студентов, и им может понадобиться другая задача, чтобы занять себя, например, промывка бюреток и опорожнение очищенной водой.
Наблюдение за испарением растворов может быть утомительным для студентов, и им может понадобиться другая задача, чтобы занять себя, например, промывка бюреток и опорожнение очищенной водой.
Оборудование
Аппарат
- Защита для глаз
- Бюретка, 30 или 50 см 3 (примечание 1)
- Коническая колба, 100 см 3
- Стакан, 100 см 3
- Пипетка, 20 или 25 см 3 , с фильтром для пипетки
- Стержень для перемешивания
- Маленькая (фильтрующая) воронка диаметром около 4 см
- Подставка для бюреток и зажим (примечание 2)
- Белая плитка (дополнительно; примечание 3)
- Горелка Бунзена
- Штатив
- Треугольник из пластилина (примечание 4)
- Испарительная чаша, не менее 50 см 3 вместимость
- Чаша для кристаллизации (примечание 5)
- Микроскоп или ручная линза, подходящая для исследования кристаллов в чашке для кристаллизации
Примечания к аппарату
- Если в вашей школе до сих пор используются бюретки со стеклянными кранами, обратитесь к Справочнику лаборатории CLEAPSS, раздел 10.
 10.1, для их ухода и обслуживания. Этот эксперимент не увенчается успехом, если используемые бюретки имеют жесткие, заблокированные или негерметичные запорные краны. Современные бюретки с запорными кранами из ПТФЭ намного проще в использовании, не требуют смазки и не забиваются. Не рекомендуются бюретки с кранами любого типа; хотя они дешевы, они также подвержены утечке, особенно в руках начинающих студентов.
10.1, для их ухода и обслуживания. Этот эксперимент не увенчается успехом, если используемые бюретки имеют жесткие, заблокированные или негерметичные запорные краны. Современные бюретки с запорными кранами из ПТФЭ намного проще в использовании, не требуют смазки и не забиваются. Не рекомендуются бюретки с кранами любого типа; хотя они дешевы, они также подвержены утечке, особенно в руках начинающих студентов. - Стойки и зажимы для бюреток предназначены для предотвращения сдавливания бюретки из-за чрезмерного затягивания, что может произойти при использовании стандартных губчатых зажимов.
- Дополнительная белая плитка должна помещаться под колбу для титрования, но вместо нее можно использовать белую бумагу.
- Вместо треугольников из глины можно использовать керамическую сетку, но в этом случае испарение занимает больше времени.
- Стадии испарения и кристаллизации могут быть незавершенными во время урока. Чашки для кристаллизации необходимо отставить в сторону, чтобы кристаллизация происходила медленно.
 Однако нельзя допускать полного высыхания посуды, так как это портит качество кристаллов.Время от времени проверяя, можно решить, когда сцеживать излишки раствора из каждой чашки, чтобы оставить хорошие кристаллы для проверки учащимися в дальнейшем.
Однако нельзя допускать полного высыхания посуды, так как это портит качество кристаллов.Время от времени проверяя, можно решить, когда сцеживать излишки раствора из каждой чашки, чтобы оставить хорошие кристаллы для проверки учащимися в дальнейшем.
Химические вещества
- Раствор гидроксида натрия, 0,4 М (РАЗДРАЖАЮЩЕЕ), около 100 см 3 в маркированной и закрытой бутылке
- Разбавленная соляная кислота, 0,4 М, около 100 см 3 в маркированной и закрытой бутылке
- Индикаторный раствор метилового оранжевого (или аналог) в маленькой бутылочке-капельнице
Примечания по охране труда и технике безопасности
- Ознакомьтесь с нашим стандартным руководством по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Раствор гидроксида натрия, NaOH (водн.) (РАЗДРАЖАЕТ при используемой концентрации) – см. карточку опасности CLEAPSS HC091a и книгу рецептов CLEAPSS RB085.
 Концентрация раствора не требует высокой точности, но должна быть достаточно близкой к той же концентрации, что и разбавленная соляная кислота, и менее 0,5 М.
Концентрация раствора не требует высокой точности, но должна быть достаточно близкой к той же концентрации, что и разбавленная соляная кислота, и менее 0,5 М. - Разбавленная соляная кислота, HCl (водн.) — см. карту опасности CLEAPSS HC047a и книгу рецептов CLEAPSS RB043.Концентрация раствора не требует высокой точности, но должна быть достаточно близкой к той же концентрации, что и раствор гидроксида натрия, и менее 0,5 М.
- Раствор индикатора метилового оранжевого (твердое вещество является ТОКСИЧНЫМ, но не раствор) – см. карту опасности CLEAPSS HC032 и книгу рецептов CLEAPSS RB000.
Процедура
Показать в полноэкранном режиме
Этап 1
- Используя маленькую воронку, налейте несколько кубических сантиметров 0.4 М соляной кислоты в бюретку с открытым краном и стаканом под открытым краном. Как только кончик бюретки заполнится раствором, закройте кран и добавьте раствор до нулевой отметки. (Не используйте повторно кислоту в стакане – ее следует смыть в раковину.
 )
) - Используйте пипетку с наполнителем для пипеток, чтобы перенести 25 (или 20) см 3 0,4 М раствора гидроксида натрия в коническую колбу и добавить две капли индикатора метилового оранжевого. Аккуратно перемешайте. Поместите колбу на белую плитку или лист чистой белой бумаги под кран бюретки.
- Добавляйте соляную кислоту в раствор гидроксида натрия небольшими объемами, осторожно взбалтывая после каждого добавления. Продолжайте до тех пор, пока раствор не изменит цвет с желто-оранжевого на красный, и в этот момент запишите показания на бюретке. Теперь этот окрашенный раствор следует смыть в раковину.
Этап 2
- Заполните бюретку до нулевой отметки. Осторожно добавьте тот же объем свежей соляной кислоты, который вы использовали на этапе 1, шаге 3, к другим 25 (или 20) см 3 раствора гидроксида натрия, чтобы получить нейтральный раствор, но на этот раз без индикатора.
Этап 3
- Вылейте этот раствор в испарительную ванну.
 Уменьшите объем раствора примерно наполовину, нагревая его на треугольнике из глины или керамической сетке над пламенем горелки Бунзена от слабого до среднего. Раствор выплескивается ближе к концу, и вы получаете меньше кристаллов. Не кипятить всухую. Возможно, вам придется выпаривать раствор порциями, скажем, по 20 см 3 во избежание переполнения резервуара для выпаривания. Не пытайтесь снять горячую чашу со штатива — сначала дайте остыть, а затем перелейте в чашу для кристаллизации.
Уменьшите объем раствора примерно наполовину, нагревая его на треугольнике из глины или керамической сетке над пламенем горелки Бунзена от слабого до среднего. Раствор выплескивается ближе к концу, и вы получаете меньше кристаллов. Не кипятить всухую. Возможно, вам придется выпаривать раствор порциями, скажем, по 20 см 3 во избежание переполнения резервуара для выпаривания. Не пытайтесь снять горячую чашу со штатива — сначала дайте остыть, а затем перелейте в чашу для кристаллизации. - Оставьте концентрированный раствор для дальнейшего испарения в кристаллизаторе. Это должно дать белое кристаллическое твердое вещество в течение одного или двух дней.
- Рассмотрите кристаллы под микроскопом.
Учебные заметки
Титрование с использованием бюретки для точного измерения объемов раствора требует тщательной и организованной работы, манипулятивных навыков в сочетании с умственной концентрацией и вниманием к деталям. Все это, конечно, желательные качества, которые следует развивать у учащихся, но прежде чем использовать бюретку в классе, должна быть определенная степень базовой компетентности и надежности. Эксперимент, скорее всего, подойдет учащимся 14–16 лет. Это обсуждается далее ниже, но нижеследующее предполагает, что вы оценили класс как способный провести этот эксперимент с использованием бюретки с разумным ожиданием успеха.
Эксперимент, скорее всего, подойдет учащимся 14–16 лет. Это обсуждается далее ниже, но нижеследующее предполагает, что вы оценили класс как способный провести этот эксперимент с использованием бюретки с разумным ожиданием успеха.
Учащиеся должны пройти обучение правильному использованию бюреток, в том числе тому, как их надежно зажимать и наполнять. Вам следует рассмотреть возможность демонстрации техники бюреток и дать студентам возможность попрактиковаться в этом. В этом эксперименте пипетка не нужна, так как цель состоит в том, чтобы нейтрализовать любой объем используемой щелочи, и это можно приблизительно измерить с помощью мерного цилиндра.
Здесь не ставится цель провести количественные измерения, ведущие к расчетам. Цель состоит в том, чтобы познакомить учащихся с методом титрования только для получения нейтрального раствора.
Альтернативные индикаторы, которые вы можете использовать, включают экранированный метиловый оранжевый (зеленый в щелочи, фиолетовый в кислоте) и фенолфталеин (розовый в щелочи, бесцветный в кислоте).
Если оставить концентрированные растворы для медленной кристаллизации, это поможет получить более крупные кристаллы. Растворимость хлорида натрия не сильно зависит от температуры, поэтому простое охлаждение раствора вряд ли приведет к образованию кристаллов.
Под микроскопом (если возможно, лучше стереомикроскопом) можно увидеть кубическую природу кристаллов. Если кристаллизация произошла в неглубоком растворе, когда кристаллы погружены лишь частично, можно увидеть кристаллы в форме воронки. В этих кристаллах каждая грань куба принимает форму полой ступенчатой пирамиды.
Вопросы учащихся
Этап 1
Какие вещества образовались в этой реакции? Напишите уравнение слова и уравнение символа.
Этап 2
Почему вы должны использовать еще 25 см 3 раствора гидроксида натрия, а не получать кристаллы из раствора на этапе 1?
Этап 3
Какой формы кристаллы?
Гидроксид натрия | Использование, преимущества и факты химической безопасности
Использование и преимущества
Гидроксид натрия используется для производства многих повседневных товаров, таких как бумага, алюминий, коммерческие чистящие средства для канализации и духовки, а также мыло и моющие средства.
Гидроксид натрия в чистящих и дезинфицирующих средствах
Гидроксид натрия используется для производства мыла и различных моющих средств, используемых в быту и в коммерческих целях. Хлорсодержащие отбеливатели получают путем соединения хлора и гидроксида натрия. Средства для чистки канализации, содержащие гидроксид натрия, превращают жиры и смазки, которые могут засорить трубы, в мыло, которое растворяется в воде.
Гидроксид натрия в фармацевтике и медицине
Гидроксид натрия используется для производства различных лекарств и фармацевтических продуктов, от обычных болеутоляющих средств, таких как аспирин, до антикоагулянтов, которые могут помочь предотвратить образование тромбов, до лекарств, снижающих уровень холестерина.
Гидроксид натрия в энергетике
В энергетике гидроксид натрия используется в производстве топливных элементов. Топливные элементы работают как батареи для чистого и эффективного производства электроэнергии для целого ряда приложений, включая транспорт; обработка материалов; а также стационарные, переносные и аварийные резервные источники питания. Эпоксидные смолы, изготовленные из гидроксида натрия, используются в ветряных турбинах.
Эпоксидные смолы, изготовленные из гидроксида натрия, используются в ветряных турбинах.
Гидроксид натрия при очистке воды
Муниципальные водоочистные сооружения используют гидроксид натрия для контроля кислотности воды и удаления тяжелых металлов из воды.Гидроксид натрия также используется для производства гипохлорита натрия, дезинфицирующего средства для воды.
Гидроксид натрия в пищевой промышленности
Гидроксид натрия используется в пищевой промышленности, например, для консервирования таких продуктов, как оливки, или для подрумянивания кренделей по-баварски, придавая им характерный хруст. Гидроксид натрия используется для удаления кожицы с помидоров, картофеля и других фруктов и овощей для консервирования, а также в качестве ингредиента пищевых консервантов, которые помогают предотвратить рост плесени и бактерий в продуктах питания.
Гидроксид натрия в изделиях из дерева и бумаги
Во многих процессах производства бумаги древесину обрабатывают раствором, содержащим сульфид натрия и гидроксид натрия. Это помогает растворить большую часть нежелательного материала в древесине, оставив относительно чистую целлюлозу, которая составляет основу бумаги. В процессе переработки бумаги гидроксид натрия используется для отделения чернил от бумажных волокон, что позволяет повторно использовать бумажные волокна.
Это помогает растворить большую часть нежелательного материала в древесине, оставив относительно чистую целлюлозу, которая составляет основу бумаги. В процессе переработки бумаги гидроксид натрия используется для отделения чернил от бумажных волокон, что позволяет повторно использовать бумажные волокна.
Гидроксид натрия также используется для очистки сырья для изделий из дерева, таких как шкафы и мебель, а также для отбеливания и очистки древесины.
Гидроксид натрия при переработке алюминиевой руды
Гидроксид натрия используется для извлечения глинозема из природных минералов. Глинозем используется для производства алюминия и различных продуктов, включая фольгу, банки, кухонную утварь, пивные кеги и детали самолетов. В строительстве алюминий используется в материалах, из которых изготавливаются фасады зданий и оконные рамы.
Гидроксид натрия в других промышленных производственных целях
Гидроксид натрия используется во многих других промышленных и производственных процессах. Он используется для производства вискозы, спандекса, взрывчатых веществ, эпоксидных смол, красок, стекла и керамики. Он также используется в текстильной промышленности для производства красителей, обработки хлопчатобумажных тканей, а также при стирке и отбеливании, а также при очистке и обработке металлов, оксидировании, гальванике и электролитической экстракции.
Он используется для производства вискозы, спандекса, взрывчатых веществ, эпоксидных смол, красок, стекла и керамики. Он также используется в текстильной промышленности для производства красителей, обработки хлопчатобумажных тканей, а также при стирке и отбеливании, а также при очистке и обработке металлов, оксидировании, гальванике и электролитической экстракции.
Академия Экономики в Кракове
%PDF-1.3
%
1 0 объект
>
эндообъект
2 0 объект
>поток
2018-06-24T00:00:43+02:002018-06-23T23:59:33+02:002018-06-24T00:00:43+02:00Acrobat PDFMaker 11 для программы Worduuid:d3160f5d-2867-46a8-9fe6 -83cd8793e1dbuuid:d7f34b16-9c57-4799-9591-3a69efc4873e
application/pdf
Библиотека Adobe PDF 11.0PDF/X-1:2001PDF/X-1a:2001FalsePDF/X-1:2001PDF/X-1:2001PDF/X-1a:2001D:20180623215906drukrol-1619488445
конечный поток
эндообъект
5 0 объект
>
эндообъект
6 0 объект
[>]
эндообъект
3 0 объект
>
эндообъект
10 0 объект
>
эндообъект
11 0 объект
>
эндообъект
17 0 объект
>/Шрифт>/ProcSet[/PDF/Text/ImageC]/XObject>>>/TrimBox[0. 0 0,0 595,38 841,98]/Тип/Страница>>
0 0,0 595,38 841,98]/Тип/Страница>>
эндообъект
18 0 объект
>/Шрифт>/ProcSet[/PDF/Text/ImageC]/XObject>>>/TrimBox[0,0 0,0 595,38 841,98]/Тип/Страница>>
эндообъект
19 0 объект
>/Шрифт>/ProcSet[/PDF/Text/ImageC]/XObject>>>/TrimBox[0,0 0,0 595,38 841,98]/Тип/Страница>>
эндообъект
20 0 объект
>/Шрифт>/ProcSet[/PDF/Text/ImageC]/XObject>>>/TrimBox[0,0 0,0 595,38 841,98]/Тип/Страница>>
эндообъект
21 0 объект
>/ProcSet[/PDF/Text]>>/TrimBox[0.0 0,0 595,38 841,98]/Тип/Страница>>
эндообъект
22 0 объект
>/ProcSet[/PDF/Text]>>/TrimBox[0.0 0.0 595,38 841,98]/Тип/Страница>>
эндообъект
43 0 объект
>поток
HWMw6W`Ic@4$mL3]X%r”*#ŧ
Образование осадка | Глава 6: Химические изменения
Проведите демонстрацию, объединив два прозрачных бесцветных раствора, которые образуют белое твердое вещество, и введите термин осадок.
Материалы для демонстрации
- Сульфат магния (английская соль)
- Карбонат натрия
- Вода
- 2 прозрачных пластиковых стаканчика
- 1 столовая ложка
- 1 чайная ложка
Подготовка учителей
- Налейте 100 мл воды в один прозрачный пластиковый стакан и добавьте 10 г (около 1 столовой ложки) сульфата магния.
 Перемешивайте, пока раствор не станет прозрачным.
Перемешивайте, пока раствор не станет прозрачным. - Налейте 50 мл воды в другую прозрачную пластиковую чашку и добавьте 5 г (около 1 чайной ложки) карбоната натрия. Перемешивайте, пока раствор не станет прозрачным.
Процедура
Поднимите два прозрачных бесцветных раствора и медленно влейте меньшее количество в большее.
Ожидаемые результаты
Образуются частицы белого твердого вещества.
Спросите студентов:
- Считаете ли вы добавление раствора карбоната натрия к раствору сульфата магния химической реакцией?
- Да.
- Почему или почему бы и нет?
- Объединение двух прозрачных бесцветных жидкостей является химическим изменением, поскольку образуется другое твердое вещество.
Расскажите учащимся, что осадок – это нерастворимое твердое вещество, которое образуется при смешивании двух растворов и химической реакции. Нерастворимый означает, что твердое вещество не растворяется.
Дайте каждому учащемуся рабочий лист.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания.Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Предложите учащимся смешать две жидкости, чтобы увидеть другой осадок.
Вопрос для расследования
Как узнать, когда в результате химической реакции образуется осадок?
Материалы для каждой группы
- Пищевая сода
- Хлорид кальция
- Вода
- Градуированный цилиндр
- Мерная ложка (½ чайной ложки) или весы
- 2 прозрачных пластиковых стаканчика
- Малярная лента
- Ручка
Примечание. Если вы хотите, чтобы учащиеся попрактиковались в использовании весов для взвешивания граммов, попросите их взвесить по два грамма пищевой соды и хлорида кальция.
Процедура
- Используйте клейкую ленту и ручку, чтобы пометить 2 пластиковых стаканчика с раствором пищевой соды и раствором хлорида кальция.
- Используйте мерный цилиндр, чтобы добавить 20 мл воды в каждую чашку.
- Добавьте 2 г (примерно ½ чайной ложки) хлорида кальция в воду в маркированной чашке. Вращайте до тех пор, пока как можно больше хлорида кальция не растворится.
- Добавьте 2 г (около ½ чайной ложки) пищевой соды в воду в стакане с маркировкой.Вращайте до тех пор, пока как можно больше пищевой соды не растворится. На дне чашки может остаться нерастворенная пищевая сода.
Осторожно влейте раствор пищевой соды в раствор хлорида кальция. Старайтесь не наливать нерастворенную пищевую соду. Наблюдать.
Ожидаемые результаты
Появляются пузырьки и белый осадок.
Обсудите наблюдения учащихся.
Спросите студентов:
- Что вы заметили, смешав раствор пищевой соды и раствор хлорида кальция?
- Растворы пузырились и образовывались маленькие белые частицы твердого вещества.

- Вы заметили осадок?
- Да. Белые частицы появились после объединения двух растворов.
- Как вы думаете, это была химическая реакция? да.Почему?
- Два вещества, которые были объединены, были жидкостями, а вещества, которые были произведены, были твердым телом и газом. Эти продукты кажутся отличными от реагентов.
Обсудите продукты, полученные в результате этой химической реакции.
Напомните учащимся, что в химических реакциях, которые они видели до сих пор, определенные атомы в молекулах реагентов отрываются друг от друга, а затем перестраиваются и вновь соединяются различными способами, образуя продукты.Они увидели, что в реагентах содержится тот же тип и число атомов, что и в продуктах.
Спроектируйте изображение Химическое уравнение хлорида кальция и бикарбоната натрия.
Спросите студентов:
- Какие продукты реакции вы знаете?
- Учащиеся должны различать хлорид натрия (NaCl), воду (H 2 O) и двуокись углерода (CO 2 ).

- Посмотрите на продукт в химическом уравнении.Какой газ образуется в результате химической реакции?
- Углекислый газ.
- Как вы думаете, что такое осадок?
- Соль и вода прозрачны и бесцветны в виде раствора, поэтому осадок должен быть CaCO 3 , представляющим собой карбонат кальция. Скажите учащимся, что карбонат кальция – это обычный мел.
- Сколько атомов каждого типа находится в реагентной части уравнения?
- 1 атом кальция, 2 атома хлора, 2 атома натрия, 2 атома водорода, 2 атома углерода и 6 атомов кислорода.
- Сколько атомов каждого типа находится в продукте химического уравнения?
- 1 атом кальция, 2 атома хлора, 2 атома натрия, 2 атома водорода, 2 атома углерода и 6 атомов кислорода.
- Это сбалансированное химическое уравнение? да. Почему?
- Один и тот же тип и количество атомов в реагентах и продуктах.
Убедитесь, что учащиеся видят, что каждый тип атома в левой части уравнения также находится в правой. Также убедитесь, что они видят одинаковое количество каждого типа с обеих сторон уравнения.
Также убедитесь, что они видят одинаковое количество каждого типа с обеих сторон уравнения.
Разделите продукты, чтобы показать, что осадок является твердым.
Спросите студентов:
- Как вы думаете, как мы можем отделить осадок от других продуктов?
Вопрос для изучения
Можете ли вы отделить карбонат кальция от остальных продуктов?
Материалы для каждой группы
- Кофейный фильтр или бумажное полотенце
- Высокий прозрачный пластиковый стаканчик
Процедура
- Используйте фильтр для кофе (или бумажное полотенце) достаточно большого размера, чтобы его можно было протолкнуть в чашку примерно на ⅓ и оставить достаточно, чтобы удерживать его снаружи чашки.
Удерживая кофейный фильтр на месте, высыпьте продукты в центр кофейного фильтра.
- Дайте жидкости стечь через фильтр. Это может занять некоторое время.
- Отложите осадок и дайте воде испариться.

Ожидаемые результаты
В фильтре для кофе останется белое твердое вещество. После испарения воды карбонат кальция будет представлять собой белый порошок.
Примечание. Если вы хотите отделить хлорид натрия от воды, прошедшей через фильтр, вылейте жидкость в чистую пустую чашку и дайте воде испариться в течение нескольких дней. По мере испарения воды учащиеся увидят, как в растворе образуются кристаллы соли кубической формы. В конце концов в чашке останутся только кристаллы соли.
Спросите студентов:
- Что представляет собой твердое белое вещество на бумаге?
- Карбонат кальция (мел).
- Является ли отфильтровывание карбоната кальция и выпаривание воды химическим или физическим изменением?
- Физическое изменение.
- Почему?
- Эти вещества уже присутствовали в воде, поэтому новые химикаты не производятся.
- Какие имеются доказательства того, что при смешивании раствора пищевой соды и раствора хлорида кальция произошла химическая реакция?
- Образовались газ и белое твердое вещество
Подтверждение того, что произошла химическая реакция
Спросите студентов:
- Как мы можем сравнить осадок с реагентами, чтобы убедиться, что осадок действительно отличается от них обоих?
- Проведите тест на растворимость всех трех веществ.

Вопрос для изучения
Отличается ли растворимость осадка от растворимости пищевой соды и хлорида кальция?
Спросите студентов:
Как нам настроить тест на растворимость?
- Должны ли мы использовать одинаковое количество каждого вещества?
- Да
- Должны ли мы использовать одинаковое количество воды?
- Да
Материалы для каждой группы
- Сухой осадок на бумажном полотенце
- Весы
- 3 маленьких пластиковых стаканчика
- Градуированный цилиндр
- Градуированный цилиндр
- Палочка для эскимо (дополнительно)
- Хлорид кальция
- Пищевая сода
- Вода
Процедура
- Этикетка 3 чашки бикарбонат натрия, хлорид кальция, осадок и
- Ложкой или палочкой от мороженого соскребите осадок в кучу.
- Соберите осадок в ¼ чайной ложки, пока он не станет как можно более полным.
 Поместите ¼ чайной ложки осадка в чашку с надписью.
Поместите ¼ чайной ложки осадка в чашку с надписью. - Поместите ¼ чайной ложки бикарбоната натрия и хлорида кальция в соответствующие чашки.
- Добавьте 25 мл воды в каждую чашку и осторожно перемешайте, пока твердые вещества не растворятся в максимально возможной степени. Посмотрите, сколько твердого вещества осталось нерастворенным в каждой чашке.
Ожидаемые результаты
Бикарбонат натрия и хлорид кальция растворяются, а осадок не растворяется.
Поскольку осадок не растворяется, как ни один из реагентов, он должен быть другим веществом, чем реагенты. Следовательно, должна была произойти химическая реакция.
Проведите демонстрацию, чтобы показать учащимся еще один пример осадка и изменения цвета.
Скажите учащимся, что вы покажете им еще одну реакцию с образованием осадка и кое-что еще.
Материалы для демонстрации
- Сульфат меди II
- Аммиак бытовой
- Перекись водорода (3%)
- Вода
- Градуированный цилиндр
- Пробирка
- 2 капельницы
- 1 прозрачный пластиковый стаканчик (пустой)
Примечание. Соединение меди называется «медь II», потому что медь может образовывать различные типы ионов.Он может потерять один электрон и быть просто Cu + или может потерять два электрона и стать Cu 2+ . Этот тип иона меди называется медью II. «Сульфат» в сульфате меди II также является ионом. Этот ион состоит из более чем одного атома. Это один из многоатомных ионов, обсуждавшихся в главе 4, уроке 3. Ион сульфата состоит из атома серы, связанного с четырьмя атомами кислорода, и рассматривается как один ион (SO 4 2− ).
Соединение меди называется «медь II», потому что медь может образовывать различные типы ионов.Он может потерять один электрон и быть просто Cu + или может потерять два электрона и стать Cu 2+ . Этот тип иона меди называется медью II. «Сульфат» в сульфате меди II также является ионом. Этот ион состоит из более чем одного атома. Это один из многоатомных ионов, обсуждавшихся в главе 4, уроке 3. Ион сульфата состоит из атома серы, связанного с четырьмя атомами кислорода, и рассматривается как один ион (SO 4 2− ).
Подготовка учителей
Приготовьте раствор сульфата меди II, добавив 5 г сульфата меди II в 50 мл воды.
Процедура
- Налейте 15–20 мл раствора сульфата меди II в пробирку так, чтобы она была заполнена примерно на ½.
- Добавьте около 10–20 капель нашатырного спирта.
- Добавьте примерно 10–20 капель перекиси водорода.
Ожидаемые результаты
После добавления аммиака в верхней части раствора сульфата меди II образуется беловатый осадок. По мере добавления большего количества аммиака цвет верхней части жидкости изменится на более глубокий темно-синий.По мере добавления перекиси водорода темно-синяя область в верхней части раствора становится темно-зеленой, и образуется темный осадок.
По мере добавления большего количества аммиака цвет верхней части жидкости изменится на более глубокий темно-синий.По мере добавления перекиси водорода темно-синяя область в верхней части раствора становится темно-зеленой, и образуется темный осадок.
Примечание. Детали химических реакций, приводящих к различным осадкам и изменению цвета, довольно сложны. Основная идея для студентов состоит в том, что атомы или группы атомов в реагентах перестраиваются и связываются по-разному, образуя различные вещества в продуктах.
Сообщите учащимся, что когда они видят выделение газа, осадка или изменение цвета, это свидетельствует о протекании химической реакции.
Спросите студентов:
- Как вы можете сказать, что было сделано что-то новое, когда сульфат меди II и аммиак прореагировали?
- Образовался осадок.
- Как вы можете сказать, что было сделано что-то новое, когда эти вещества реагировали с перекисью водорода?
- Изменение цвета и другой осадок свидетельствуют о другой химической реакции.

Проект в классе или дома.
Предложите учащимся использовать такие предметы, как жевательные резинки, бусинки, M&Ms, лего или другие мелкие предметы, чтобы изобразить атомы в двух из трех реакций, которые они исследовали до сих пор. Учащиеся могут скотчем или приклеить объекты к плакатной доске и записать химическую формулу реагентов и продуктов.
Приготовление кренделей в домашних условиях | Выпечка короля Артура
№
Приготовить традиционный мягкий крендель в домашних условиях можно почти так же, как и в профессиональной пекарне: замесить тесто, оставить для брожения, придать форму, окунуть в щелочную ванну, а затем испечь.Хотя существует множество способов придания формы кренделям, которые мы рассмотрим позже, часть, которая иногда отличает домашнего пекаря от профессионального пекаря, заключается в том, как они готовят щелочную ванну: при приготовлении кренделей в домашних условиях в большинстве случаев используется обычная пищевая сода. , в то время как во многих пекарнях для ванн используется щелочь (каустическая сода).
, в то время как во многих пекарнях для ванн используется щелочь (каустическая сода).
Щелок — это сильная щелочь, которая может быть опасна при неправильном использовании, но именно щелочь усиливает реакцию Майяра на внешней стороне теста. Эта реакция придает каждому претцелю жевательную корочку, цвет красного дерева, глянцевый блеск и безошибочно узнаваемый вкус претцеля, типичный для мягкого немецкого претцеля.
Использование ванны с пищевой содой, которая не такая едкая, как щелочь, дает аналогичный результат, но не с такой интенсивностью. Внешняя корка все еще будет несколько мягкой; окраска выглядит коричневой, а не насыщенным красным деревом; на корке гораздо меньше блеска; и типичный вкус кренделя присутствует, но не в той же степени.
Несмотря на то, что каждый подход к щелочной ванне приводит к разным результатам, оба стиля имеют очень приятный вкус. Давайте рассмотрим каждый способ приготовления крендельной ванны.Вы сами можете решить, что подходит для вашей кухни.
Приготовление кренделей в домашних условиях с использованием щелочной ванны
Традиционные немецкие крендельки перед выпечкой сначала погружают в ванну с 3-4% раствором щелочи в воде. Сторонники чистоты кренделя часто утверждают, что крендель на самом деле не крендель, если в нем не используется щелочь.
Крендели с солью, показанные выше, были погружены в 4%-й раствор щелочи с использованием процесса, описанного в статье Джеффри Хамельмана «Хлеб», прежде чем надрезать их, посолить, а затем выпечь при температуре 450°F. Как видите, они пропеклись до красивого цвета красного дерева с блестящей корочкой.
Давайте признаем: щелочь может быть немного пугающей. В конце концов, он очень агрессивен, но при правильной подготовке и осторожном подходе работа с ним не так сложна, как вы думаете.
Процесс прост. Надев защитные очки и резиновые или латексные перчатки, смешайте 37 г порошка/гранул щелочного раствора в миске с 4 чашками (907 г) холодной воды и перемешайте до растворения. Перенесите сформированный крендель в ванну на 10-15 секунд. Затем выньте крендель и положите его на стальную решетку на пергаментную бумагу, чтобы собрать лишний раствор.Через несколько минут переложите обмоченный крендель на противень, застеленный силиконом или пергаментной бумагой. Затем тесто можно надрезать, посолить и испечь.
Перенесите сформированный крендель в ванну на 10-15 секунд. Затем выньте крендель и положите его на стальную решетку на пергаментную бумагу, чтобы собрать лишний раствор.Через несколько минут переложите обмоченный крендель на противень, застеленный силиконом или пергаментной бумагой. Затем тесто можно надрезать, посолить и испечь.
Не ожидайте найти пищевой щелок (100% гидроксид натрия) в продуктовых магазинах, но в США его легко можно купить в Интернете.
Приготовление крендельков дома с пищевой содой
Использование ванночки с пищевой содой является распространенным подходом для домашних пекарей кренделей. Пищевая сода является основным продуктом многих рецептов выпечки, и это гораздо более слабая щелочь.Это означает, что он гораздо менее агрессивен и безопаснее в обращении.
Как вы можете видеть выше, получившиеся крендельки по-прежнему выглядят великолепно, но у них меньше цвета корочки и меньше блеска. Текстурно интерьер был все еще довольно жевательным и мягким. Хотя классический вкус кренделя все еще ощущался, он не был такой интенсивности, как у кренделей, приготовленных с использованием щелочной ванны.
Хотя классический вкус кренделя все еще ощущался, он не был такой интенсивности, как у кренделей, приготовленных с использованием щелочной ванны.
Ванна с пищевой содой, показанная выше, соответствует рецепту классических кренделей короля Артура. В большой широкой кастрюле доведите до кипения 6 стаканов воды и 2 столовые ложки пищевой соды.Затем перенесите один сформированный крендель в ванну с помощью шпателя с прорезями и оставьте на 1 минуту. Затем переместите крендель на решетку для охлаждения поверх пергаментной бумаги. Это позволит стечь лишнему раствору.
После обработки переложите каждый крендель на противень, застеленный силиконом или пергаментной бумагой. Затем надрежьте (как показано ниже), посолите и запеките.
Формование классических кренделей
Теперь, когда мы обсудили различия между ванночками с кренделями, как нам сформировать эти красивые маленькие узелки?
Обычно существует два метода придания кренделям формы традиционного узла:
В юго-западной Германии (Швабия) крендельки обычно имеют преувеличенную выпуклость внизу, сопровождаемую большой петлей кренделя. Кроме того, скрещенные руки в верхней части кренделя очень тонко раскатаны. Цель состоит в том, чтобы получить толстую, мягкую часть на одном конце и нежные, хрустящие кусочки на другом. Это приводит к отчетливому контрасту текстуры между каждым концом.
Кроме того, скрещенные руки в верхней части кренделя очень тонко раскатаны. Цель состоит в том, чтобы получить толстую, мягкую часть на одном конце и нежные, хрустящие кусочки на другом. Это приводит к отчетливому контрасту текстуры между каждым концом.
В Баварии крендели меньше сужаются от середины выпуклости к скрещенным плечам. Этот стиль подчеркивает постоянную толщину на всем протяжении. Эта постоянная толщина делает их идеальными для нарезки и приготовления сэндвичей. Конечно, они также отлично подходят для погружения.
Я предпочитаю, чтобы крендель был более однородным. Как и во многих других вещах в выпечке, придание формы требует некоторой практики. Как только вы научитесь раскатывать тесто до желаемой толщины, окончательное скручивание не составит труда.
Сначала сформируйте из теста «сигары» и дайте им отдохнуть, пока они немного не расслабятся. Затем раскатайте тесто в длинную прядь, как показано выше. Затем выложите тесто перед собой в форме перевернутой буквы «U» (вверху слева, вверху). Возьмите кончик с правой стороны и сложите его поверх левой.
Возьмите кончик с правой стороны и сложите его поверх левой.
Затем возьмите кончик, который теперь находится с правой стороны, и снова согните его поверх левой стороны (второй поворот). Наконец, сложите кончики так, чтобы они перекрывали стороны петли кренделя (внизу справа, вверху). Слегка надавите на перекрывающиеся кончики, чтобы стимулировать прилипание.
Приготовление крендельков дома: какой способ выбрать?
После долгих испытаний я был удивлен, увидев, насколько хорошо получились мои крендели с пищевой содой.Как пекарь, который обычно любит придерживаться традиций, я сначала сомневался, но использование пищевой соды оказалось вполне приемлемой альтернативой. Хотя я предпочитаю использовать щелочь, как для вкуса, так и для текстуры, я все равно буду доволен результатами, используя пищевую соду.
В конце концов, выбор между щелочью и пищевой содой остается за вами. Если вы опасаетесь приносить щелочь на кухню, хорошо подойдет пищевая сода. И хотя у вас не будет того же цвета, блеска и текстуры, он все равно сводится (извините!) к восхитительному кренделю.
И хотя у вас не будет того же цвета, блеска и текстуры, он все равно сводится (извините!) к восхитительному кренделю.
Мой совет по формированию: каждый раз пробуйте новый подход, пока не найдете один (или два), которые вам понравятся. Иногда приятно иметь тонкие «руки» для кранча. Но бывают моменты, когда нет ничего лучше кренделя, начиненного как бутерброд.
Если вы ищете дополнительную информацию о приготовлении кренделей в домашних условиях, особенно об традиционном использовании щелочи, обратите внимание на авторитетную книгу Хамельмана ХЛЕБ. Как он утверждает в своей книге, он готовил более тысячи кренделей в неделю — если кто-то и знает крендели с солью, то, осмелюсь сказать, это он.
Приятного аппетита!
.
 Таким «коктейлем» опрыскивают листву, стебли, плоды пораженных растений. Специалисты настоятельно не рекомендуют обрабатывать культуры во время их цветения.
Таким «коктейлем» опрыскивают листву, стебли, плоды пораженных растений. Специалисты настоятельно не рекомендуют обрабатывать культуры во время их цветения.

 10.1, для их ухода и обслуживания. Этот эксперимент не увенчается успехом, если используемые бюретки имеют жесткие, заблокированные или негерметичные запорные краны. Современные бюретки с запорными кранами из ПТФЭ намного проще в использовании, не требуют смазки и не забиваются. Не рекомендуются бюретки с кранами любого типа; хотя они дешевы, они также подвержены утечке, особенно в руках начинающих студентов.
10.1, для их ухода и обслуживания. Этот эксперимент не увенчается успехом, если используемые бюретки имеют жесткие, заблокированные или негерметичные запорные краны. Современные бюретки с запорными кранами из ПТФЭ намного проще в использовании, не требуют смазки и не забиваются. Не рекомендуются бюретки с кранами любого типа; хотя они дешевы, они также подвержены утечке, особенно в руках начинающих студентов. Однако нельзя допускать полного высыхания посуды, так как это портит качество кристаллов.Время от времени проверяя, можно решить, когда сцеживать излишки раствора из каждой чашки, чтобы оставить хорошие кристаллы для проверки учащимися в дальнейшем.
Однако нельзя допускать полного высыхания посуды, так как это портит качество кристаллов.Время от времени проверяя, можно решить, когда сцеживать излишки раствора из каждой чашки, чтобы оставить хорошие кристаллы для проверки учащимися в дальнейшем. Концентрация раствора не требует высокой точности, но должна быть достаточно близкой к той же концентрации, что и разбавленная соляная кислота, и менее 0,5 М.
Концентрация раствора не требует высокой точности, но должна быть достаточно близкой к той же концентрации, что и разбавленная соляная кислота, и менее 0,5 М. )
) Уменьшите объем раствора примерно наполовину, нагревая его на треугольнике из глины или керамической сетке над пламенем горелки Бунзена от слабого до среднего. Раствор выплескивается ближе к концу, и вы получаете меньше кристаллов. Не кипятить всухую. Возможно, вам придется выпаривать раствор порциями, скажем, по 20 см 3 во избежание переполнения резервуара для выпаривания. Не пытайтесь снять горячую чашу со штатива — сначала дайте остыть, а затем перелейте в чашу для кристаллизации.
Уменьшите объем раствора примерно наполовину, нагревая его на треугольнике из глины или керамической сетке над пламенем горелки Бунзена от слабого до среднего. Раствор выплескивается ближе к концу, и вы получаете меньше кристаллов. Не кипятить всухую. Возможно, вам придется выпаривать раствор порциями, скажем, по 20 см 3 во избежание переполнения резервуара для выпаривания. Не пытайтесь снять горячую чашу со штатива — сначала дайте остыть, а затем перелейте в чашу для кристаллизации. Перемешивайте, пока раствор не станет прозрачным.
Перемешивайте, пока раствор не станет прозрачным.



 Поместите ¼ чайной ложки осадка в чашку с надписью.
Поместите ¼ чайной ложки осадка в чашку с надписью.