что входит в состав, какая от него польза и есть ли вред?
Гематоген считается одним из самых популярных БАДов для восполнения нехватки железа в организме. Мы знакомы с ним с детства — многие малыши любят это сладкое лакомство. Но, несмотря на приятный вкус, гематоген — это не кондитерское изделие, и его применение связано с некоторыми ограничениями. Из чего состоят эти сладкие плитки, насколько они эффективны для профилактики железодефицитной анемии, в чем заключается польза этой пищевой добавки, может ли она навредить здоровью и, наконец, как правильно принимать гематоген?
Из истории создания гематогена
В XIX веке стараниями выдающегося врача Сергея Боткина была выявлена связь между составом крови и здоровьем человека. Конечно, предположения о том, что кровь несет некую «жизненную силу», высказывались и ранее, но лишь в середине позапрошлого века было доказано, что кровопотеря и снижение уровня железа в крови приводят к слабости, упадку сил и нарушению многих важных функций.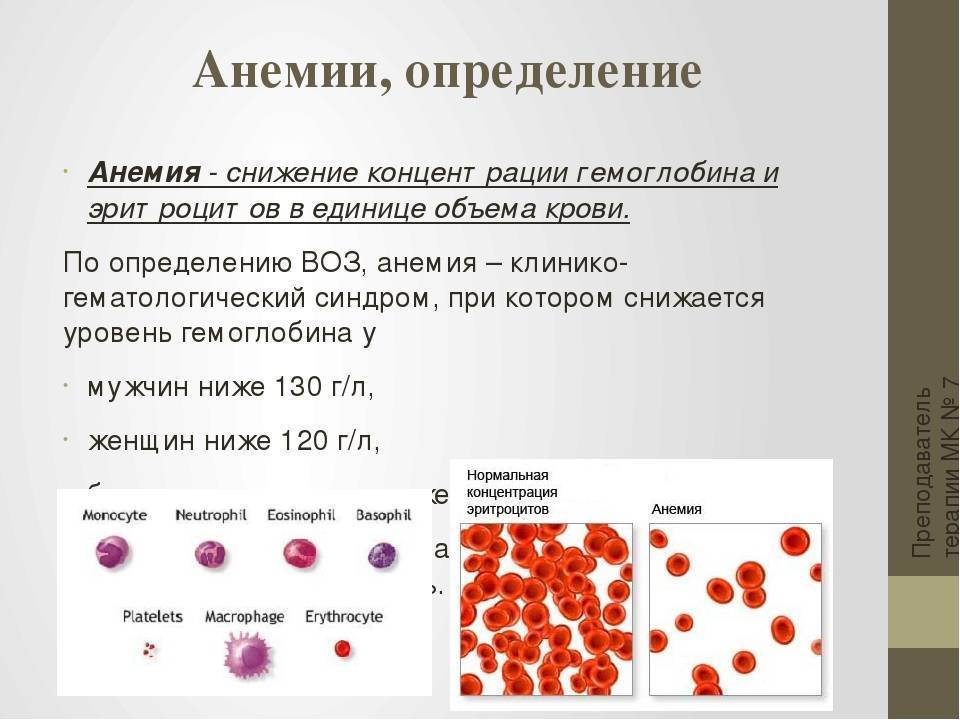
Начались активные поиски средства, которое помогало бы улучшить качество крови, повысить количество гемоглобина — белка, который с помощью железа переносит кислород к органам. В 1890 году в Швейцарии был разработан первый гематоген — богатая железом микстура на основе бычьей крови. Ее эффективность была так высока, что средство моментально получило широкое распространение. После революции гематоген начали выпускать и в России. Во времена Второй мировой гематоген стал жизненно важным препаратом, его активно использовали в военных госпиталях для реабилитации раненых, потерявших много крови.
После войны в СССР было решено провести «ребрендинг» гематогена, приспособив его под нужды послевоенного времени. В те годы питание часто было бедным, однообразным и недостаточным, детская анемия стала обычным явлением. Так появился знакомый нам твердый гематоген — сладкая плитка, похожая на ирис. Он нравился и детям, и взрослым, мог заменить конфеты к чаю, стоил дешево, легко делился на порции и не выглядел, как лекарство. Над разработкой рецептуры трудились лучшие умы медицины того времени. С 1970 годов гематоген начали выпускать на Уфимском заводе витаминов, причем технология много раз улучшалась и совершенствовалась.
Над разработкой рецептуры трудились лучшие умы медицины того времени. С 1970 годов гематоген начали выпускать на Уфимском заводе витаминов, причем технология много раз улучшалась и совершенствовалась.
Последнее серьезное изменение произошло в 1999 году, когда технологи Уфимского завода витаминов и ученые Санкт-Петербургской Военно-медицинской академии имени С. М. Кирова объединили усилия, чтобы создать намного более эффективный продукт. В состав гематогена были добавлены витамины, которые повышают усвояемость железа и оказывают общеукрепляющее действие. Позднее к работе были привлечены и европейские технологи, которые помогли сделать продукт вкуснее и мягче. Новый продукт — «Феррогематоген-Фармстандарт» — превосходит по эффективности более ранние аналоги, к тому же он гораздо приятнее на вкус.
В настоящее время Уфимский витаминный завод входит в группу «Фармстандарт» и специализируется на создании и выпуске современных высокоэффективных витаминных комплексов, а «Феррогематоген» остается одним из самых популярных продуктов компании.
Важно!
Популярность гематогена привела к появлению огромного количества аналогов, но многие из них копируют лишь вкус этого средства, не обладая его полезными свойствами. Поскольку по закону сладости, не содержащие альбумина, не могут называться именно гематогеном, их производители выходят из положения, изменяя название на созвучное — «Гемаген», «Гематогешка» и т.д. Эти сладкие плитки могут быть обогащены витаминами, но гематогеном они не являются.
Из чего сделан гематоген: состав пастилок
Основной действующий компонент гематогена — белок альбумин, получаемый из очищенной бычьей крови. Это вещество богато железом и может восполнить железодефицит. Готовый к употреблению альбумин выглядит как растворимый в воде порошок. Цельную кровь в гематоген не добавляют с 1950 годов — это крайне устаревшая технология.
По ГОСТу, продукт «гематоген детский» должен содержать 4–5% черного пищевого альбумина, 30–33% сгущенного молока с сахаром, 18–23% крахмальной патоки, 0,01–0,015% ванилина и около 40% сахара.
Однако сегодня производители сами решают, следовать ГОСТу или использовать другие рецептуры. Поэтому покупателю приходится внимательно читать состав продукта. Очень часто производством аналогов гематогена занимаются не фармацевтические компании, а кондитерские фабрики, и их продукция может вообще не содержать альбумина. В некоторых плитках альбумин есть, но в незначительной концентрации — менее 2,5%. К тому же ради улучшения вкуса в такой продукт нередко добавляют орехи, семечки, кокосовую стружку, изюм, сухофрукты, цукаты, шоколад, ароматизаторы и вкусовые добавки. Это увеличивает калорийность батончика (и без того немалую!) и может препятствовать всасыванию железа.
Чем полезен гематоген
Настоящий гематоген — ценный БАД. Это источник белка и аминокислот, необходимых для регулировки обменных процессов. Но самое важное качество гематогена — способность восполнять нехватку железа. Железодефицит — проблема, которая знакома едва ли не каждому жителю нашей планеты. На разных этапах жизни почти все мы хоть раз сталкиваемся с проявлениями дефицита этого элемента. Железо — один из основных элементов гемоглобина. Это вещество необходимо для транспортировки кислорода ко всем тканям организма. При нехватке железа снижается уровень гемоглобина (если он падает до критической отметки, говорят о железодефицитной анемии). Нехватка железа чревата массой проблем, поскольку кислород требуется всем органам и системам. Симптомы железодефицита разнообразны — сухая, бледная кожа, ломкие ногти и волосы, сонливость и хроническая усталость, раздражительность, ухудшение памяти и концентрации, появление странных пищевых пристрастий и восприятия запахов (часто люди с железодефицитом начинают грызть мел или находить запах автомобильных выхлопов очень приятным), головные и мышечные боли, сухость во рту, проблемы с глотанием.
Железо — один из основных элементов гемоглобина. Это вещество необходимо для транспортировки кислорода ко всем тканям организма. При нехватке железа снижается уровень гемоглобина (если он падает до критической отметки, говорят о железодефицитной анемии). Нехватка железа чревата массой проблем, поскольку кислород требуется всем органам и системам. Симптомы железодефицита разнообразны — сухая, бледная кожа, ломкие ногти и волосы, сонливость и хроническая усталость, раздражительность, ухудшение памяти и концентрации, появление странных пищевых пристрастий и восприятия запахов (часто люди с железодефицитом начинают грызть мел или находить запах автомобильных выхлопов очень приятным), головные и мышечные боли, сухость во рту, проблемы с глотанием.
Причиной нехватки железа часто становится несбалансированная диета. Занятые горожане, вынужденные питаться фаст-фудом и полуфабрикатами, женщины, которые придерживаются строгой диеты, привередливые в еде малыши — все они входят в группу риска по железодефициту.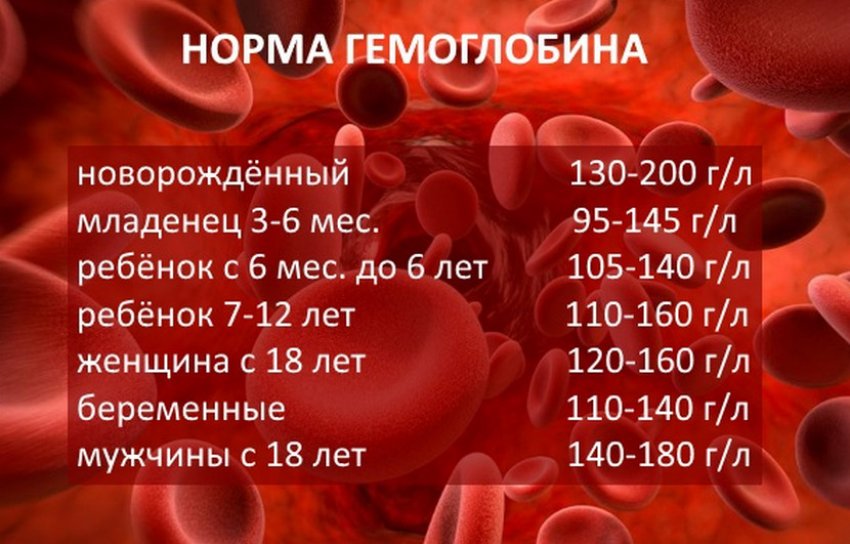 Даже при хорошем питании мы получаем с пищей лишь около 20% необходимого нам железа. Но большинство людей питается неправильно, и поступление этого элемента при несбалансированной диете еще ниже.
Даже при хорошем питании мы получаем с пищей лишь около 20% необходимого нам железа. Но большинство людей питается неправильно, и поступление этого элемента при несбалансированной диете еще ниже.
Часто причиной железодефицита становятся и кровопотери — причем не только в результате травм и операций. К нехватке железа могут привести частые носовые кровотечения (особенно это характерно для детей), обильные менструации и кровопотери во время родов, кровотечения при геморрое и некоторых заболеваниях внутренних органов.
Иногда железо поступает в полном объеме, но плохо усваивается из-за патологических изменений в кишечнике, из-за болезни или нехватки некоторых витаминов, без которых всасывание этого элемента невозможно (в частности, витамина С).
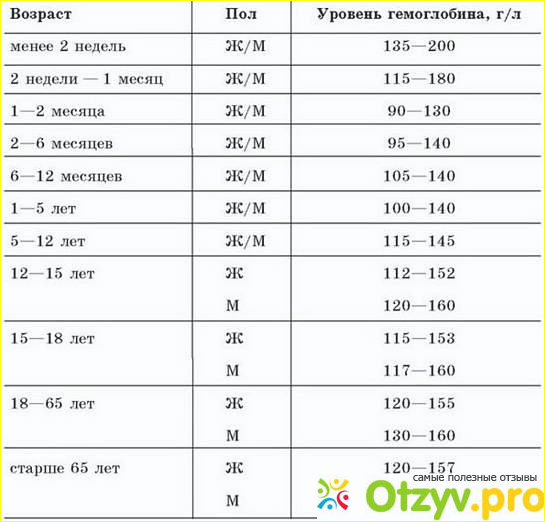
В определенные периоды — при беременности и лактации, после операций, в детские годы, — наша потребность в железе особенно высока и норма его потребления должна быть увеличена, иначе железодефицита не миновать.
Определить низкий уровень железа можно не только по описанным выше признакам, но и при помощи обычного анализа крови. Если содержание железа в крови понижено, рекомендуется принимать железосодержащие препараты, в частности, гематоген. Врачи также рекомендуют использовать его для профилактики железодефицита.
Если содержание железа в крови понижено, рекомендуется принимать железосодержащие препараты, в частности, гематоген. Врачи также рекомендуют использовать его для профилактики железодефицита.
Польза для детей
Дети и подростки до 18 лет должны получать 5–15 мг железа в сутки — чем старше ребенок, тем выше потребность в этом элементе. При нехватке железа дети становятся вялыми и капризными, плохо спят, у школьников падает успеваемость. Недостаток железа у детей может быть вызван как погрешностями в диете, кровотечениями и заболеваниями, так и наличием у мамы железодефицита и анемии во время беременности и кормления грудью.
Чем полезен гематоген детям? Его применение поможет ребенку справиться с высокими нагрузками в школе, предотвратить железодефицит и спровоцированное им отставание в физическом развитии, улучшит иммунитет.
Польза для мужчин
Суточная норма железа для мужчины — 10 мг. По статистике, мужчины страдают от нехватки железа реже женщин и детей, тем не менее они не застрахованы от этой проблемы.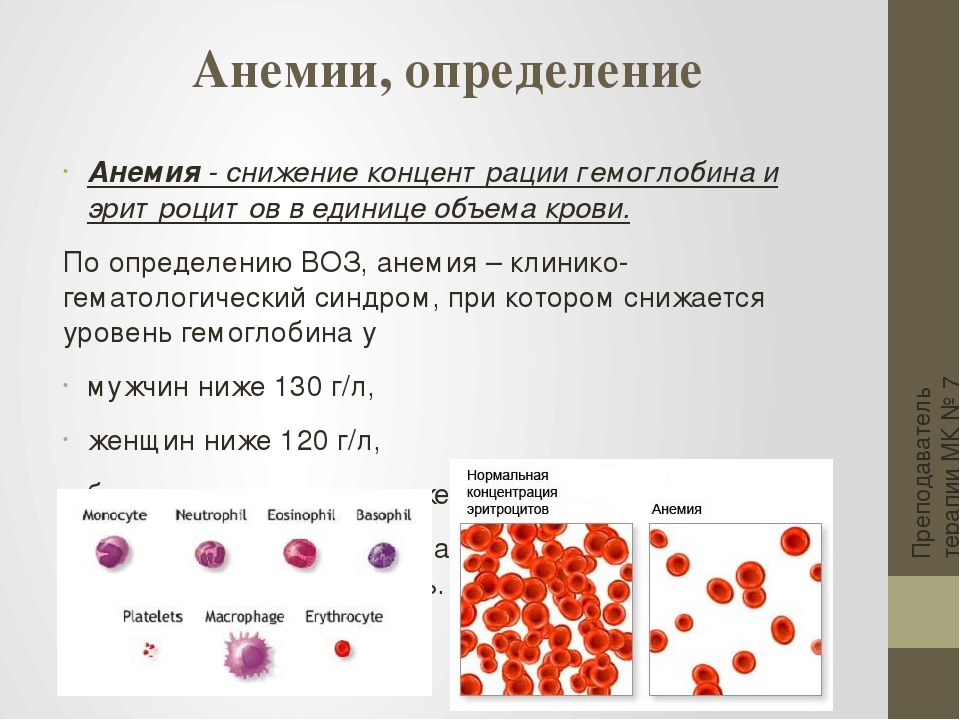 Чаще всего потребность в дополнительном источнике железа испытывают те, кто привык питаться кое-как, всухомятку, чипсами, бутербродами и фаст-фудом, а это очень обширная категория: от студентов и молодых холостяков до карьеристов, лишенных свободного времени. Неумеренное употребление алкоголя также приводит к железодефициту, а мужчины, как правило, выпивают активнее женщин.
Чаще всего потребность в дополнительном источнике железа испытывают те, кто привык питаться кое-как, всухомятку, чипсами, бутербродами и фаст-фудом, а это очень обширная категория: от студентов и молодых холостяков до карьеристов, лишенных свободного времени. Неумеренное употребление алкоголя также приводит к железодефициту, а мужчины, как правило, выпивают активнее женщин.
Ежедневное употребление гематогена помогает восстановить уровень железа и избавиться от постоянной усталости, апатичности, одышки и головных болей, оставаться физически активным и выносливым.
Польза для женщин
Норма железа для женщин — 15 мг в сутки, а во время беременности и лактации она может возрасти до 20 мг и выше. По данным исследований, именно женщины страдают от нехватки железа чаще всего. Примерно 60% женщин хотя бы раз сталкивалось с симптомами железодефицита. Причиной тому — ежемесячные кровопотери во время менструаций и ограничения в еде. Многие женщины придерживаются строгих диет ради стройности, но такие диеты нередко исключают продукты, богатые железом — красное мясо, субпродукты, яйца — и в результате организм не получает нужного количества витаминов и минералов.
Польза гематогена для женщин несомненна — его употребление позволяет укрепить иммунитет, справиться с хронической усталостью, раздражительностью и плаксивостью, головными болями и головокружениями. Железодефицит пагубно сказывается не только на состоянии здоровья женщины, но и на ее внешности. Использование гематогена в целях профилактики нехватки железа возвращает коже гладкость и здоровый цвет, укрепляет ногти и волосы.
Гематоген советуют употреблять при беременности и лактации — это позволит не только избежать развития железодефицита у мамы, но и убережет от этой неприятности ребенка.
А есть ли вред?
Мы рассмотрели, чем полезен гематоген, но есть ли у этого продукта «темная сторона»?
Прежде всего следует понимать, что гематоген — это не конфета, а БАД, поэтому употреблять его бесконтрольно не следует. Лучше всего посоветоваться с врачом. Важно также соблюдать дозировку, указанную на упаковке, и не превышать ее.
Гематоген очень вкусен, однако, это калорийный продукт. В 100 г гематогена содержится 370–500 килокалорий, и об этом следует помнить, включая его в рацион. Особенно калорийны разновидности с добавками — орехами, шоколадом и другими.
В 100 г гематогена содержится 370–500 килокалорий, и об этом следует помнить, включая его в рацион. Особенно калорийны разновидности с добавками — орехами, шоколадом и другими.
Как выбрать правильный гематоген
Поскольку гематоген — это не лекарство, продают его не только в аптеках. Для его покупки не требуется рецепта. И, как уже было сказано выше, далеко не все производители заботятся о пользе продукта. Многие виды этой добавки не обладают никакими полезными свойствами — это, в сущности, кондитерское изделие.
Главное отличие хорошего гематогена — высокое содержание альбумина, не менее 3%. Такое количество альбумина уже способно повлиять на уровень железа и состав крови.
Имейте в виду, что любые посторонние компоненты могут негативно сказываться на всасывании железа, к тому же они делают продукт калорийнее. Лучше выбирать гематоген без таких «присадок», но с высоким содержанием альбумина.
Если вы покупаете гематоген в качестве биодобавки, а не в качестве лакомства, выбирайте сорта, выпущенные фармацевтическими концернами, а не кондитерскими фабриками. В такой гематоген не добавляют орехи и цукаты, зато он дополнительно обогащен витаминами и другими компонентами, которые повышают его ценность и способствуют наиболее эффективному всасыванию железа.
В такой гематоген не добавляют орехи и цукаты, зато он дополнительно обогащен витаминами и другими компонентами, которые повышают его ценность и способствуют наиболее эффективному всасыванию железа.
Терапия андрогенами у мужчин с сахарным диабетом 1 типа, получающих лечение программным гемодиализом | Лепетухин
С 1990 по 2005 год количество больных с терминальной хронической почечной недостаточностью (тХПН) увеличилось в 3 раза, в основном за счет пациентов с сахарным диабетом (СД) 1 и 2 типа. По данным объединенной системы данных о донорских почках США (US Renal Data Sistem), в мире ежегодное увеличение больных, получающих гемодиализ, составляет 4,1%. Предполагается, что к 2030 году количество пациентов с СД в структуре тХПН увеличится в 10 раз, при этом 70% пациентов, получающих заместительную почечную терапию (ЗПТ), составят больные СД 2 [21]. В Российской Федерации в структуре больных СД с тХПН, получающих ЗПТ, преобладают пациенты с сахарным диабетом 1 типа и составляют 74,6% [1].
Одной из важных причин смертности пациентов на программном гемодиализе (ПГД) является анемия. В 90% случаев у пациентов перед началом ЗПТ уровень гемоглобина составляет менее 90 г/л [13]. Известно, что смертность пациентов на диализе при Нв < 80 г/л в 2 раза выше, чем при Нв 100–110 г/л. Анемия является важным фактором, влияющим на выживаемость больных [1, 5, 8].
Многими исследователями доказано положительное влияние препаратов тестостерона (Т) на эритропоэз, протеин-синтетические и другие анаболические процессы у пациентов с тХПН (в том числе женщин), получающих ЗПТ, при этом назначение препаратов в проведенных исследованиях было вне зависимости от уровня Т в крови [6, 11, 15, 17, 18, 19, 20].
Как известно, тХПН является одной из причин развития гипогонадизма у мужчин. До 70% мужчин с тХПН имеют уровень общего тестостерона (ОТ) в крови ниже нормальных значений [2, 5, 6, 9, 10, 12, 19]. Хроническая декомпенсация сахарного диабета также вносит свой негативный вклад в развитие и прогрессирование андрогенного дефицита [2, 3, 6].
Цель работы: изучение влияния андрогенного дефицита на эритропоэз и коррекция его с помощью комбинированной терапии препаратами эритропоэтина и тестостерона.
Материалы и методы исследования
В исследование включено 43 мужчины с сахарным диабетом 1 типа, получающих терапию ПГД. Пациенты были разделены на 2 группы в соответствии с возрастным критерием: группа 1 (n=20) – моложе 40 лет; группа 2 (n=23) – старше 40 лет. Пациенты обеих групп для коррекции почечной анемии получали комбинированную терапию препаратами эритропоэтина (ЭПО) и Т (смесь эфиров) – Сустанон® 250. Для оценки эффективности действия препарата Т, в каждой группе создавалась подгруппа контроля (монотерапия) – мужчины, получающие препарат ЭПО и не получающие препарат Т. Группы лечения и контроля не различались по возрасту, длительности СД и диализной терапии, уровню HbA1c, Hb, ОT. Длительность исследования составила 6 месяцев.
В исследование не включались пациенты с диагностированным раком простаты и/или грудной железы; при уровне общего простатоспецифического антигена (ПСА) более 4 нг/мл.
Всем пациентам проводилось определение антропометрических показателей (рост, вес, индекс массы тела). Выполнена оценка состояния углеводного обмена, гемопоэза. Для оценки андрогенного дефицита выполнено исследование уровней: лютеинизирующего гормона (ЛГ), ОТ, секс-стероид, связывающего глобулина (СССГ). Дополнительно мужчинам у которых выявлялось снижение уровня тестостерона, проводилось исследование уровня пролактина в крови (при этом в исследование включались пациенты с уровнем пролактина в пределах нормы). Гормональное исследование выполнено в лаборатории ФГУ ЭНЦ Росмедтехнологий (руководитель – профессор Н.П. Гончаров). Определение свободного тестостерона (РСТ) осуществлялось математическим методом (http://www.issam.ch/freetesto.htm). Для оценки безопасности терапии препаратом тестостерона выполнено пальцевое ректальное и ультразвуковое исследование предстательной железы, определение уровня ПСА в крови.
Статистические методы анализа данных: статистическая обработка полученных данных была проведена с использованием специализированной программы Statistica 6. 0.
0.
Результаты исследования
Общая характеристика обследованных больных представлена в табл. 1.
Для оценки состояния гипоталамо-гипофизарно-тестикулярной оси выполнено гормональное исследование с определением уровней ЛГ, ОТ, СССГ в сыворотке крови у всех пациентов (табл. 2).
Дефицит андрогенов, определяемый как уровень Т менее 12 нмоль/л, выявлен у 21 из 43 мужчин общей группы, что составило 48,8% (см. рис. 1). В группе 2 уровень Т был существенно ниже, чем в группе 1 (см. табл. 2). Данный факт подтверждает снижение уровня Т в крови с увеличением возраста мужчин. В группе мужчин с СД 1 на ПГД в возрасте 30–39 лет андрогенный дефицит выявлен в 5,0% случаев (рис. 2), что соответствует данным в общей популяции [14]. В группе мужчин с СД 1 на ПГД в возрасте 40–49 лет снижение уровня Т ниже нормы определялось в 81,2% случаев (рис. 2), что превышает показатель такой же возрастной группы в общей популяции в 9 раз (9% в общей популяции), а в группе 50–59 лет – в 8 раз (12% в общей популяции) [14]. При распределении мужчин по возрастным группам получены данные, демонстрирующие, что прогрессивное снижение концентрации Т с возрастом не сопровождается повышением уровня ЛГ выше нормы (рис. 3) – это свидетельствует о вторичности процесса или о нарушении механизма отрицательной обратной связи. Также возможно снижение чувствительности рецепторов Т в гипофизе и на уровне периферических тканей. Данные результаты чрезвычайно важны для понимания патогенеза андрогенного дефицита у больных СД 1 на стадии тХПН. Необходимо отметить, что единого мнения на патогенез данного состояния и взаимодействия гормонов гипоталамо-гипофизарно-тестикулярной оси до сих пор не существует.
При распределении мужчин по возрастным группам получены данные, демонстрирующие, что прогрессивное снижение концентрации Т с возрастом не сопровождается повышением уровня ЛГ выше нормы (рис. 3) – это свидетельствует о вторичности процесса или о нарушении механизма отрицательной обратной связи. Также возможно снижение чувствительности рецепторов Т в гипофизе и на уровне периферических тканей. Данные результаты чрезвычайно важны для понимания патогенеза андрогенного дефицита у больных СД 1 на стадии тХПН. Необходимо отметить, что единого мнения на патогенез данного состояния и взаимодействия гормонов гипоталамо-гипофизарно-тестикулярной оси до сих пор не существует.
Влияние терапии андрогенами на компенсацию сахарного диабета
Полученные в исследовании данные позволили установить, что андрогенный дефицит и его коррекция не влияли на компенсацию сахарного диабета (табл. 3). При разделении общей группы на подгруппы, получающие и не получающие терапию андрогенами, также не было получено изменения уровня HbA1c.
Динамика уровня ОТ в крови в период диализа
При проведении гемодиализа проводилось измерение уровня ОТ в процессе процедуры. При этом выявлено отсутствие значимых различий уровня ОТ в различные периоды диализа (р>0,05). Сравнительный анализ уровня ОТ до диализа, через 2 часа после начала процедуры и после окончания диализа позволяет сделать вывод об отсутствии краткосрочного влияния процедуры гемодиализа на уровень ОТ в крови (рис. 4).
Динамика введенного (экзогенного) тестостерона
Для подбора схемы терапии препаратом тестостерона и определения взаимодействия гормонов гипоталамо-гипофизарно-тестикулярной оси было выполнено одновременное исследование уровня Т (экзогенного) и ЛГ в сыворотке крови (рис. 5). Анализ крови выполнялся до введения препарата, через 24 часа, через 1, 2, 3 и через 4 недели после введения препарата. Рисунок 5 иллюстрирует, что при повышении уровня тестостерона в крови определяется снижение уровня ЛГ по принципу отрицательной обратной связи. При исследовании динамики уровня ОТ в крови после введения препарата выявлено его максимальное повышение в первый день после введения, значения в пределах лабораторной нормы на 3 недели и снижение ниже лабораторной нормы через 4 недели. Динамика уровня препарата в крови у пациентов в исследуемой группе соответствует динамике уровня препарата у мужчин в общей популяции [4]. В результате можно сделать вывод, что программный гемодиализ не оказывает среднесрочного влияния на уровень тестостерона в крови.
При исследовании динамики уровня ОТ в крови после введения препарата выявлено его максимальное повышение в первый день после введения, значения в пределах лабораторной нормы на 3 недели и снижение ниже лабораторной нормы через 4 недели. Динамика уровня препарата в крови у пациентов в исследуемой группе соответствует динамике уровня препарата у мужчин в общей популяции [4]. В результате можно сделать вывод, что программный гемодиализ не оказывает среднесрочного влияния на уровень тестостерона в крови.
Оценка компенсации сахарного диабета по гликированному гемоглобину
В общей популяции больных СД наиболее точным методом оценки состояния компенсации углеводного обмена является уровень гликированного гемоглобина HbA1c. У больных без ХПН уровень HbA1c прямо коррелирует со среднесуточными значениями гликемии. Однако у пациентов с тХПН уровень HbA1c может иметь ложно завышенные или ложно заниженные значения [16].
Результаты международных исследований свидетельствуют о том, что значения HbA1c при тХПН, как правило, не отражают истинные показатели среднесуточной гликемии. Уровень HbA1c от 6 до 7% чаще всего является критерием компенсации СД, соответствующим таковому у лиц без тХПН. Значения HbA1c более 7,5% у больных на диализе могут быть ложно завышены, т.е. истинные значения среднесуточной гликемии у пациентов несколько ниже. Очень высокие значения HbA1c (>8,5%) всегда свидетельствуют о плохой компенсации углеводного обмена и требуют пересмотра дозы и режима сахароснижающей терапии.
Уровень HbA1c от 6 до 7% чаще всего является критерием компенсации СД, соответствующим таковому у лиц без тХПН. Значения HbA1c более 7,5% у больных на диализе могут быть ложно завышены, т.е. истинные значения среднесуточной гликемии у пациентов несколько ниже. Очень высокие значения HbA1c (>8,5%) всегда свидетельствуют о плохой компенсации углеводного обмена и требуют пересмотра дозы и режима сахароснижающей терапии.
Уровень HbA1c, по данным проведенного исследования, от 6 до 7% соответствует корреляционной зависимости выявленной в исследовании DCCT для пациентов с тХПН. При уровне HbA1c больше 7% также повторяется тенденция ложного занижения уровня среднесуточной гликемии, полученной в исследовании DCCT (рис. 6).
Таким образом, у больных СД, получающих лечение диализом, более точная информация о состоянии компенсации углеводного обмена может быть получена при непосредственном мониторировании уровня гликемии в течение суток, в том числе с помощью CGMS.
Исследование влияния комбинированной терапии препаратом ЭПО и тестостерона на уровень гемоглобина и потребность в эритропоэтине (ЭПО)
При разделении группы 1 и 2 на подгруппы с комбинированной терапией (препарат ЭПО и тестостерона) и контроля (монотерапия ЭПО) в группе 1, вне зависимости от вида терапии, данных об увеличении уровня гемоглобина получено не было; в группе 2 получено значимое увеличение уровня гемоглобина на 16,2% (р=0,01) у мужчин, которые получали комбинированную терапию (рис. 7).
7).
Все пациенты до начала исследования получали препарат эритропоэтина в дозах, соответствующих уровню гемоглобина. В процессе исследования доза ЭПО увеличивалась или уменьшалась в зависимости от уровня гемоглобина в крови [8].
При разделении группы 1 и 2 на подгруппы с комбинированной терапией (препарат ЭПО и Т) и контроля (монотерапия ЭПО) получено значимое уменьшение дозы ЭПО в подгруппах, получающих комбинированную терапию, на 32,1% (р=0,007) и 41,1% (р=0,001), соответственно. В группах, получающих монотерапию, уменьшения дозы ЭПО не отмечалось (см. рис. 8).
Исследование безопасности терапии тестостероном в отношении предстательной железы
Для исследования безопасности терапии тестостероном в отношении предстательной железы пациенты были разделены на две группы: 1-я группа – пациенты, получающие препарат тестостерона; 2-я группа – не получающие препарат тестостерона. При пальцевом ректальном и ультразвуковом исследовании (до и после лечения) увеличения предстательной железы в обеих группах выявлено не было. Также не было получено отрицательной динамики уровня ПСА.
Также не было получено отрицательной динамики уровня ПСА.
Экономическая эффективность применения комбинированной терапии препаратами ЭПО и тестостерона (смесь эфиров)
Оценка экономической эффективности комбинированной терапии (ЭПО и Т) в сравнении с монотерапией (ЭПО) выполнялась при помощи специализированного математического метода клинико-экономической матрицы [7].
В течение первого полугода стоимость проведенного лечения на каждого пациента из обеих групп, вне зависимости от вида терапии – комбинированной терапии (ЭПО и Т) или монотерапии (ЭПО), значимо не отличалась. Второе полугодие лечебного процесса позволило, за счет внедренной методики комбинированной терапии, получить экономию в среднем на каждого пациента 39,8%. На годовом интервале экономия составляет 19,1% – в среднем на каждого пациента в группе с комбинированной терапией.
Заключение
Таким образом, андрогенный дефицит у мужчин, получающих лечение ПГД, является широко распространенным состоянием.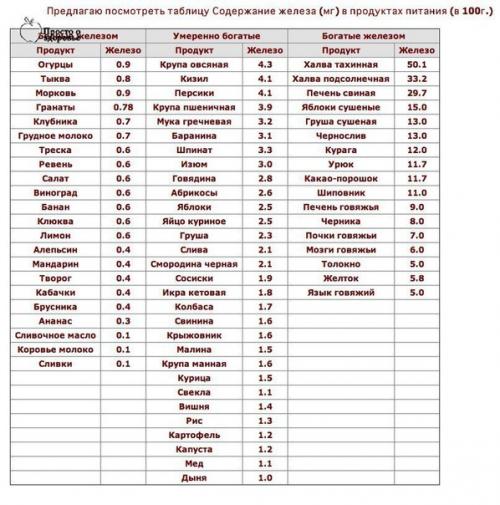 Более выраженное влияние терапии препаратом Т получено в старшей возрастной группе с лабораторно подтвержденным андрогенным дефицитом. В настоящее время разрабатываются новые методы коррекции андрогенного дефицита у мужчин с СД и тХПН. При этом подлежит исследованию вопрос: влияет ли гормональная терапия препаратами Т на продолжительность жизни мужчин с СД 1, получающих лечение ПГД?
Более выраженное влияние терапии препаратом Т получено в старшей возрастной группе с лабораторно подтвержденным андрогенным дефицитом. В настоящее время разрабатываются новые методы коррекции андрогенного дефицита у мужчин с СД и тХПН. При этом подлежит исследованию вопрос: влияет ли гормональная терапия препаратами Т на продолжительность жизни мужчин с СД 1, получающих лечение ПГД?
Выводы
1. Распространенность андрогенного дефицита у мужчин с СД 1 на ПГД зависит от возраста.
2. Наличие андрогенного дефицита у мужчин старше 40 лет с СД 1 на ПГД является самостоятельным независимым фактором риска развития анемии.
3. Добавление препарата Т к терапии ЭПО у мужчин с СД 1 на ПГД позволяет достигать целевых значений уровня гемоглобина в старшей возрастной группе.
4. Добавление препарата Т к терапии ЭПО у мужчин с СД 1 на ПГД снижает потребность в ЭПО не зависимо от возраста.
5. Комбинированная терапия препаратами ЭПО и Т снижает потребность в ЭПО и в результате является экономически эффективной.
1. Бикбов Б.Т., Томилина Н.А. О состоянии заместительной терапии больных с хронической почечной недостаточностью в Российской Федерации в 1998 – 2005 гг. Нефрология и диализ. т.7, №1. 2007.
2. Гончаров Н.П., Кация Г.В., Калинченко С.Ю., и др. Метаболизм андрогенов у мужчин, больных сахарным диабетом 1 типа. Проблемы эндокринологии. 2001. Т. 47, №4. с. 23-26
3. Гончаров Н.П., Кация Г.В., Калинченко С.Ю., Тодуа Т.Н. и др. Современные подходы к оценке андрогенной функции у мужчин на модели сахарного диабета 1 и 2 типа: значение биологически доступного, свободного и общего тестостерона. // Андрология и генитальная хирургия. №2 2003. 53-57).
4. Дедов И.И., Мельниченко Г.А., Рациональная фармакотерапия заболеваний эндокринной системы и нарушений обмена веществ, Руководство по эндокринологии, Т XII, Москва, 2006
Дедов И.И., Мельниченко Г.А., Рациональная фармакотерапия заболеваний эндокринной системы и нарушений обмена веществ, Руководство по эндокринологии, Т XII, Москва, 2006
5. Ермоленко В.М., Иващенко М.А. Уремия и эритропоэтин. Методическое пособие. 2000. 104 с.
6. Лопаткин Н.А., Руководство по урологии, Москва, 1998
7. Хальфин Р.А. с соавт. «Проблемы стандартизации в здравоохранении» № 9, 2004
8. Шестакова М.В., Лепетухин А.Е., Кварацхелия М.В., и др. Ведение больных сахарным диабетом с терминальной хронической почечной недостаточностью на диализе. Методическое пособие. Москва. 2004 г.
9. Abero К., Jangula J., Jain S. et al. Aluminium uptake end toxicity in cultured mouse hepatocytes. // J. Am. Soc. Nephrol. – 1990. – Vol. 11. – P. 1229-1304.
Abero К., Jangula J., Jain S. et al. Aluminium uptake end toxicity in cultured mouse hepatocytes. // J. Am. Soc. Nephrol. – 1990. – Vol. 11. – P. 1229-1304.
10. Bhasin S., et al: Effects of an oral androgen on muscle and metabolism in older, community-dwelling men. Am J Physiol Endocrinol Metab. 284. Vol. 284, Issue 1, E120-E128, January 2003.
11. Everaerd W. Chronic renal failure and sexual functioning: clinical status versus objectively assessed sexual response. Nephrology Dialysis Transplantation, 1997.
12. Gasc n A, Belvis JJ, Berisa F, et al. : Nandrolone decanoate is a good alternative for the treatment of anemia in elderly male patients on hemodialysis. Ger Nephrol Urol 1999; 9: 67-72.,
13. Handelsman DJ, Dong Q. 1993 Hypothalamo-pituitary gonadal axis in chronic renal failure. Endocrinol Metab North Am. 22:145-159.
Handelsman DJ, Dong Q. 1993 Hypothalamo-pituitary gonadal axis in chronic renal failure. Endocrinol Metab North Am. 22:145-159.
14. Harman SM, Metter EJ, Tobin JD, Pearson J, Blackman MR; Baltimore Longitudinal Study of Aging. Longitudinal effects of aging on serum total and free testosterone levels in healthy men. Baltimore Longitudinal Study of Aging. J Clin Endocrinol Metab. 2001 Feb;86(2):724-31.
15. Horl WH. Non-erythropoietin-based anaemia management in chronic kidney disease. Nephrol Dial Transplant. 2002;17 Suppl 11:35-8.
16. Joy MS, Cefalu WT, Hogan SL, Nachman PH. Long-term glycemic control measurements in diabetic patients receiving hemodialysis. Am J Kidney Dis. 2002 Feb;39(2):297-307.
17. Morales A, Lunenfeld B: Investigation, treatment and monitoring of lateonset hypogonadism in males. Official recommendations of ISSAM. International Society for the Study of the Aging Male. Aging Male 5:74-86, 2002.
Morales A, Lunenfeld B: Investigation, treatment and monitoring of lateonset hypogonadism in males. Official recommendations of ISSAM. International Society for the Study of the Aging Male. Aging Male 5:74-86, 2002.
18. Navarro JF, Mora C. Androgen therapy for anemia in elderly uremic patients. Int Urol Nephrol 2001; 32: 549-557.
19. Navarro JF, Mora C. Effect of androgens on anemia and malnutrition in renal failure: implications for patients on peritoneal dialysis. Perit Dial Int 2001; 21: 14-24.
20. Teruel JL, Marc n R, Navarro J. et al: Androgen versus erythropoietin for the treatment of anemia in hemodialysis patients: a prospective study. J Am Soc Nephrol 1996; 7: 140-144.
21. U.S. Renal Data System: Annual Data Report. Atlas of End Stage Renal Disease in the United States. Bethesda, MD: National Institute of Diabetes and Digestive and Kidney Diseases, 2003.
U.S. Renal Data System: Annual Data Report. Atlas of End Stage Renal Disease in the United States. Bethesda, MD: National Institute of Diabetes and Digestive and Kidney Diseases, 2003.
Рекомендации по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин с сахарным диабетом | Дедов
Авторы и рецензенты представляют собой междисциплинарную группу экспертов, состоящую из эндокринологов, андрологов, урологов. Рекомендации публикуются впервые. Клинические рекомендации содержат самые надежные доказательства, доступные экспертам на момент создания. Рекомендации утверждены на II Всероссийской конференции с международным участием «Сахарный диабет: макро- и микрососудистые осложнения» 4–5 ноября 2017 г. Однако рекомендации не могут заменить клинический опыт. Принимать решение о начале лечения, выбирать метод терапии или препарат для конкретных пациентов необходимо с учетом их индивидуальных особенностей. При разработке проекта данных рекомендаций междисциплинарная группа экспертов и рецензентов не получала каких-либо гонораров или вознаграждений.
При разработке проекта данных рекомендаций междисциплинарная группа экспертов и рецензентов не получала каких-либо гонораров или вознаграждений.
В качестве рецензентов проекта рекомендаций выступили:
- Бабенко А.Ю. (Санкт-Петербург) – доктор медицинских наук, заведующая НИЛ диабетологии ФГБУ «НМИЦ имени В. А. Алмазова» Минздрава РФ
- Боголюбов С.В. (Москва) – кандидат медицинских наук, ведущий научный сотрудник отдела Вспомогательных репродуктивных технологий ФГБУ «НМИЦ Эндокринологии» Минздрава РФ
- Золоедов В.И. (Воронеж) – доктор медицинских наук, профессор кафедры госпитальной терапии и эндокринологии ГБОУ ВПО «Воронежский государственный медицинский университет им. Н.Н. Бурденко» Минздрава РФ
- Коган М.И. (Ростов-на-Дону) – доктор медицинских наук, профессор, заведующий кафедрой урологии ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава РФ
- Мкртумян А.М. (Москва) – доктор медицинских наук, профессор, заведующий кафедрой эндокринологии и диабетологии ГБОУ ВПО «Московский государственный медико-стоматологический университет им.
 А. И. Евдокимова» Минздрава РФ
А. И. Евдокимова» Минздрава РФ - Один В.И. (Санкт-Петербург) – доктор медицинских наук, профессор кафедры факультетской терапии ФГБВОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ.
- Петунина Н.А. (Москва) – доктор медицинских наук, профессор, заведующая кафедрой эндокринологии ИПО ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» (Сеченовский университет) Минздрава РФ
- Хрипун И.А. (Ростов-на-Дону) – кандидат медицинских наук, доцент кафедры эндокринологии с курсом детской эндокринологии ФПК и ППС ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава РФ
Идентификация данных
Указания, представленные в настоящих рекомендациях, основаны на систематическом обзоре литературы, выполненном членами группы. Для обзорного изучения были представлены все статьи, опубликованные до января 2017 г. Эксперты в составе группы выполнили обзор этих данных и отдельных статей с максимальным уровнем доказательности.
1. Определение
Сахарный диабет (СД) – это группа метаболических (обменных) заболеваний, характеризующихся хронической гипергликемией, которая является результатом нарушения секреции инсулина, действия инсулина или обоих этих факторов.
Гипогонадизм у мужчин – это клинический и биохимический синдром, связанный с низким уровнем тестостерона, а также нечувствительностью рецепторного аппарата к андрогенам, который может оказывать негативное воздействие на множество органов и систем, ухудшая качество жизни и жизненный прогноз.
Оба заболевания нередко сосуществуют и взаимно отягощают друг друга. Это обусловлено тем, что андрогены, основным из которых является тестостерон, играют важную роль в регуляции жирового и углеводного метаболизма [1, 2]. Уровень тестостерона снижается в процессе старения, и это снижение может быть ассоциировано с развитием сахарного диабета 2 типа (СД2), который также встречается преимущественно в пожилом возрасте [3, 4]. У пациентов с клинической картиной и лабораторно подтвержденным гипогонадизмом может быть эффективна терапия препаратами тестостерона, в том числе в отношении улучшения углеводного обмена [5].
2. Эпидемиология
Распространенность СД в популяции составляет 5–7% [3]. Установлено, что уровни тестостерона у пациентов с СД2 ниже таковых у здоровых мужчин в среднем на 2,5 нмоль/л [6]. Распространенность гипогонадизма при СД выше, чем в общей популяции, а при СД2 может превышать 50% [7–10].
Уровень доказательности | Тип доказательств |
1а | Доказательства получены на основании данных мета-анализа рандомизированных исследований |
1б | Доказательства получены на основании данных как минимум одного рандомизированного исследования |
2а | Доказательства получены на основании данных одного хорошо спланированного контролируемого нерандомизированного исследования |
2б | Доказательства получены на основании данных как минимум одного хорошо спланированного квази-экспериментального исследования другого типа |
3 | Доказательства получены на основании данных хорошо спланированных неэкспериментальных исследований, таких как сравнительные исследования, корреляционные исследования или клинические случаи |
4 | Доказательства получены на основании данных отчетов экспертного комитета, а также мнений и клинического опыта уважаемых авторитетов |
Степень доказательности | Тип рекомендации |
А | Основана на качественных доказательных клинических исследованиях, включающих в себя как минимум одно рандомизированное исследование, в которых высказываются конкретные рекомендации |
В | Основана на результатах хорошо спланированных, но не рандомизированных клинических исследований |
С | Рекомендации даны, несмотря на отсутствие прямой прикладной связи с клиническими исследованиями хорошего качества |
3.
 Этиология
Этиология
Гипогонадизм обусловлен нарушением функции яичек и/или гонадотропин-продуцирующей функции гипофиза, а также прерыванием определенных звеньев гипоталамо-гипофизарно-гонадной цепи. Для мужчин с СД характерно развитие смешанного гипогонадизма, при котором механизмам нарушения отрицательной обратной связи сопутствуют компоненты первичного (уменьшение числа клеток Лейдига и их чувствительности к гонадотропинам, ишемические тестикулярные изменения), а также вторичного (уменьшение выброса лютеинизирующего гормона (ЛГ), увеличение активности ароматазы) гипогонадизма [10]. Безусловно, при СД могут встречаться и «классические» типы гипергонадотропного, гипогонадотропного гипогонадизма, а также резистентность андрогенных рецепторов [9]. Эти состояния подробно рассмотрены в рекомендациях по диагностике и лечению синдрома гипогонадизма у мужчин [8, 11]. Но если говорить именно о гипогонадизме, который развивается на фоне метаболических нарушений, то главным аспектом его этиологии на начальном этапе является нарушение механизмов отрицательной обратной связи, что предполагает его потенциальную обратимость при устранении метаболических нарушений, в отличие от первичного (гипергонадотропного) и вторичного (гипогонадотропного) типов гипогонадизма, которые являются необратимыми [1, 2].
4. Диагностика
Гипогонадизм диагностируется при наличии клинических симптомов, ассоциированных с дефицитом андрогенов, и выявлении стойкого снижения уровня тестостерона (как минимум двукратное подтверждение) надежным методом (например, методом усиленной хемилюминесценции) (уровень доказательности 2, степень доказательности А) [8, 12, 13].
Симптомы и сбор анамнеза
Сбор анамнеза должен быть направлен на выявление симптомов дефицита тестостерона. Поскольку гипогонадизм у больных СД в подавляющем большинстве случаев является постпубертатным, этими симптомами являются: снижение либидо и эректильной функции, мужское бесплодие, гинекомастия, изменения настроения, повышенная утомляемость и раздражительность, нарушения сна, потеря жизненной энергии, приливы, снижение когнитивных способностей, снижение минеральной плотности костей (остеопороз), переломы при небольшой травме, уменьшение безжирового компонента массы тела и мышечной силы, висцеральное ожирение, метаболический синдром (уровень 2, степень A) [1, 2, 8, 11].
Эти симптомы являются неспецифическими, и при клинической диагностике гипогонадизма следует ориентироваться на три основных признака [11, 14–16]:
- снижение либидо и сексуальной активности;
- снижение числа утренних эрекций;
- снижение адекватных эрекций.
Симптомы нарушений половой функции как при наличии дефицита тестостерона, так и без такового могут быть связаны с сопутствующими заболеваниями или приемом лекарственных препаратов (например, спиронолактона, неселективных бета-адреноблокаторов) (уровень 2а, степень А) [8, 11]. Сама по себе неудовлетворительная компенсация углеводного обмена ассоциируется со снижением уровня тестостерона [17]. Кроме того, в патогенез нарушений половой функции могут вносить вклад нейропатия и васкулопатия, часто встречающиеся у больных СД [18]. При обследовании пациента важно выявить и/или исключить эти заболевания, а также задать вопросы относительно фармакологической терапии (уровень 2, степень А) [18–23].
Стоит отметить, что в процесс диагностики, дифференциальной диагностики, а также оценки безопасности терапии гипогонадизма при СД по показаниям должны включаться такие специалисты, как диабетологи, кардиологи, урологи, терапевты и др. [1, 2, 18].
[1, 2, 18].
Лабораторные признаки
Пороговым значением, позволяющим разграничить нормальное состояние и потенциальный дефицит тестостерона, следует считать 12,1 нмоль/л для общего тестостерона сыворотки крови (уровень 2б, степень A) [11].
При уровне общего тестостерона от 8 до 12 нмоль/л целесообразно определить уровень глобулина, связывающего половые стероиды (уровень 1a, степень A), с дальнейшим расчетом уровня свободного тестостерона, нижняя граница нормы которого, по данным различных источников, составляет 225–250 пмоль/л, но большинством исследователей предлагается величина 243 пмоль/л [11, 25].
Забор крови для определения уровня тестостерона показано производить натощак, между 7 и 11 ч утра (уровень 2а, степень А) [1, 2, 11].
Для дифференциации первичной и вторичной форм гипогонадизма, а также выявления субклинического гипогонадизма необходимо определение сывороточного уровня ЛГ (уровень 1a, степень A) [11]. Анализ на сывороточный уровень ЛГ, как и тестостерона, должен выполняться двукратно [1, 2, 11].
У мужчин с первичным поражением яичек в ряде случаев наблюдается нормальный уровень тестостерона при высоком уровне ЛГ – это может рассматриваться как субклиническая или компенсированная форма гипогонадизма [26]. У этих мужчин потенциально возможно появление симптомов гипогонадизма в будущем, поэтому они требуют наблюдения, и при клинической манифестации гипогонадизма пациентам показана заместительная терапия препаратами тестостерона [1, 2, 27].
Кроме того, рекомендуется определение пролактина и тиреотропного гормона (ТТГ) в сыворотке крови, поскольку симптомы гиперпролактинемии и гипотиреоза могут частично совпадать с симптомами гипогонадизма [28, 29] (уровень 2, степень A).
Физикальное обследование
Физикальное обследование при постановке диагноза и в динамике должно включать в себя оценку индекса массы тела, окружности талии, роста волос на теле, грудных желез и органов мошонки, в том числе оценку размеров и консистенции яичек (измерение с помощью орхидометра или УЗИ), а также обследование полового члена и предстательной железы [1, 2, 8, 11].
Инструментальное обследование
При выявлении патологических изменений при осмотре показано проведение ультразвуковых исследований. При выявлении гипогонадотропного гипогонадизма в сочетании с гиперпролактинемией рекомендуется проведение МРТ головного мозга [30].
5. Клинические последствия гипогонадизма
В зависимости от основной причины гипогонадизма снижение функции гонад может быть постепенным и частичным. Клиническая картина, признаки и симптомы могут быть скрыты вследствие физиологической фенотипической вариабельности. Вероятность возникновения большинства симптомов возрастает со снижением плазменного уровня тестостерона [11, 31].
Установлено, что у мужчин с гипогонадизмом часто развиваются многие из компонентов метаболического синдрома, такие как ожирение, артериальная гипертензия, дислипидемия, нарушение регуляции обмена глюкозы и инсулинорезистентность [32, 33]. Само по себе висцеральное ожирение ассоциируется со снижением уровня тестостерона [34]. СД2 также часто наблюдается у лиц с низкими уровнями тестостерона в сочетании с другими симптомами гипогонадизма [35–38]. В связи с этим рекомендуется определять уровни тестостерона у всех мужчин с ожирением и СД2 (уровень 2б, степень А) [11]. При этом развитие у таких пациентов эректильной дисфункции (ЭД) является предиктором возникновения и прогрессирования атеросклероза и ишемической болезни сердца при диабете [39, 40]. Поскольку одной из основных функций эндотелия является синтез оксида азота (NO), а эндотелиальная дисфункция играет важную роль в развитии ЭД у больных СД, ЭД рассматривается как маркер сердечно-сосудистой патологии [41]. В исследовании, посвященном изучению ЭД как фактора риска ишемической болезни сердца, было показано, что большое число пациентов с ангиографически зарегистрированной патологией коронарных артерий имеют ЭД, и что она является очевидным признаком коронарной патологии почти в 70% случаев и требует своевременного назначения лечения (уровень 1б, степень А) [42].
СД2 также часто наблюдается у лиц с низкими уровнями тестостерона в сочетании с другими симптомами гипогонадизма [35–38]. В связи с этим рекомендуется определять уровни тестостерона у всех мужчин с ожирением и СД2 (уровень 2б, степень А) [11]. При этом развитие у таких пациентов эректильной дисфункции (ЭД) является предиктором возникновения и прогрессирования атеросклероза и ишемической болезни сердца при диабете [39, 40]. Поскольку одной из основных функций эндотелия является синтез оксида азота (NO), а эндотелиальная дисфункция играет важную роль в развитии ЭД у больных СД, ЭД рассматривается как маркер сердечно-сосудистой патологии [41]. В исследовании, посвященном изучению ЭД как фактора риска ишемической болезни сердца, было показано, что большое число пациентов с ангиографически зарегистрированной патологией коронарных артерий имеют ЭД, и что она является очевидным признаком коронарной патологии почти в 70% случаев и требует своевременного назначения лечения (уровень 1б, степень А) [42]. Кроме того, было установлено, что сам по себе низкий уровень тестостерона повышает риски смертности у мужчин с СД2 (уровень 2a, степень B) [43, 44].
Кроме того, было установлено, что сам по себе низкий уровень тестостерона повышает риски смертности у мужчин с СД2 (уровень 2a, степень B) [43, 44].
6. Выбор методов лечения
Всем пациентам с СД должны быть даны рекомендации по питанию, расширению физической активности. Достижение целевых показателей гликемии, липидов и артериального давления является обязательным компонентом комплексного лечения пациентов с СД. Помимо этого, всем пациентам с СД должен проводиться скрининг на выявление и компенсацию осложнений, согласно существующим алгоритмам [3]. Целью лечения является облегчение симптомов гипогонадизма путем восстановления сывороточных уровней тестостерона до нормальных физиологических значений. Выбор метода лечения определяется формой заболевания, факторами риска и репродуктивными планами пациента. Необходимо помнить о возможном транзиторном снижении уровня тестостерона, например, на фоне выраженной декомпенсации СД, которое должно быть исключено при тщательном клиническом обследовании и повторном измерении уровня гормонов [17, 24]. В случаях вторичного обратимого гипогонадизма, например, у молодых людей с декомпенсацией углеводного обмена, терапия тестостероном не показана, так как физиологическое восстановление уровня тестостерона возможно при лечении основного заболевания, являющегося причиной гипогонадизма. Однако при невозможности добиться целевых показателей терапии основного заболевания возможно назначение короткодействующих препаратов тестостерона [45, 46]. В таких случаях андрогенная терапия проводится с подбором индивидуальной дозы тестостерона, что позволяет сохранить циркадный физиологический ритм секреции тестостерона, а также минимизировать риски подавления гонадотропной функции гипофиза и сперматогенеза [47]. В литературе не представлены исследования, демонстрирующие конкретный уровень гликированного гемоглобина, при котором необходимо сначала приступить к коррекции углеводного обмена, и только при достижении целевого уровня этого показателя оценивать андрогенный статус мужчины и при необходимости проводить лечение гипогонадизма.
В случаях вторичного обратимого гипогонадизма, например, у молодых людей с декомпенсацией углеводного обмена, терапия тестостероном не показана, так как физиологическое восстановление уровня тестостерона возможно при лечении основного заболевания, являющегося причиной гипогонадизма. Однако при невозможности добиться целевых показателей терапии основного заболевания возможно назначение короткодействующих препаратов тестостерона [45, 46]. В таких случаях андрогенная терапия проводится с подбором индивидуальной дозы тестостерона, что позволяет сохранить циркадный физиологический ритм секреции тестостерона, а также минимизировать риски подавления гонадотропной функции гипофиза и сперматогенеза [47]. В литературе не представлены исследования, демонстрирующие конкретный уровень гликированного гемоглобина, при котором необходимо сначала приступить к коррекции углеводного обмена, и только при достижении целевого уровня этого показателя оценивать андрогенный статус мужчины и при необходимости проводить лечение гипогонадизма. Тем не менее, по мнению авторов рекомендаций, у пациента с СД и гипогонадизмом (за исключением случаев гипергонадотропного гипогонадизма) при уровне гликированного гемоглобина более 8% следует сначала достичь нормализации углеводного обмена и индивидуализированных целевых значений гликемии, а далее провести повторную диагностику гипогонадизма (уровень 4, степень С). Выбор данного уровня гликированного гемоглобина обусловлен тем, что при представленных показателях происходит развитие и прогрессирование большинства осложнений СД [3].
Тем не менее, по мнению авторов рекомендаций, у пациента с СД и гипогонадизмом (за исключением случаев гипергонадотропного гипогонадизма) при уровне гликированного гемоглобина более 8% следует сначала достичь нормализации углеводного обмена и индивидуализированных целевых значений гликемии, а далее провести повторную диагностику гипогонадизма (уровень 4, степень С). Выбор данного уровня гликированного гемоглобина обусловлен тем, что при представленных показателях происходит развитие и прогрессирование большинства осложнений СД [3].
В случаях необратимого гипогонадизма выбор метода андрогенной терапии основывается на виде гипогонадизма, желании пациента, факторах риска и возможности проведения репродуктивной реабилитации [48]. Пациент должен быть полностью информирован о предполагаемой пользе лечения и побочных эффектах каждого метода лечения.
Поскольку при экзогенном введении тестостерона возможно подавление сперматогенеза путем отрицательной обратной связи в системе гипоталамус-гипофиз-гонады, при репродуктивной реабилитации пациента (мужском бесплодии) следует рассматривать возможность терапии гонадотропинами (препараты хорионического гонадотропина человека, лютеинизирующего и фолликулостимулирующего гормонов) или антиэстрогенами, а также использование методов вспомогательных репродуктивных технологий [48, 49]. Коррекция дозы препаратов должна проводиться индивидуально. Информации о терапевтических и неблагоприятных эффектах долгосрочной терапии гонадотропинами или антиэстрогенами в настоящее время недостаточно, и этот вид лечения не может быть рекомендован для пожизненного использования [1, 2].
Коррекция дозы препаратов должна проводиться индивидуально. Информации о терапевтических и неблагоприятных эффектах долгосрочной терапии гонадотропинами или антиэстрогенами в настоящее время недостаточно, и этот вид лечения не может быть рекомендован для пожизненного использования [1, 2].
В случаях необратимого гипогонадизма, когда нет необходимости в сохранении репродуктивной функции, рекомендуется тестостерон-заместительная терапия (ТЗТ), которая является безопасной и эффективной [1, 2, 11] (уровень 1б, степень А).
Существующие препараты отличаются по пути введения и фармакокинетическим особенностям, решение о выборе конкретного препарата должно приниматься врачом и пациентом совместно [50, 51].
На начальном этапе лечения следует отдать предпочтение препаратам короткого действия над препаратами длительного действия, особенно у пациентов с факторами риска. Это позволит при необходимости прекратить лечение, если возникнут любые нежелательные явления, которые могут развиться во время терапии [51]. Используемые препараты тестостерона представлены в таблице 1.
Используемые препараты тестостерона представлены в таблице 1.
Таблица 1. Используемые препараты тестостерона
Форма | Применение | Время оценки уровня тестостерона | Преимущества | Недостатки |
Тестостерона ундеканоат | Внутрь; 2–6 капсул через каждые 6 ч | В любое время | Всасывается через лимфатическую систему | Вариабельность уровня тестостерона. Необходимость приема нескольких доз в течение дня с жирной пищей |
Смесь эфиров тестостерона | В/м, каждые 2–4 нед. | Через 2–4 нед. с момента инъекции | Средняя продолжительность действия | Вариабельность уровня тестостерона, описаны супрафизиологические пики тестостерона в первые дни после инъекции. У пациентов с СД существует потенциальный риск развития местных инфекционных осложнений при инъекциях масляных растворов |
Тестостерона ундеканоат | В/м, каждые 10–14 нед. | Через 10–14 нед. с момента инъекции | Редкие инъекции. Равновесная концентрация тестостерона после 3–5 инъекций | Препарат длительного действия. Нельзя быстро отменить. Описаны супрафизиологические пики тестостерона в течение 1–2 нед после инъекции. У пациентов с СД существует потенциальный риск развития местных инфекционных осложнений при инъекциях масляных растворов |
Трансдермальный тестостерон в виде геля | Гель для ежедневного применения | Через 2–4 ч с момента нанесения геля | Равновесная концентрация тестостерона без колебаний. Можно быстро отменить | Раздражение кожи в месте применения, потенциальный риск воздействия тестостерона на половых партнерш или детей, находящихся в тесном контакте |
В период ТЗТ рекомендуется осуществлять периодический мониторинг сывороточной концентрации тестостерона с целью минимизации побочных эффектов, связанных с лечением.
Данных об определении оптимального сывороточного уровня тестостерона на фоне заместительной терапии в настоящее время недостаточно. Мнения экспертов свидетельствуют о том, что на фоне лечения сывороточный уровень тестостерона должен восстанавливаться до средне-нормальных значений, этого обычно достаточно для нивелирования различных проявлений андрогенного дефицита (уровень 2, степень B) [11]. Следует избегать супрафизиологических значений тестостерона в крови, особенно у лиц пожилого и старческого возраста с сопутствующей патологией. Оптимальная схема мониторинга сывороточного уровня тестостерона зависит от используемой лекарственной формы [1, 2, 11].
7. Показания, противопоказания и факторы риска лечения
Необходимым и достаточным показанием к лечению является наличие гипогонадизма. Целью лечения гипогонадизма при СД является улучшение качества жизни, самочувствия, сексуальной функции, снижение жировой массы тела, улучшение показателей углеводного обмена [52].
Часто врачи неохотно предлагают терапию тестостероном, особенно мужчинам пожилого и старческого возраста (следует отметить, что какой бы то ни было большой возраст пациента сам по себе не является противопоказанием к началу терапии препаратами тестостерона, и лечение может проводиться пожизненно), в связи с потенциальным риском данного вида лечения, обычно эти сомнения связаны с возможными последствиями для тканей предстательной и грудной железы, сердечно-сосудистой системы. В табл. 2 перечислены противопоказания к терапии препаратами тестостерона.
Таблица 2. Противопоказания к терапии препаратами тестостерона
Рак предстательной железы |
Рак грудной железы у мужчин |
Необходимость репродуктивной реабилитации |
Гематокрит >54% |
Тяжелая хроническая сердечная недостаточность класса IV по классификации Нью-Йоркской кардиологической ассоциации (NYHA) |
Мужчинам, имеющим в анамнезе рак грудной и/или предстательной железы, терапия препаратами тестостерона противопоказана. При этом взаимосвязь между терапией тестостероном и развитием рака грудной железы не подтверждена достоверными доказательствами [53]. Терапия тестостероном также не повышает риск развития рака предстательной железы (уровень 2, степень B) [14, 54].
При этом взаимосвязь между терапией тестостероном и развитием рака грудной железы не подтверждена достоверными доказательствами [53]. Терапия тестостероном также не повышает риск развития рака предстательной железы (уровень 2, степень B) [14, 54].
В настоящее время отсутствуют доказательства того, что экзогенно вводимый тестостерон увеличивает риск доброкачественной гиперплазии простаты либо способствует ухудшению симптомов нижних мочевых путей [55, 56].
По данным мета-анализа плацебо-контролируемых рандомизированных клинических исследований эффектов тестостерона при сердечно-сосудистой патологии с участием почти 5500 пациентов, терапия тестостероном не сопровождалась увеличением риска развития сердечно-сосудистых заболеваний (уровень 1, степень А) [57].
Мета-анализ показал, что, несмотря на более высокую частоту повышенного гематокрита на фоне лечения тестостероном, ни о каких клинически неблагоприятных эффектах не сообщалось [54]. Тем не менее, пациенты с эритроцитозом и серьезной застойной сердечной недостаточностью (класс III–IV по NYHA) относятся к группе риска осложнений со стороны сердечно-сосудистой системы, поэтому терапия препаратами тестостерона у них должна быть прекращена до момента разрешения застойной сердечной недостаточности (уровень 3, степень B) [58].
Нежелательные явления со стороны сердечно-сосудистой системы чаще встречаются у лиц с множественными сопутствующими заболеваниями и ограничением физической активности, в связи с этим при назначении лечения пациентам пожилого и особенно старческого возраста с сопутствующими заболеваниями препаратами выбора должны являться короткодействующие препараты тестостерона. Кроме того, пациенты группы сердечно-сосудистого риска должны наблюдаться особенно тщательно первые три месяца от начала терапии [51, 59].
Данные, свидетельствующие о влиянии терапии гелевыми формами тестостерона на ночное апноэ, отсутствуют. Также отсутствуют данные о том, что это лечение может приводить к дебюту или усугублению апноэ [60]. Тем не менее, развитие гипергемоглобинемии с уровнем гемоглобина >180 г/л и/или гематокрита >54% у таких пациентов требует уменьшения используемой дозы препаратов тестостерона вплоть до отмены или изменения режима терапии (уровень 3, степень A) [1, 2, 11].
8. Благоприятные эффекты лечения
ТЗТ способствует развитию ряда благоприятных эффектов в отношении как нарушений половой функции, так и метаболического контроля [11]. Терапия препаратами тестостерона у мужчин с гипогонадизмом влияет на телосложение, приводя к последующему уменьшению жировой массы и увеличению безжировой массы тела (уровень 1a, степень A) [55]. При применении тестостерона было установлено снижение содержания висцерального жира, что сопровождалось уменьшением окружности талии [61, 62, 63]. Имеются также доказательства, что долгосрочная терапия препаратами тестостерона может приводить к значительному и устойчивому снижению массы тела, окружности талии и ИМТ у тучных мужчин с гипогонадизмом [64–66]. Мета-анализ показал достоверное уменьшение массы жировой ткани у пациентов с СД2 на фоне коррекции дефицита тестостерона [67]. Успешное достижение потери массы тела, как и одновременное увеличение тощей массы, положительно влияет на СД2 (уровень 2а, степень А) [68].
Терапия препаратами тестостерона у мужчин с гипогонадизмом влияет на телосложение, приводя к последующему уменьшению жировой массы и увеличению безжировой массы тела (уровень 1a, степень A) [55]. При применении тестостерона было установлено снижение содержания висцерального жира, что сопровождалось уменьшением окружности талии [61, 62, 63]. Имеются также доказательства, что долгосрочная терапия препаратами тестостерона может приводить к значительному и устойчивому снижению массы тела, окружности талии и ИМТ у тучных мужчин с гипогонадизмом [64–66]. Мета-анализ показал достоверное уменьшение массы жировой ткани у пациентов с СД2 на фоне коррекции дефицита тестостерона [67]. Успешное достижение потери массы тела, как и одновременное увеличение тощей массы, положительно влияет на СД2 (уровень 2а, степень А) [68].
ТЗТ оказывала благоприятное влияние на углеводный и липидный спектр крови, инсулинорезистентность и висцеральное ожирение у мужчин, имеющих гипогонадизм, нарушение толерантности к глюкозе и дислипидемию, что сопровождалось снижением сердечно-сосудистого риска (уровень 2a, степень B) [68–70]. Установлено, что восстановление тестостерона до физиологических уровней путем назначения ТЗТ приводит к улучшению соматических и метаболических показателей у пожилых мужчин с ожирением, возрастным гипогонадизмом и нарушениями гликемии натощак [71]. Кроме того, терапия препаратами тестостерона оказывает положительное влияние на улучшение компенсации СД, что сопровождается снижением уровня гликированного гемоглобина, инсулина и повышением чувствительности к нему [72, 73, 74]. Так, в многоцентровом проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании TIMES изучались эффекты ТЗТ с использованием трансдермального геля, содержащего 2% тестостерон в отношении инсулинорезистентности, сердечно-сосудистых факторов риска и других симптомов у 220 мужчин с гипогонадизмом и СД2 и/или метаболическим синдромом. Длительность наблюдения составила 12 мес. Лечение привело к снижению показателя HOMA-IR на 15,2% через 6 мес (p=0,018) и на 16,4% через 12 мес (p=0,006). У пациентов с диабетом гликемический контроль к 9-му месяцу наблюдения оказался существенно лучше в группе лечения тестостероном, чем в группе плацебо (средняя разница по уровням HbA1c составила 0,446%; р=0,035).
Установлено, что восстановление тестостерона до физиологических уровней путем назначения ТЗТ приводит к улучшению соматических и метаболических показателей у пожилых мужчин с ожирением, возрастным гипогонадизмом и нарушениями гликемии натощак [71]. Кроме того, терапия препаратами тестостерона оказывает положительное влияние на улучшение компенсации СД, что сопровождается снижением уровня гликированного гемоглобина, инсулина и повышением чувствительности к нему [72, 73, 74]. Так, в многоцентровом проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании TIMES изучались эффекты ТЗТ с использованием трансдермального геля, содержащего 2% тестостерон в отношении инсулинорезистентности, сердечно-сосудистых факторов риска и других симптомов у 220 мужчин с гипогонадизмом и СД2 и/или метаболическим синдромом. Длительность наблюдения составила 12 мес. Лечение привело к снижению показателя HOMA-IR на 15,2% через 6 мес (p=0,018) и на 16,4% через 12 мес (p=0,006). У пациентов с диабетом гликемический контроль к 9-му месяцу наблюдения оказался существенно лучше в группе лечения тестостероном, чем в группе плацебо (средняя разница по уровням HbA1c составила 0,446%; р=0,035).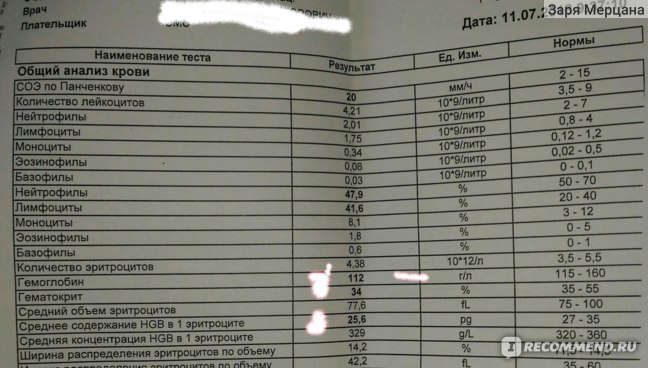 В подгруппе с метаболическим синдромом заместительная терапия привела к достоверно более выраженному снижению от исходных значений уровней липопротеина А, общего холестерина и холестерина липопротеинов низкой плотности (ЛПНП), чем плацебо. Лечение также привело к снижению липопротеина А во всей выборке. Холестерин липопротеинов высокой плотности (ЛПВП) снизился от исходных значений в значительно большей степени на терапии тестостероном, чем на плацебо во всех группах наблюдений. Между группами не наблюдалось значимых различий по частоте нежелательных явлений, большинство из них были легкими или умеренными. Таким образом, трансдермальная терапия тестостероном оказала благоприятные эффекты в отношении инсулинорезистентности и дислипидемии (уровень 1б, степень А) [74].
В подгруппе с метаболическим синдромом заместительная терапия привела к достоверно более выраженному снижению от исходных значений уровней липопротеина А, общего холестерина и холестерина липопротеинов низкой плотности (ЛПНП), чем плацебо. Лечение также привело к снижению липопротеина А во всей выборке. Холестерин липопротеинов высокой плотности (ЛПВП) снизился от исходных значений в значительно большей степени на терапии тестостероном, чем на плацебо во всех группах наблюдений. Между группами не наблюдалось значимых различий по частоте нежелательных явлений, большинство из них были легкими или умеренными. Таким образом, трансдермальная терапия тестостероном оказала благоприятные эффекты в отношении инсулинорезистентности и дислипидемии (уровень 1б, степень А) [74].
В других клинических исследованиях также продемонстрировано достоверное снижение уровней глюкозы плазмы натощак, HbA1c, триглицеридов [5, 67]. В мета-анализ были включены только рандомизированные контролируемые исследования. Было выявлено 5 таких исследований, посвященных изучению метаболизма глюкозы, липидов и содержанию жировой ткани, в которых участвовал 351 человек, при средней продолжительности наблюдения в 6,5 мес. По результатам мета-анализа, основанного на извлекаемых данных, оказалось, что применение тестостерона приводило к снижению концентраций глюкозы в плазме натощак (средняя разница составила -1,10; 95% доверительный интервал (ДИ) (от -1,88 до -0,31)), инсулина сыворотки натощак (средняя разница составила -2,73; 95% ДИ (от -3,62 до -1,84)), HbA1c, % (средняя разница составила -0,87; 95% ДИ (от -1,32 до -0,42)) и триглицеридов (средняя разница составила -0,35; 95% ДИ (от -0,62 до -0,07)). По прочим исходам значимых различий между группами тестостерона и контрольными группами не наблюдалось. В заключение сделан вывод о том, что ТЗТ может улучшать гликемический контроль и снижать уровни триглицеридов у мужчин с гипогонадизмом при наличии СД2 (уровень 1а, степень А) [5]. Однако, учитывая ограниченное число участников, а также факторы, ограничивающие возможности интерпретации мета-анализа, можно говорить о необходимости проведения дополнительных крупных исследований, которые позволили бы рассмотреть вопрос о метаболических эффектах ТЗТ и ее долгосрочных эффектах в отношении мужчин с гипогонадизмом при наличии СД.
Было выявлено 5 таких исследований, посвященных изучению метаболизма глюкозы, липидов и содержанию жировой ткани, в которых участвовал 351 человек, при средней продолжительности наблюдения в 6,5 мес. По результатам мета-анализа, основанного на извлекаемых данных, оказалось, что применение тестостерона приводило к снижению концентраций глюкозы в плазме натощак (средняя разница составила -1,10; 95% доверительный интервал (ДИ) (от -1,88 до -0,31)), инсулина сыворотки натощак (средняя разница составила -2,73; 95% ДИ (от -3,62 до -1,84)), HbA1c, % (средняя разница составила -0,87; 95% ДИ (от -1,32 до -0,42)) и триглицеридов (средняя разница составила -0,35; 95% ДИ (от -0,62 до -0,07)). По прочим исходам значимых различий между группами тестостерона и контрольными группами не наблюдалось. В заключение сделан вывод о том, что ТЗТ может улучшать гликемический контроль и снижать уровни триглицеридов у мужчин с гипогонадизмом при наличии СД2 (уровень 1а, степень А) [5]. Однако, учитывая ограниченное число участников, а также факторы, ограничивающие возможности интерпретации мета-анализа, можно говорить о необходимости проведения дополнительных крупных исследований, которые позволили бы рассмотреть вопрос о метаболических эффектах ТЗТ и ее долгосрочных эффектах в отношении мужчин с гипогонадизмом при наличии СД. Результаты нескольких ретроспективных исследований показали, что назначение препаратов тестостерона мужчинам с СД2 и дефицитом тестостерона приводит к уменьшению смертности пациентов (уровень 3, степень B) [43, 44, 75].
Результаты нескольких ретроспективных исследований показали, что назначение препаратов тестостерона мужчинам с СД2 и дефицитом тестостерона приводит к уменьшению смертности пациентов (уровень 3, степень B) [43, 44, 75].
Таким образом, у мужчин с гипогонадизмом ТЗТ оказывает благоприятное влияние на снижение жировой массы тела, улучшение гликемического и липидного профиля, однако не следует рассматривать эту терапию как основное средство коррекции ожирения, СД и сердечно-сосудистых заболеваний.
В большинстве ретроспективных исследований был зафиксирован благоприятный эффект в отношении либидо, эрекции и эякуляции (уровень 2a, степень A) [76, 77]. Международное многоцентровое проспективное исследование с участием 1493 мужчин показало, что ТЗТ достоверно улучшает либидо, эректильную функцию и ответ на терапию ингибиторами фосфодиэстеразы 5 типа, часто используемыми при лечении ЭД на фоне СД [18, 78, 79]. Следует отметить, что при СД наряду с гипогонадизмом причинами ЭД являются нейропатия и васкулопатия, а снижение либидо может быть психогенным [18]. Эти причины следует учитывать при назначении и оценке эффективности терапии препаратами тестостерона (уровень 2a, степень B).
Эти причины следует учитывать при назначении и оценке эффективности терапии препаратами тестостерона (уровень 2a, степень B).
Таким образом, андрогенная терапия абсолютно рекомендуется пациентам с гипогонадизмом и СД.
9. Мониторинг состояния пациентов, получающих тестостерон-заместительную терапию
Обязательной частью каждого визита к врачу должен быть тщательный мониторинг динамики клинических проявлений дефицита тестостерона и маркеров безопасности лечения [1, 2, 11].
Положительная динамика признаков и симптомов гипогонадизма со стороны разных систем и органов происходит в разное время. Для динамической оценки клинических симптомов и качества жизни, а также для оценки эффективности проводимого лечения возможно использовать вопросники симптомов андрогенного дефицита (например, AMS) [1, 2, 11]. Влияние лечения тестостероном на интерес к сексуальной жизни может проявляться уже через 3 нед лечения, стойкий эффект (фаза плато) достигается на 6-й неделе. Для положительной динамики эректильной и эякуляторной функции может потребоваться до 6 мес; остеопороза, мышечной силы – до года, влияние на углеводный обмен становится очевидным спустя 3–12 мес [55].
Пациентам, получающим препараты тестостерона, показано периодическое гематологическое обследование (до назначения лечения, затем через 3, 6 и 12 мес терапии, далее ежегодно) [55]. Следует иметь в виду, что изолированное повышение гематокрита может быть следствием недостаточного потребления жидкости. Только при повторных значениях гематокрита >54% и/или гемоглобина >180 г/л следует проводить коррекцию терапии [80]. В случаях использования трансдермальной формы тестостерона снижение дозы препарата в подавляющем большинстве случаев является достаточным, в случаях использования инъекционных форм показана либо их замена на трансдермальную форму, либо отмена с дальнейшей оценкой уровней гемоглобина и гематокрита через 3 мес, за которые происходит их нормализация (уровень 4, степень С) [11, 81].
Состояние предстательной железы должно оцениваться путем исследования простаты и по показателю простатспецифического антигена (ПСА) (у мужчин старше 35 лет) до начала лечения тестостероном [58].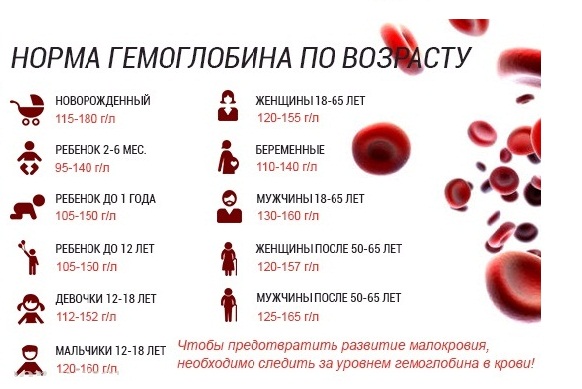 Контроль уровня ПСА должен выполняться спустя 3, 6 и 12 мес, а в последующем – ежегодно (уровень 2, степень B). Во время лечения применять дополнительные методы исследования предстательной железы (биопсия) следует при выявлении новых пальпируемых образований в простате при пальцевом ректальном исследовании или при вызывающем беспокойство повышении уровня ПСА (на 1 нг/мл от исходного значения) (уровень 2b, степень A) [82]. При отрицательных результатах биопсии простаты может проводиться терапия тестостероном (уровень 2a, степень B).
Контроль уровня ПСА должен выполняться спустя 3, 6 и 12 мес, а в последующем – ежегодно (уровень 2, степень B). Во время лечения применять дополнительные методы исследования предстательной железы (биопсия) следует при выявлении новых пальпируемых образований в простате при пальцевом ректальном исследовании или при вызывающем беспокойство повышении уровня ПСА (на 1 нг/мл от исходного значения) (уровень 2b, степень A) [82]. При отрицательных результатах биопсии простаты может проводиться терапия тестостероном (уровень 2a, степень B).
Терапия тестостероном не является показанием для рутинного скринингового исследования на предмет выявления потенциальных побочных эффектов со стороны сердечно-сосудистой системы [54]. Мужчины, имеющие сердечно-сосудистые заболевания, до начала лечения должны быть обследованы кардиологом, а в период терапии должен проводиться тщательный мониторинг состояния сердечно-сосудистой системы [59]. В крупном наблюдательном исследовании было установлено, что терапия тестостероном даже сопровождалась уменьшением вероятности развития инфаркта миокарда у мужчин, относящихся к категории наиболее высокого риска (уровень 1б, степень А) [83].
Таким образом, ответ на лечение должен оцениваться спустя 3, 6 и 12 мес после начала лечения, а в последующем – ежегодно (табл. 3)
Таблица 3. Мониторинг безопасности при тестостеронзаместительной терапии
Исследуемые показатели | Исходно | 3–6 мес | 12 мес | Последующий периодический скрининг |
Тестостерон | + | + | + | 6–12 мес |
ЛГ | + | |||
Гематокрит/гемоглобин | + | + | + | 6–12 мес |
ПСА | + | + | + | 6–12 мес |
ПРИ | + | + | + | 12 мес |
Примечания: ПРИ – пальцевое ректальное исследование; ЛГ – лютеинизирующий гормон; ПСА – простатспецифический антиген.
Дополнительная информация
Финансирование работы
Проект рекомендаций был разработан без какой-либо финансовой поддержки. Внешние источники финансирования и поддержки отсутствовали. Гонорары или другие компенсации не выплачивались.
Конфликт интересов
Все члены рабочей группы, занимавшейся разработкой и рецензированием проекта рекомендаций по диагностике и лечению гипогонадизма у мужчин с сахарным диабетом, декларируют полное отсутствие конфликта интересов. Авторы несут ответственность за содержание и написание данной статьи.
Участие авторов
И.И. Дедов – разработка концепции рекомендаций, редактирование текста; Г.А. Мельниченко – разработка концепции рекомендаций, редактирование текста; М.В. Шестакова – разработка концепции рекомендаций, редактирование текста; Р.В. Роживанов – сбор научного материала, написание текста рекомендаций; А.Л. Терехова – сбор научного материала; А.В. Зилов – сбор научного материала; Д. О. Ладыгина – сбор научного материала; Д.Г. Курбатов – сбор научного материала, редактирование текста.
О. Ладыгина – сбор научного материала; Д.Г. Курбатов – сбор научного материала, редактирование текста.
1. Дедов И.И., Мельниченко Г.А., Роживанов Р.В., Курбатов Д.Г. Рекомендации по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин. Проект. // Проблемы эндокринологии. – 2015. – Т.61. – №5. – С.60-71. [Dedov II, Mel’nichenko GAe, Rozhivanov RV, Kurbatov DG. The recommendations on diagnostics and treatment of male hypogonadism (deficit of testosterone). The project. Problems of Endocrinology. 2015;61(5):60-71. (In Russ).] doi: 10.14341/probl201561560-71.
2. Дедов И.И., Мельниченко Г.А., Роживанов Р.В., Курбатов Д.Г. Рекомендации по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин. // Проблемы эндокринологии. – 2016. – Т.62. – №6.– С.78-80. [Dedov II, Melnichenko GA, Rozhivanov RV, Kurbatov DG. Guidelines for the Diagnosis and Treatment of testosterone deficiency (hypogonadism) in male patients. Problems of Endocrinology. 2016;62(6):78-80. (In Russ).] doi: 10.14341/probl201662678-80.
Guidelines for the Diagnosis and Treatment of testosterone deficiency (hypogonadism) in male patients. Problems of Endocrinology. 2016;62(6):78-80. (In Russ).] doi: 10.14341/probl201662678-80.
3. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. – 8-й выпуск // Сахарный диабет. – 2017. – Т. 20. – №1S. – C. 1-121. [Dedov II, Shestakova MV, Mayorov AY, Vikulova OK, Galstyan GR, Kuraeva TL, et al. Standards of specialized diabetes care. Edited by Dedov II, Shestakova MV, Mayorov AY. 8th edition. Diabetes mellitus. 2017;20(1S):1-121. (in Russ.)] doi: 10.14341/DM20171S8
4. Trinick TR, Feneley MR, Welford H, Carruthers M. International web survey shows high prevalence of symptomatic testosterone deficiency in men. The Aging Male. 2010;14(1):10-15. doi: 10.3109/13685538.2010.511325.
The Aging Male. 2010;14(1):10-15. doi: 10.3109/13685538.2010.511325.
5. Wang K-J, Li H, Cai X, et al. Metabolic effects of testosterone replacement therapy on hypogonadal men with type 2 diabetes mellitus: a systematic review and meta-analysis of randomized controlled trials. Asian Journal of Andrology. 2014;16(1):146. doi: 10.4103/1008-682x.122346.
6. Ding EL, Song Y, Malik VS, Liu S. Sex Differences of Endogenous Sex Hormones and Risk of Type 2 Diabetes. JAMA. 2006;295(11):1288. doi: 10.1001/jama.295.11.1288.
7. Endocrine Society. “Previously Unrecognized Testosterone Deficiency Common In Men With Type 1 Diabetes.” ScienceDaily. ScienceDaily, 27 March 2008. Available at: https://www.sciencedaily.com/releases/2008/03/080326202018. htm Ссылка активна на 01.12.2017
htm Ссылка активна на 01.12.2017
8. Bhasin S, Cunningham GR, Hayes FJ, et al. Testosterone Therapy in Men with Androgen Deficiency Syndromes: An Endocrine Society Clinical Practice Guideline. J Clin Endocr Metab. 2010;95(6):2536-2559. doi: 10.1210/jc.2009-2354.
9. Syed R, Agarwal P, Singh P, et al. A study to evaluate the prevalence of hypogonadism in Indian males with Type-2 diabetes mellitus. Indian J Endocrinol Metab. 2017;21(1):64. doi: 10.4103/2230-8210.196008.
10. Kumar M, Dutta D, Anne B, et al. Testosterone levels and type 2 diabetes in men: current knowledge and clinical implications. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 2014:481. doi: 10.2147/dmso.s50777.
11.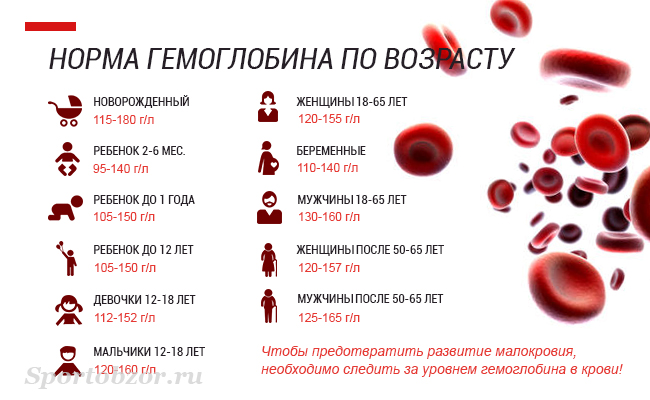 EAU Guidelines. Edn. presented at the EAU Annual Congress London 2017. ISBN 978-90-79754-91-5.
EAU Guidelines. Edn. presented at the EAU Annual Congress London 2017. ISBN 978-90-79754-91-5.
12. Rosner W, Vesper H. Toward Excellence in Testosterone Testing: A Consensus Statement. J Clin Endocr Metab. 2010;95(10):4542-4548. doi: 10.1210/jc.2010-1314.
13. Bhasin S, Pencina M, Jasuja GK, et al. Reference Ranges for Testosterone in Men Generated Using Liquid Chromatography Tandem Mass Spectrometry in a Community-Based Sample of Healthy Nonobese Young Men in the Framingham Heart Study and Applied to Three Geographically Distinct Cohorts. J Clin Endocr Metab. 2011;96(8):2430-2439. doi: 10.1210/jc.2010-3012.
14. Wu FCW, Tajar A, Beynon JM, et al. Identification of Late-Onset Hypogonadism in Middle-Aged and Elderly Men. N Engl J Med.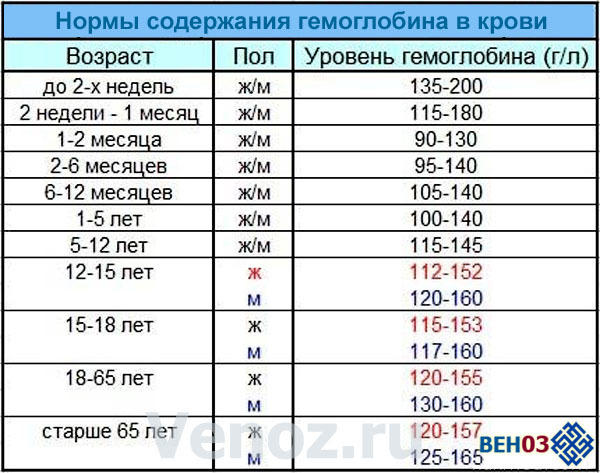 2010;363(2):123-135. doi: 10.1056/NEJMoa0911101.
2010;363(2):123-135. doi: 10.1056/NEJMoa0911101.
15. Lejeune H, Huyghe É, Droupy S. Diminution du désir sexuel et déficit en testostérone chez l’homme. Prog Urol. 2013;23(9):621-628. doi: 10.1016/j.purol.2013.01.019.
16. Lunenfeld B, Arver S, Moncada I, et al. How to help the aging male? Current approaches to hypogonadism in primary care. The Aging Male. 2012;15(4):187-197. doi: 10.3109/13685538.2012.729110.
17. Ho C-H, Jaw F-S, Wu C-C, et al. The Prevalence and the Risk Factors of Testosterone Deficiency in Newly Diagnosed and Previously Known Type 2 Diabetic Men. The Journal of Sexual Medicine. 2015;12(2):389-397. doi: 10.1111/jsm.12777.
18. Курбатов Д.Г., Дубский С.А., Роживанов Р.В., и др. Урологические и андрологические заболевания при сахарном диабете. В кн.: Сахарный диабет и репродуктивная система / Под ред. И.И. Дедова, М.В. Шестаковой. – М., 2016. – С.135-148. [Kurbatov DG, Dubski SA, Rozhivanov RV, et al. Urological and andrological diseases in diabetes mellitus. In: Dedov II, Shestakova MV, editors. Diabetes mellitus and reproductive system. Moscow; 2016. p.135–148. (In Russ.)]
Курбатов Д.Г., Дубский С.А., Роживанов Р.В., и др. Урологические и андрологические заболевания при сахарном диабете. В кн.: Сахарный диабет и репродуктивная система / Под ред. И.И. Дедова, М.В. Шестаковой. – М., 2016. – С.135-148. [Kurbatov DG, Dubski SA, Rozhivanov RV, et al. Urological and andrological diseases in diabetes mellitus. In: Dedov II, Shestakova MV, editors. Diabetes mellitus and reproductive system. Moscow; 2016. p.135–148. (In Russ.)]
19. Cattabiani C, Basaria S, Ceda G, et al. Relationship between testosterone deficiency and cardiovascular risk and mortality in adult men. J Endocrinol Invest. 2012;35(1):104-120.
20. Lee DM, Tajar A, Pye SR, et al. Association of hypogonadism with vitamin D status: the European Male Ageing Study. European Journal of Endocrinology. 2011;166(1):77-85. doi: 10.1530/eje-11-0743.
21. Khera M, Bhattacharya RK, Blick G, et al. The effect of testosterone supplementation on depression symptoms in hypogonadal men from the Testim Registry in the US (TRiUS). The Aging Male. 2011;15(1):14-21. doi: 10.3109/13685538.2011.606513.
22. Reddy RG, Aung T, Karavitaki N, Wass JAH. Opioid induced hypogonadism. BMJ. 2010;341(aug31 1):c4462-c4462. doi: 10.1136/bmj.c4462.
23. Rey RA, Grinspon RP. Normal male sexual differentiation and aetiology of disorders of sex development. Best Practice & Research Clinical Endocrinology & Metabolism. 2011;25(2):221-238. doi: 10.1016/j.beem.2010.08.013.
24. Isidori AM, Lenzi A. Risk factors for androgen decline in older males: lifestyle, chronic diseases and drugs.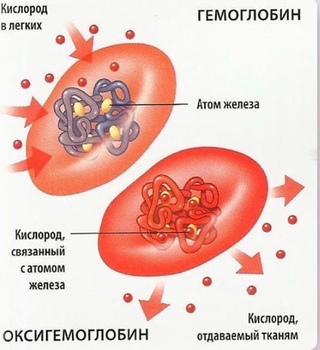 J Endocrinol Invest. 2005;28(3 Suppl):14-22.
J Endocrinol Invest. 2005;28(3 Suppl):14-22.
25. Vermeulen A, Verdonck L, Kaufman JM. A Critical Evaluation of Simple Methods for the Estimation of Free Testosterone in Serum. J Clin Endocr Metab. 1999;84(10):3666-3672. doi: 10.1210/jcem.84.10.6079.
26. Tajar A, McBeth J, Lee DM, et al. Elevated levels of gonadotrophins but not sex steroids are associated with musculoskeletal pain in middle-aged and older European men. Pain. 2011;152(7):1495-1501. doi: 10.1016/j.pain.2011.01.048.
27. Tajar A, Forti G, O’Neill TW, et al. Characteristics of Secondary, Primary, and Compensated Hypogonadism in Aging Men: Evidence from the European Male Ageing Study. J Clin Endocr Metab. 2010;95(4):1810-1818. doi: 10.1210/jc.2009-1796.
28. Vermeulen A. Hormonal cut-offs of partial androgen deficiency: a survey of androgen assays. J Endocrinol Invest. 2005;28(3 Suppl):28-31.
Vermeulen A. Hormonal cut-offs of partial androgen deficiency: a survey of androgen assays. J Endocrinol Invest. 2005;28(3 Suppl):28-31.
29. Bremner AP, Feddema P, Leedman PJ, et al. Age-Related Changes in Thyroid Function: A Longitudinal Study of a Community-Based Cohort. J Clin Endocr Metab. 2012;97(5):1554-1562. doi: 10.1210/jc.2011-3020.
30. Rastrelli G, Corona G, Tarocchi M, et al. How to define hypogonadism? Results from a population of men consulting for sexual dysfunction. J Endocrinol Invest. 2016;39(4):473-484. doi: 10.1007/s40618-015-0425-1.
31. Zitzmann M, Faber S, Nieschlag E. Association of Specific Symptoms and Metabolic Risks with Serum Testosterone in Older Men. J Clin Endocr Metab. 2006;91(11):4335-4343. doi: 10.1210/jc.2006-0401.
doi: 10.1210/jc.2006-0401.
32. Tan WS, Ng CJ, Khoo E-M, et al. The triad of erectile dysfunction, testosterone deficiency syndrome and metabolic syndrome: findings from a multi-ethnic Asian men study (The Subang Men’s Health Study). The Aging Male. 2011;14(4):231-236. doi: 10.3109/13685538.2011.597463.
33. Tsujimura A, Miyagawa Y, Takezawa K, et al. Is Low Testosterone Concentration a Risk Factor for Metabolic Syndrome in Healthy Middle-aged Men? Urology. 2013;82(4):814-819. doi: 10.1016/j.urology.2013.06.023.
34. Antonio L, Wu FCW, O’Neill TW, et al. Associations Between Sex Steroids and the Development of Metabolic Syndrome: A Longitudinal Study in European Men. J Clin Endocr Metab. 2015;100(4):1396-1404. doi: 10.1210/jc. 2014-4184.
2014-4184.
35. Kapoor D, Aldred H, Clark S, et al. Clinical and Biochemical Assessment of Hypogonadism in Men With Type 2 Diabetes: Correlations with bioavailable testosterone and visceral adiposity. Diabetes Care. 2007;30(4):911-917. doi: 10.2337/dc06-1426.
36. Tajar A, Huhtaniemi IT, O’Neill TW, et al. Characteristics of Androgen Deficiency in Late-Onset Hypogonadism: Results from the European Male Aging Study (EMAS). J Clin Endocr Metab. 2012;97(5):1508-1516. doi: 10.1210/jc.2011-2513.
37. Cignarella A, Brand JS, Rovers MM, et al. Testosterone, Sex Hormone-Binding Globulin and the Metabolic Syndrome in Men: An Individual Participant Data Meta-Analysis of Observational Studies. PLoS One. 2014;9(7):e100409. doi: 10.1371/journal. pone.0100409.
pone.0100409.
38. Cheung KKT, Luk AOY, So WY, et al. Testosterone level in men with type 2 diabetes mellitus and related metabolic effects: A review of current evidence. Journal of Diabetes Investigation. 2015;6(2):112-123. doi: 10.1111/jdi.12288.
39. Fukui M, Kitagawa Y, Nakamura N, et al. Association Between Serum Testosterone Concentration and Carotid Atherosclerosis in Men With Type 2 Diabetes. Diabetes Care. 2003;26(6):1869-1873. doi: 10.2337/diacare.26.6.1869.
40. Kloner RA, Mullin SH, Shook T, et al. Erectile Dysfunction in the Cardiac Patient: How Common and Should We Treat? The Journal of Urology. 2003;170(2):S46-S50. doi: 10.1097/01.ju.0000075055.34506.59.
41. Sullivan M. Nitric oxide and penile erection: Is erectile dysfunction another manifestation of vascular disease? Cardiovasc Res. 1999;43(3):658-665. doi: 10.1016/s0008-6363(99)00135-2.
Sullivan M. Nitric oxide and penile erection: Is erectile dysfunction another manifestation of vascular disease? Cardiovasc Res. 1999;43(3):658-665. doi: 10.1016/s0008-6363(99)00135-2.
42. Montorsi F, Briganti A, Salonia A, et al. Erectile Dysfunction Prevalence, Time of Onset and Association with Risk Factors in 300 Consecutive Patients with Acute Chest Pain and Angiographically Documented Coronary Artery Disease. Eur Urol. 2003;44(3):360-365. doi: 10.1016/s0302-2838(03)00305-1.
43. Muraleedharan V, Marsh H, Kapoor D, et al. Testosterone deficiency is associated with increased risk of mortality and testosterone replacement improves survival in men with type 2 diabetes. European Journal of Endocrinology. 2013;169(6):725-733. doi: 10.1530/eje-13-0321.
44. Hackett G, Heald AH, Sinclair A, et al. Serum testosterone, testosterone replacement therapy and all-cause mortality in men with type 2 diabetes: retrospective consideration of the impact of PDE5 inhibitors and statins. Int J Clin Pract. 2016;70(3):244-253. doi: 10.1111/ijcp.12779.
Hackett G, Heald AH, Sinclair A, et al. Serum testosterone, testosterone replacement therapy and all-cause mortality in men with type 2 diabetes: retrospective consideration of the impact of PDE5 inhibitors and statins. Int J Clin Pract. 2016;70(3):244-253. doi: 10.1111/ijcp.12779.
45. Роживанов Р.В., Шурдумова Б.О., Парфенова Н.С., Савельева Л.В. Комплексный подход к лечению ожирения и метаболического синдрома у мужчин. // Ожирение и метаболизм. – 2009. – Т.6. – №.4. – С. 38-41. [Rozhivanov RV, Shurdumova BO, Parfenova NS, Savel’eva LV. Kompleksnyy podkhod k lecheniyu ozhireniyai metabolicheskogo sindroma u muzhchin. Obesity and metabolism. 2009;6(4):38-41. (in Russ.)] doi: 10.14341/2071-8713-4877.
46. Роживанов Р.В. Эффективная терапия и ошибки в лечении эндокринных нарушений в андрологии. В кн.: Эндокринология. Фармакотерапия без ошибок. / Под ред. Дедова И.И., Мельниченко Г.А. – М., 2013. – С. 615-625. [Rozhivanov RV. Effective therapy and errors in treatment of endocrine disorders in andrology. In: Dedov II, Melnichenko GA, editors. Endocrinology. Pharmacotherapy without errors. Moscow; 2013. р.615-625. (in Russ.)]
Фармакотерапия без ошибок. / Под ред. Дедова И.И., Мельниченко Г.А. – М., 2013. – С. 615-625. [Rozhivanov RV. Effective therapy and errors in treatment of endocrine disorders in andrology. In: Dedov II, Melnichenko GA, editors. Endocrinology. Pharmacotherapy without errors. Moscow; 2013. р.615-625. (in Russ.)]
47. Pechersky A. Features of diagnostics and treatment of partial androgen deficiency of aging men. Central European Journal of Urology. 2014;67(4). doi: 10.5173/ceju.2014.04.art16.
48. Роживанов Р.В. Эндокринные нарушения половой функции у мужчин. В кн.: Рациональная фармакотерапия заболеваний эндокринной системы и нарушений обмена веществ. / Под ред. Дедова И.И., Мельниченко Г.А. Второе издание, исправленное и дополненное. – М., 2013. – С. 754-775. [Rozhivanov RV. Endocrine disorders of sexual function in men. In: Dedov II, Mel’nochenko GA, editors. Rational pharmacotherapy of diseases of the endocrine system and metabolic disorders. 2nd ed. Moscow; 2013. р.754-775. (in Russ.)]
In: Dedov II, Mel’nochenko GA, editors. Rational pharmacotherapy of diseases of the endocrine system and metabolic disorders. 2nd ed. Moscow; 2013. р.754-775. (in Russ.)]
49. Kim ED, McCullough A, Kaminetsky J. Oral enclomiphene citrate raises testosterone and preserves sperm counts in obese hypogonadal men, unlike topical testosterone: restoration instead of replacement. BJU Int. 2016;117(4):677-685. doi: 10.1111/bju.13337.
50. Moon DG, Park MG, Lee SW, et al. The Efficacy and Safety of Testosterone Undecanoate (Nebido®) in Testosterone Deficiency Syndrome in Korean: A Multicenter Prospective Study. The Journal of Sexual Medicine. 2010;7(6):2253-2260. doi: 10.1111/j.1743-6109.2010.01765.x.
51. Basaria S, Lakshman KM. Safety and efficacy of testosterone gel in the treatment of male hypogonadism. Clin Interv Aging. 2009:397. doi: 10.2147/cia.s4466.
Clin Interv Aging. 2009:397. doi: 10.2147/cia.s4466.
52. Lunenfeld B, Mskhalaya G, Zitzmann M, et al. Recommendations on the diagnosis, treatment and monitoring of hypogonadism in men. The Aging Male. 2015;18(1):5-15. doi: 10.3109/13685538.2015.1004049.
53. Medras M, Alicja F, Pawel J, et al. Breast cancer and long-term hormonal treatment of male hypogonadism. Breast Cancer Res Treat. 2006;96(3):263-265. doi: 10.1007/s10549-005-9074-y.
54. Fernández-Balsells MM, Murad MH, Lane M, et al. Adverse Effects of Testosterone Therapy in Adult Men: A Systematic Review and Meta-Analysis. J Clin Endocr Metab. 2010;95(6):2560-2575. doi: 10.1210/jc.2009-2575.
55. Saad F, Aversa A, Isidori AM, et al. Onset of effects of testosterone treatment and time span until maximum effects are achieved. European Journal of Endocrinology. 2011;165(5):675-685. doi: 10.1530/eje-11-0221.
Saad F, Aversa A, Isidori AM, et al. Onset of effects of testosterone treatment and time span until maximum effects are achieved. European Journal of Endocrinology. 2011;165(5):675-685. doi: 10.1530/eje-11-0221.
56. Pearl JA, Berhanu D, François N, et al. Testosterone Supplementation does not Worsen Lower Urinary Tract Symptoms. The Journal of Urology. 2013;190(5):1828-1833. doi: 10.1016/j.juro.2013.05.111.
57. Corona G, Maseroli E, Rastrelli G, et al. Cardiovascular risk associated with testosterone-boosting medications: a systematic review and meta-analysis. Expert Opin Drug Saf. 2014;13(10):1327-1351. doi: 10.1517/14740338.2014.950653.
58. Calof OM, Singh AB, Lee ML, et al. Adverse Events Associated With Testosterone Replacement in Middle-Aged and Older Men: A Meta-Analysis of Randomized, Placebo-Controlled Trials. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 2005;60(11):1451-1457. doi: 10.1093/gerona/60.11.1451.
The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 2005;60(11):1451-1457. doi: 10.1093/gerona/60.11.1451.
59. Basaria S, Coviello AD, Travison TG, et al. Adverse Events Associated with Testosterone Administration. N Engl J Med. 2010;363(2):109-122. doi: 10.1056/NEJMoa1000485.
60. Hanafy HM. Testosterone Therapy and Obstructive Sleep Apnea: Is There a Real Connection? The Journal of Sexual Medicine. 2007;4(5):1241-1246. doi: 10.1111/j.1743-6109.2007.00553.x.
61. Saad F, Gooren L, Haider A, Yassin A. An Exploratory Study of the Effects of 12 Month Administration of the Novel Long-Acting Testosterone Undecanoate on Measures of Sexual Function and the Metabolic Syndrome. Arch Androl. 2009;53(6):353-357. doi: 10.1080/01485010701730880.
doi: 10.1080/01485010701730880.
62. Haider A, Gooren LJG, Padungtod P, Saad F. Improvement of the Metabolic Syndrome and of Non-alcoholic Liver Steatosis upon Treatment of Hypogonadal Elderly Men with Parenteral Testosterone Undecanoate. Experimental and Clinical Endocrinology & Diabetes. 2009;118(03):167-171. doi: 10.1055/s-0029-1202774.
63. Haider A, Saad F, Doros G, Gooren L. Hypogonadal obese men with and without diabetes mellitus type 2 lose weight and show improvement in cardiovascular risk factors when treated with testosterone: An observational study. Obes Res Clin Pract. 2014;8(4):e339-e349. doi: 10.1016/j.orcp.2013.10.005.
64. Saad F, Haider A, Doros G, Traish A. Long-term treatment of hypogonadal men with testosterone produces substantial and sustained weight loss. Obesity. 2013;21(10):1975-1981. doi: 10.1002/oby.20407.
Obesity. 2013;21(10):1975-1981. doi: 10.1002/oby.20407.
65. Yassin AA, Doros G. Testosterone therapy in hypogonadal men results in sustained and clinically meaningful weight loss. Clinical Obesity. 2013;3(3-4):73-83. doi: 10.1111/cob.12022.
66. Francomano D, Ilacqua A, Bruzziches R, et al. Effects of 5-Year Treatment With Testosterone Undecanoate on Lower Urinary Tract Symptoms in Obese Men With Hypogonadism and Metabolic Syndrome. Urology. 2014;83(1):167-174. doi: 10.1016/j.urology.2013.08.019.
67. Corona G, Monami M, Rastrelli G, et al. Type 2 diabetes mellitus and testosterone: a meta-analysis study. Int J Androl. 2011;34(6pt1):528-540. doi: 10.1111/j.1365-2605.2010.01117.x.
68. Haider A, Yassin A, Doros G, Saad F. Effects of Long-Term Testosterone Therapy on Patients with “Diabesity”: Results of Observational Studies of Pooled Analyses in Obese Hypogonadal Men with Type 2 Diabetes. Int J Endocrinol. 2014;2014:1-15. doi: 10.1155/2014/683515.
Haider A, Yassin A, Doros G, Saad F. Effects of Long-Term Testosterone Therapy on Patients with “Diabesity”: Results of Observational Studies of Pooled Analyses in Obese Hypogonadal Men with Type 2 Diabetes. Int J Endocrinol. 2014;2014:1-15. doi: 10.1155/2014/683515.
69. Kapoor D. Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolaemia in hypogonadal men with type 2 diabetes. European Journal of Endocrinology. 2006;154(6):899-906. doi: 10.1530/eje.1.02166.
70. Aversa A, Bruzziches R, Francomano D, et al. Effects of Testosterone Undecanoate on Cardiovascular Risk Factors and Atherosclerosis in Middle-Aged Men with Late-Onset Hypogonadism and Metabolic Syndrome: Results from a 24-month, Randomized, Double-Blind, Placebo-Controlled Study. The Journal of Sexual Medicine. 2010;7(10):3495-3503. doi: 10.1111/j.1743-6109.2010.01931.x.
2010;7(10):3495-3503. doi: 10.1111/j.1743-6109.2010.01931.x.
71. Strollo F, Strollo G, Morè M, et al. Low-intermediate dose testosterone replacement therapy by different pharmaceutical preparations improves frailty score in elderly hypogonadal hyperglycaemic patients. The Aging Male. 2013;16(2):33-37. doi: 10.3109/13685538.2013.773305.
72. Heufelder AE, Saad F, Bunck MC, Gooren L. Fifty-two-Week Treatment With Diet and Exercise Plus Transdermal Testosterone Reverses the Metabolic Syndrome and Improves Glycemic Control in Men With Newly Diagnosed Type 2 Diabetes and Subnormal Plasma Testosterone. J Androl. 2009;30(6):726-733. doi: 10.2164/jandrol.108.007005.
73. Hackett G, Cole N, Bhartia M, et al. The response to testosterone undecanoate in men with type 2 diabetes is dependent on achieving threshold serum levels (the BLAST study). Int J Clin Pract. 2014;68(2):203-215. doi: 10.1111/ijcp.12235.
Int J Clin Pract. 2014;68(2):203-215. doi: 10.1111/ijcp.12235.
74. Jones TH, Arver S, Behre HM, et al. Testosterone Replacement in Hypogonadal Men With Type 2 Diabetes and/or Metabolic Syndrome (the TIMES2 Study). Diabetes Care. 2011;34(4):828-837. doi: 10.2337/dc10-1233.
75. Wallis CJD, Lo K, Lee Y, et al. Survival and cardiovascular events in men treated with testosterone replacement therapy: an intention-to-treat observational cohort study. The Lancet Diabetes & Endocrinology. 2016;4(6):498-506. doi: 10.1016/s2213-8587(16)00112-1.
76. Moon DG, Park MG, Lee SW, et al. The Efficacy and Safety of Testosterone Undecanoate (Nebido®) in Testosterone Deficiency Syndrome in Korean: A Multicenter Prospective Study. The Journal of Sexual Medicine. 2010;7(6):2253-2260. doi: 10.1111/j.1743-6109.2010.01765.x.
2010;7(6):2253-2260. doi: 10.1111/j.1743-6109.2010.01765.x.
77. Giltay EJ, Tishova YA, Mskhalaya GJ, et al. Effects of Testosterone Supplementation on Depressive Symptoms and Sexual Dysfunction in Hypogonadal Men with the Metabolic Syndrome. The Journal of Sexual Medicine. 2010;7(7):2572-2582. doi: 10.1111/j.1743-6109.2010.01859.x.
78. Aversa A, Francomano D, Lenzi A. Does testosterone supplementation increase PDE5-inhibitor responses in difficult-to-treat erectile dysfunction patients? Expert Opin Pharmacother. 2015;16(5):625-628. doi: 10.1517/14656566.2015.1011124.
79. Zitzmann M, Mattern A, Hanisch J, et al. IPASS: A Study on the Tolerability and Effectiveness of Injectable Testosterone Undecanoate for the Treatment of Male Hypogonadism in a Worldwide Sample of 1,438 Men. The Journal of Sexual Medicine. 2013;10(2):579-588. doi: 10.1111/j.1743-6109.2012.02853.x.
The Journal of Sexual Medicine. 2013;10(2):579-588. doi: 10.1111/j.1743-6109.2012.02853.x.
80. McMullin MF, Bareford D, Campbell P, et al. Guidelines for the diagnosis, investigation and management of polycythaemia/erythrocytosis. Br J Haematol. 2005;130(2):174-195. doi: 10.1111/j.1365-2141.2005.05535.x.
81. Роживанов Р.В., Курбатов Д.Г. Гематологические и урологические аспекты безопасности заместительной андрогенной терапии препаратом тестостерона ундеканоата пролонгированного действия у пациентов с гипогонадизмом // Проблемы эндокринологии. – 2009. – Т. 55. – №.6. – С.31-35. [Rozhivanov RV, Kurbatov DGe, Rozhivanov RV, G Kurbatov D. Hematological and urological aspects of the safety of androgen substitution therapy using long-acting testosterone undecanoate in patients with hypogonadism. Problems of Endocrinology. 2009;55(6):31-35. (In Rus.)] doi: 10.14341/probl200955631-35.
2009;55(6):31-35. (In Rus.)] doi: 10.14341/probl200955631-35.
82. Rhoden EL, Morgentaler A. Risks of Testosterone-Replacement Therapy and Recommendations for Monitoring. N Engl J Med. 2004;350(5):482-492. doi: 10.1056/NEJMra022251.
83. Baillargeon J, Urban RJ, Kuo Y-F, et al. Risk of Myocardial Infarction in Older Men Receiving Testosterone Therapy. Ann Pharmacother. 2014;48(9):1138-1144. doi: 10.1177/1060028014539918.
“Высокий уровень гемоглобина в крови представляет определённую опасность для здоровья спортсмена”
В свете участившихся на нынешних Олимпийских Играх отстранений от стартов профессор Бенгт Салтин, председатель медицинского комитета FIS, ответил на самые распространённые вопросы, связанные с программой контроля уровня гемоглобина в крови спортсменов.
– В чём заключается цель этой программы?
– Высокий уровень гемоглобина в крови представляет определённую опасность для здоровья спортсмена. Научные исследования показали, что люди с большим количеством красных кровяных телец в крови живут меньше, чем люди, у которых уровень гемоглобина находится в норме. Слишком «густая» кровь также способствует образованию тромбоцитов. Чаще всего люди с высоким уровнем гемоглобина прибегают к соответствующей медицинской помощи.
Программа контроля уровня гемоглобина спортсменов, которая представлена здесь, в Турине, была обнародована для того, чтобы обратиться к вопросам культуры в лыжных гонках, а также чтобы следить за тем, чтобы уровень гемоглобина олимпийцев был в норме. Все спортсмены, которые принимают участие в Кубке мира, проверялись также на постоянной основе на протяжении всего соревновательного сезона.
– Как спортсмен может получить высокий уровень гемоглобина?
– Количество красных кровяных телец возрастает в крови человека тогда, когда он поднимается на высоту. Чем выше над уровнем моря – тем выше гемоглобин, так как потребность в кислороде увеличивается. Гемоглобин – основной дыхательный пигмент и главный компонент эритроцита, выполняющий перенос кислорода из легких в ткани и углекислого газа из тканей в легкие. Высокий уровень гемоглобина может также являться результатом применения допинга.
Чем выше над уровнем моря – тем выше гемоглобин, так как потребность в кислороде увеличивается. Гемоглобин – основной дыхательный пигмент и главный компонент эритроцита, выполняющий перенос кислорода из легких в ткани и углекислого газа из тканей в легкие. Высокий уровень гемоглобина может также являться результатом применения допинга.
– Как были установлены нормы: 160 – для женщин и 170 – для мужчин?
– Эти нормы являются одинаковыми для всех видов спорта, а также не отличаются от норм для обычных людей. Они согласованны и утверждены Всемирным Антидопинговым Агентством.
– Некоторые спортсмены получили особый статус от FIS, который позволяет им выступать в соревнованиях, несмотря превышающие норму показатели уровня гемоглобина… Что нужно сделать для того, чтобы получить этот статус?
– Для того чтобы получить этот статус, необходимо предоставить множество документов, подтверждающих генетическую предрасположенность к высокому уровню гемоглобина. Мы тщательно исследуем все врачебные заключения спортсмена, сделанные ещё в детстве, проверяем информацию по родителям, помимо того, что обследуем его сами.
– На этапах Кубка мира все проверки крови на уровень гемоглобина сопровождаются анализом мочи? В Турине вы действуете по такому же принципу?
– Проверка спортсменов здесь осуществляется так же, как и на этапах Кубка мира. На Олимпийских Играх МОК отвечает за проведение анализов мочи спортсменов, которые следуют за анализом крови, потому что только по анализу мочи можно определить, применял ли спортсмен некоторые виды допинга, как, например, эритропоэтин.
– Спортсмены с высоким уровнем гемоглобина отстраняются от гонок на 5 дней? Как был установлен этот срок?
– По сравнению с велогонками, где отстранение длится две недели, этот срок достаточно короткий. Мы полагаем, что за 5 дней уровень гемоглобина может нормализоваться, если он явился следствием высоты. В то же время пяти дней не хватит для того, чтобы снизить уровень гемоглобина после применения допинга.
По материалам сайта FIS (www.fis-ski.com)
Диагноз истинной полицитемии | Общество лейкемии и лимфомы
Хотя у человека могут быть определенные признаки и симптомы истинной полицитемии (ПВ), для подтверждения диагноза необходимы лабораторные анализы. Как правило, врач сначала рассматривает другие условия.
Как правило, врач сначала рассматривает другие условия.
Иногда состояние, называемое «вторичной полицитемией», вызывает увеличение красных кровяных телец, но, в отличие от PV, оно начинается не в костном мозге и не является раком. Высокое количество эритроцитов, вызванное вторичной полицитемией, является реакцией на другую проблему, такую как:
- Большая высота
- Заболевание, приводящее к снижению оксигенации крови
- Опухоль почки или печени, секретирующая гормон эритропоэтин
- Наследственная болезнь
Вторичная полицитемия лечится, прежде всего, путем лечения основного состояния, вызывающего заболевание.У пациента с вторичной полицитемией должно быть нормальное количество эритроцитов после успешного лечения первичной проблемы.
История болезни и медицинский осмотр
Обследование пациента с подозрением на ЛВ должно начинаться с подробного медицинского анамнеза и медицинского осмотра онкологом-гематологом
История болезни должна включать информацию о пациенте:
- Факторы риска сердечно-сосудистых заболеваний
- Болезни в прошлом
- Травмы
- Процедуры
- Лекарства
- История образования или наличия сгустка крови внутри кровеносного сосуда (тромбоз) или потери крови из поврежденных кровеносных сосудов (геморрагические события)
- История кровных родственников – некоторые болезни передаются по наследству
- Текущие симптомы
После сбора анамнеза врач проведет медицинский осмотр. Во время медицинского осмотра врач может:
Во время медицинского осмотра врач может:
- Слушайте сердце и легкие пациента
- Осмотреть тело пациента на наличие признаков болезни
- Проверка различных органов тела
Анализы крови
Общий анализ крови
Этот тест измеряет количество эритроцитов, лейкоцитов и тромбоцитов в образце крови. Он также измеряет количество богатого железом белка, переносящего кислород в красных кровяных тельцах, и процент цельной крови, состоящий из красных кровяных телец (гематокрит).Люди с PV имеют высокое количество эритроцитов. Также в них часто бывает:
- Повышенное содержание лейкоцитов и тромбоцитов
- Повышение уровня гемоглобина
- Повышенный уровень гематокрита
Тест мачты красных клеток
Эта процедура используется для измерения объема (количества) эритроцитов по отношению к объему плазмы (жидкости) в цельной крови. У пациентов с ПВ может наблюдаться абсолютное увеличение массы эритроцитов.Этот тест нечасто проводится в Соединенных Штатах из-за высокой стоимости, трудностей с получением соответствующих тестовых материалов и появления новых анализов крови, таких как мутационное тестирование.
У пациентов с ПВ может наблюдаться абсолютное увеличение массы эритроцитов.Этот тест нечасто проводится в Соединенных Штатах из-за высокой стоимости, трудностей с получением соответствующих тестовых материалов и появления новых анализов крови, таких как мутационное тестирование.
Мазок периферической крови
Процедура, при которой образец крови исследуется под микроскопом. Патологоанатом исследует образец, чтобы увидеть, нет ли каких-либо необычных изменений в размере, форме и внешнем виде различных клеток крови. Тест также проверяет наличие незрелых (бластных) клеток в крови.
Комплексная метаболическая панель
Эти тесты измеряют уровни веществ, попадающих в кровь органами и тканями. К ним относятся электролиты, жиры, белки, глюкоза (сахар) и ферменты. Биохимические анализы крови предоставляют важную информацию о том, насколько хорошо работают почки, печень и другие органы человека. У пациентов с подозрением на ПВ важно определить уровень эритропоэтина в сыворотке крови. Эритропоэтин – это гормон, который естественным образом вырабатывается почками и стимулирует выработку новых красных кровяных телец.У лиц с ПВ обычно очень низкий уровень эритропоэтина.
Эритропоэтин – это гормон, который естественным образом вырабатывается почками и стимулирует выработку новых красных кровяных телец.У лиц с ПВ обычно очень низкий уровень эритропоэтина.
Тесты костного мозга
Ваш врач может исследовать ваш костный мозг, даже если тест не нужен для диагностики PV.
Исследование костного мозга включает два этапа, обычно выполняемых одновременно в кабинете врача или больнице:
- Аспирация костного мозга для взятия образца жидкого костного мозга
- Биопсия костного мозга для удаления небольшого количества кости, заполненной костным мозгом
При PV костный мозг показывает количество клеток крови выше нормы и аномальное количество тромбоцитов, называемых «мегакариоцитами» в костном мозге.Патолог также исследует хромосомы клеток костного мозга, чтобы исключить другие заболевания крови.
Молекулярное тестирование
Молекулярно-генетические тесты – очень чувствительные тесты, которые ищут специфические генные мутации. Если есть подозрение на ПВ, необходимо провести молекулярное тестирование на мутацию JAK2 . Мутация JAK2 V617F обнаруживается более чем у 90 процентов пациентов с ПВ.
Если есть подозрение на ПВ, необходимо провести молекулярное тестирование на мутацию JAK2 . Мутация JAK2 V617F обнаруживается более чем у 90 процентов пациентов с ПВ.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило тест под названием ipsogen JAK2 RGQ PCR Kit для обнаружения мутаций, влияющих на ген Janus Tyrosine Kinase 2 ( JAK2 ).Этот тест призван помочь врачам оценить пациентов с подозрением на PV.
Дополнительную информацию о тестах костного мозга и других лабораторных тестах см. В бесплатной публикации LLS Understanding Lab and Imaging Tests.
Критерии диагностики истинной полицитемии
В 2016 году Всемирная организация здравоохранения опубликовала новые критерии диагностики PV. Диагностика ПВ требует наличия
- Основные критерии 1, 2 и 3 (перечислены ниже) или
- Основные критерии 1 и 2 и второстепенный критерий (перечислены ниже)
Основные критерии 1. Очень высокое количество эритроцитов, обычно идентифицируемое как A, B, или C ниже:
Очень высокое количество эритроцитов, обычно идентифицируемое как A, B, или C ниже:
- A. Уровень гемоглобина
- Повышенный уровень гемоглобина
- Уровни гемоглобина у мужчин выше 16,5 г / дл
- Уровни гемоглобина у женщин выше 16,0 г / дл
- Повышенный уровень гемоглобина
- B. Уровень гематокрита
- Повышенный уровень гематокрита
- Гематокрит выше 49 процентов у мужчин
- Гематокрит у женщин выше 48 процентов
- Повышенный уровень гематокрита
- С.Масса эритроцитов
Основные критерии 2. Биопсия костного мозга (A или B ниже) показывает:
- A. Аномальный избыток клеток крови в костном мозге (так называемый «гиперцеллюлярность») с повышенным содержанием эритроцитов, лейкоцитов и тромбоцитов (так называемый «панмиелез»)
- B. Пролиферация зрелых мегакариоцитов, различающихся по размеру и форме
Основные критерии 3. Наличие экзона 12 JAK2V617F или JAK2 12 мутация гена
Наличие экзона 12 JAK2V617F или JAK2 12 мутация гена
Незначительный критерий: Очень низкий уровень эритропоэтина
Ссылки по теме
Гемоглобин, высота и чувствительные швейцарские мужчины | Кровь
В этом выпуске журнала Blood Штауб и его коллеги в общих чертах воссоздают грубую топографическую карту Швейцарии, нанося на карту концентрации гемоглобина (Hb) и высоту проживания почти 72 000 мужчин-призывников швейцарской армии. 1
Удивление исходит от обследованных высот: от 200 до 2000 м над уровнем моря (над уровнем моря), которые покрывают Женеву (374 над уровнем моря) и Давос (1560 над уровнем моря), но не Маттерхорн (4487 над уровнем моря). Blood Читатели, которым известно о повышенных концентрациях Hb среди высокогорных гостей и жителей Анд, европейцев, ханьцев и оромо (Эфиопия), могут задаться вопросом, почему результаты швейцарских исследований заслуживают внимания. Адаптация к гипоксии обычно изучается на высоте 2500 м или более, потому что «уровни O 2 в артериальной крови не снижаются заметно, пока не будет выше ∼8000 футов (2300 м).” 2 (p1371) . Штауб и др. Задались целью ответить на вопрос, влияет ли небольшое увеличение высоты ниже 2000 м над уровнем моря на концентрацию гемоглобина. Они делают. Данные, обобщенные в 6 высотных диапазонах по 300 м каждый, показывают, что концентрация Hb выросла со среднего значения 155,2 г / л на высотах <300 м над уровнем моря до 159,6 г / л на высотах ≥2000 м над уровнем моря. Подъем означает, что наши клетки чувствуют и реагируют на постепенные изменения внешней гипоксии во всем доступном диапазоне высот от уровня моря до горы Эверест, даже при отсутствии заметных изменений уровня кислорода в артериальной крови на более низких высотах.Очень большая и однородная выборка молодых швейцарских мужчин позволила обнаружить небольшую разницу в концентрации гемоглобина всего + 2,8%, которую нельзя было бы обнаружить в ходе небольших клинических или полевых исследований.
Адаптация к гипоксии обычно изучается на высоте 2500 м или более, потому что «уровни O 2 в артериальной крови не снижаются заметно, пока не будет выше ∼8000 футов (2300 м).” 2 (p1371) . Штауб и др. Задались целью ответить на вопрос, влияет ли небольшое увеличение высоты ниже 2000 м над уровнем моря на концентрацию гемоглобина. Они делают. Данные, обобщенные в 6 высотных диапазонах по 300 м каждый, показывают, что концентрация Hb выросла со среднего значения 155,2 г / л на высотах <300 м над уровнем моря до 159,6 г / л на высотах ≥2000 м над уровнем моря. Подъем означает, что наши клетки чувствуют и реагируют на постепенные изменения внешней гипоксии во всем доступном диапазоне высот от уровня моря до горы Эверест, даже при отсутствии заметных изменений уровня кислорода в артериальной крови на более низких высотах.Очень большая и однородная выборка молодых швейцарских мужчин позволила обнаружить небольшую разницу в концентрации гемоглобина всего + 2,8%, которую нельзя было бы обнаружить в ходе небольших клинических или полевых исследований.
Факторы, индуцируемые гипоксией (HIF), регулируют дифференцированный ответ на колебания клеточного уровня кислорода. HIF индуцируют транскрипцию EPO и других локусов, которые вносят вклад в синтез Hb, что согласуется с отчетом Staub et al, который связывает более низкие уровни кислорода в окружающей среде с более высокими концентрациями Hb. 3 HIF отрицательно регулируют ферритин запасного белка железа; однако Staub и др. сообщают об увеличении уровней ферритина с высотой от 1200 до 1499 над уровнем моря. Они выдвигают гипотезу о существовании механизмов увеличения запасов железа при хронической легкой гипоксии, возможно, путем изменения абсорбции и высвобождения железа в кишечнике. Интересно, что другое исследование молодых мужчин, хронически подвергавшихся воздействию 2210 м над уровнем моря, показало более высокую концентрацию гемоглобина и ферритина по сравнению с контрольной группой на уровне моря. 4 Исследование систем измерения кислорода HIF и не-HIF 5 может быть полезным в этих условиях.
4 Исследование систем измерения кислорода HIF и не-HIF 5 может быть полезным в этих условиях.
Выводы Staub et al. Говорят о продолжающейся инициативе Всемирной организации здравоохранения (ВОЗ) по пересмотру ее рекомендаций по выявлению анемии с использованием пороговых значений концентрации Hb. 6,7 В рекомендациях ВОЗ рекомендуется применять поправку на высоту, чтобы увеличить пороговое значение концентрации Hb для диагностики анемии. Исследования андских мужчин дали научное обоснование. Теперь мы знаем, что горцы Тибета и Амхары (Эфиопия) ослабили реакцию концентрации Hb на высоту. 8 Следовательно, пороговые значения ВОЗ значительно переоценивают анемию у здоровых, обеспеченных железом горцев Амхары и женщин Анд. 9,10 В пересмотрах ВОЗ следует принимать во внимание популяционные различия в адаптации к высокогорной гипоксии. Другая рекомендация ВОЗ, основанная на выводах Штауба и др. , Предполагает, что поправки на высоту к пороговым значениям концентрации Hb начинаются с 250 м над уровнем моря, а не с нынешних 1000 м над уровнем моря. Принимая во внимание различия в реакции населения на гипоксию, полный диапазон жилых районов и их взаимодействие может усложнить задачу ВОЗ по пересмотру своих руководящих принципов.
, Предполагает, что поправки на высоту к пороговым значениям концентрации Hb начинаются с 250 м над уровнем моря, а не с нынешних 1000 м над уровнем моря. Принимая во внимание различия в реакции населения на гипоксию, полный диапазон жилых районов и их взаимодействие может усложнить задачу ВОЗ по пересмотру своих руководящих принципов.
В заключение, статья Штауба и др. Отвечает на вопросы фундаментальной науки, предоставляя доказательства того, что здоровые молодые люди ощущают и системно реагируют на изменения в уровнях кислорода в окружающей среде, происходящие на уровне 300 м над уровнем моря, и что неизвестный механизм может увеличивать запасы железа на столь же низких уровнях. высоты. Пациентам с заболеваниями, вызывающими легкую гипоксемию, могут быть полезны новые исследования реакции HIF и не-HIF на незначительные изменения в доступности кислорода, которые могут помочь или затруднить выздоровление.Призывники швейцарской армии, предоставившие данные, помогли понять важный вопрос общественного здравоохранения – как диагностировать анемию.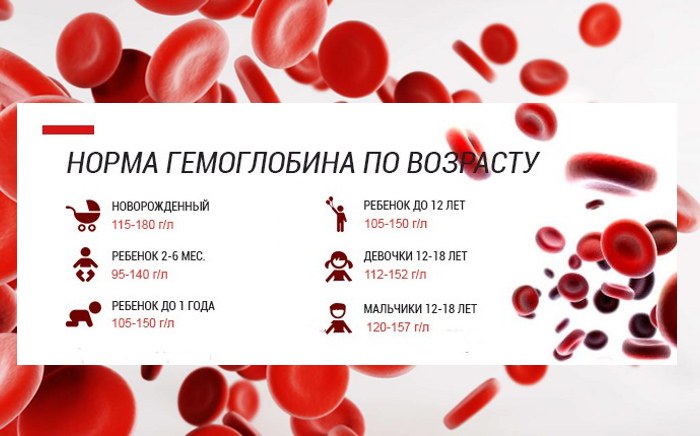 Следует провести повторные исследования в этой и других популяциях с различными моделями реакции на высотную гипоксию.
Следует провести повторные исследования в этой и других популяциях с различными моделями реакции на высотную гипоксию.
Раскрытие информации о конфликте интересов: автор заявляет об отсутствии конкурирующих финансовых интересов.
Повышение гематокрита во время терапии тестостероном и риск образования тромбов
Риск достижения гематокрита> 54% определяется продолжительностью супрафизиологического уровня тестостерона, который, в свою очередь, определяется составом тестостерона (и, следовательно, фармакокинетикой) и дозой. 18,26,55-57 Внутримышечные препараты тестостерона короткого действия (ципионат тестостерона и энантат тестостерона) связаны с наиболее быстрым и заметным повышением уровня тестостерона – и, следовательно, повышения гематокрита – с супрафизиологическими уровнями тестостерона, достигаемыми в течение нескольких дней после инъекции и возврат к исходному уровню через 10-14 дней с последующим снижением до субфизиологических уровней в течение 3 недель, если не вводить повторно. 26,58 Напротив, другие составы тестостерона, которые приводят к более медленному и более стабильному увеличению уровня тестостерона, такие как инъекции ундеканоата тестостерона длительного действия, трансдермальные гели и гранулы, приводят к низкой частоте эритроцитоза, который зависит от дозы. и достигнутый уровень тестостерона, независимо от продолжительности терапии тестостероном. 18,55,56 Ундеканоат тестостерона длительного действия поддерживает стабильный уровень тестостерона в пределах нормы в течение примерно 12 недель. 59 Гемоглобин и гематокрит сначала повышаются в течение первых 3-6 месяцев лечения, но затем стабилизируются и остаются в пределах нормы в течение всего периода лечения. 60,61
26,58 Напротив, другие составы тестостерона, которые приводят к более медленному и более стабильному увеличению уровня тестостерона, такие как инъекции ундеканоата тестостерона длительного действия, трансдермальные гели и гранулы, приводят к низкой частоте эритроцитоза, который зависит от дозы. и достигнутый уровень тестостерона, независимо от продолжительности терапии тестостероном. 18,55,56 Ундеканоат тестостерона длительного действия поддерживает стабильный уровень тестостерона в пределах нормы в течение примерно 12 недель. 59 Гемоглобин и гематокрит сначала повышаются в течение первых 3-6 месяцев лечения, но затем стабилизируются и остаются в пределах нормы в течение всего периода лечения. 60,61
Проспективное обсервационное исследование специально изучало побочные эффекты, включая повышение гематокрита, ундеканоата тестостерона длительного действия; 347 мужчин с гипогонадизмом получили в общей сложности 3022 инъекции ундеканоата тестостерона в течение трех. 5 лет. 54 Только 14 пациентов (4%) развили уровень гематокрита выше 52% и 25 пациентов (7%) развили уровень гематокрита выше 54%. 54 Напротив, среди мужчин, получающих инъекции тестостеронэнантата короткого действия, до 67% испытывают повышение гематокрита более чем на 50%. 53 Предыдущее фармакокинетическое исследование, сравнивающее ундеканоат тестостерона длительного действия (1000 мг каждые 6 недель, затем 1000 мг каждые 9 недель) и энантат тестостерона короткого действия (250 мг каждые 3 недели), также показало более высокие и стабильные минимальные уровни тестостерона для ундеканоат тестостерона во время инъекций (14.От 9 до 16,5 нмоль / л) по сравнению с энантатом тестостерона (<10 нмоль / л). 59
5 лет. 54 Только 14 пациентов (4%) развили уровень гематокрита выше 52% и 25 пациентов (7%) развили уровень гематокрита выше 54%. 54 Напротив, среди мужчин, получающих инъекции тестостеронэнантата короткого действия, до 67% испытывают повышение гематокрита более чем на 50%. 53 Предыдущее фармакокинетическое исследование, сравнивающее ундеканоат тестостерона длительного действия (1000 мг каждые 6 недель, затем 1000 мг каждые 9 недель) и энантат тестостерона короткого действия (250 мг каждые 3 недели), также показало более высокие и стабильные минимальные уровни тестостерона для ундеканоат тестостерона во время инъекций (14.От 9 до 16,5 нмоль / л) по сравнению с энантатом тестостерона (<10 нмоль / л). 59
Комментарий
Почти все ранее описанные случаи венозной тромбоэмболии, связанной с лечением тестостероном, наблюдались у пациентов с ранее не диагностированной тромбофилией. 34,38 Учитывая низкий годовой уровень венозной тромбоэмболии среди населения в целом – от 48 до 120 на 100 000 человек 62-64 – боязнь венозной тромбоэмболии не должна препятствовать подавляющему большинству страдающих гипогонадизмом мужчин от приема тестостероновой терапии и его хорошо задокументированные преимущества для здоровья.Сообщается, что распространенность наследственной тромбофилии составляет 9% среди здорового населения. 65 Хотя скрининг на тромбофилию перед началом терапии тестостероном является оправданным для мужчин с историей или семейным анамнезом тромбоза, данные не оправдывают универсальный скрининг, поскольку абсолютный риск остается низким. 66
Риск повышенного гематокрита у пациентов с истинной полицитемией не может быть экстраполирован на повышение гематокрита, наблюдаемое во время терапии тестостероном у мужчин без рака крови или генетических мутаций.Данные свидетельствуют о том, что терапия тестостероном имеет эффекты, которые могут противодействовать потенциально повышенному риску венозной тромбоэмболии. Например, терапия тестостероном – одно из немногих методов лечения, которое снижает уровень липопротеина (а) [Lp (a)] на впечатляющий диапазон 20-59%. 67-69 В соответствии с этим, подавление эндогенного тестостерона у молодых здоровых мужчин значительно увеличивает уровни Lp (a), до 40-60% выше исходного уровня. 70 Было высказано предположение, что Lp (a) может быть фактором риска венозной тромбоэмболии. 71-73 Менделирующие рандомизационные исследования не подтвердили связь между Lp (a) и риском венозного тромбоза в общих популяционных исследованиях. 74,75 Однако метаанализ восьми исследований в педиатрической популяции показал, что повышенные уровни Lp (a) связаны с 4,5-кратным (отношение шансов 4,50) повышенным риском венозной тромбоэмболии с первым началом. 76 Lp (a) не обязательно может быть протромботическим, но может склонить чашу весов в сторону тромбоза из-за потенциальной потери фибринолитической активности. 77 Интересно, что исследования по менделевской рандомизации, которые не обнаружили связи между Lp (a) с риском венозного тромбоза, действительно показали связь между Lp (a) и фактором V Leiden (который увеличивает риск свертывания крови). 74,75 Хотя необходимы дальнейшие исследования, это предполагает, что повышенному уровню Lp (a) может потребоваться второй фактор, лежащий в основе тромба, и что снижение уровней Lp (a) может снизить общую склонность к тромбообразованию. 77
Вторая причина того, что повышение гематокрита при лечении тестостероном может не быть опасным по своей природе, заключается в том, что низкие уровни тестостерона связаны с более высокими уровнями протромботических факторов у мужчин, независимо от возраста, ожирения, распределения жира в организме и связанных с ними параметров метаболизма. 78
Наконец, экспериментальное исследование предполагает, что существуют адаптивные физиологические механизмы, которые восстанавливают вязкость цельной крови до нормального значения во время длительного приема тестостерона. 79 В этом исследовании всесторонне оценивалось влияние тестостерона на вязкость цельной крови, вязкость плазмы и деформируемость эритроцитов, а также сравнивались половые различия после кратковременного и длительного лечения тестостероном. 79 Результаты показали, что длительное лечение тестостероном не оказало отрицательного воздействия на вязкость цельной крови или вязкость плазмы у взрослых мышей, даже когда были достигнуты супрафизиологические уровни тестостерона.Интересно, что деформируемость эритроцитов увеличивалась после длительного лечения высокими дозами тестостерона. Напротив, краткосрочное лечение высокими дозами тестостерона временно повышало вязкость цельной крови в сочетании с повышенным уровнем гематокрита у самок и кастрированных самцов мышей. 79 Повышенная деформируемость эритроцитов может снизить вязкость цельной крови до гораздо более низкого уровня, чем прогнозируется на основе исключительно высоких гематокритов. 79,80 Примечательно, что лечение тестостероном у мужчин с гипогонадизмом улучшает состав и текучесть мембран эритроцитов. 81 , что, вероятно, улучшает реологию крови и способствует снижению риска тромбоза. 82 Тестостерон также обладает сосудорасширяющим и антиатеросклеротическим эффектами, которые, кроме того, могут объяснять отсутствие увеличения сердечно-сосудистых событий с повышенным гематокритом во время терапии тестостероном. 83-85
Подтверждение лучшей толерантности к повышению гематокрита во время лечения тестостероном ундеканоатом тестостерона получено из исследования, в котором один пациент показал постоянно повышенные значения гематокрита при лечении энантатом тестостерона. 86 У этого пациента не было выявлено повышенного уровня гематокрита в последующем исследовании через 27 месяцев при лечении ундеканоатом тестостерона. 86 Это говорит о том, что мужчины, у которых наблюдается заметное повышение гематокрита при приеме инъекционных препаратов тестостерона короткого действия, могут лучше переносить лечение ундеканоатом тестостерона.
В известном исследовании ретроспективно были рассмотрены диаграммы 217 мужчин с гипогонадизмом старше 65 лет, получавших терапию тестостероном, для определения распространенности тромботических событий и общей смертности. 36 У мужчин с гипогонадизмом, не получавших тестостерон, была повышенная смертность от всех причин по сравнению с мужчинами, которые получали лечение тестостероном. 36 Не было различий в частоте инфаркта миокарда, транзиторной ишемической атаки, инсульта или тромбоза глубоких вен / легочной эмболии между пациентами, получавшими тестостерон, и мужчинами с гипогонадизмом, не получавшими тестостерон. 36 В исследовании TEAAM (Эффекты тестостерона на прогрессирование атеросклероза у пожилых мужчин) из 155 мужчин, получавших тестостерон в течение 3 лет, 13 мужчин (8%) имели гематокрит выше 54%. Следовательно, частота значительного повышения гематокрита при длительной терапии тестостероном мала.Принимая во внимание значительное снижение смертности, наблюдаемое в нескольких исследованиях у мужчин, получавших тестостерон, по сравнению с мужчинами, не получавшими лечения 36,87-90 , небольшое количество мужчин испытывало повышение гематокрита, достигающее 54%, последствия которого все еще не доказаны 32- 36 – не должно удерживать врачей от назначения лечения тестостероном страдающим гипогонадизмом мужчинам.
10.6: Железодефицитная анемия – Medicine LibreTexts
Цели обучения
- Обсудите, почему железодефицитная анемия является наиболее распространенной недостаточностью питания во всем мире, ее влияние на здоровье человека и возможные решения по борьбе с ней.
Железодефицитная анемия – это заболевание, которое развивается из-за недостаточного уровня железа в организме, приводящего к уменьшению количества красных кровяных телец, содержащих меньшее количество гемоглобина. Независимо от причины (будь то низкое потребление железа с пищей или чрезмерная кровопотеря) железодефицитная анемия имеет следующие признаки и симптомы, которые связаны с основными функциями железа в энергетическом обмене и здоровье крови:
- Усталость
- Слабость
- Бледная кожа
- Одышка
- Головокружение
- Опухший, болезненный язык
- Аномальная частота пульса
Железодефицитная анемия диагностируется по характерным признакам и симптомам и подтверждается простыми анализами крови, которые подсчитывают эритроциты и определяют содержание гемоглобина и железа в крови.Анемию чаще всего лечат с помощью добавок железа и увеличения потребления продуктов с высоким содержанием железа. См. Таблицу \ (\ PageIndex {1} \) для получения информации о хороших диетических источниках железа. Добавки железа имеют некоторые побочные эффекты, включая тошноту, запор, диарею, рвоту и боль в животе. Снижение дозы сначала, а затем постепенное увеличение до полной дозы часто сводит к минимуму побочные эффекты добавок железа.
| Продукты питания | Миллиграммы на порцию | Процент RDA (мужчины) | Процент RDA (женщины) |
|---|---|---|---|
| Устрицы (3 унции.) | 13,20 | 165 | 73 |
| Говяжья печень (3 унции) | 7,50 | 94 | 42 |
| Чернослив (½ стакана) | 5,20 | 65 | 29 |
| Моллюски (2 унции) | 4,20 | 53 | 23 |
| Грецкие орехи (½ гр.) | 3,75 | 47 | 21 |
| Нут (½ ц.) | 3,00 | 38 | 19 |
| Хлопья отрубей (½ c.) | 2,80 | 37 | 16 |
| Жаркое из свинины (3 унции) | 2,70 | 34 | 15 |
| Изюм (½ гр.) | 2,55 | 32 | 14 |
| Ростбиф (3 унции) | 1,80 | 23 | 10 |
| Горошек зеленый (½ ц.) | 1,50 | 19 | 8 |
| Арахис (½ гр.) | 1,50 | 19 | 8 |
| Зеленая фасоль (½ гр.) | 1,00 | 13 | 6 |
| Яйцо (1) | 1,00 | 13 | 6 |
Источник: Медицинский центр Университета Мэриленда. “Утюг.” © 2011 Медицинский центр Университета Мэриленда (УГМК). Все права защищены. www.umm.edu/altmed/articles/i…#ixzz2BIykoCPs.
Избегание продуктов и напитков с высоким содержанием фитатов, а также чая (который содержит дубильную кислоту и полифенолы, которые ухудшают усвоение железа), важно для людей с железодефицитной анемией.Употребление диетического источника витамина С одновременно с железосодержащими продуктами улучшает всасывание негемового железа в кишечнике. Кроме того, неизвестные соединения, которые, вероятно, находятся в мышечной ткани мяса, птицы и рыбы, увеличивают абсорбцию железа как из гемовых, так и из негемовых источников. В таблице \ (\ PageIndex {2} \) указаны другие усилители и ингибиторы абсорбции железа.
| Усилитель | Ингибитор |
|---|---|
| Мясо | Фосфат |
| Рыба | Кальций |
| Птица | Чай |
| Морепродукты | Кофе |
| Желудочная кислота | Кола |
| Соевый белок | |
| Высокие дозы минералов (антацидов) | |
| Отруби / волокна | |
| Фитаты | |
| Оксалаты | |
| Полифенолы |
Дефицит железа: проблема питания во всем мире
Центры по контролю и профилактике заболеваний сообщают, что дефицит железа является наиболее распространенным дефицитом питания во всем мире.По оценкам ВОЗ, 80 процентов людей страдают дефицитом железа, а 30 процентов мирового населения страдает железодефицитной анемией. Основными причинами дефицита железа во всем мире являются паразитарные глисты в кишечнике, вызывающие чрезмерную кровопотерю, и малярия, паразитарное заболевание, вызывающее разрушение красных кровяных телец. В развитом мире дефицит железа в большей степени является результатом недостаточности питания и / или чрезмерной кровопотери, происходящей во время менструации или родов.
Группы риска
Младенцы, дети, подростки и женщины во всем мире являются группами населения, наиболее подверженными риску железодефицитной анемии по всем причинам.Младенцам, детям и даже подросткам требуется больше железа, потому что железо необходимо для роста. В этих группах населения дефицит железа (и, в конечном итоге, железодефицитная анемия) также может вызывать следующие признаки и симптомы: плохой рост, неспособность развиваться и низкая успеваемость в школе, а также психические, моторные и поведенческие расстройства. Женщины, у которых наблюдаются обильные менструальные кровотечения или беременные, нуждаются в большем количестве железа в рационе. Еще одна группа риска – пожилые люди. И пожилые мужчины, и женщины часто страдают анемией, и наиболее частыми причинами являются дефицит железа в пище и хронические заболевания, такие как язва, воспалительные заболевания и рак.Кроме того, тем, кто недавно пострадал от травматической кровопотери, часто сдает кровь или принимает чрезмерное количество антацидов от изжоги, необходимо больше железа в рационе.
Токсичность для железа
Организм выделяет мало железа, поэтому его способность к накоплению в тканях и органах значительна. Накопление железа в определенных тканях и органах может вызвать множество проблем со здоровьем у детей и взрослых, включая сильную усталость, артрит, боли в суставах и тяжелую токсичность для печени и сердца.У детей смерть наступила в результате употребления всего лишь 200 мг железа, поэтому крайне важно, чтобы добавки железа были недоступны для детей. IOM установил допустимые верхние уровни потребления железа (Таблица \ (\ PageIndex {1} \)). Гемохроматоз, в основном наследственное заболевание, является результатом генетической мутации, которая приводит к аномальному метаболизму железа и накоплению железа в определенных тканях, таких как печень, поджелудочная железа и сердце. Признаки и симптомы гемохроматоза сходны с симптомами перегрузки железом в тканях, вызванной высоким потреблением железа с пищей или другими негенетическими метаболическими аномалиями, но часто имеют более выраженную тяжесть.
| Возраст | Мужчины (мг / день) | Женщины (мг / день) | Беременность (мг / сут) | Лактация (мг / день) |
|---|---|---|---|---|
| 7–12 месяцев | 40 | 40 | НЕТ | НЕТ |
| 1–13 лет | 40 | 40 | НЕТ | НЕТ |
| 14–18 лет | 45 | 45 | 45 | 45 |
| 19+ лет | 45 | 45 | 45 | 45 |
Источник: Институт медицины. Нормы потребления витамина А, витамина К, мышьяка, бора, хрома, меди, йода, железа, марганца, молибдена, никеля, кремния, ванадия и цинка. , 9 января 2001 г. www.iom.edu/Reports/2001/Diet…-and-Zinc.aspx.
Профилактика железодефицитной анемии
У детей раннего возраста железодефицитная анемия может вызывать серьезные длительные двигательные, психические и поведенческие нарушения. В Соединенных Штатах высокая заболеваемость железодефицитной анемией у младенцев и детей была серьезной проблемой общественного здравоохранения до начала 1970-х годов, но теперь заболеваемость значительно снизилась.Это достижение было достигнуто путем проведения скрининга детей грудного возраста на железодефицитную анемию в секторе здравоохранения в качестве общей практики, пропаганды обогащения детских смесей и каш железом и их распределения в программах дополнительного питания, таких как программа для женщин и младенцев. , и Дети (WIC). Также поощрялось грудное вскармливание, добавление железа и отсрочка введения коровьего молока по крайней мере в течение первых двенадцати месяцев жизни. Эти методы применялись во всем социально-экономическом спектре, и к 1980-м годам количество случаев железодефицитной анемии у младенцев значительно снизилось.Пришлось вводить другие решения для маленьких детей, которые больше не получали грудное молоко или обогащенные смеси и потребляли коровье молоко. Родителям были предложены следующие решения: обеспечить рацион, богатый источниками железа и витамина С, ограничить потребление коровьего молока до менее двадцати четырех унций в день и поливитамины, содержащие железо.
Рисунок \ (\ PageIndex {1} \). Хотя добавки могут потребоваться в острых ситуациях, лучший способ увеличить потребление железа – это правильное питание.Изображение использовано с разрешения (общественное достояние; это изображение было выпущено Национальным институтом рака, входящим в состав Национального института здравоохранения).
В странах третьего мира железодефицитная анемия остается серьезной проблемой для общественного здравоохранения. Всемирный банк утверждает, что ежегодно от анемии умирает миллион человек, и большинство из них происходит в Африке и Юго-Восточной Азии. Всемирный банк называет пять ключевых мероприятий по борьбе с анемией:
- Обеспечьте группы риска препаратами железа.
- Обогащайте основные продукты питания железом и другими питательными микроэлементами, дефицит которых связан с анемией.
- Предотвратить распространение малярии и вылечить сотни миллионов больных.
- Обеспечьте надкроватную сетку, обработанную инсектицидами, для предотвращения паразитарных инфекций.
- Лечение паразитарно-червей в группах высокого риска.
Кроме того, продолжается расследование относительно того, является ли поставка посуды из железа для групп риска эффективной в профилактике и лечении железодефицитной анемии.
Основные выводы
- Железодефицитная анемия – это заболевание, которое развивается из-за недостаточного уровня железа в организме, что приводит к уменьшению количества эритроцитов и уменьшению их размера, содержащих меньшее количество гемоглобина. Он диагностируется на основании характерных признаков и симптомов и подтверждается простыми анализами крови, которые подсчитывают эритроциты и определяют содержание гемоглобина и железа в крови. Анемию чаще всего лечат с помощью добавок железа и увеличения потребления продуктов с высоким содержанием железа.
- Основными причинами дефицита железа во всем мире являются паразитарно-глистные инфекции кишечника (вызывающие чрезмерную кровопотерю), малярия, паразитарное заболевание, вызывающее разрушение красных кровяных телец, и недостаток железа в рационе.
- Младенцы, дети, подростки и женщины во всем мире являются группами населения, наиболее подверженными риску железодефицитной анемии по всем причинам.
- В прошлом в Америке железодефицитная анемия была распространена среди младенцев и маленьких детей. После введения скрининга младенцев, обогащения смесей и продуктов питания и обучения родителей обеспечению диеты, богатой железом, железодефицитная анемия в этой стране значительно снизилась.
- В странах третьего мира железодефицитная анемия остается серьезной проблемой для общественного здравоохранения. Решения по снижению распространенности железодефицитной анемии в развивающихся странах включают предоставление пищевых добавок целевым группам населения, обогащение продуктов питания железом и другими полезными для крови микронутриентами, предотвращение распространения малярии, лечение паразитарных инфекций и предоставление посуды из железа людям из группы повышенного риска. населения.
- Организм выделяет мало железа, поэтому его способность к накоплению в тканях и органах значительна.Накопление железа в определенных тканях и органах может вызвать множество проблем со здоровьем у детей и взрослых, включая сильную усталость, артрит, боли в суставах и тяжелую токсичность для печени и сердца.
Обсуждение стартеров
- Придумайте две гипотезы о том, почему так важно, чтобы кровь постоянно обновлялась.
- Обсудите эффективность и стоимость некоторых возможных решений по устранению железодефицитной анемии во всем мире.
 А. И. Евдокимова» Минздрава РФ
А. И. Евдокимова» Минздрава РФ