Антрополог назвал генную модификацию человека в будущем неизбежной
https://ria.ru/20190118/1549546818.html
Антрополог назвал генную модификацию человека в будущем неизбежной
Антрополог назвал генную модификацию человека в будущем неизбежной
Генная модификация человека неизбежна в будущем, несмотря на сегодняшние протесты общественных организаций, сообщил в интервью РИА Новости доцент кафедры… РИА Новости, 03.03.2020
2019-01-18T11:43
2019-01-18T11:43
2020-03-03T13:26
россия
наука
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.img.ria.ru/images/148641/75/1486417561_0:300:5760:3540_1920x0_80_0_0_f21d150d573dcec622984b082629398e.jpg
МОСКВА, 18 янв – РИА Новости. Генная модификация человека неизбежна в будущем, несмотря на сегодняшние протесты общественных организаций, сообщил в интервью РИА Новости доцент кафедры антропологии биологического факультета МГУ имени М.В. Ломоносова, кандидат биологических наук Станислав Дробышевский.В этом году кафедре антропологии биологического факультета МГУ исполняется 100 лет.Как отметил Дробышевский, сейчас во всем мире подобные опыты под запретом, но китайские ученые заявили о рождении ребенка, чей геном удалось модифицировать таким образом, что он не сможет болеть СПИДом.”Мы уже сейчас находимся в состоянии, близком к вымиранию, полезные ресурсы Земли уходят в минус, пики добычи угля и нефти уже пройдены. Решить проблему численности населения планеты можно разными способами, в том числе – с помощью генной инженерии, то, что она будет использоваться – очевидно”, – сказал Дробышевский.По словам ученого, в противном случае человечество вновь окажется в средневековье.Читайте полный текст интервью >>
https://ria.ru/20181229/1548869899.html
https://ria.ru/20181018/1530949087.html
https://ria.ru/20180821/1526890023.html
россия
РИА Новости
internet-group@rian.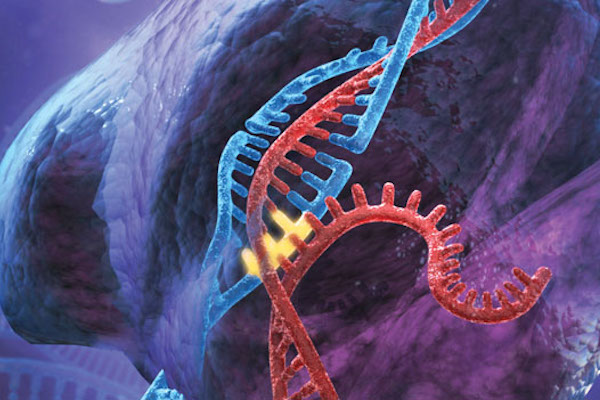 ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn24.img.ria.ru/images/148641/75/1486417561_320:0:5440:3840_1920x0_80_0_0_f5ff8689b94bc3426a65498f4fa6d40a.jpg
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
россия
МОСКВА, 18 янв – РИА Новости. Генная модификация человека неизбежна в будущем, несмотря на сегодняшние протесты общественных организаций, сообщил в интервью РИА Новости доцент кафедры антропологии биологического факультета МГУ имени М.В. Ломоносова, кандидат биологических наук Станислав Дробышевский.
В этом году кафедре антропологии биологического факультета МГУ исполняется 100 лет.
29 декабря 2018, 08:00НаукаСмерть по наследству. Как судьба родителей влияет на здоровье детей
“Ученые научились на генетическом уровне модифицировать сельскохозяйственные культуры и продукты питания. Следующий шаг – генная модификация самого человека. Генная инженерия позволяет “подвинтить” необходимые гены и получить свойства особи, которые нам нужны, причем не в перспективе десятилетий, а гораздо быстрее… Проблема таких манипуляций с геномом человека в том, что этим экспериментам сопротивляются общественные организации, особенно – религиозные.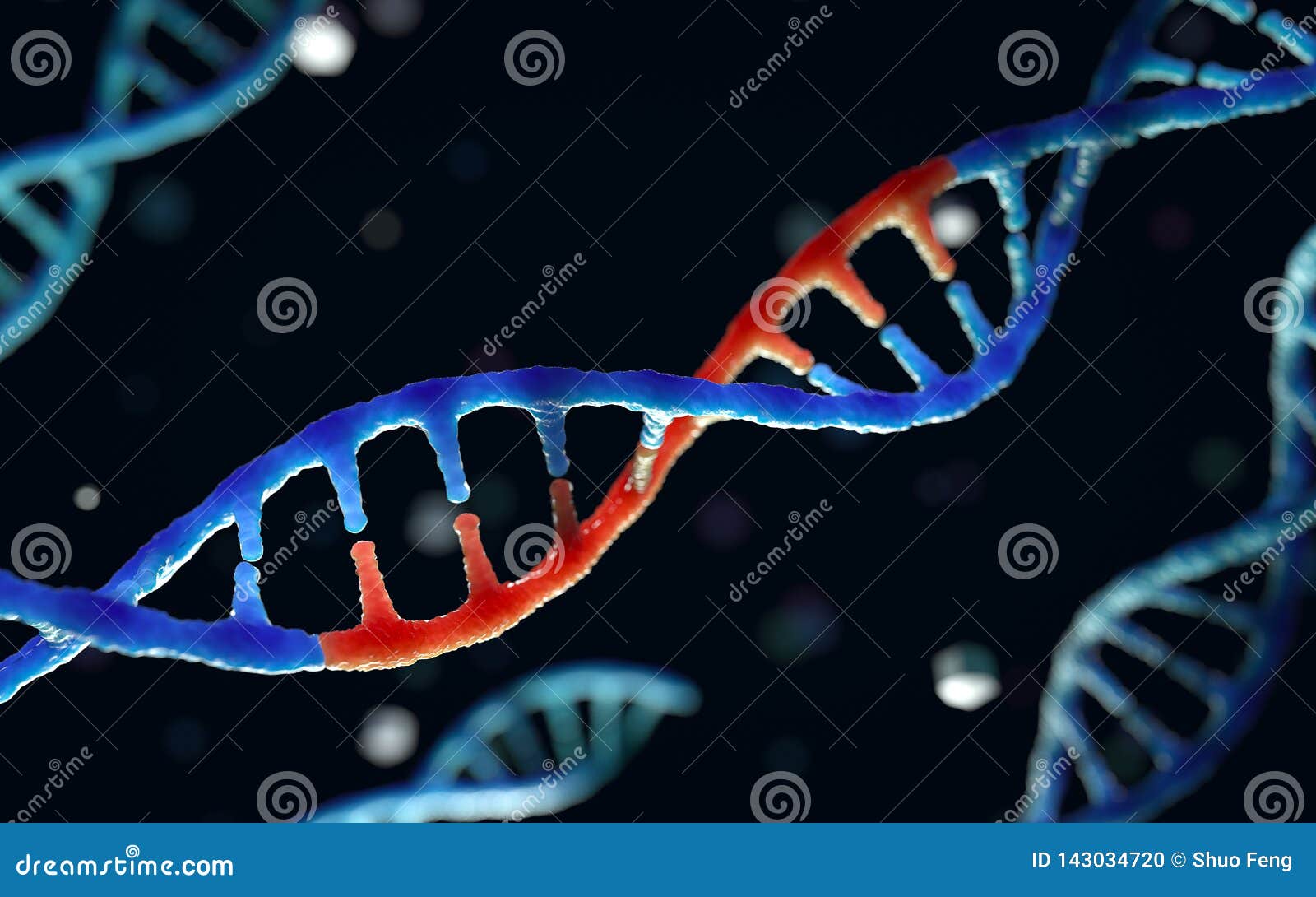 Но, несмотря на эти протесты, генная инженерия в ближайшем будущем станет частью нашей жизни. Ведь человечество ставит перед собой цель выжить, а при неконтролируемом размножении и истощении природных ресурсов это невозможно”, – сказал он.
Но, несмотря на эти протесты, генная инженерия в ближайшем будущем станет частью нашей жизни. Ведь человечество ставит перед собой цель выжить, а при неконтролируемом размножении и истощении природных ресурсов это невозможно”, – сказал он.
Как отметил Дробышевский, сейчас во всем мире подобные опыты под запретом, но китайские ученые заявили о рождении ребенка, чей геном удалось модифицировать таким образом, что он не сможет болеть СПИДом.
18 октября 2018, 12:00НаукаВ России созданы эмбрионы, неуязвимые для действия ВИЧ
“Мы уже сейчас находимся в состоянии, близком к вымиранию, полезные ресурсы Земли уходят в минус, пики добычи угля и нефти уже пройдены. Решить проблему численности населения планеты можно разными способами, в том числе – с помощью генной инженерии, то, что она будет использоваться – очевидно”, – сказал Дробышевский.
По словам ученого, в противном случае человечество вновь окажется в средневековье.
21 августа 2018, 08:00НаукаСекс или деньги? Ученые поняли, почему на Земле рождается больше мальчиков
“В режиме средневековья оно сможет существовать до бесконечности, но продолжительность жизни сократится до 30 лет и резко упадет ее уровень. Зато, к примеру, мало кто будет иметь проблемы с сердечно-сосудистой системой, так как до возраста связанных с ней болезней люди просто не смогут доживать”, – добавил Дробышевский.
Читайте полный текст интервью >>
Комфортная антиутопия: как мир примиряется с генной модификацией людей | Статьи
Двойняшки, которым запрограммировали иммунитет к ВИЧ на генетическом уровне, родились пять месяцев назад. Тогда научное сообщество раскритиковало подобные исследования. Теперь Всемирная организация здравоохранения призывает ученых поделиться опытом. За тем, как из антиутопии генная инженерия превращается в норму, наблюдают «Известия».
В ноябре 2018 Хэ Цзянькуй (He Jiankui), китайский ученый из Южного университета науки и технологий в Шэньчжэне, рассказал о рождении близняшек с измененным геномом. Чтобы защитить детей от ВИЧ, он был отредактирован во время беременности.
Чтобы защитить детей от ВИЧ, он был отредактирован во время беременности.
Задачей ученого было «отключить» ген CCR5, который связан с формированием белка, позволяющего вирусу попасть в клетку. Хэ работал с парами, в которых ВИЧ-положительными были только мужчины. Они принимали препараты и потому были незаразны. Геном был изменен в 16 эмбрионах, из них 11 были использованы для искусственного оплодотворения. Одна женщина в результате забеременела. Обе копии гена CCR5 удалось изменить лишь у одной из близняшек. У второй отредактирована одна копия, так что она может в будущем заразиться ВИЧ. Позже Хэ заявил, что еще одна женщина ждет ребенка с отредактированным геномом.
Об этой работе ученый рассказал на Втором международном саммите по генетическому редактированию человека в Гонконге. И хотя отдельные коллеги поддержали его исследования, большинство отнеслось к ним негативно.
Фото: Getty Images/Luke Chan
Отредактированные дети
Ведущий конференции в Гонконге нобелевский лауреат Дэвид Балтимор (David Baltimore) назвал эксперимент безответственным. «Отключение» гена CCR5 повышает опасность заражения лихорадкой Западного Нила и другими вирусными заболеваниями, а также увеличивает вероятность смерти от гриппа. «Я не думаю, что в этом была медицинская необходимость. Список заболеваний [к которым в результате эксперимента снизилась сопротивляемость двойняшек], который был озвучен во время дискуссий, вызывает гораздо больше опасений», — заявил Балтимор.
Неприемлемым назвала эксперимент и Дженнифер Дудна (Jennifer Doudna), одна из создательниц технологии редактирования генома CRISPR/Cas9, которую, предположительно, использовал Хе. Коллега Дудны Фэн Чжан также поддержал мораторий на имплантацию отредактированных эмбрионов.
Фото: Getty Images/zorazhuang
Вскоре от исследований Хэ открестился его университет. На сайте появилось объявление о том, что он не ставил руководство в известность о своей работе. И вообще с февраля 2018 года по январь 2021-го находится в неоплачиваемом отпуске. Раздел, посвященный работе с детьми, на сайте лаборатории самого Хэ недоступен. И он не выпустил ни одной статьи об исследовании в рецензируемом научном журнале, хоть и говорил на конференции, что статья передана в одну из редакций. Так что все сведения об успехе эксперимента основаны на выступлении в Гонконге и интервью Associated Press. В университете, как и в больнице, которая якобы одобрила исследования, отметили, что шокированы произошедшим и проводят собственные расследования.
На сайте появилось объявление о том, что он не ставил руководство в известность о своей работе. И вообще с февраля 2018 года по январь 2021-го находится в неоплачиваемом отпуске. Раздел, посвященный работе с детьми, на сайте лаборатории самого Хэ недоступен. И он не выпустил ни одной статьи об исследовании в рецензируемом научном журнале, хоть и говорил на конференции, что статья передана в одну из редакций. Так что все сведения об успехе эксперимента основаны на выступлении в Гонконге и интервью Associated Press. В университете, как и в больнице, которая якобы одобрила исследования, отметили, что шокированы произошедшим и проводят собственные расследования.
Непонятно и на чьи деньги проводился эксперимент. На саммите Хэ отказался отвечать на этот вопрос. Позже в одном из интервью сказал, что работа финансировалась на частные средства.
Финалом скандала стало заявление правительства Китая о запрете редактирования генома эмбрионов. Подобный запрет до этого был введен во многих странах. Из-за этого Китай и был выбран местом эксперимента Хэ и его бывшим научным руководителем, физиком и биоинженером Майклом Димом (Michael Deem) из Университета Райса в Хьюстоне.
Сюй Нанпин, вице-министр Китая по науке и технологиям
Эксперимент перешел грань морали и этики, которых придерживается академическое сообщество, и оказался шокирующим и неприемлемым.
Ген на милость
За пять месяцев, прошедших с тех пор, отношение к редактированию генома в научном сообществе изменилось. Резкое осуждение превратилось в острожный интерес.
Сторонники китайских опытов были с самого начала, пусть и в меньшинстве. Например, гарвардский генетик Джордж Черч (George Church), обративший внимание на то, что ВИЧ — растущая угроза для человечества. Или заведующий лабораторией эпигенетики развития Института цитологии и генетики СО РАН Сурен Закиян. По его словам, если заявления Хэ правда, «то это колоссальный прорыв для фундаментальной науки».
По его словам, если заявления Хэ правда, «то это колоссальный прорыв для фундаментальной науки».
Тут надо отметить, что вопрос о том, реально ли Хэ достиг успеха, остается открытым. Все личные данные участников эксперимента конфиденциальны.
Больше того, вскоре после скандала выяснилось, что подобными исследованиями занимаются ученые во многих странах. В том числе в России с 2017 года в Национальном медицинском исследовательском центре имени Кулакова.
Фото: Depositphotos
Денис Ребриков, заведующий лабораторией редактирования генома Национального медицинского исследовательского центра имени Кулакова
В рамках нашей исследовательской работы, продолжающейся с начала 2017 года, мы вносим в геном зиготы такую же модификацию, что и Хэ, с той лишь разницей, что мы не подсаживаем полученные эмбрионы пациенткам.
Отказ от выращивания эмбрионов с отредактированным геномом заведующий лабораторией редактирования генома Денис Ребриков объяснил тем, что побочные эффекты не изучены. И этически эта технология оправдана только для планирующих беременность ВИЧ-положительных женщин с плохим ответом на антиретровирусную терапию.
В феврале 2019 года в американском рецензируемом журнале Cell вышла статья о позитивном побочном эффекте редактирования генома. Тесты показали, что удаление у мышей того самого гена CCR5 улучшает их когнитивные (познавательные) функции. Также ученые выяснили, что люди, у которых CCR5 отсутствует из-за естественной мутации, быстрее восстанавливаются после инсульта.
Одна из авторов статьи, Альчино Сильва (Alcino Silva) из Калифорнийского университета в Лос-Анджелесе, подчеркнула, что последствия от такого воздействия известны пока только для мышей. Так что ученые сконцентрировались на разработке препаратов, которые смогут блокировать этот ген у пациентов, проходящих реабилитацию после инсульта.
В апреле авторы другого исследования побочных эффектов редактирования генома отозвали статью из британского научного журнала Nature Methods. За год с момента публикации ее несколько раз критиковали за некорректную постановку эксперимента. Ученые из Стэнфордского и Колумбийского университетов сравнивали мышей с отредактированным геномом с другими мышами той же линии (так называют группы искусственно выведенных мышей). И пришли к выводу, что мутацию, приводящую к слепоте, можно вылечить с минимальным количеством побочных эффектов. Научное сообщество, среди прочего, указало на то, что сравнивать подопытных нужно было с их родителями. В таком случае в геноме после тестов обнаруживается более 100 крупных мутаций. В новой публикации ученые признают, что их начальные выводы ошибочны. Однако с отзывом статьи согласились только двое из шести авторов.
Фото: Depositphotos
Редактирование генома отдельных клеток с помощью системы CRISPR/Cas9 по всему миру продолжается. В Китае, где запретили менять геном эмбриона, пациентам вводят модифицированные лимфоциты в качестве иммунотерапии рака. Тестировать технологию по борьбе с этим заболеванием на 18 добровольцах начали в США еще в январе 2018 года. А на 2019 год в Соединенных Штатах и Европе запланировано начало клинических испытаний по редактированию стволовых клеток крови для лечения бета-талассемии и серповидноклеточной анемии (связанных с гемоглобином заболеваний).
Кстати, в Великобритании, где в 2016 году было разрешено в исследовательских целях редактировать геном эмбрионов человека, запрет после истории с китайскими двойняшками так и не был введен. И там в том же 2016 году на свет появился ребенок, родителями которого можно считать трех человек. Исследования, которые к этому привели, очевидно, велись до официального разрешения.
Российские ученые планируют заняться редактированием генома у живого человека в ближайшие три-четыре года, сообщила в августе прошлого года «РИА Новости» сотрудник лаборатории мутагенеза ФГБНУ «Медико-генетический научный центр», кандидат медицинских наук Светлана Смирнихина.
В феврале этого года Минобрнауки вместе с РАН разработали проект программы развития генетических технологий на 2019–2027 годы. Сделать это распорядился в ноябре 2018 года президент Владимир Путин. Тогда отмечалось, что программа нужна для ускорения развития генетических технологий и предупреждения чрезвычайных ситуаций биологического характера. А издание «Хайтек» отмечало, что в рамках этой программы откроют лаборатории по развитию технологии генетического редактирования.
Экономика против этики
Через несколько дней после того, как правительство Китая запретило редактировать геном эмбрионов, глава Всемирной организации здравоохранения Тедрос Адханом Гебрейесус призвал обсудить возможные последствия использования генной инженерии. И отметил, что надо начать обсуждение с того, стоит ли вообще подобное обсуждать, так как «есть большая часть населения, которая говорит: «Не надо это трогать».
И вот несколько дней назад эксперты ВОЗ пришли к выводу, что обсуждать, как и трогать, нужно. Они призвали создать регистр проводимых в мире исследований в сфере редактирования генов человека. И надеются на дискуссию с учеными, чтобы «лучше понять технические условия и нынешние мероприятия в сфере управления» исследованиями. Также ВОЗ будет проводить консультации с общественниками, группами пациентов, специалистами по этике и учеными в области социальных отношений.
По мнению профессора юриспруденции в Стэнфорде Хэнка Грили (Henry T. Greely), вопрос, когда ученым позволят улучшать людей, связан не столько с этикой, сколько с экономикой. Общественное мнение может измениться, если какая-нибудь крупная фармацевтическая компания начнет работать в этой сфере. И достаточно будет нескольких ярких маркетинговых кампаний под лозунгом «Мы изменим ваших детей», а также социологических опросов, посвященных праву родителей убирать возможные наследственные заболевания у потомков.
Фото: Depositphotos
Правда, Грили полагает, что произойдет это нескоро. Пока технология CRISPR слишком сложна. И крупные игроки не будут заниматься незаконными исследованиями, чтобы спрогнозировать возможную выгоду.
Пока технология CRISPR слишком сложна. И крупные игроки не будут заниматься незаконными исследованиями, чтобы спрогнозировать возможную выгоду.
Способствовать популяризации генной модификации могут и компании, не связанные с медициной. В декабре 2017 года Управление перспективных исследовательских проектов Минобороны США (DARPA) вложило $100 млн в разработку генетического оружия для борьбы с малярийными комарами, грызунами и другими видам животных, несущими угрозу человеку и окружающей среде. В ООН выступили с критикой этого проекта, так как уничтожение одних видов может оказать негативное воздействие на другие.
Есть успехи с CRISPR и у сельского хозяйства. Так, в Китае удалось создать свиней с пониженным содержанием жира после замены части генов генами мышей. А американская компания Monsanto планирует использовать CRISPR, чтобы вывести новые сорта растений, более урожайные и устойчивые к экстремальным условиями среды.
Справка «Известий»
CRISPR, или короткие палиндромные повторы, регулярно расположенные группами, обнаружили в Японии еще в 1980-е годы. Но догадались, как использовать особенности генома этой бактерии, только в 2010-е французские генетики Филипп Хорват (Philippe Horvath), Эммануэль Шарпентье (Emmanuelle Marie Charpentier) и их американская коллега Дженнифер Дудна (Jennifer Doudna).
Отличие CRISPR/Cas9 от других способов генного редактирования в том, что изменения ДНК можно четко направлять. Раньше конструкцию клетки изменяли, не имея возможности предсказать, куда встанет новая последовательность. К тому же невозможно было изменить существующие свойства организма — только добавить новые.
В CRISPR/Cas9 есть специальный фермент, который разрывает нужно место в геноме. Cas в названии — это белок, участвующий в разрушении клеток. Когда организм начинает восстанавливать клетку, он ищет для этого нужные последовательности в соседних геномах. По технологии, клетка должна найти ее в ферментах, которые ввели в организм генетики.
ЧИТАЙТЕ ТАКЖЕ
состояние на 2020 — Будущее на vc.ru
Представьте, что люди получили возможность выбирать эстетические, физические и интеллектуальные параметры для будущего ребёнка, лечить рак самостоятельно дома без дорогих лекарств и изнуряющих процедур, а также без труда избавляться от страшных и серьезных генетических заболеваний.
{“id”:109057,”url”:”https:\/\/vc.ru\/future\/109057-gennaya-inzheneriya-sostoyanie-na-2020″,”title”:”\u0413\u0435\u043d\u043d\u0430\u044f \u0438\u043d\u0436\u0435\u043d\u0435\u0440\u0438\u044f: \u0441\u043e\u0441\u0442\u043e\u044f\u043d\u0438\u0435 \u043d\u0430 2020″,”services”:{“facebook”:{“url”:”https:\/\/www.facebook.com\/sharer\/sharer.php?u=https:\/\/vc.ru\/future\/109057-gennaya-inzheneriya-sostoyanie-na-2020″,”short_name”:”FB”,”title”:”Facebook”,”width”:600,”height”:450},”vkontakte”:{“url”:”https:\/\/vk.com\/share.php?url=https:\/\/vc.ru\/future\/109057-gennaya-inzheneriya-sostoyanie-na-2020&title=\u0413\u0435\u043d\u043d\u0430\u044f \u0438\u043d\u0436\u0435\u043d\u0435\u0440\u0438\u044f: \u0441\u043e\u0441\u0442\u043e\u044f\u043d\u0438\u0435 \u043d\u0430 2020″,”short_name”:”VK”,”title”:”\u0412\u041a\u043e\u043d\u0442\u0430\u043a\u0442\u0435″,”width”:600,”height”:450},”twitter”:{“url”:”https:\/\/twitter.com\/intent\/tweet?url=https:\/\/vc.ru\/future\/109057-gennaya-inzheneriya-sostoyanie-na-2020&text=\u0413\u0435\u043d\u043d\u0430\u044f \u0438\u043d\u0436\u0435\u043d\u0435\u0440\u0438\u044f: \u0441\u043e\u0441\u0442\u043e\u044f\u043d\u0438\u0435 \u043d\u0430 2020″,”short_name”:”TW”,”title”:”Twitter”,”width”:600,”height”:450},”telegram”:{“url”:”tg:\/\/msg_url?url=https:\/\/vc.ru\/future\/109057-gennaya-inzheneriya-sostoyanie-na-2020&text=\u0413\u0435\u043d\u043d\u0430\u044f \u0438\u043d\u0436\u0435\u043d\u0435\u0440\u0438\u044f: \u0441\u043e\u0441\u0442\u043e\u044f\u043d\u0438\u0435 \u043d\u0430 2020″,”short_name”:”TG”,”title”:”Telegram”,”width”:600,”height”:450},”odnoklassniki”:{“url”:”http:\/\/connect. ok.ru\/dk?st.cmd=WidgetSharePreview&service=odnoklassniki&st.shareUrl=https:\/\/vc.ru\/future\/109057-gennaya-inzheneriya-sostoyanie-na-2020″,”short_name”:”OK”,”title”:”\u041e\u0434\u043d\u043e\u043a\u043b\u0430\u0441\u0441\u043d\u0438\u043a\u0438″,”width”:600,”height”:450},”email”:{“url”:”mailto:?subject=\u0413\u0435\u043d\u043d\u0430\u044f \u0438\u043d\u0436\u0435\u043d\u0435\u0440\u0438\u044f: \u0441\u043e\u0441\u0442\u043e\u044f\u043d\u0438\u0435 \u043d\u0430 2020&body=https:\/\/vc.ru\/future\/109057-gennaya-inzheneriya-sostoyanie-na-2020″,”short_name”:”Email”,”title”:”\u041e\u0442\u043f\u0440\u0430\u0432\u0438\u0442\u044c \u043d\u0430 \u043f\u043e\u0447\u0442\u0443″,”width”:600,”height”:450}},”isFavorited”:false}
ok.ru\/dk?st.cmd=WidgetSharePreview&service=odnoklassniki&st.shareUrl=https:\/\/vc.ru\/future\/109057-gennaya-inzheneriya-sostoyanie-na-2020″,”short_name”:”OK”,”title”:”\u041e\u0434\u043d\u043e\u043a\u043b\u0430\u0441\u0441\u043d\u0438\u043a\u0438″,”width”:600,”height”:450},”email”:{“url”:”mailto:?subject=\u0413\u0435\u043d\u043d\u0430\u044f \u0438\u043d\u0436\u0435\u043d\u0435\u0440\u0438\u044f: \u0441\u043e\u0441\u0442\u043e\u044f\u043d\u0438\u0435 \u043d\u0430 2020&body=https:\/\/vc.ru\/future\/109057-gennaya-inzheneriya-sostoyanie-na-2020″,”short_name”:”Email”,”title”:”\u041e\u0442\u043f\u0440\u0430\u0432\u0438\u0442\u044c \u043d\u0430 \u043f\u043e\u0447\u0442\u0443″,”width”:600,”height”:450}},”isFavorited”:false}
30 719
просмотров
Какая технология служит предпосылкой к такого рода идеям и насколько мы близки к их воплощению в 2020 году — рассмотрим в данной статье.
Что такое ген
Для того, чтобы понять что такое гены, необходимо начать с более привычного понятия клеток.
Клетки являются основными строительными блоками всего живого, человеческое тело состоит из триллионов из них. Они обеспечивают структуру тела, получают питательные вещества из пищи, преобразуют эти питательные вещества в энергию и выполняют специализированные функции. Клетки также содержат наследственный материал тела и могут делать копии самих себя.
В ядре каждой клетки молекула дезоксирибонуклеиновой кислоты (ДНК) упакована в нитевидные структуры, называемые хромосомами. Каждая хромосома состоит из ДНК, многократно обмотанной белками, называемыми гистонами, которые поддерживают ее структуру.
Каждая хромосома состоит из ДНК, многократно обмотанной белками, называемыми гистонами, которые поддерживают ее структуру.
В наших клетках содержатся тысячи генов, которые предоставляют информацию для производства определенных белков и ферментов, которые производят мышцы, кости и кровь, и которые, в свою очередь, поддерживают большинство функций нашего организма, таких как пищеварение, выработка энергии и рост.
Иначе говоря, гены представляют собой сегменты ДНК, которые содержат код для конкретного белка, который функционирует в одном или нескольких типах клеток организма.
Итак, гены состоят из ДНК, которая является основой для создания ферментов и белков, заставляющих наше тело работать.
Белки, вероятно, самый важный класс материала в организме. Они например, строят кости, позволяют мышцам двигаться, поддерживают биение сердца.
Насколько сейчас известно, у людей от 20 тысяч до 25 тысяч генов. У каждого человека есть две копии каждого гена, по одной унаследованной от каждого родителя.
Большинство генов у всех людей одинаковы, однако небольшое их количество (менее 1%) все же различаются, это и является причиной индивидуальных физический особенностей у людей. Гены влияют на все: от цвета наших волос до нашей иммунной системы.
Гены влияют на все: от цвета наших волос до нашей иммунной системы.
Однако они не всегда строятся правильно. Небольшое изменение в них может изменить работу наших белков, которые затем изменят то, как мы дышим, ходим или даже перевариваем пищу.
Гены также могут изменяться по мере того, как они проходят через унаследованные мутации, или с возрастом. Также причиной изменения в генах может служить их повреждение химическими веществами и радиацией.
Когда необходима генная терапия
В ситуации, когда ген видоизменяется таким образом, что вызывает определенное заболевание, генная инженерия и является тем решением, способным помочь. Что же конкретно она из себя представляет?
Что такое генная терапия и как она работает
Генная терапия — это введение, удаление или изменение генетического материала, в частности ДНК или РНК (рибонуклеиновая кислота), в клетке пациента для лечения определенного заболевания.
Важно сказать, что генная модификация по сути своей придумана не нами и возникла еще за долго до появления человека. Редактированием кусочков чужого генома всегда занимались вирусы а также некоторые бактерии.
Бактерия приносят в растения последовательности генов, которые нужны бактерии, и растение меняет свой геном. Поэтому люди, безусловно, развили и научились применять технологию видоизменения генов, но ни в коем случае не изобрели ее.
Существует три основных стратегии использования генной терапии для восстановления клеток-мишеней или тканей-мишеней до нормального, здорового состояния:
- Замена мутировавшего гена, вызывающего заболевание, здоровой копией гена.
- Инактивация или «выбивание» мутировавших генов, которые функционируют неправильно.
- Введение нового гена в организм, помогающего бороться с болезнью.
Наиболее часто используемый метод включает вставку «терапевтического» гена в геном для замены «ненормального» или «вызывающего болезнь» гена.
Роль вируса в генной терапии
Чтобы вставить новые гены непосредственно в клетки, ученые используют средство, называемое «вектор», которое генетически спроектировано для доставки нужного гена. Чаще всего в качестве вектора выступают вирусы.
Чаще всего в качестве вектора выступают вирусы.
Прежде чем мы поговорим о вирусе в контексте генной терапии, давайте сначала обсудим основы встречающихся в природе вирусов.
Как известно из сезона простуды и гриппа, вирусы достаточно искусны в искусстве вторжения в наши тела — добавления своего генетического материала в наши клетки. Тем не менее исследователи научились использовать эту хитрую способность в своих интересах.
Вирус — это инфекционный агент, который может прикрепляться к клеткам нашего организма. Вирусы являются паразитами, они выживают, заражая хозяина. Так же, как люди и бактерии, вирусы естественным образом развивались здесь, на Земле.
После прикрепления к клетке человека вирус вставляет свой собственный генетический материал (ДНК или РНК) в ядро инфицированных клеток. Эта вставка позволяет вирусу копировать свою генетику в наших клетках. После репликации вирус переходит к заражению соседних клеток. В конце концов, хозяин заболевает от вирусной инфекции. Часто эта инфекция приводит к смерти.
Иначе говоря, вирусы обладают естественной способностью доставлять генетический материал в клетки и, следовательно, могут использоваться в качестве векторов.
Однако прежде чем вирус можно использовать для переноса терапевтических генов в клетки человека, его модифицируют, чтобы устранить его способность вызывать инфекционное заболевание.
В 1952 году биологи впервые обратили внимание на эффективный метод, который вирус будет использовать для введения ДНК в клетки своего хозяина.
В 1971 году, почти 20 лет спустя, ученые начали использовать этот метод вирусной инъекции для генной терапии человека.
На сегодняшний день система доставки вируса остается наиболее распространенной формой доставки генетического материала с помощью генной терапии.
Распространенные формы вируса, используемые для генной терапии
Ретровирус
Во многих ранних экспериментах по генной терапии использовался тип вируса, называемый ретровирусом. Ретровирус заражает клетки одной цепью РНК. Оказавшись внутри клетки, этот вирус использует свой собственный механизм (фермент обратной транскриптазы) для производства ДНК. Затем эта ДНК вводится в геном клетки-хозяина.
Ретровирусы, однако, могут интегрироваться только в геном активно делящихся клеток. Следовательно, многие клетки (например, нейроны) устойчивы к ретровирусной инфекции и интеграции.
Многие испытания генной терапии основаны на использовании модифицированного лентивируса. Лентивирус — это тип ретровируса.
Лентивирус — это тип ретровируса.
Адено-ассоциированный вирус (AAV)
В последнее время многие испытания генной терапии проводятся с вирусом, называемым AAV (аденоассоциированный вирус).
AAV — это небольшой вирус, который заражает людей и некоторых обезьян. Этот тип вируса стал предпочтительным по следующим причинам:
- вызывает только слабый иммунный ответ;
- заражает как делящиеся, так и неделящиеся клетки;
- сохраняется в клетках без прямой вставки в геном хозяина (остается во внехромосомном состоянии.).
Недостатком AAV является то, что пропускная способность этого вирусного вектора ограничена. Это означает, что невозможно вставить большие гены в AAV. Ученые в настоящее время пытаются преодолеть это ограничение.
Факторы риска в использовании вирусов
Концепция генной терапии кажется простой, но это явно упрощение, и существуют многочисленные проблемы и риски, которые препятствуют генной терапии с использованием вирусных векторов. Вот некоторые из них:
Нежелательная реакция иммунной системы. Иммунная система вашего организма может воспринимать недавно введенные вирусы как злоумышленников и атаковать их. Это может вызвать воспаление и, в тяжелых случаях, отказ органов.
Иммунная система вашего организма может воспринимать недавно введенные вирусы как злоумышленников и атаковать их. Это может вызвать воспаление и, в тяжелых случаях, отказ органов.
Ориентация на неправильные клетки. Поскольку вирусы могут поражать более одного типа клеток, возможно, что измененные вирусы могут заразить дополнительные клетки, а не только клетки-мишени, содержащие мутированные гены. Если это произойдет, здоровые клетки могут быть повреждены, вызывая другие заболевания, в том числе рак.
Инфекция, вызванная вирусом. Вполне возможно, что после попадания в организм вирусы могут восстановить свою первоначальную способность вызывать заболевание.
Возможность возникновения опухоли. Если новые гены будут вставлены в неправильное место в вашей ДНК, есть вероятность, что вставка может привести к образованию опухоли.
Кроме того, когда вирусы используются для доставки ДНК к клеткам внутри тела пациента, существует небольшая вероятность того, что эта ДНК может непреднамеренно попасть в репродуктивные клетки. Если это произойдет, это может привести к изменениям, которые могут быть переданы детям пациента.
Тем не менее этот основной способ введения генов в настоящее время демонстрирует большие перспективы, и врачи и ученые прилагают все усилия, чтобы решить любые потенциальные проблемы, которые могут существовать.
Они используют тестирование на животных и другие меры предосторожности, чтобы определить и избежать этих рисков, прежде чем проводить какие-либо клинические испытания на людях.
CRISPR CAS9 или революция в генной инженерии
В 2014 году MIT Technology Review назвал эту технологию редактирования генов как «самое большое биотехнологическое открытие века».
«Не будет преувеличением сказать, что CRISPR был революционным открытием», — говорит Марк Меркола, доктор философии, профессор сердечно-сосудистой медицины и член Стэнфордского института сердечно-сосудистых заболеваний.
«С CRISPR мы можем проводить генетические эксперименты, которые были бы невообразимыми всего несколько лет назад, не только в отношении наследственных заболеваний, но и генов, которые способствуют приобретенным заболеваниям, включая СПИД, рак и болезни сердца».
На фото пионеры технологии CRISPR (cлева направо): Джордж Чёрч, Дженнифер Дудна, Чжан Фэн и Эммануэль Шарпантье
Еще давным давно многие ученые отмечали, что система CRISPR является естественной защитной системой организма от бактерий. В 1993 году Франциско Мохика был первым исследователем, который охарактеризовал то, что сейчас называется CRISPR.
В 1993 году Франциско Мохика был первым исследователем, который охарактеризовал то, что сейчас называется CRISPR.
Однако профессору Дудне и ее коллегам приписывают прорывное открытие того, как CRISPR может использоваться для того, чтобы можно было самостоятельно направить изменения генома в бактериях. Ученые на фото изменили систему, чтобы сделать ее более удобной для других ученых.
В 2012 году лаборатории Дудны и Шарпантье упростили компонент направляющей РНК (объединяя 2 элемента РНК в один). Затем они подтвердили, что CRISPR можно использовать для прямого разрезания двухцепочечной ДНК в любом желаемом месте.
В 2013 году д-р Фенг Чжан (Широкий институт Массачусетского технологического института и Гарварда) открыл ключевое новшество в настройке CRISPR, оптимизировав систему для клеток млекопитающих (то есть людей).
Что же представляет из себя это технология, в чем ее основное отличие от предыдущих способов модификации генов и в чем заключается ее революционность? Давайте разбираться.
CRISPR/Cas9 — это метод, который позволяет осуществлять высокоточную и быструю модификацию ДНК в геноме, с его помощью может быть задан любой набор генетических инструкций в организме.
Чем CRISPR/Cas9 отличается от предыдущих методов генной инженерии?
- Тогда как другие методы занимают месяцы или годы, CRISPR ускоряет это время до нескольких недель.
 Способность так быстро и точно срезать и склеивать гены имеет потенциальные возможности для создания новых видов биотоплива, материалов, лекарств и продуктов питания в гораздо более короткие сроки при относительно низких затратах.
Способность так быстро и точно срезать и склеивать гены имеет потенциальные возможности для создания новых видов биотоплива, материалов, лекарств и продуктов питания в гораздо более короткие сроки при относительно низких затратах. - Он позволяет вводить или удалять более одного гена одновременно. Это позволяет очень быстро манипулировать многими различными генами в клеточной линии, растении или животном, сокращая процесс от нескольких лет до нескольких недель.
- Он также отличается тем, что не является видоспецифичным, поэтому может использоваться на организмах, ранее устойчивых к генной инженерии.
Одна из создателей CRISPR французский генетик Emmanuelle Marie Charpentier описывает технологию так:
Представьте себе текст со словами и программное обеспечение, которое позволяет заменять буквы в тексте с большой точностью, удалять слово или несколько слов, заменять их на другие.
Иными словами — это инструмент для редактирования текста, который работает с большой точностью, только все это происходит с нашими ДНК и генами. Это похоже на программируемые ножницы, которые способны распознавать определенные места ДНК и изменять их.
Возникновение
Технология возникла в рамках проекта фундаментальных исследований, целью которого было выяснение того, как бактерии борются с вирусными инфекциями.
Бактериям приходится сталкиваться с вирусами в среде своего обитания, и вирусную инфекцию можно представить как тикающую бомбу замедленного действия: у бактерии есть всего несколько минут, чтобы ее обезвредить до того как бактерия будет разрушена.
В клетках многих бактерий существует адаптивная именная система — CRISPR, позволяющая им выявлять и разрушать вирусную ДНК. В состав системы CRISPR входит белок Cas9, который способен искать, расщеплять и в конечном итоге уничтожать вирусную ДНК особым способом.
Именно в ходе этого исследования по изучению активности этого белка Cas9 ученые поняли, что могут использовать его активность в генно-инженерной технологии.
Что такое CRISPR
CRISPR (англ. clustered regularly interspaced short palindromic repeats) — короткие палиндромные повторы, регулярно расположенные группами
Важно обратить внимание на названия, потому что в нем заложены 2 основные части, заложенные в систему: во-первых, это повторы. Повторы — это короткие сегменты ДНК 20–40 букв в длину, которые являются палиндромными, то есть могут быть прочтены одинаково в обоих направлениях. (Как, например: «а роза упала на лапу Азора»). На рисунке повторы показаны последовательностью из цветных букв.
Однако между повторами есть пробелы (серый цвет). В этих пробелах находятся так называемые «cпейсеры» (англ. spacer DNA). Они, в свою очередь, уже не идентичные, каждый из спейсеров уникален. Этот факт очень озадачил ученых, когда они пытались их распознать в 80-е и 90-е годы.
Но уже в 2000 -е ученые выяснили, что именно cпейсеры идеально соответствуют ДНК вирусов, поразившим когда-то эту конкретную бактерию. То есть в спейсерах хранится информация о всех вирусах когда-либо поражавших данную бактерию. Таким образом получается, что спейсеры — это ни что иное как элемент иммунной системы бактерии.
Итак, когда бактериофаг (вирус) впрыскивает свою ДНК внутрь клетки, обычно, если отсутствует иммунная система, это приводит к ее разрушению и смерти.
Тем не менее при наличии системы CRISPR клетка транскрибирует и переводит ДНК вируса при помощи белка CAS, для того чтобы создать CRISP РНК, инструмент который и будет бороться с вирусной ДНК и в итоге разрушит ее еще до начала заражения.
Основным прорывом в изучении технологий связанных с CRISPS , вызвавших сильный ажиотаж в обществе, стало то, что ученые догадались, что данная система, существующая у бактерий, может быть использована людьми для редактирования генома у любых живых существ.
Также фундаментальным открытием было обнаружения белка CAS9. У большинства бактерий работу по транскрибированию и переводу вирусной ДНК выполняет не один белок, а несколько.
Однако существует очень небольшое количество бактерий, у которых вся это работа осуществляет с помощью одного лишь белка. Его название — СAS9.
Как работает CRISPR
Система CRISPR-Cas9 состоит из двух ключевых молекул, которые вносят изменения В ДНК:
- Фермент Cas9.
 Он действует как пара «молекулярных ножниц», которые могут разрезать две нити ДНК в определенном месте в геноме, так что кусочки ДНК могут быть добавлены или удалены.
Он действует как пара «молекулярных ножниц», которые могут разрезать две нити ДНК в определенном месте в геноме, так что кусочки ДНК могут быть добавлены или удалены. - Кусок РНК называется направляющей РНК. Он состоит из небольшого фрагмента предварительно сконструированной последовательности РНК (длиной около 20 оснований), расположенной в более длинном каркасе РНК. Часть каркаса связывается с ДНК, а предварительно разработанная последовательность «направляет» Cas9 к необходимой части генома. Это гарантирует, что фермент Cas9 режет в нужной точке генома.
Таким образом мы можем заменять вполне конкретные участки ДНК на те, которые нам необходимы.
Резюмируя еще раз основное отличие CRISPR CAS 9 как технологии от прежних методов:
До сих пор ДНК выделяли из клетки, с ней манипулировали и вводили обратно, то есть редактирование шло в пробирке. Что гораздо менее точно и сложнее.
Теперь с появлением системы CRISPR стало возможным редактировать ДНК прямо внутри клетки.
Какие болезни могут быть излечены с помощью CRISPR CAS9
Теоретически технология CRISPR может позволить нам редактировать любую генетическую мутацию по желанию, излечивая заболевание, которое она вызывает. Однако на практике мы только начинаем разработку CRISPR в качестве терапии, и много чего по прежнему остается непонятным.
Но если бы у вас была хоть какая-то возможность вылечить какое-нибудь генетическое заболевание, с чего бы вы начали? Ниже представлены семь болезней, с которыми ученые уже борются с помощью CRISPR-Cas9, и которые в конечном итоге могут стать первыми состояниями, которые будут использоваться для применения этой революционной технологии:
1. Рак
Первые применения CRISPR могли бы быть при раке. Действительно, одно из первых и самых передовых клинических испытаний CRISPR, которое в настоящее время проводится в Китае, заключается в тестировании потенциала инструмента редактирования генов для лечения пациентов с запущенным раком пищевода.
Лечение тестируется в онкологической больнице Ханчжоу, начинается с извлечения у пациента иммунных Т-клеток. Используя CRISPR, клетки модифицируются для удаления гена, который кодирует белок PD-1 — некоторые опухоли способны связываться с этим белком на поверхности иммунных клеток и инструктировать их не атаковать.
Затем модифицированные клетки помещают в пациента с более высокой способностью атаковать раковые клетки.
До настоящего времени, по крайней мере, 86 человек с различными формами рака прошли курс лечения CRISPR в Китае. В США другое исследование CRISPR, в котором первые пациенты прошли лечение в апреле 2019 года, также нацелено на рак.
Ученые из Университета Пенсильвании используют CRISPR для удаления PD-1, а также для изменения молекулы на поверхности иммунных клеток, чтобы они могли находить и атаковать опухоли.
2. Заболевания крови
Первое исследование CRISPR в Европе и США, в котором был зарегистрирован первый пациент в феврале этого года, направлено на лечение бета-талассемии и серповидноклеточной анемии, двух заболеваний крови, которые влияют на транспорт кислорода в крови.
Терапия, разработанная CRISPR Therapeutics и Vertex Pharmaceuticals, заключается в сборе стволовых клеток костного мозга у пациента и использовании технологии CRISPR, чтобы заставить их вырабатывать фетальный гемоглобин, естественную форму несущего кислород белка, который связывает кислород гораздо лучше, чем взрослая форма.
Перед началом испытания FDA отложило его в США, чтобы прояснить некоторые вопросы безопасности. Несколько месяцев спустя трюм был снят, и лечение было назначено для ускоренного определения обоих состояний.
Гемофилия — еще одно заболевание крови, с которым может справиться технология CRISPR. CRISPR Therapeutics работает с Casebia над терапией CRISPR в естественных условиях, где инструмент для редактирования генов доставляется непосредственно в печень.
3. Слепота
CRISPR — отличный кандидат для лечения генетической слепоты. Многие наследственные формы слепоты вызваны специфической мутацией, что позволяет легко поручить CRISPR-Cas9 нацеливаться и модифицировать один ген.
Кроме того, глаз является частью тела, лишенной иммунитета, то есть активность иммунной системы там ограничена. Это становится преимуществом ввиду опасений относительно возможности того, что CRISPR может вызвать против него иммунные реакции, которые блокируют его активность и приводят к побочным эффектам.
Editas Medicine работает над терапией CRISPR для лечения врожденного амавроза Лебера, наиболее частой причины наследственной слепоты у детей, для которой нет лечения.
Компания ставит своей целью выявить наиболее частые мутации, вызывающие заболевание, используя CRISPR для восстановления функции светочувствительных клеток до того, как дети полностью потеряют зрение.
4. СПИД
Существует несколько способов, с помощью которых технология CRISPR может помочь нам в борьбе со СПИДом. Один из них использует CRISPR, чтобы вырезать ДНК вируса ВИЧ из его укрытия в ДНК иммунных клеток. Этот подход может быть использован для атаки на вирус в его скрытой, неактивной форме, что делает возможным полное избавление от вируса.
Другой подход может сделать нас устойчивыми к ВИЧ-инфекции. Некоторые люди рождаются с естественной устойчивостью к ВИЧ благодаря мутации в гене, известном как CCR5, который кодирует белок на поверхности иммунных клеток, который ВИЧ использует в качестве точки входа для заражения клеток. Мутация изменяет структуру белка, так что вирус больше не может связываться с ним.
Этот подход был использован в очень спорном случае в Китае в прошлом году. CRISPR-Cas9 использовался для редактирования человеческих эмбрионов, чтобы сделать их устойчивыми к ВИЧ-инфекциям.
Эксперимент вызвал возмущение среди научного сообщества, причем некоторые исследования указывают на то, что «дети CRISPR» могут подвергаться большему риску умереть моложе. Общее мнение, по-видимому, заключается в том, что необходимы дополнительные исследования, прежде чем этот подход можно будет использовать у людей.
5. Муковисцидоз
Муковисцидоз является генетическим заболеванием, которое вызывает серьезные проблемы с дыханием. Хотя существуют способы лечения симптомов, продолжительность жизни человека с этим заболеванием составляет всего около 40 лет.
Технология CRISPR может помочь нам найти причину проблемы, отредактировав мутации, вызывающие муковисцидоз, которые находятся в гене CFTR.
Исследователи доказали, что можно использовать CRISPR в клетках легких человека, полученных от пациентов с муковисцидозом, и зафиксировать наиболее распространенную мутацию, лежащую в основе заболевания. Следующим шагом будет его тестирование на людях, что планируют сделать и Editas Medicine, и CRISPR Therapeutics.
Однако муковисцидоз может быть вызван множеством различных мутаций в гене CFTR, а это означает, что для различных генетических дефектов необходимо будет разработать различные методы лечения CRISPR. Editas заявил, что он будет смотреть на наиболее распространенные мутации, а также некоторые из редких, для которых нет лечения.
6. Мышечная дистрофия
Мышечная дистрофия Дюшенна вызвана мутациями в гене DMD, который кодирует белок, необходимый для сокращения мышц. Дети, рожденные с этим заболеванием, страдают от прогрессирующей мышечной дегенерации, и в настоящее время нет никакого лечения, кроме паллиативной помощи.
Исследования на мышах показали, что технология CRISPR может использоваться для устранения множественных генетических мутаций, лежащих в основе заболевания.
В прошлом году группа исследователей в США раскрыла инновационный метод, который вместо того чтобы фиксировать каждую мутацию в отдельности, использовал CRISPR, чтобы сократить 12 стратегических «горячих точек мутации», охватывающих большинство из примерно 3000 различных мутаций, вызывающих это мышечное заболевание.
Компания под названием Exonics Therapeutics была выделена для дальнейшего развития этого подхода.
Editas Medicine также работает над терапией CRISPR при мышечной дистрофии Дюшенна. Он также следует более широкому подходу, где вместо фиксации мутаций CRISPR удаляет целые участки мутированного белка, что делает белок более коротким, но все же функционирующим.
7. Болезнь Хантингтона
Болезнь Хантингтона — это нейродегенеративное состояние с сильным генетическим компонентом. Заболевание вызвано аномальным повторением определенной последовательности ДНК в гене Хантингтина. Чем больше количество копий, тем раньше болезнь проявится.
Лечение Хантингтона может быть сложным, так как любое нецелевое воздействие CRISPR на мозг может иметь очень опасные последствия. Чтобы уменьшить риск, ученые ищут способы настроить инструмент редактирования генов, чтобы сделать его более безопасным.
Американские исследователи разработали KamiCas9, версию CRISPR-Cas9, которая включает «кнопку самоуничтожения». Группа польских исследователей выбрала сочетание CRISPR-Cas9 с ферментом под названием nickase, чтобы сделать редактирование генов более точным.
Биохакинг в генной инженерии
Университеты и фармацевтические компании уже не единственные платформы, доступные ученым. Многие независимые ученые проводят эксперименты в небольших частных лабораториях.
Некоторые биологи работают из временных лабораторий в своем собственном подвале, другие присоединяются к общественным лабораторным пространствам, которые открыты для публики.
Эти небольшие независимые лаборатории являются частью более широкого движения, называемого «Самодельная биология» («Сделай сам») (англ. Do-it-yourself biology (DIY biology). Фраза «биохакерство» часто используется для описания этого процесса подпольной или неинституциональной биотехнологии.
Джошуа Зайнер
Джошуа Зайнер — бывший сотрудник синтетической биологии НАСА и один из первых биохакеров, который применил CRISPR CAS9 для редактирования собственного генома.
В 2017 году он сделал инъекцию CRISPR с ретровирусом, несущим новую версию гена, кодирующего мышечный белок миостатин, на биотехнологической конференции, транслируя трюк в прямом эфире, чем вызвал огромный резонанс обсуждений в обществе.
Сделал он это, разумеется, не ради хлеба и зрелищ, а пытаясь донести до людей несколько очень интересных и важных идей, касаемо применения технологии.
По словам ученого, основной целью эксперимента было не сделать себе больше мышц или изменить свою ДНК.
Цель эксперимента была изложена в видео, которое я разместил. Я не ожидал, что эксперимент будет работать, и моя цель не состояла в том, чтобы нарастить мускулы.
Целью было показать, что есть больницы или компании, занимающиеся генной терапией, которая может стоить вам $2,1 млн, тогда как я могу очень легко заказать оборудование онлайн и сделать себе инъекцию. Это буквально просто инъекция людям ДНК или вируса с ДНК. Вот и все. Это так просто.
Доктор Зайнер считает, что CRISPR настолько прорывная технология, что она должна быть доступна всем людям, и если CRISPR станет ключевым научным инструментом будущего, то ученые-любители уже сейчас должны учиться экспериментировать с ним у себя дома.
В настоящее время Джошуа Зайнер является генеральным директором и основателем компании ODIN, которая занимается продажей наборов для редактирования генов своими руками у себя дома.
Наборы содержат все необходимое начинающему ученому для проведения экспериментов CRISPR на дрожжах или бактериях.
За $130 вы можете попробовать переработать бактерии, чтобы они могли выжить на еде, с которой обычно бы не справились. Или за $160 можете включить эукариот и отредактировать ген дрожжей ADE2, чтобы дать ему красный пигмент.
Вот основные идеи, которые продвигает Зайнер:
- Децентрализация.
У вас есть два подхода к этому. Есть подход, при котором вы можете сделать технологию с большими инвестициями в систему, а затем попытаться сделать ее доступной для людей с помощью субсидий и других вещей.
Или вы могли бы начать с самого низа, научите всех, как использовать технологию, и затем технология становится доступной с самого начала. Никогда не возникает вопрос: «Ну, у всех будет доступ к ней?» Да, у всех будет доступ к ней, потому что все знают, как сделать это самим с нуля.
Мы просто делаем эту технологию доступной на самом базовом уровне. Мы постоянно отправляем комплекты в такие места, как Непал, и в африканские страны, такие как Сенегал и Нигерия, и мы отправляем комплекты в США в районы с низким уровнем дохода. Мы думаем, что каждый должен иметь доступ к этой технологии. Я думаю, именно это отличает ее от всего остального.
Люди должны иметь возможность использовать технологии которые развивает наука. Они не должны быть патентованы и отданы компаниям, или только каким-то исключительным людям.
- Вовлечение людей в науку.
Самое невероятное в системе CRISPR это то, что теперь всем вдруг стала интересна генная инженерия.
Итак, Зайнер стремится сделать технологию редактирования генов доступной для всех, независимо от социально-экономического положения или предыдущего научного опыта, через ODIN.
Как же сейчас обстоят дела с доступность генной терапии для больных?
Доступность
Как уже было сказано ранее, модификация ДНК с помощью CRISPR не является ни чрезмерно дорогой, ни запредельно трудной для выполнения. Однако делает ли это доступной ее для потребителя?
Когда на рынке появилось первое поколение препаратов, их высокие цены вызвали споры и заставили задуматься о том, как финансировать инновационные методы лечения.
Luxturna, единовременное лечение наследственной болезни глаз сетчатки, стоит $850 тысяч в США и £613 410 в Великобритании. Zolgensma, лекарство для лечения атрофии мышц позвоночника, стоит в США $2,1 млн, а Zynteglo, предназначенная для лечения редкого генетического заболевания крови, стоит $1,78 млн.
Цены вызвали критику со стороны групп пациентов и комментаторов, что привело к появлению заголовков о рекордных ценах на лекарства. Но биотехнологические компании защищают затраты, утверждая, что альтернативные методы стоят дороже.
«Мнение о том, что Zolgensma является самой дорогой терапией в мире, откровенно ошибочно», — говорит Дэвид Леннон, президент AveXis, биотехнологии, приобретенной Novartis, которая его разработала.
«Когда вы рассматриваете стоимость терапии в течение чьей-то жизни, вы говорите о миллионах долларов. Тот факт, что мы сжимаем стоимость в одну процедуру, делает ее дорогой».
AveXis считает, что альтернативная стоимость лечения ребенка со спинальной мышечной атрофией составляет $4 млн в течение 10 лет.
Лечение, о котором говорит Леннон, называется Spinraza и требует четырех однократных инъекций на общую сумму $750 тысяч долларов в первый год, а затем поддерживающие дозы каждые четыре месяца на всю жизнь при ежегодной стоимости в $375 тысяч.
Гемофилия, еще одно заболевание, хорошо подходящее для генной терапии, сейчас обходится сильно дороже.Если пациент испытывает кровотечение, он может стоить плательщикам до $1 млн в год.
Дело в том, что сейчас тратится огромные средства на поддержание жизнедеятельности людей с серьезными заболеваниями в течение многих лет, и терапии, которые длятся иногда всю жизнь.
Многие виды лечения некоторых заболеваний включают в себя хроническую паллиативную помощь, обеспечивающую постепенные улучшения или временные задержки в прогрессирование болезни. Все это невероятно дорого.
Генная терапия же предлагает решение, которое, грубо говоря, будет бороться с причиной болезни, а не симптомами, обеспечивание длительный или пожизненный эффект при одноразовом введении лекарства. Это все равно что купить квартиру, вместо того чтобы ее снимать.
Даже если первоначальная стоимость одобренной генной терапии составляет несколько миллионов долларов, эта терапия представит наиболее экономически эффективный вариант лечения всего через несколько лет по сравнению с нынешним лечением.
Главный вопрос сейчас — как могут системы здравоохранения адаптироваться под это новую форму финансирования, чтобы помочь донести лекарства до тех пациентов, кому они отчаянно нужны.
Становится ясно, что генная терапия на самом деле сэкономит драгоценные доллары системы здравоохранени за счет снижения прямых медицинских расходов, повышения качества жизни пациентов, их социальной интеграции и других косвенных сбережения. Однако реформы, которые потребуется и займут еще немало времени.
Хакнуть фарминдустрию
Как показывают текущие цены, вывести лекарство для генной терапии на рынок дорого. От разработки препарата до утверждения требуется много лет.
Даже если лекарство будет одобрено регулирующими органами, затраты могут быть такими высокими, а количество пациентов настолько незначительным, что для фармацевтических компаний в конечном итоге не будет никакого коммерческого смысла производить и продавать такие лекарства.
Иначе говоря, мы имеем революционное лекарство, которые имеет потенциал в вылечивание самых изнуряющих болезней, но рыночная структура, которая существует на сегодняшний день, никак не способна сделать их доступными для людей.
В то время как конгресс США занимается долгими обсуждениями касаемо разработки новый системы финансирования, появляются идеи и технологии, бросающие вызов фарминдустрии в целом.
Эндрю Гессель
Эндрю Гессель — синтетический биолог, некогда работающий в фармацевтической отрасли. Его главное разочарование — это темп, с которым любое новое лекарство выходит на рынок, поэтому он решил пойти по собственному пути и поставил своей основной целью «взлом биофармацевтической промышленности»
Для понимания идей Эндрю необходимо сказать пару слов об области науки, которой он занимается.
Синтетическая биология — это направление, объединяющее в себе молекулярную биологию, генную инженерию, физику и химию, которое занимается созданием простых и удобных биологических систем для перепрограммирования живых организмов с целью решения необходимых задач в разных областях.
Итак, почему развитие синтетической биологии — это огромный прорыв в области генной инженерии?
Во-первых, именно с помощью методов синтетической биологии мы получили возможность с легкостью манипулировать не только реальными генами, но и искусственно конструировать любую генетическую последовательность и использовать ее в нужных нам целях.
Во-вторых, синтетическая биология внесла огромный вклад в развитие генной инженерии тем, что сделала ее гораздо более простой и доступной для понимания, чем прежде.
Работая как с компьютерами, так и с биологическим материалом, ученые в основном имеют дело с элементарными (наименьшими) составляющими. В программировании это нули и единицы, в биологии же это буквы «A, C, T и G», которые составляют генетический код. Все еще невероятно сложно для обычного человека.
Развитие синтетической биологии позволило создать из блоков кода модули, чем существенно облегчила ученым задачу. Теперь мы знаем, что определенная последовательность букв ACTG — это переключатель, который может «выключить» ген, а другая их последовательность — это репортерный ген и так далее.
Иначе говоря, теперь мы имеем не просто буквенные последовательности, а конкретные модули, обладающие определенными функциями, которые мы можем с лёгкостью использовать для конструирование биологических схем.
Именно поэтому сегодня кто угодно может экспериментировать с генной инженерией у себя дома, будь это хоть 10-летний ребенок.
Синтетическая биология таким образом позволила теперь сделать генную инженерию понятной и доступной не только для биологов, но и для обычных людей.
Гессель считает, что основная проблема с развитием медицины на сегодняшний день, состоит в том, что все происходит очень долго и требует очень больших затрат.
Моя основная задача — это перенести биологические инструменты в цифровой мир, сделать их максимально автоматизированными и доступными, создать оpensource для бизнеса, чтобы мы могли обмениваться информацией и в итоге создать сообщество, которое будет работать как фармацевтическая компания.
Под оцифровкой биологии Гессель имеет ввиду создание на компьютере вирусов, содержащих ДНК, которые в последствии могут быть использованы, например, для борьбы с раком.
Вирусы — это очень интересные биологические агенты. Я не отношусь к ним как к живым, я отношусь к ним как к программному обеспечению. Вирус сам по себе — это протеин и нуклеиновая кислота RNA или DNA, он как карта памяти, которая может быть помещена в клетку для того, чтобы загрузить туда свою программу, например, мы можем загрузить программу в раковую клетку, которая будет давать команду «умри».
Вирусы — это просто способ загрузить программное обеспечение в клетку и добавлять туда новые «приложения». Мое главное «приложение» — это программного обеспечения, которое будет убивать раковые клетки.
Как известно, все раковые опухоли разные. В своей компании Humane Genomics Гессель планирует создать вирусы, ДНК которых направлено точно на конкретные опухоли. Специальные ДНК принтеры будут печатать определенную ДНК и помещать ее в вирусы. Таким образом люди получат доступ к персонализированномулечению рака.
В 2016 году Гессель в сотрудничестве с ветеринарной школой в Алабамском Политехническом институте уже разработали первый синтетически созданный вирус, который борется с раком для собак.
В конечном итоге у вас будет девайс, в котором у вас будет по сути целая фармацевтическая компания. Врачу смогут загружать необходимые вам медикаменты прямо на ваш девайс. Когда он готов, вы слышите сигнал — устройство готово для автоинфекции.
На первый взгляд, все это может показаться чем-то из мира фантастики, однако миниатюризация оборудования уже создана, а сами девайсы уже запроектированы, как скоро мы получим их для широкого использования, — всего лишь вопрос времени.
В целом у Зайнера и Гесселя цель по сути своей одна и та же — сделать биотехнологии доступными всем и каждому. Только Зайнер делает это с помощью своих наборов Crispr-kits, а Хейл через оцифровку биоэлементов.
Этические проблемы
Изменения, которые влечет генетическая инженерия, могут быть рассмотрены с двух сторон. С одной стороны, эти изменения существенно помогут нам в борьбе с серьезными генетическими заболеваниями и сильно улучшат уровень жизни людей в моменте. С другой стороны, эти изменения прямо влияют на человеческую эволюцию.
Люди манипулируют генетическим кодом, и эти манипуляции передаются из поколения в поколение. Поэтому главный вопрос, касающийся редактирования генов на сегодняшний день, — это имеем ли мы право «играть в Бога» и менять мир раз и навсегда? Мы думаем, что знаем, что делаем, что точно просчитываем, какие изменения мы вносим в гены.
Однако всегда есть вероятность, что либо мы что-то упустим, либо наша технология не сможет уловить другие изменения, которые были сделаны не нами. И тогда возникает опасение, что эти изменения приводят к устойчивости к антибиотикам или другим мутациям, которые распространяются в популяции и которые очень трудно контролировать.
По сути — это создание неизлечимых болезней или других потенциальных мутаций, которые мы не могли бы контролировать. Сообществу ученых, медиков и юристов предстоят еще не мало исследований, конференций и саммитов для того, чтобы такого рода опасения ушли.
На ряду с этим главным этическим беспокойством имеется еще ряд вопросов, вызывающий в обществе много волнений.
Безопасность
Важной этической проблемой в исследованиях является то, что выгоды технологии должно быть больше, чем рисков. Применение CRISPR/Cas9 на данный момент все еще сопряжено с рисками, поскольку может вызывать мутации — мишени, которые могут быть вредными.
Высокая частота нежелательных эффектов была обнаружена в клетках человека. Проблема заключается в том, что большие геномы могут содержать несколько последовательностей ДНК, идентичных или высоко гомологичных предполагаемой последовательности ДНК-мишени.
CRISPR/Cas9 может также расщеплять эти непреднамеренные последовательности, вызывая мутации, которые могут вызывать гибель или трансформацию клеток. В настоящее время ученые работают над уменьшением мутаций, но необходимо и дальнейшее улучшение, особенно для точных модификаций, необходимых для терапевтических вмешательств.
Применение метода CRISPR/Cas9 к зародышевой линии человека
Этические проблемы были подняты относительно возможности редактирования генома в зародышевой линии человека. Ранее все терапевтические вмешательства на людях с использованием редактирования генома проводились в соматических (не принимающие участия в половом размножении) клетках.
Но эксперимент китайских исследователей вызвал обеспокоенность по поводу возможности внесения изменений в зародышевую линию человека.
Разница заключается в том, что предполагаемые терапевтические генетические модификации в зародышевой линии могут передаваться следующим поколениям.
В целом терапевтические вмешательства по редактированию генома в соматических клетках являются этически приемлемыми, учитывая баланс между рисками и выгодами и использованием информированного согласия.
Но клетки зародышевой линии это совершенно другое. Поскольку метод CRISPR/Cas9 может вызывать мутации и побочные эффекты, непредсказуемые изменения могут быть переданы будущим поколениям.
Многие ученые выступают категорически против таких вмешательств и предлагают ввести запрет на редактирований в зародышах.
Уже в 1997 году ЮНЕСКО выпустила Всеобщую декларацию о геноме человека и правах человека, рекомендовав мораторий на вмешательство генетически в зародышевую линию человека.
В декабре 2015 года на международном саммите по геномному редактированию человека, на котором собрались члены национальных научных академий Америки, Великобритании и Китая, обсуждалась этическая сторона данного вопроса.
Они согласились продолжить базовые и клинические исследования в соответствии с соответствующими правовыми и этическими принципами, но изменение гаметоцитов и эмбрионов для генерации наследственных изменений у людей было объявлено безответственным.
Российское сообщество генетиков, клиницистов и биоэтиков также достигло консенсуса в отношении использования технологий редактирования на человеческих эмбрионах и половых клетках в клинических целях. Они считают, что такие эксперименты на данный момент преждевременны и требуют более глубокого исследования и обсуждений.
Тем не менее в феврале 2016 года британские ученые получили разрешение регулирующих органов на генетическую модификацию эмбрионов человека с использованием CRISPR/Cas9 и связанных с ним методов только для исследований.
Следовательно, геномное редактирование человеческих эмбрионов по терапевтическим причинам до сих пор существует. Риск наследственных непредсказуемых генетических мутаций выше, чем возможные преимущества терапии, затрагивающей принцип отсутствия вреда.
Очевидно, что техника должна быть полностью безопасной, чтобы пробовать терапию в зародышевой линии. Ведь если был нанесен ущерб, возникнет проблема, за которую ответственность понесут уже следующие поколения людей.
Редактирование генома для улучшения физических характеристик
Другой этический вопрос для обсуждения — это возможность нетерапевтических вмешательств с использованием редактирования генома. Его использование в зародышевой линии запрещено по соображениям безопасности.
Но эффективность техники CRISPR/Cas9 увеличивает возможность вмешательства в соматические клетки, для того чтобы генетика соответствовала нашим жизненным интересам. Например, техника может быть использована для повышения работоспособности спортсменов или для предотвращения агрессивного поведения или уменьшения зависимости.
Как правило, генная терапия направлена на улучшение здоровья пациента для его собственной пользы, но в будущем может случиться так, что система уголовного правосудия, например, потребует редактирования генома генов, связанных с насилием, для рецидивистов или опасных насильственных преступников.
В социальном плане возникнет проблема, когда некоторые группы населения или отдельные лица будут генетически улучшены, имея преимущество над другими, например, в интеллектуальном или физическом потенциале, что может послужить причиной локальным и глобальным конфликтам.
Формирование животных химер для трансплантации органов
Производство человеческих органов у животных также поднимает множество этический возражений.
Развитие человеческих/животных химер для трансплантации органов может дать надежду многим, кому приходится стоять в очереди за донорскими органами.
Впервые эти этические соображение относительно химер были подняты в связи с медицинскими методами, которые сегодня достаточно широко распространены. Например, биологические клапаны сердца свиньи, крупного рогатого скота и лошади часто имплантируют пациентам с дисфункцией клапана сердца, а инсулин, извлеченный из поджелудочной железы свиньи, обычно используется пациентами с диабетом.
Оправдано ли считать, что свинья с поджелудочной железой человеческого происхождения является химерой, производство которой должно быть запрещено, тогда как человек с митральным клапаном свиного происхождения является допустимой химерой?
Два ответа в зависимости от принятой точки зрения. Что касается благополучия животных, эксперименты на свиньях уже строго регламентированы, чтобы избежать ненужных страданий животных во время исследований.
Тот факт, что химерные животные выращиваются для целей человеческой органной культуры, не должен вызывать больше этических споров, чем выращивание их для потребления.
Одна из действительно важных проблем относительно химер — это медицинская сторона вопроса. Дело в том, что ретровирусы, встроенные в геном животных, могут передаваться человеку. Действительно, эффекты этих ретровирусов могут быть известны у животных, но нет возможности предсказать то, что они могут вызвать у людей.
Опасение заключается в том, что ткани человека, вырабатываемые животными, могут быть источником новых зоонозов, что поднимает этические проблемы, связанные с защитой людей, участвующих в клинических исследованиях, для проверки безопасности таких органов.
Более того, невозможность предвидеть потенциальные риски, связанные с трансплантацией органов человека, выращенных у свиней, требует предельной осторожности.
Также химеры подняли этические проблемы по поводу риска нарушения порядка природы, создавая моральную путаницу в отношении того, как относиться к организму, как к животному или человеку? Каким образом должны мы должны будет его классифицировать? Вариантов существует огромное множество, все они должны будут быть зафиксированны и регламентированны.
Заключение
Несмотря на все выше изложенные опасения, технология в любом случае рано или поздно будет использоваться, неважно хотим мы этого или нет. Ее масштаб и сила слишком велики для того, что бы кто то мог ее запретить или остановить ее развитие.
Так или иначе, будущее уже здесь.
В Британии одобрена генная модификация эмбриона человека
Автор фото, Getty
Подпись к фото,
Генная модификация эмбрионов поможет узнать тайны зарождения человеческой жизни
Британские ученые получили добро от управления по оплодотворению и эмбриологии человека для начала работ по генетической модификации человеческих эмбрионов.
Эксперименты над эмбрионами будут проходить в течение первых семи дней после оплодотворения и смогут помочь объяснить природу ранних выкидышей.
Тем не менее, ученые не смогут имплантировать генномодифицированные эмбрионы с тем чтобы вырастить из них человека, так как это остается под запретом.
“Генное редактирование” – манипуляции нашей ДНК – своеобразный набросок будущей жизни.
Подпись к фото,
Генное радактирование – набросок человеческой жизни, которой не суждено появиться на свет
Эта область науки вызывает ожесточенные споры: многие говорят, что дело уже зашло слишком далеко, а изменение ДНК эмбриона открывает двери в мир конструирования “ГМО-младенцев”.
Бесплодие
Ранее в этом году доктор Кэти Ниакан объяснила, почему она подала заявку на участие в работе над генной модификацией человеческих эмбрионов: “Мы бы очень хотели понять, какие гены необходимы для того, чтобы человеческий эмбрион успешно развился в здорового ребенка”.
“Это важно потому, что выкидыши и бесплодие чрезвычайно распространены, но они не очень хорошо изучены”, – сказала она.
Автор фото, Science Photo Library
Подпись к фото,
Оппоненты манипуляций с эмбрионами обеспокоены тем, что человеческие зародыши зачинаются лишь для эксперимента и последующего уничтожения
Управление по оплодотворению и эмбриологии человека (HFEA), уже дало свое согласие, и эксперименты могут начаться в ближайшие несколько месяцев.
“Я рад, что HFEA одобрило заявку доктора Ниакан на участие в эксперименте”, – говорит Пол Нерс, директор института Крика.
“Предложенные доктором Ниакан исследования важны для понимания того, как развивается здоровый человеческий эмбрион, а также будут способствовать нашему пониманию показателей успеха ЭКО (экстракорпорального оплодотворения – Би-би-си), благодаря изучению самых ранних стадий развития человека.”
Доктор Ниакан, которая посвятила десятилетие исследованию человеческого развития, сейчас пытается понять его самые первые семь дней.
За это время мы переходим от состояния оплодотворенной яйцеклетки к структуре, называемой бластоциста, которая содержит около 200-300 клеток.
Но даже на этой ранней стадии бластоцист, некоторые клетки уже дифференцируются для выполнения конкретных функций – одни формируют плаценту, другие желточный мешок, ну а некоторые формируют в конечном итоге собственно нас самих.
В течение этого периода части нашей ДНК обладают высокой активностью.
Это, скорее всего, гены, которые руководят нашим ранним развитием, но неясно, что именно они делают, и почему в некоторых случаях все заканчивается выкидышем.
Исследование будет проводиться с использованием пожертвованных для эксперимента эмбрионов. Через семь дней после оплодотворения зародыши будут уничтожаться.
Доктор Сара Чан из университета Эдинбурга, заявила: “Использование технологий редактирования генома в научных исследованиях эмбриона затрагивает некоторые деликатные вопросы, поэтому вполне логично, что это исследование и его этические последствия были тщательно рассмотрены HFEA, прежде чем было получено одобрение продолжить эксперименты”.
“Мы должны быть уверены, что наша система регулирования в этой области функционирует хорошо, чтобы наука развивалась в соответствие с общественными интересами”, – добавляет Сара Чан.
Международный консорциум по стволовым клеткам, этике и праву “Хинкстон Груп” (Hinxton Group) в сентябре прошлого года
выпустил заявление, в котором призвал разрешить генетическую модификацию эмбрионов человека. Но до нынешнего момента подобные практики в Европе были запрещены.
Для кого еще это важно
Кроме потенциальной пользы для изучения природы выкидышей и борьбы с бесплодием, генная инженерия возможно сможет помочь и тем людям, которые с рождения страдают неизлечимыми на сегодняшний день генетическими заболеваниями.
Шармила Никапота, мама ребенка с редким генетическим расстройством, возлагает большие надежды на успех редактирования генов.
“Для нас эта технология, возможно, исполнит мечту об излечении”, – говорит она.
Ее 13-летняя дочь Сухана всю свою жизнь борется с последствиями генетически обусловленного заболевания буллёзный эпидермолиз (Синдром бабочки). Тело девочки покрыто множеством болезненных волдырей, которые возникают даже при небольшом воздействии на кожу.
Это обусловлено двумя неисправными участками VII гена. Это означает, что организм больного человека не производит белок, который помогает коже закрепиться на месте.
Автор фото, SPL
Подпись к фото,
Кажется удивительным, что ученые экспериментируют с генами в формате copy-paste “(вырезать-вставить”)
Три года назад ученые изобрели новый способ, который позволяет вырезать и вставлять участки генов для редактирования ДНК.
Ученые по всему миру сразу приняли этот быстрый, дешевый и доступный способ на вооружение, чтобы ускорить свои собственные исследования.
Пациентам с заболеваниями крови, иммунитета, мышечными или кожными расстройствами это дает надежду, что их неисправные клетки могут быть удалены, исправлены в лаборатории, а затем повторно имплантированы.
Этика против генной инженерии
Существует огромный лагерь противников генной инженерии, в который входят множество ученых и общественных деятелей.
Например Марси Дарновски, исполнительный директор Центра генетики и общества в Калифорнии, не против фундаментальных исследований с использованием генетически измененных эмбрионов, хотя она подчеркивает, что за всем этим будет необходимо установить строгий контроль.
Она хотела бы, чтобы были установлены международные соглашения о запрещении использования генетически измененных эмбрионов для репродукции.
Автор фото, Reuters
Подпись к фото,
Генетическая инженерия может привнести в мир еще больше неравенства, заявляют противники экспериментов
“Это слишком рискованно, и мы не должны это использовать. У нас уже есть возможность проведения скрининга эмбрионов, который в подавляющем большинстве случаев позволяет родителям обзавестись здоровым ребенком”, – сказала она.
“Это открывает дверь в мир генетически “правильных” и “неправильных” людей. Нам не нужно еще больше дискриминации”, – предостерегает Дарновски.
Александр Панчин: «С точки зрения политиков, вколоть в кровь ГМО не страшно, а съесть — страшно»
Что такое ГМО, почему люди боятся генной инженерии и что с этим делать
«Страшилки» о ГМО занимают заслуженное место в мире околонаучных фейков и находятся в топе этого «антихит-парада» — где-то рядом с антипрививочной кампанией и ВИЧ-диссидентством. Александр Панчин, известный российский биолог, писатель и научный журналист, поговорил с «Реальным временем» о генно-модифицированных организмах. Выяснилось: каждый из нас — это ГМО, вакцина от коронавируса — тоже ГМО, а маркировка «без ГМО» на бутылке молока — чистой воды маркетинг.
«Мы все — мутанты»
— Что же такое эти страшные и ужасные ГМО?
— Генно-модифицированный организм — это скорее юридический термин, нежели что-то осмысленное с точки зрения биологии. Биология подразумевает, что мы все — мутанты, все мы подвергаемся генной модификации в процессе размножения. Дело в том, что в каждом поколении у животных и растений возникают мутации. Это генетические изменения, которые могут приводить впоследствии к тем или иным отличиям организма.
Так вот, генная инженерия позволяет нам вносить точечные генетические особенности в будущий организм в лаборатории. Такой организм и будет с юридической точки зрения называться генно-модифицированным.
До этого тысячи лет человек выводил новые породы и сорта растений и животных, искусственно влияя на формирование генома — это называется селекцией. Если проводить аналогию, то методы селекции можно сравнить с кувалдой, которой мы грубо били по геному и смотрели, что получится. Теперь у нас есть своеобразные маникюрные ножницы, благодаря которым мы можем внести изменения аккуратнее — технологии генной инженерии.
В конечном итоге важнее не то, каким образом мы редактируем ДНК, а то, какая конкретная мутация произошла в организме. Допустим, мы получили папайю, устойчивую к вирусам. Или бактерию, производящую инсулин. Или картошку, устойчивую к вредителям. Это все разные организмы с разными мутациями.
Но и в рамках селекции мы тоже получаем организмы с определенными особенностями. Просто это происходит дольше, и вместе с желаемым признаком развиваются сопутствующие. Генная инженерия — метод более точный и аккуратный.
— С чего началась индустрия ГМО?
— Изменения в геном бактерий ученые вносят уже несколько десятилетий. И в геном растений — тоже. Первыми ГМО, нацеленными на то, чтобы использовать их в пищевой промышленности, были помидоры, из которых изготавливали томатную пасту, это было в начале 1990-х годов. И что любопытно, эти самые томаты с гордостью маркировали как ГМО, как продукт высокой технологии. Изначально это так и воспринималось людьми: генная инженерия — это что-то современное и крутое.
— А потом что-то пошло не так.
— А потом началась информационная кампания против этого как против чего-то противоестественного, неприродного, страшного. Появились некорректные ассоциации между ГМО и какими-нибудь ядами, химикатами, которые якобы добавляют в пищу. Я как-то был на одной телепередаче, там был противник ГМО, эксперт, который думал, что ГМО — это пестициды. То есть люди часто просто не понимают, что такое ГМО. А это просто живые организмы, они размножаются, просто у них есть определенные генетические особенности, целенаправленно внесенные в лаборатории.
Фото vesti.ua
Люди часто просто не понимают, что такое ГМО. А это просто живые организмы, они размножаются, просто у них есть определенные генетические особенности, целенаправленно внесенные в лаборатории
«Ни на каком гене не написано, что он принадлежит определенному организму»
— Чтобы получить определенную желаемую мутацию, в ген исходного организма встраивается геном другого организма?
— Необязательно, но есть и такая технология. В природе такое тоже происходит и называется «горизонтальным переносом генов». В результате получаются так называемые трансгенные организмы. Но на самом деле ни на каком гене не написано, что он принадлежит какому-то определенному организму. Это всего лишь последовательность буковок из нуклеотидной последовательности, которые кодируют наш геном. Сами буквы одинаковы у человека, у рыбы, у бактерии и различаются только порядком расположения.
Как вы можете из одних и тех же букв составлять разные слова и предложения, так и генетическая последовательность любого организма составлена из одних и тех же нуклеотидов.
Если проводить аналогии — например, если бы вы взяли цитату из Пушкина и вставили ее в книгу Толстого — у вас получится генно-модифицированный, в данном случае — трансгенный текст. А могли бы просто одну букву у Толстого поменять, это была бы точечная мутация.
— В природе такое встречается? Или трансгенные организмы могут появиться только в лаборатории?
— В природе горизонтальный перенос генов встречается, причем не так уж и редко. Один из основных методов генной инженерии с растениями — агробактериальная трансформация. В ней участвуют почвенные бактерии Agrobacterium tumefaciens. Так вот, они от природы сами умеют переносить свои гены в ДНК растений и заставлять их производить вещества, которыми питаются. Ученые взяли эту бактерию и «переоборудовали» ее таким образом, чтобы переносить в растения не те гены, которые нужны ей, а те, которые нужны нам. Так получился один из основных методов генной модификации растений.
Было много примеров того, как вирусы передавали свои гены разным живым организмам, в том числе растениям и животным. Кстати, в геноме человека есть гены вирусного происхождения. Например, такие гены играют важную роль в формировании плаценты и даже в работе нервной системы. Так что с точки зрения биологии, мы с вами тоже не просто ГМО, а еще и трансгенные организмы. Но с юридической точки зрения, поскольку наши гены изменились не в лаборатории, то на нас можно смело вешать лейбл «Био-Эко-Органик». Это по факту не отменяет того, что во время нашей эволюции случался горизонтальный перенос.
Большинство генов передаются вертикально — от родителей к детям. Но случаются в эволюции отдельные события, когда гены переносятся горизонтально — от одного организма к другому. Такие примеры чаще встречаются у бактерий, но их можно найти и у растений, и у животных.
— Может быть, поэтому и столько страшилок вокруг ГМО? Ведь если какой-то вирус умеет встроить в человеческий геном свой ген, то почему бы этого не сделать новым ГМО?
— Мы поедаем гены живых организмов постоянно. Мы съели картошку — и вместе с ней полную ее последовательность генов. Но от этого у нас ботва не выросла, ничего на голове не заколосилось. Для нашей пищеварительной системы совершенно все равно, какую последовательность буковок ей переваривать, обращается она с ними одинаково.
Вероятность того, что в нас встроятся гены из трансгенной картошки, не выше вероятности того, что в нас встроятся гены из картошки «нормальной». И эта вероятность с любой практической точки зрения равна нулю.
Те примеры горизонтального переноса, которые мы знаем, работают по-другому, они не так тривиально устроены: не так, чтобы съел — и генно-модифицировался.
Фото farminguk.com
Для нашей пищеварительной системы совершенно все равно, какую последовательность буковок ей переваривать, обращается она с ними одинаково
«Самое важное, что удалось сделать в агрокультуре, — вызвать устойчивость к вредителям и вирусам»
— Генная инженерия сейчас — один из двигателей прогресса в медицине?
— Сейчас все обсуждают первую вакцину от коронавируса. Она представляет собой генно-модифицированный вирус, созданный генными инженерами. Оболочку взяли от одного вируса, в нее поместили генетический материал от SARS Cov2 — вот вам и пример применения генной инженерии. Понятно, что эту вакцину еще нужно изучать и проверять на безопасность, потому что ее будут, предположительно, вводить большому количеству людей. Но подобных вакцин очень много.
С помощью генной инженерии производятся генно-терапевтические препараты, которые могут бороться с врожденными заболеваниями. Например, таким образом — на основе ГМ-вирусов — создали лекарство от одного из типов гемофилии.
Практически весь инсулин производится на основе генетически модифицированных микроорганизмов — если бы не генная инженерия, людям с диабетом было бы жить гораздо тяжелее, чем сейчас.
— А в сельском хозяйстве в какую сторону в основном двигается генная инженерия?
— Наверное, самое важное, что удалось с ее помощью сделать в агрокультуре — вызвать устойчивость к вредителям и вирусам. Например, без использования ГМО на Гавайях сейчас бы там вымерла папайя. Или, например, был под угрозой вымирания один из самых популярных сортов банана — его уничтожала грибковая инфекция. И тогда ученые внесли в геном банана генетическое изменение — теперь есть сорт, который этой болезни не боится. Есть ГМО-сорта, устойчивые к вредителям, и это помогает не поливать поля огромным количеством инсектицидов, а значит, благотворно отражается на состоянии окружающей среды.
Я читал забавный пример из жизни амишей (религиозное движение, которое в числе прочих запретов полностью отказывается от всевозможных современных технологий, — прим. ред.). Они свои растения на полях выращивают вручную. Проблема вредителей для них одна из самых актуальных — они не могут опрыскивать свои посевы, потому что для этого нужны механические средства. Так вот, некоторые амиши используют генно-модифицированный посадочный материал — семена сортов, не боящихся вредителей. И это вроде как не противоречит их религии. Они отказываются от электричества и металлических машин, их религия запрещает то, что мы бы ассоциировали с механикой. А вот ГМО — пожалуйста.
Фото wikipedia.org
Наверное, самое важное, что удалось с ее помощью сделать в агрокультуре — вызвать устойчивость к вредителям и вирусам
— Почему же тогда «Гринпис» так не любит ГМО?
— Для меня это одна из величайших загадок. Потому что есть масса примеров того, как некоторые ГМО могут быть использованы для защиты окружающей среды, есть даже экологические генно-инженерные проекты. Например, была история про свинку, которая могла меньше загрязнять окружающую среду — она содержала ген, позволявший лучше перерабатывать некоторые соединения фосфора — но «Гринпис» был против.
По идее они должны были очень избирательно относиться к теме ГМО, говорить: «Вот эти генно-модифицированные организмы мы одобряем, а эти — нет», — причем аргументированно. На практике же мы видим довольно принципиальную позицию против ГМО, выраженную всем движением. И это очень печально на самом деле, потому что это связано не с научными вещами, а с тем, как устроено групповое мышление людей.
— Есть слух о том, что коронавирус — это тоже ГМО…
— Слух заключается в том, что он якобы синтезирован в лаборатории. И этот слух не имеет под собой никаких оснований. Это, по-видимому, один из тех случаев, когда вирус перешел от животных к людям. Мы можем досконально изучить геном этого вируса, есть тысячи прочитанных геномов из разных популяций людей, которые болели коронавирусом. И там нет никаких признаков вмешательства. Конечно, конспиролог может сказать: «Они просто так замаскировали это, чтоб было похоже на естественную эволюцию».
Для меня это разговор того же порядка, что Земле на самом деле 6 тысяч лет, просто Бог закопал в нее кости динозавров, чтобы мы думали, что ему миллиарды или сотни миллионов лет. Нет ничего, что мешало бы естественному появлению этого вируса, как и нет никаких признаков того, что кто-то вмешивался в эту эволюцию искусственно.
«Еще не было случаев, когда человек пострадал бы, съев продукт из ГМО»
— Среди противников ГМО бытует еще и такой аргумент, что такие растения будут вытеснять натуральные на полях, и все естественное вымрет, а ГМО захватят Землю.
— Сложно себе представить, чтобы любой культивируемый сорт оказался жизнеспособным без ухода. Вся селекция этих организмов была направлена на то, чтобы поставить их выживание в полную зависимость от человека. Они нуждаются в том, чтоб мы их поливали, удобряли и т.д. Это не дикорастущие организмы. Такие растения не смогут выйти за пределы возделываемых полей, они не выживут без нас. Кроме того, те генные модификации, которые мы вносим, в большинстве не были бы полезны в дикой среде. Например, никакого толка в дикой природе нет от улучшения вкусовых качеств картошки или яблока.
Есть более разумная тема для обсуждения — то, что называется проблемой монокультур. Допустим, у вас есть очень хороший сорт, который дает прекрасную урожайность и производительность. Вы заменяете им все остальные сорта этой культуры (повторюсь, я говорю не о дикорастущих видах, а о культурных растениях), и получается, что все покупают одни и те же семена одной и той же культуры от одного и того же производителя. Это приводит к низкому генетическому разнообразию.
Тогда если появляется новый патоген, хорошо приспособленный к конкретно этому сорту, то он сразу поражает множество площадей во многих странах. Проблему монокультур можно решать заранее — и инструментом этого решения тоже может стать генная инженерия. Она позволяет и устранять проблему отсутствия генетического разнообразия (если она появляется), и создавать растения, устойчивые к конкретным патогенам. Например, та же самая монокультура бананов сорта «Кавендиш», которая оказалась бы жертвой болезни, если бы не генная инженерия.
Фото wikipedia.org
Проблему монокультур можно решать заранее — и инструментом этого решения тоже может стать генная инженерия
— Есть ли свидетельства опасности или вреда ГМО?
— За всю историю человечества еще не было случаев, когда человек пострадал бы, съев продукт из ГМО.
Единственная история, где генная инженерия была в какой-то степени неблагоприятна для людей, была на самой заре создания генных терапий, когда генно-модифицированные вирусы используются для лечения наследственных заболеваний. Сейчас это очень перспективные технологии с большим количеством положительных результатов. А на первых порах бывали и нежелательные побочные эффекты. Поэтому, как только эта технология появилась, были определенные опасения насчет нее и насчет этих исследований. Но ученые уже научились все это делать безопасно. И конечно, есть разница между тем, что вы что-то едите — и между ситуацией, когда вам вирус вводят в кровь. Во втором случае потенциальный риск гораздо больше.
— А как с тем, что была научная статья об увеличении числа онкологических заболеваний у крыс, которые питались ГМО?
— Основная масса идей о том, что ГМО могут вызывать рак, или бесплодие, или другие напасти, берутся из журналистских «уток». Публиковались несколько исследований — единицы — в которых утверждалось о вреде ГМО.
Одну из самых известных таких статей написал француз Жиль-Эрик Сералини. Его работа была подвергнута критике за методологию исследования, и ее в итоге вообще отозвали из научного журнала. Проблема там была в статистическом анализе. Если его провести, оказывается, что никакой разницы между животными, которые употребляли и не употребляли ГМО, нет. Все оказывается в пределах случайной погрешности.
На статью Сералини ссылались все борцы с ГМО, потому что там были еще и фотографии крыс со страшными раковыми опухолями. Но часто умалчивают важную деталь: в своих опытах Сералини использовал специально выведенную линию крыс для онкологических исследований. У таких животных к полутора годам в 45% случаев и безо всякого ГМО развивались раковые опухоли! И, кстати, такие же крысы без ГМО, но с раком, присутствовали в этой работе — но уже без фотографий. Таким образом акцентировали внимание людей: вот, дескать, смотрите, мышка ГМО ела, и вот у нее страшный рак. Но ГМО тут совершенно ни при чем.
Подобные страшилки и создали образ вредных ГМО.
«Я своими глазами видел плакат с рекламой концерта Стаса Михайлова с надписью «Без ГМО»
— Понятно, что сейчас идет истерия. Как она связана с маркетингом?
— Есть конкретные стороны, которые весьма заинтересованы в этих страшилках. Но это не какой-то глобальный заговор, а обычные вещи: есть вот фермер, который производит продукцию без ГМО и хотел бы продавать ее дороже. И когда возникает вопрос, почему у него дороже, он должен всем объяснить: «У них там страшное ГМО, а у меня его нет, поэтому моя сметана стоит в 5 раз дороже».
Я недавно был в США в продуктовом магазине, и там рядом стояли два пакета апельсинового сока. Чтоб вы понимали: генно-модифицированного апельсина в продаже не бывает вообще. Тем не менее на одном из пакетов было написано «Не содержит ГМО». Они были от одного и того же производителя. У них был абсолютно одинаковый состав. Но тот, который «не содержит ГМО», стоил в полтора раза дороже. Это просто вот такой маркетинговый прием: приходит человек, который обеспокоен этими страшилками, и у него есть лишние деньги в кошельке, и он готов платить больше за продукт без ГМО.
Фото yaplakal.com
Это просто вот такой маркетинговый прием: приходит человек, который обеспокоен этими страшилками, и у него есть лишние деньги в кошельке, и он готов платить больше за продукт без ГМО
— Я соль видела без ГМО…
— А есть и вода без ГМО, и презервативы без ГМО, и я своими глазами видел плакат с рекламой концерта Стаса Михайлова, на котором было написано «Без ГМО». Это давно уже маркетинговый бренд. Есть даже бизнес-модели, основанные на таком: «Мы вам продадим БАДы, которые исправляют вред, который нанесли вам ГМО». Так что есть в этом простые заинтересованные лица. А дальше — общая тенденция: страшилки хорошо продаются как новостные инфоповоды.
А как можно информационному изданию словить хайпа лучше, кроме как рассказать о какой-то страшной угрозе этому миру? Верит ведь кто-то и в то, что вышки 5G вызывают COVID-19. Точно так же и с ГМО: так устроено групповое мышление. То, что много раз повторено большим количеством людей, воспринимается многими за правду.
— А у нас есть и те, кто на государственном уровне в это верит. У нас же действует закон, запрещающий распространять ГМО?
— Запрет — на выпуск в окружающую среду.
— То есть в лаборатории можно работать?
— Можно работать в лаборатории. А потом, за невозможностью применить на практике ваши прикладные результаты, вы их патентуете, продаете западным компаниям, которые потом это реализуют, а мы — импортируем. По крайней мере я не вижу другого сценария, как это можно сделать.
— Получается, сейчас в России генетически модифицированных организмов не выращивают вообще?
— В каких-то промышленных коммерческих количествах — нет, в каких-то частных теплицах научно-исследовательских институтов — да. В России есть специалисты, которые умеют создавать ГМО, причем это очень интересные штуки. Хорошо, что этот запрет не коснулся медицины — хотя выглядит это парадоксально.
Как я уже сказал, некоторые вакцины — это же продукт генной инженерии! То есть с точки зрения наших политиков, вколоть в кровь ГМО — не страшно, а съесть — страшно. Хотя я рад, что хотя бы так. Остаться без важного раздела медицины сейчас было бы страшнее. Но тем не менее этот парадокс забавен.
— Что мы можем купить в магазине в России, что может оказаться генно-модифицированным?
— Картошка, соя, кукуруза. Теоретически (я в этом не уверен) может оказаться папайя (если она с Гавайев — то почти наверняка она ГМО). Кстати, чтобы продемонстрировать маркетинговость этого всего, упомяну еще, что животной продукции ГМО на рынке нет нигде. Единственное исключение — это быстрорастущий лосось, который одобрен к продаже в Канаде. Но если вы зайдете в магазин, то найдете кучу примеров животной продукции — начиная от молока, заканчивая котлетами, на которых будет налеплена наклейка «Не содержит ГМО». Но это чистый маркетинг.
Нет в мире молока с ГМО. Нет мяса с ГМО (если только это не колбаса, в которую ГМ-сою добавили).
«Генная инженерия — это не инструмент по созданию сверхлюдей»
— Как вы думаете, есть вероятность того, что генетические модификации человека в лаборатории когда-нибудь одобрят?
— Я думаю, это наступит довольно скоро, и в ближайшие десять лет это станет нормальной практикой. Когда-то ведь были дискуссии и сомнения по поводу экстракорпорального оплодотворения и пренатальной диагностики. Это казалось многим чем-то вообще немыслимым, а сейчас это стандартная практика. То же самое в какой-то момент, думаю, станет возможным и с генной инженерией.
Фото metronews.ru
Есть люди, которые родились с заболеванием генетическим, есть — которые без него. Справедливо ли это? Вопрос философский. Но очевидно, хорошо бы, если люди с генетическими проблемами могли бы посредством направленной мутации уравняться со здоровыми людьми
Но тут пока есть техническая проблема: инструменты для генной модификации, с одной стороны, очень хорошо работают, когда мы проверяем, что получилось, а потом из полученных образцов отбираем тот, который нас больше устраивает. Но в случае если мы модифицируем человека, нам надо быть уверенными в том, что не вносим никаких дополнительных мутаций, что мы все сделали хорошо с первого раза. И современные методы генной инженерии к этому очень близки, но не до конца. Еще чуть-чуть!
Как только технологию отладят до совершенства, сделают ее несомненной, тогда, думаю, отпадет и вопрос этики. Ведь почему есть этический вопрос для ученого? Представьте себе, если мы сделаем генно-модифицированного ребенка, и у него будет какое-то заболевание — насколько, во-первых, это будет ужасно для этой семьи и этого ребенка, а во-вторых — насколько это ужасно будет для всего человечества, как сильно это откинет назад доверие к этой технологии. Поэтому ученые очень осторожно выступают за тщательную регуляцию этого процесса.
С растениями и животными проще: если что-то пошло не так, то мы переделаем. А человека вы не переделаете.
— Вряд ли это будет дешево. Нет ли в этом гипотетической проблемы возникновения впоследствии некоей высшей расы — «идеальных людей», родители которых могут себе позволить модифицировать себе ребенка «под заказ»?
— Во-первых, надо понимать, что генная инженерия — это не инструмент для создания сверхлюдей. Единственное, что мы можем сделать — посмотреть, есть ли мутация, которая присутствует в человеческой популяции, оценить ее (полезная она или вредная) и воспроизвести полезную мутацию в организме, у которого ее нет, или убрать вредную. Есть люди, которые родились с заболеванием генетическим, есть — которые без него. Справедливо ли это? Вопрос философский. Но очевидно, хорошо бы, если люди с генетическими проблемами могли бы посредством направленной мутации уравняться со здоровыми людьми.
Все исследования, которые идут в этой области сегодня — все это проекты по поиску возможности избежать генетических заболеваний, а вовсе не по созданию «супермена».
— Что нужно сделать, чтобы в России 75% населения верили не во вредность генной инженерии, а в ее пользу?
— Мне кажется, что тема генной инженерии — это одна из тех тем, где большинство людей противники именно из-за незнания простейших биологических вещей. Вроде того, что мутации возникают абсолютно в каждом поколении, и мы все мутанты. Мне кажется, надо это все транслировать, рассказывать, разъяснять максимально широко.
Я бы, конечно, хотел увидеть и изменения в курсе биологии, чтобы школьникам рассказывали о достижениях современной биотехнологии, развеивали актуальные мифы. Это, может быть, утопично с учетом российских реалий. Но то, что мы, научные журналисты и популяризаторы науки, можем сделать — это развеивать заблуждения и хотя бы надеяться на то, что постепенно хорошие идеи вытеснят плохие.
Людмила Губаева
ОбществоМедицина
Модификация человеческих генов — это почти реальность / Хабр
Главный редактор MIT Technology Review Антонио Регаладо пообщался с сотрудниками Гарвардской медицинской школы, которые специализируются на разработке способов генных модификаций. Главный вывод, к которому он пришёл, таков: вмешательство в ДНК человека — это уже скорее вопрос этики, чем научная проблема. Какие вмешательства допустимы и к чему они могут привести? Готово ли общество к тому, что человека можно будет конструировать ещё до его рождения? И как скоро сюжет фильма «Гаттака» станет обыденной реальностью?
Молодой сотрудник Гарварда доктор Лухан Янг (Luhan Yang), одна из ключевых фигур в разработке метода генетической манипуляции CRISPR-Cas9, недавно основала биотехнологическую компанию, которая занимается изменением геномов крупного рогатого скота. Он говорит, что этот же метод может быть использован для модификации генов человека. Например, сейчас ничто не мешает учёным заменить дефектный ген, ответственный за появление у человека серповидно-клеточной анемии или болезни Альцгеймера.
Несмотря на имеющиеся недостатки, CRISPR уже успешно применяется не только для домашних животных, а и для приматов. Например, гены пары макак были изменены в прошлом году с целью регуляции их метаболизма и производства стволовых клеток. Обезьянки родились здоровыми, но для проверки успешности генной модификации должно пройти три года, прежде чем они достигнут половой зрелости. Сейчас, как говорят генетики Гарварда, в их распоряжении находятся примерно 20 эмбрионов обезьян, так что ожидаемое время таких же манипуляций с ДНК человека они оценивают в 10-20 лет.
Именно при помощи CRISPR-Cas9 совсем недавно группа учёных под руководством профессора института Солка (США) Хуана Бельмонте (Juan Carlos Izpisua Belmonte) провела успешный эксперимент по удалению фрагментов вируса иммунодефицита из ДНК человека. В вирусной ДНК были установлены специальные маркеры в виде молекул РНК, отмечающие фрагменты для удаления. Этот метод протестировали на лимфоцитах и прочих клетках иммунной системы, зараженных ВИЧ. Первая версия РНК-маркеров смогла удалить вирус и его следы в 72% клеток. Уничтожены были как «свежие» ДНК вируса, так и его «спящие» копии.
Недавнее социологическое исследование в США показало, что современное общество в целом готово к подобным манипуляциям. Взрослым задавали вопрос — согласны ли они на то, что с генами их ребёнка будет выполнена генетическая модификация с тем, чтобы он стал «умнее» и был бы менее подвержен серьёзным заболеваниям. Значительное число респондентов высказались положительно:
Генная модификация против голода и болезней. Кто и почему тормозит технологию?
В мире технологий прогресс происходит чуть ли не каждый день. В центре особого внимания ‒ генное редактирование. Оно может не только избавить человека болезней и физических недостатков, но и решить проблему голода в мире, от которой страдают сотни миллионов людей. Но на пути ученых стоят законы.
Человечество тысячелетиями модифицировало гены пищевых продуктов. Профессор биомедицинской инженерии, компьютерных наук и биостатистики в Университете Джона Хопкинса Стивен Зальцберг в статье для Forbes пишет: «Каждая буханка органического, не-ГМО-хлеба производится из пшеницы, которую люди с давних времен изменяли. Каждый стакан молока, полученный от коровы, которую кормили травой и не давали гормон роста, происходит от коров, которых люди выводили на протяжении веков. Все коровы – генетически модифицированные».
Использование ГМО уже не одно десятилетие находится в центре жарких споров в разных странах мира. Но это не мешает технологиям генной модификации достигать новых уровней.
CRISPR, который изменит мир
Технология, известная под названием CRISPR появилась несколько лет назад. Она может позволить удалять одни гены и добавлять другие, но ее особенность – в чрезвычайной точности редактирования генома: в возможности вырезать, вставлять и удалять «отдельные буквы генетического кода».
Эту технологию можно использовать, например, в сельском хозяйстве ‒ чтобы сделать растения более плодовитыми и устойчивыми к внешним условиям, или в медицине – чтобы лишить людей болезней, в том числе и онкологических.
Преодоление голода в мире
По данным ООН, в мире растет количество людей, страдающих от голода. В 2017 году от голода страдали 821 миллион людей, то есть каждый девятый житель планеты. Эта проблема остро стоит в Африке и Южной Америке. Исследователи называют среди причин этого засухи и наводнения, а также насилие и войны.
CRISPR, по данным ученых, может решить эту проблему. Технология позволяет улучшить рост растений, сделать их устойчивыми к любым погодным условиям и непривлекательными для вредителей, убрать потребность растений в пестицидах, повысить их пищевую ценность и сделать устойчивыми к засухе.
«Редактирование генов, чтобы сделать культуры богаче и устойчивыми, может стать спасателем огромных масштабов», ‒ писал в своей статье для ведущего американского издания Foreign Affairs основатель компании Билл Гейтс, чей фонд уже не один год существенно поддерживает развитие генной инженерии в сельском хозяйстве.
Технология также способна прекратить цепь заболеваний в природе. Ученые уже попробовали в лабораторных условиях отредактировать геном москитов таким образом, чтобы они были не способны передавать людям малярию. Это спасло бы десятки тысяч жизней.
Но начать активно использовать эти возможности не так просто. Причина ‒ в правовом регулировании генной модификации на государственном уровне из-за опасений неожиданных последствий для природы, ее экосистемы и здоровья человека.
Подход в разных странах
Во многих странах подход к ГМО достаточно суров: в ЕС, например, решили, что потенциальные преимущества от генной модификации продуктов питания не преобладают над возможными рисками, говорится в новом анализе американского аналитического центра Stratfor.
Высшее звено судебной системы ЕС недавно постановило, что растения, чьи геномы модифицировали по технологии CRISPR, подпадают под те же строгие ограничения, что и генетически модифицированные организмы.
«Этот шаг может поставить фермеров в невыгодное положение и сделать сельское хозяйство ЕС менее конкурентоспособным», ‒ говорится в статье Stratfor.
В США, тем временем, выбрали противоположный подход, объявив еще в апреле, что генетически измененные культуры регулировать не будут. В Канаде также к генному изменению относятся в том же ключе, что и к традиционному выведению. Австралия пошла на шаг вперед и решила прекратить регулировать методы генного изменения животных, говорится в статье.
Модификация человека
А пока на Западе продолжаются споры о безопасности использования технологий генного регулирования, Китай уже использовал новую технологию в испытаниях и медицине.
«Китайские ученые были первыми, кто успешно использовал CRISPR на нежизнеспособных и жизнеспособных человеческих эмбрионах. Более 100 человек привлекли к исследованиям CRISPR для преодоления различных заболеваний, включая рак», ‒ говорится в статье.
Китай имеет целью стать глобальным лидером в сфере биотехнологий и имеет преимущества по сравнению с западными странами из-за менее строгого регулирования и этических стандартов, пишет автор.
«Биотехнология вступила в новую эру, которая будет определяться технологиями генного редактирования. Маловероятно, что появятся какие-либо эффективные глобальные нормативные акты или регулирующие органы, поскольку экономические, политические и социальные интересы стран значительно отличаются в разных уголках мира. От вопросов этики до ограничений сектор биотехнологий будет сформирован, по международным стандартам, которые выходят за пределы глобального порядка», ‒ убеждает автор.
Генетическая модификация, редактирование генома и CRISPR – pgEd
Что такое генетическая модификация?
В разных странах и организациях генетическая модификация (ГМ) определяется по-разному. В общем, GM относится к внесению изменений в генетическую информацию живого существа, которые в противном случае не произошли бы в результате естественного спаривания или воспроизводства. Обычно это предполагает использование методов биотехнологии, таких как «рекомбинантная ДНК», «нацеливание на ген» или «редактирование генома» для добавления, удаления или иного изменения ДНК организма.Генетическая модификация может также включать перемещение генетического материала между видами.
Генетически модифицированные организмы (ГМО), включая микробы, клетки, растения и животных, давно используются в научных и медицинских исследованиях как способ понимания процессов в биологии, а также механизмов заболеваний. Использование генетических технологий для лечения заболеваний или внесения других изменений в организм человека, называемое «генной терапией», предпринимается с 1990-х годов. Менее горстки этих методов лечения до сих пор одобрены органами безопасности и регулирующими органами, такими как Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Использование генной терапии для непосредственного лечения генетических причин заболеваний долгое время было целью врачей, ученых и пациентов. Некоторые заболевания, такие как муковисцидоз или серповидно-клеточная анемия, относительно хорошо известны как вызываемые вариантами в отдельных генах. В этих случаях есть надежда, что, если ген, вызывающий заболевание, будет исправлен или заменен, то можно будет вылечить людей с этим заболеванием или, по крайней мере, предотвратить его ухудшение. Однако генная терапия является более сложной для более сложных состояний, таких как болезни сердца, диабет или многие формы рака, которые являются результатом взаимодействия между многими генами и между генами и окружающей средой.
Чтобы использовать генетическую терапию для лечения заболеваний у человека после рождения, может потребоваться изменение значительной части клеток в соответствующих тканях или органах. Это создает технические проблемы для безопасной и эффективной доставки механизма модификации и / или альтернативных версий генов к клеткам-мишеням, а также для успешного внесения изменений в геном клеток с минимальными ошибками. Если модификация вносится в «зародышевую линию» (включая репродуктивные клетки, а также клетки на ранних стадиях эмбрионов), то все клетки в организме последующих поколений унаследуют эту модификацию, а также любые ошибки или неожиданные изменения, сделанные во время процесс.
Что такое CRISPR?
С конца 2000-х годов ученые начали разрабатывать методы, известные как «редактирование генома (или гена)». Редактирование генома позволяет ученым вносить изменения в конкретный «целевой» сайт в геноме. Один из методов, который вызвал наибольший интерес благодаря своей эффективности и простоте использования, называется «CRISPR». CRISPR означает «кластерные короткие палиндромные повторы с регулярными интервалами». В основе технологии CRISPR лежит система, созданная бактериями для защиты от вирусов.Ученые взяли компоненты системы CRISPR и превратили ее в инструмент для редактирования генома.
Система CRISPR состоит из двух компонентов: молекула, известная как «направляющая РНК» (gRNA), которая имеет ту же последовательность, что и целевой сайт в геноме; и «нуклеаза» (то есть молекула, разрезающая ДНК), называемая Cas9. Когда оба этих компонента доставляются в клетку, gRNA будет связываться с целевым геномным сайтом посредством комплементарного спаривания оснований (это означает, что A будут связываться с T, а G будут связываться с C).При этом гРНК помогает доставить Cas9 к целевому сайту, чтобы разрезать двойную спираль ДНК. Механизм естественной репарации ДНК клетки закроет этот пробел, но, поскольку процесс не идеален, несколько оснований ДНК будут добавлены или удалены. Это делает исходный ген – например, вариант гена, связанный с раком или связанный с ВИЧ-инфекцией, – нефункциональным. Альтернативно, другую версию целевого гена можно поместить в клетку вместе с gRNA и Cas9. Затем клетка будет использовать эту альтернативную последовательность в качестве «шаблона» для восстановления разорванной ДНК, копирования и включения ее в геном.Это может позволить заменить нежелательную версию гена желаемой копией.
Недавние научные открытия сделали возможным «редактирование» генома для исправления генетических вариантов, вызывающих болезни. Хотя это еще только начало, есть надежда, что технологии редактирования генов могут однажды обеспечить лекарство от генетических заболеваний, таких как серповидноклеточная анемия, муковисцидоз или болезнь Хантингтона, и позволить людям лучше бороться с вирусными инфекциями (например, ВИЧ).
CRISPR и редактирование зародышевой линии
Исследователи использовали CRISPR в клетках человека, растений и животных; фактически, CRISPR работал на всех исследованных на сегодняшний день видах. Примечательно, что технология CRISPR использовалась для обращения симптомов у взрослых мышей с заболеванием печени и для изменения ДНК у нечеловеческих приматов – важные шаги на пути к разработке новых методов лечения генов у людей. В то время как генетические изменения, внесенные в клетку печени, не будут унаследованы в геноме какого-либо будущего потомства человека, изменения ДНК, внесенные в клетки, которые станут яйцеклеткой или сперматозоидом, или клетки в эмбрионах на ранних стадиях, могут передаваться дальше. будущим поколениям.Это известно как редактирование зародышевой линии, и его перспективы вызвали дискуссии и дебаты во всем мире о том, уместна ли генетическая модификация зародышевой линии у людей, и следует ли и как общество продолжать такие исследования и возможное применение.
С одной стороны, критики подчеркивают как технические, так и этические проблемы с внесением изменений в геном, которые могут передаваться потомству. Есть опасения, что любой непредвиденный эффект в процессе редактирования может унаследоваться. Возникают и другие вопросы – имеем ли мы право изменять геном наших будущих поколений? Приведет ли исправление определенных заболеваний или инвалидности к стигматизации людей, живущих с такими заболеваниями? И кто решает, какие болезни или инвалидность следует отредактировать? В то же время сторонники утверждают, что модификация зародышевой линии может потенциально устранить такие заболевания, как болезнь Хантингтона, изнурительное неврологическое состояние, вызванное одним вариантом гена.Они также утверждают, что люди уже давно меняют жизнь и генетику нашего потомства без их явного согласия с помощью таких процедур, как генетическое консультирование и предимплантационная генетическая диагностика.
В декабре 2015 года Национальные академии США, Королевская академия Великобритании и Китайская академия наук созвали ученых, социологов, специалистов по этике и других заинтересованных сторон на Международный саммит по редактированию генов человека в Вашингтоне, округ Колумбия. В заявлении, опубликованном в конце саммита, подчеркивалось, что в настоящее время было бы «безответственно» продолжать клиническое использование редактирования зародышевой линии, но не рекомендовалось запрещать методику, а вместо этого предлагалось продолжить исследования.В феврале 2017 года комитет экспертов национальных академий США по редактированию генома человека опубликовал свой отчет, в котором рекомендовал продолжить исследования и использование редактирования соматического генома для лечения в рамках существующей нормативной базы, но при этом «широкая общественность ввод », прежде чем расширить область применения технологии до« генетического улучшения ». В то же время в отчете рекомендуется проводить клинические испытания редактирования генома зародышевой линии для лечения «серьезных заболеваний или нарушений» только после проведения гораздо большего количества исследований и только при соблюдении строгих технических и этических критериев.В дальнейшем в отчете подчеркивается необходимость продолжения участия общественности и политических дебатов.
В настоящее время генетическая модификация зародышевой линии является незаконной во многих европейских странах и в Канаде, и федеральное финансирование в Соединенных Штатах не может быть использовано для такой работы. По состоянию на январь 2017 года исследователи из Великобритании, Швеции и Китая получили разрешение на редактирование генов в человеческих эмбрионах только в исследовательских целях (кроме того, существующие законы или руководящие принципы в этих странах разрешают исследования только на эмбрионах в течение 14 дней после оплодотворения). .
В ноябре 2018 года в новостях появились сообщения о том, что первые дети, чьи геномы были отредактированы с помощью CRISPR на эмбриональной стадии, пара близнецов, родились в Китае. Хотя утверждения до сих пор не прошли независимую проверку и не опубликованы в рецензируемых журналах, они вызвали серьезные разногласия. В 2019 году ученые, специалисты по этике и широкая общественность продолжают обсуждать путь вперед.
CRISPR и окружающая среда
CRISPR также открыл путь к проектированию окружающего нас мира на благо здоровья человека и окружающей среды.Применения включают возможность модификации или даже искоренения насекомых-распространителей болезней, таких как комары. Также возможно воссоздать давно вымерших животных, таких как шерстистый мамонт, чтобы они снова бродили по Земле, что, по мнению некоторых ученых, может помочь решить проблему изменения климата. Однако не все согласны с тем, что эти приложения обязательно принесут «пользу», в то время как другие беспокоятся о непредвиденных последствиях этих действий, изменяющих экосистему.
Путь вперед
Редактирование генов может принести пользу здоровью человека.В то же время возникает серьезный вопрос, требующий публичного обсуждения: что, если мы внесем изменения, о которых сожалеем? Что, если кажущиеся безопасными генетические изменения приведут к непредвиденным последствиям? Каковы стандарты безопасности, когда медицинское сообщество стремится изучить эти инструменты, чтобы уменьшить страдания? Кроме того, если мы как общество согласны с тем, что использование редактирования генома приемлемо, как мы можем гарантировать, что все люди осведомлены о возможностях этих технологий и что каждый, кто хочет получить доступ к таким технологиям, может их себе позволить? Исследователи, специалисты по биоэтике и политики, в том числе ряд ученых, первопроходцев CRISPR, призвали к осторожности и необходимости общественных консультаций и диалога, в которых также участвуют религиозные лидеры, экологические активисты и защитники интересов пациентов и людей с ограниченными возможностями.Поскольку общество ищет баланс между желанием реализовать преимущества редактирования генов и множеством других проблем, pgEd надеется сыграть роль в содействии широкому обсуждению, которое вовлекает все сообщества и гарантирует, что различные ценности и голоса будут услышаны.
Для получения дополнительной информации о технических и политических вопросах, связанных с CRISPR и редактированием генома, щелкните здесь.
Связанные планы уроков:
Редактирование генома и CRISPR
Заявления об использовании CRISPR для редактирования геномов девочек-близнецов, рожденных в 2018 году
Разработка окружающего мира: редактирование генома и окружающая среда
Сообщения по теме:
«Урок pgEd о близнецах, редактируемых CRISPR» (март 2019 г.)
«Серповидноклеточная анемия и генная инженерия: мини-урок от pgEd» (ноябрь 2017 г.)
«В новостях: прогресс в генной терапии» (октябрь 2017 г.)
«В новостях: ученые используют CRISPR для редактирования варианта гена, вызывающего заболевание, в человеческих эмбрионах» (август 2017 г.)
«В новостях: клиническое использование CRISPR делает шаг вперед» (июнь 2016 г.)
«В новостях: первые оптогенетические испытания на людях» (март 2016 г.)
«В новостях: борьба с болезнетворными комарами на основе генного драйва становится ближе к реальности» (декабрь 2015 г.)
«В новостях: потенциальный новый подход к генной терапии серповидноклеточной анемии» (сентябрь 2015 г.)
Подробнее:
Шэрон Бегли, «Нет красной черты против CRISPR’ing ранних эмбрионов, эксперты считают» ( STAT , февраль 2017 г.)
Дэвид Сираноски, «Редактирование генов CRISPR протестировано на человеке впервые» ( Nature , ноябрь 2016 г.)
Антонио Регаладо, «Познакомьтесь с моралистами, которые следят за генными приводами, технологией, которая идет вразрез с эволюцией» ( MIT Technology Review , июнь 2016)
Эрика Чек Хайден, “Стоит ли редактировать гены своих детей?” ( Nature , февраль 2016)
Эд Йонг, «Что на самом деле можно сделать с помощью своей причудливой технологии редактирования генов?» ( The Atlantic , декабрь 2015)
Карл Циммер, «Редактирование ДНК свиньи может привести к большему количеству органов у людей» ( New York Times , октябрь 2015 г.)
Натаниэль Комфорт, «Можем ли мы лечить генетические болезни, не углубляясь в евгенику?» ( The Nation , июль 2015)
Эндрю Поллак, «Новый мощный способ редактирования ДНК» ( New York Times , март 2014 г.)
Генное редактирование людей: дело не только в безопасности
Китайский ученый Хэ Цзянькуй удивил научное сообщество и мир, когда в ноябре 2018 года объявил, что он генетически модифицировал два эмбриона, а затем позволил им развиться в младенцев.Мало того, он считал, что действовал в соответствии с рекомендациями, изложенными в отчете Национальной академии наук, инженерии и медицины за 2017 год.
Совсем недавно российский ученый Денис Ребриков объявил о своем намерении отредактировать человеческий эмбрион и имплантировать его женщине, чтобы дать ему развиться. Эти ученые-ренегаты спровоцировали то, что STAT News назвало «переделкой» Национальной академии наук, Национальной академии медицины и Королевского общества Великобритании.
На прошлой неделе эти организации провели первое из серии важных заседаний совместно спонсируемой ими Международной комиссии по клиническому использованию редактирования генома зародышевой линии человека.Кроме того, Всемирная организация здравоохранения сформировала Консультативный комитет экспертов по разработке глобальных стандартов управления и надзора за редактированием генома человека.
Эти группы стремятся на этот раз быть более ясными и создать структуру управления, чтобы такие ученые, как Хе и Ребриков, понимали и уважали руководящие принципы, установленные их коллегами: модификация зародышевой линии человека еще небезопасна. Поскольку остается еще много нерешенных вопросов, включая так называемые результаты, не соответствующие цели, частичное редактирование и другие проблемы, базовые лабораторные исследования по редактированию генов могут продолжаться до тех пор, пока эмбрионы не могут развиваться.
Однако, несмотря на то, что эти органы перегруппировываются для выработки более четких указаний, я чувствую сдвиг в дебатах. В течение очень долгого времени научный и биоэтический консенсус заключался в том, что мы не должны вносить изменения в зародышевую линию человека – что мы не должны изменять гаметы и эмбрионы таким образом, который был бы постоянным и затрагивал бы все будущие поколения. Напротив, соматические модификации, которые затрагивают только человека, в котором вносятся правки, в основном не вызывали споров.
Но граница между модификацией зародышевой линии и соматической модификацией генома стирается; дух времени ощущается иначе.Растет ощущение неизбежности того, что мы в конечном итоге произведем модификацию зародышевой линии человека и что наша единственная обязанность – ждать, пока это не станет безопасным. Когда наступит этот день, мы, возможно, захотим внести в человеческий вид постоянные наследственные изменения, чтобы искоренить трудноизлечимые болезни. Однако мы должны начать это обсуждение с широко открытыми глазами, рассматривая каждое приложение по отдельности и предвидя широкий круг вопросов, выходящих далеко за рамки безопасности. Многие из этих вопросов рассматриваются в книге Human Flourishing in an Age of Gene Editing, , которая будет опубликована Oxford University Press 28 августа 2019 года.
Хотя мы еще не знаем генетических предикторов многих состояний, по мере того, как мы узнаем больше, соблазн использовать технологии редактирования генов для «улучшения» самих себя будет необычайным – и особенно проблематичным, если мы получим способность снижать вероятность высокой стигматизированные черты, такие как гомосексуализм, или исправление очень желательных черт, таких как рост или атлетизм. Многие родители, возможно, законно, утверждают, что они не предвзято относятся к гомосексуализму или какому-либо другому образу жизни, а просто думают, что это усложняет жизнь.Так почему бы не удалить гены, увеличивающие вероятность того, что это произойдет? И разве не все хорошие родители стремятся дать своим детям преимущества?
Многие из вариантов, которые нам предстоит сделать, будут по праву принадлежать будущим родителям. Но даже когда решения носят личный и частный характер, они должны быть хорошо информированы, поэтому нам нужно гораздо больше способов вовлечь общественность в разговоры о редактировании генома зародышевой линии. Для принятия действительно информированных личных решений необходимо активное обсуждение в сообществе поставленных на карту ценностей.
Нам нужна широкая общественная дискуссия по вопросам, выходящим за рамки безопасности, по другой причине. То, что люди решают делать самостоятельно, может изменить коллектив, даже если эти изменения не предназначались для населения в целом. Редактирование генома зародышевой линии человека является типичным примером технологии, которая будет иметь как личные, так и коллективные последствия, влияя на нашу общую среду.
Как, например, способность выбирать в своих детях те качества, которые мы хотим, может повлиять на отношения между родителями и детьми и на добродетели, которые мы хотим видеть в наших общинах? Комментаторы, такие как Майкл Сэндел из Гарвардского университета, предупредили, что контроль над геномами наших детей может привести к ощущению «гиперактивности», в результате чего мы потеряем ощущение детей как подарков, которых нужно взращивать, когда они приходят к нам и предпочитают их видеть. как объекты, которые мы разработали.Будут ли дети, которых отредактировали так, чтобы они обладали большим музыкальным талантом или спортивным мастерством, почувствовали себя обязанными осуществить мечты своих родителей даже больше, чем обычно это делают дети?
Более того, мы могли создавать наше потомство на основе популярных, но подозрительных норм, таких как гомофобия или определенные физические особенности. Мы также могли бы непреднамеренно создать то, что некоторые комментаторы назвали «генетической гонкой вооружений», в которой попытки родителей дать детям преимущество просто заставят всех соревноваться на все более высоких уровнях, независимо от того, какие черты они ищут.
Конечно, до такого контроля еще далеко, но сейчас мы прокладываем путь к усовершенствованию человека, который может в конечном итоге уменьшить вариабельность видов или, в течение длительного периода времени, привести к подвидам. Действительно, трансгуманисты защищают именно этот результат – слияние новых биологических и синтетических сил, которое существенно изменит саму природу нашего вида.
Нам нужны форумы и стратегии для обсуждения последствий, выходящих за рамки безопасности: книги для ученых, политиков и заинтересованных представителей общественности, которые предвидят широкий спектр социальных, экономических и этических последствий улучшения: образовательный опыт для студентов и их учителей; литература и фильмы, которые не делают сенсаций, но помогают нам рассмотреть социальную и этическую сложность наших вновь обретенных способностей; совещательный опрос и другие формы демократического обсуждения; и множественные каналы связи между экспертами и неспециалистами.
И международная комиссия, и комитет ВОЗ обещают рассмотреть широкий круг социальных и этических вопросов, выходящих далеко за рамки безопасности. Я надеюсь, что они будут придерживаться этого намерения. Их встреча на прошлой неделе началась с прекрасного начала, с призывов к большей научной прозрачности и возобновления обязательств по созданию глобальной основы для определения параметров этого исследования.
Но потребуется стойкое мужество, чтобы устранить все последствия использования этой технологии. В плюралистическом обществе может быть страшно открывать ящик Пандоры для обсуждения глубоко укоренившихся ценностей.При таком большом количестве различных взглядов, которые, казалось бы, невозможно примирить, будет легче сосредоточиться только на безопасности, которая является абсолютным минимумом, с которым может согласиться практически каждый. Но мы избегаем более серьезных и жестких разговоров, опасаясь за своих внуков.
Генетическая модификация человека (вероятно) произошла – что теперь?
Китайский ученый Хэ Цзянькуй потряс мир в ноябре 2018 года, когда сообщил о рождении девочек-близнецов, рожденных от генетически измененных эмбрионов, с еще одним генетически измененным ребенком на подходе.Хотя это сообщение о генетической модификации не было и, возможно, никогда не будет подтверждено независимо из соображений конфиденциальности, рождение так называемых «младенцев CRISPR», названных в честь подхода редактирования ДНК, используемого для изменения их генома в процессе ЭКО. , оказал сейсмическое воздействие на научное сообщество и за его пределами.
Новости
Цзянькуй были немедленно встречены критикой во всех уголках земного шара. Если это правда, он провел безрассудный эксперимент на людях, который нарушил международный научный и медицинский консенсус, не имел надлежащей этической и нормативной экспертизы и потенциально мог иметь серьезные последствия для здоровья девочек, а также более широкие последствия для общества.Многочисленные научные организации, в том числе ISSCR, выступили с заявлениями, осуждающими клиническое применение редактирования ДНК человеческих эмбрионов.
Проблемы научного и этического характера
По иронии судьбы, неожиданное объявление было сделано во время международного саммита по редактированию генов человека, цель которого заключалась в том, чтобы собрать экспертов из различных дисциплин для обсуждения и обсуждения «многих оставшихся вопросов, касающихся науки, применения, этики и управления геномом человека. редактирование.«С момента открытия CRISPR научное сообщество признало широкое медицинское применение этого подхода для исправления генетических дефектов, а также этические и социальные последствия, особенно если и / или когда он будет использоваться для исправления генетических дефектов эмбриона. Генетические изменения эмбриона могут быть включены во все клетки, включая те, которые дают начало сперматозоидам и яйцеклеткам (также известные как клетки зародышевой линии), и, таким образом, изменения могут быть переданы будущим поколениям .Это не относится к генетическим изменениям взрослых клеток вне гонад.
Множество этических и социальных последствий возникает при рассмотрении возможности наследования антропогенных изменений в геноме эмбриона человека. Некоторые подробно описаны в недавнем отчете Nuffield Group, например:
- при каких обстоятельствах допустимо редактирование генома эмбриона человека?
- каковы последствия таких модификаций для благосостояния людей?
- какой уровень безопасности и научных доказательств требуется для того, чтобы реализовать этот подход?
Хотя в отчете делается вывод о том, что существуют «обстоятельства, при которых вмешательства по редактированию генома человека должны быть разрешены», в нем также говорится, что они не должны проводиться до тех пор, пока не начнется «инклюзивная общественная дискуссия» по данному вопросу (вопросам).
В дополнение к продолжающимся и в настоящее время активизировавшимся дискуссиям существует ряд групп, работающих над новыми инициативами по созданию более строгих рамок и руководящих принципов для этого исследования и его потенциального клинического применения.
- Всемирная организация здравоохранения созвала Консультативный комитет экспертов для «разработки глобальных стандартов управления и надзора за редактированием генома человека». Среди обсуждаемых тем – центральный реестр редактирования генома человека «с целью создания открытой и прозрачной базы данных о текущей работе».”
- Независимо, международное сотрудничество академий наук, Национальной академии наук США (NAS), Национальной академии медицины США (NAM) и Королевского общества Великобритании возглавляет международную комиссию по обсуждению научных и нормативных вопросов, связанных с редактированием информации о людях. эмбрионы.
- Международная группа ученых также выпустила международную структуру управления и вместе с другой группой призвала ввести мораторий на любые манипуляции с клиническим геномом эмбриона, «до тех пор, пока не будут полностью решены серьезные научные, социальные и этические проблемы.”
- Отдельные страны предлагают ужесточить правила в отношении исследований по редактированию генов.
Важный потенциал для медицины
Редактирование генов, будь то во взрослых клетках или ранних эмбрионах, может изменить то, как мы лечим и думаем о болезни. С заменой одного нуклеотида в некоторых случаях можно вылечить потенциально смертельное заболевание. Однако прежде чем это произойдет, необходимо рассмотреть и проработать важные научные и этические вопросы.Объявление Хэ Цзянькуя в конце 2018 года стимулировало эти разговоры, и исследователи, клиницисты, специалисты по этике и другие в настоящее время активно обсуждают вопрос о том, может ли редактирование генома зародышевой линии человека стать частью медицинского лечения и каким образом. Через различные международные рабочие группы, научные общества, такие как ISSCR, и отдельные страны, эти вопросы будут решаться в ближайшие месяцы, а остальной мир будет ждать и наблюдать.
генетически модифицированных людей? Взлом ДНК, что значит быть человеком, Конец секса
Ученые уже генетически модифицировали человеческие эмбрионы, наша ДНК становится такой же редактируемой и поддающейся взлому, как и другие типы кода, а гонка в области генной инженерии продвигается бешеными темпами.Недавно мы взяли интервью у Джейми Метцля, доктора философии, одного из ведущих футуристов и геополитических экспертов в мире, о грядущей генетической революции и о том, что нам нужно делать сейчас, чтобы подготовиться.
Метцль – старший научный сотрудник Атлантического совета и член экспертного консультативного комитета Всемирной организации здравоохранения по разработке глобальных стандартов редактирования генома человека. Ранее он работал в Совете национальной безопасности США, в комитете Сената по международным отношениям и в качестве сотрудника по правам человека в Организации Объединенных Наций в Камбодже.(И да, он также является триатлетом Ironman.) Его последняя книга, Hacking Darwin: Genetic Engineering and the Future of Humanity , исследует грядущую генетическую революцию и будущее человечества.
СИНИЕ ЗОНЫ: Ваша новая книга,
Hacking Darwin , звучит захватывающе и пугающе. Почему нам нужно сесть и обратить внимание на то, что происходит с генной инженерией?
ДЖЕЙМИ МЕТЦЛ: Генетическая революция, которая коренным образом изменит наше здравоохранение, способ рождения детей, характер рождаемых нами детей и, в конечном итоге, нашу эволюционную траекторию как вида, уже началась.
Это похоже на научную фантастику, но это очень реально и очень скоро изменит нашу жизнь.
Поскольку эта трансформация затронет каждого из из нас, это все нашего бизнеса. Я написал Hacking Darwin , чтобы людям было легче понять, что происходит, что поставлено на карту, что это значит для каждого из нас и что мы все можем сделать, чтобы подготовиться.
БЖ: Что на самом деле люди теперь могут делать? С точки зрения генной инженерии своих детей?
JM: Многие родители уже сегодня генно-инженерные методы своих детей, даже если мы не называем это так.Все большее число родителей используют ЭКО и предимплантационное генетическое тестирование вместо секса, чтобы зачать детей, и предпочитают имплантировать эмбрионы с меньшей вероятностью наличия определенных генетических заболеваний и хромосомных нарушений. Другие используют пренатальное тестирование для выявления генетических аномалий и, в некоторых случаях, предпочитают прерывание беременности.
В Китае родились две девочки, чьи предварительно имплантированные эмбрионы были изменены неэтичным ученым.
Это все еще самые ранние дни генной инженерии, нашего потомства … но впереди еще много чего.
BZ: Вы сказали, что в ближайшем будущем секс для воспроизводства будет происходить в лабораториях. Вы можете уточнить?
ДМ: Революция в способах рождения детей побудит многих из нас зачать детей в лабораториях, а не в кроватях и на задних сиденьях автомобилей.
1 Сначала мы сделаем это, чтобы снизить примерно трехпроцентный риск того, что дети, зачатые половым путем, будут иметь какие-либо вредоносные генетические аномалии.
Но как только мы начнем привыкать к ЭКО и скринингу эмбрионов, чтобы снизить риски для здоровья, многие из нас захотят сделать выбор, который даст нашим детям больше шансов на долгую и здоровую жизнь.
2 Затем мы, вероятно, будем использовать технологий стволовых клеток , чтобы помочь женщинам произвести на тысячи яиц больше, чем они могли бы самостоятельно, и значительно увеличить количество эмбрионов, которые можно секвенировать, прежде чем будет принято решение о том, какие из них имплантировать.
3 Мы также будем использовать прецизионные инструменты для редактирования генов , более точные, чем CRISPR, , чтобы внести ряд дискретных генетических изменений в эти предварительно имплантированные эмбрионы, чтобы исключить риски или принести пользу.
Все это будет спорным и поднимет колоссальные этические проблемы, которые нам необходимо будет активно изучить.
Я написал Hacking Darwin , чтобы помочь начать то, что я называю «межвидовым диалогом» о будущем генной инженерии человека. Эта наука неизбежно будет развиваться, но ценности, которыми руководствуется этот прогресс, зависят от нас. Если мы хотим оптимизировать преимущества и минимизировать вред, мы все должны действовать прямо сейчас.
BZ: Было проведено множество исследований по продлению жизни с помощью технологии стволовых клеток, но некоторые из наиболее важных факторов долголетия невозможно воспроизвести в лаборатории (любовь, социальные связи, цель).Как вы думаете, действительно ли возможно добиться долголетия?
ДМ: Я определенно считаю, что долголетие можно взломать. На самом деле мы занимаемся этим уже давно. Если наша цель – продолжать увеличивать здоровье и продолжительность жизни среди населения, мы должны делать все, что Дэн описывает в синих зонах, которые он обнаружил по всему миру. Но даже если каждый из нас будет жить точно так же, как самый просвещенный житель Окинавы, самое долгое, что мы можем надеяться прожить с нынешней биологией, будет 122 – самая долгоживущая человеческая жизнь за всю историю.
Я думаю, что со временем мы сможем выйти за рамки этого, применив технологии. Такие препараты, как метформин, рапамицин и никотинамидмононуклеотид (NMN), уже увеличивают продолжительность жизни у модельных организмов, таких как мыши. Ученые показывают, как сокращение стареющих клеток и управление путями рециклинга клеток замедляют процесс старения в этих организмах. Сумасшедший процесс, называемый асинхронным парабиозом, – разрезание и сшивание молодых и старых животных, обычно мышей, – предполагает, что что-то в плазме более молодых мышей делает более старых мышей биологически моложе.Подобные технологии еще не совсем готовы к полноценному использованию человеком, но многие из них будут готовы. Раскрывая генетические секреты людей, которые живут особенно долгой и здоровой жизнью, мы сможем отбирать для имплантации во время ЭКО эмбрионы, которые генетически предрасположены к этим качествам. Я выступил с основным докладом на эту тему на SXSW (видео ниже ), возможно, вашим читателям понравится.
Но если мы проживем более долгую здоровую жизнь, нам нужно будет еще больше наполнить их истинным смыслом, который исходит из наших отношений и нашей цели.Это то, за что стоит бороться за нашу жизнь.
BZ: Да, в Blue Zones мы делаем упор не только на добавление лет к жизни, но и на добавление жизни к годам. Кажется, что нет смысла долго жить без хорошего качества жизни, включая целеустремленность и любовь.
ДМ: Совершенно верно. Одна из моих рекомендаций людям, вступающим в новую эру, – инвестировать друг в друга. Люди – социальный вид, и одна из основных причин, по которой мы поднялись на вершину пищевой цепочки, заключается в том, что мы можем сотрудничать друг с другом.
Даже в этом все более виртуальном мире мы все еще не виртуальные существа. Нам все еще нужно сообщество людей вокруг нас, чтобы быть счастливыми и удовлетворенными. Поскольку мир меняется и становится все более виртуальным с каждым днем, мы должны инвестировать в конструктивные отношения с окружающими нас людьми.
BZ: Что еще мы должны делать сейчас, когда мы знаем, что грядет генетическая революция?
JM: Ученые находят новые способы замедлить биологический процесс старения, и я не думаю, что пройдет много времени, прежде чем врачи назначат генную терапию и лекарства, чтобы справиться со старением.Чтобы получить пользу от этих новых методов лечения, мы должны сделать все возможное, чтобы позаботиться о своем теле прямо сейчас. Чем вы будете здоровее, когда придут омолаживающие процедуры, тем лучше будет.
Мы все должны быть:
- Соблюдение здоровой и преимущественно растительной диеты
- Спать 6-7 часов в сутки
- Создание и поддержание крепких дружеских отношений и поддержки
- Физические упражнения 45 минут в день
- Целенаправленная жизнь
Вы можете прочитать больше советов в моем недавнем интервью TechCrunch.
BZ: Вы технический футурист и геополитический эксперт, который также пишет научно-фантастические романы. Какой путь вы выбрали в этой области обучения?
ДМ: С самого раннего детства я всегда спрашивал, почему. Я защитил докторскую диссертацию. в истории, сосредоточив внимание на прошлых нарушениях прав человека , потому что я хотел знать, почему мы коллективно так много раз терпели неудачу, чтобы предотвратить самые ужасные человеческие трагедии. Работая в лагерях беженцев в Таиланде и для ООН в Камбодже, я быстро понял, что причиной геноцида и беженцев была политика.
Я работал в Белом доме и Государственном департаменте и стал экспертом по геополитике , потому что хотел внести свой вклад, чтобы помочь нам принимать более разумные решения, которые помогут, а не навредят людям. Но по мере того, как перекрывающиеся экспоненциальные технологические революции разыгрывались на протяжении моей жизни, мне стало совершенно ясно, что нам нужно использовать лучшие из наших исторических ценностей, чтобы гарантировать, что наши технологии улучшают нашу человечность, а не подрывают ее.
Я пишу свои романы и научно-популярные книги, такие как Hacking Darwin , чтобы попытаться вовлечь всех в этот процесс.Нам всем нужно быть историками, чтобы понимать, откуда мы пришли, какие ошибки мы сделали и извлеченные уроки, геополитиками, чтобы понять большие политические силы, формирующие наш мир, и футуристами, чтобы представить, куда мы идем, чтобы мы наметили самый мудрый путь, чтобы попасть туда.
Быстрые ответы с Джейми Метцлем:
Какие 3 блюда всегда есть на кухне?
- Семена чиа
- Семена льна
- Темный шоколад (у меня есть вторая тайная жизнь шамана какао)
Какой совет вы бы дали себе 20-летнему?
- Примите жизненные необходимые и связанные взлеты и падения, чтобы принять себя
- Читай так, будто от этого зависит твоя жизнь, а она и делает
- Имейте конкретную цель, инвестируйте время и энергию, необходимые для ее достижения, и будьте полностью открыты для изменения направления несколько раз на пути
Чем вы больше всего гордитесь?
- Мои отношения с самыми близкими людьми в моей жизни
- Мое сообщение и возможность поделиться им с другими
- Мне кажется, что я делаю немного, чтобы сделать мир лучше
Когда и где вы больше всего счастливы?
- Когда я чувствую, что нахожусь в состоянии потока и действительно общаюсь с людьми
- Когда я чувствую в себе глубочайшее спокойствие (часто на дистанции около 30 миль ультрамарафона)
- На Ранчо ла Пуэрта в Текате, Мексика, маленький кусочек рая
Какая у вас личная мантра или девиз?
- “ Draco dormiens nunquam titillandus. «Подождите, это кто-то другой.
- Если я могу украсть у Торо: «Если вы построили воздушные замки, ваша работа не будет потеряна; вот где они должны быть. Теперь положите под них фундамент ».
Генная терапия и генная инженерия
Введение
Клетки человека или другого организма имеют части, называемые «генами», которые контролируют химические реакции в клетке, которые заставляют ее расти и функционировать и в конечном итоге определяют рост и функции организма.Организм наследует некоторые гены от каждого родителя, и, таким образом, родители передают определенные черты своему потомству.
Генная терапия и генная инженерия – две тесно связанные технологии, которые включают изменение генетического материала организмов. Различие между ними основано на цели. Генная терапия направлена на изменение генов для исправления генетических дефектов и, таким образом, предотвращения или лечения генетических заболеваний. Генная инженерия направлена на изменение генов, чтобы расширить возможности организма сверх нормальных.
Этические противоречия вокруг возможного использования обеих этих технологий на растениях, животных и людях. В частности, в отношении генной инженерии, например, возникает вопрос, правильно ли было бы возиться с человеческими генами, чтобы сделать людей способными превзойти величайших олимпийских спортсменов, или они будут намного умнее Эйнштейна.
Непонятная терминология
Если под генной инженерией подразумевается в очень широком смысле слова любые преднамеренные генетические изменения, то она включает генную терапию.Таким образом, можно услышать о «терапевтической генной инженерии» (генная терапия) и «негативной генной инженерии» (генная терапия) в отличие от «генной инженерии улучшения» и «позитивной генной инженерии» (то, что мы называем просто «генной инженерией»).
Мы используем фразу «генная инженерия» в более узком смысле для обозначения вида изменения, направленного на улучшение, а не на терапию. Мы используем термин «генная терапия» для попыток привести людей в норму, а «генная инженерия» или «усиленная генная инженерия» – для усилий по расширению возможностей людей за пределы нормы.
Соматические клетки и репродуктивные клетки
Два основных вида клеток – это соматические клетки и репродуктивные клетки. Большинство клеток в нашем организме соматические – клетки, из которых состоят такие органы, как кожа, печень, сердце, легкие и т. Д., И эти клетки отличаются друг от друга. Изменение генетического материала в этих клетках не передается потомству человека. Репродуктивные клетки – это сперматозоиды, яйцеклетки и клетки очень ранних эмбрионов. Изменения в генетическом составе репродуктивных клеток передаются потомству человека.Эти изменения репродуктивных клеток могут привести к иной генетике соматических клеток потомства, чем в противном случае, потому что генетический состав соматических клеток напрямую связан с генетическим составом половых клеток, из которых они произошли.
Методы генетической модификации
При смене генов необходимо столкнуться с двумя проблемами. Во-первых, какое изменение нужно внести в ген. Во-вторых, как включить это изменение во все остальные ячейки, которые необходимо изменить для достижения желаемого эффекта.
Есть несколько вариантов того, какие изменения внести в ген. ДНК в гене может быть заменена другой ДНК извне (так называемая «гомологичная замена»). Или ген можно заставить мутировать (изменить структуру – «селективная обратная мутация»). Или можно просто добавить ген. Или можно использовать химическое вещество, чтобы просто выключить ген и предотвратить его действие.
Есть также несколько вариантов того, как распространить генетическое изменение на все клетки, которые необходимо изменить.Если измененная клетка является репродуктивной клеткой, то несколько таких клеток могут быть изменены, и изменение достигнет других соматических клеток, поскольку эти соматические клетки были созданы по мере развития организма. Но если бы изменение было внесено в соматическую клетку, изменение всех других соответствующих соматических клеток по отдельности, как первая, было бы непрактичным из-за огромного количества таких клеток. Клетки такого крупного органа, как сердце или печень, слишком многочисленны, чтобы изменяться одна за другой. Вместо этого для достижения таких соматических клеток обычным подходом является использование носителя или вектора, который представляет собой молекулу или организм.Например, в качестве вектора можно использовать вирус. Вирус был бы безобидным или измененным, чтобы не вызывать болезнь. Ему будет вводиться генетический материал, а затем, когда он воспроизводится и «заражает» клетки-мишени, он вводит новый генетический материал. Это должен быть очень специфический вирус, который, например, инфицировал бы клетки сердца, не заражая и не изменяя при этом все остальные клетки тела. Частицы жира и химические вещества также использовались в качестве переносчиков, поскольку они могут проникать через клеточную мембрану и перемещаться в ядро клетки с новым генетическим материалом.
Аргументы в пользу генной терапии и генной инженерии
Генную терапию часто считают безупречной с моральной точки зрения, хотя следует соблюдать осторожность. Основные аргументы в пользу этого метода заключаются в том, что он предлагает потенциал для лечения некоторых заболеваний или расстройств у тех, у кого есть проблема, и для предотвращения болезней у тех, чьи гены предрасполагают их к этим проблемам. Если бы она проводилась на репродуктивных клетках, генная терапия могла бы уберечь детей от таких генов (неблагоприятных генетических заболеваний и нарушений), которые дети получили от своих пациентов.
Генная инженерия для улучшения организмов уже широко используется в сельском хозяйстве, в первую очередь в отношении генетически модифицированных (ГМ) культур (также известных как ГМО – генетически модифицированные организмы). Например, сельскохозяйственные культуры и животные были спроектированы таким образом, чтобы они были устойчивы к гербицидам и пестицидам, что означает, что фермеры могут затем использовать эти химические вещества для борьбы с сорняками и насекомыми на этих культурах, не рискуя нанести вред этим растениям. В будущем генетическое улучшение может быть использовано для создания сельскохозяйственных культур с более высокой питательной ценностью и селективного разведения сельскохозяйственных животных, скаковых лошадей и выставочных животных.
Генно-инженерные бактерии и другие микроорганизмы в настоящее время используются для производства человеческого инсулина, гормона роста человека, белка, используемого для свертывания крови, и других фармацевтических препаратов, и количество таких соединений может возрасти в будущем.
Улучшение людей все еще в будущем, но основной аргумент в пользу этого заключается в том, что это может значительно улучшить жизнь за счет улучшения определенных характеристик людей. Мы ценим интеллект, красоту, силу, выносливость, а также определенные личностные характеристики и поведенческие тенденции, и если бы эти черты были обнаружены благодаря генетическому компоненту, мы могли бы улучшить людей, наделив их такими качествами.Сторонники генной инженерии отмечают, что многие люди уже пытаются улучшить себя этими способами – с помощью диеты, физических упражнений, образования, косметики и даже пластической хирургии. Люди стараются делать это для себя, а родители стараются дать это своим детям. Если упражнения для улучшения силы, ловкости и общей физической формы – стоящая цель, и если кого-то хвалят за обучение, направленное на повышение своих умственных способностей, то почему бы не достичь этого с помощью генетики?
Защитники генной инженерии также рассматривают улучшение как элемент базовой репродуктивной свободы.Мы уже не стесняемся выбирать себе пару, частично исходя из возможности иметь желанных детей. Мы думаем, что нет ничего плохого в выборе спутника жизни, который, как мы надеемся, может дать умных и привлекательных детей, а не другого партнера, который обеспечит менее желанных детей. Выбор пары для того типа детей, которых можно получить, является вопросом базовой репродуктивной свободы, и у нас есть свобода выбирать лучшие гены для наших детей. Почему, как гласит этот аргумент, у нас должно быть меньше свободы давать нашим детям лучшие гены, которые мы можем, посредством генетического улучшения?
Тех, кто выступает за существенное изменение человека с помощью таких технологий, как генная инженерия, иногда называют «трансгуманистами».”
Аргументы против генной терапии
Три аргумента, которые иногда приводятся против генной терапии, заключаются в том, что она технически слишком опасна, что она дискриминирует или поощряет дискриминацию в отношении людей с ограниченными возможностями и что в некоторых случаях она может становиться все более неуместной.
Возражение об опасности указывает на то, что несколько недавних попыток генной терапии в клинических испытаниях попали в заголовки газет из-за трагической гибели некоторых людей, участвовавших в испытаниях.Не до конца известно, в какой степени это было связано с самой генной терапией, в отличие от ранее существовавших условий или неправильных методов исследования, но в свете таких событий некоторые критики призвали прекратить генную терапию до тех пор, пока не станет известно больше. . Мы просто недостаточно знаем о том, как работает генная терапия и что может пойти не так. Особые опасения вызывает то, что
- векторы могут доставлять ДНК в клетки, отличные от клеток-мишеней, с непредвиденными результатами
- вирусы как переносчики могут быть не такими безобидными, как предполагалось, и могут вызывать болезни
- добавление новых генов в ядро не гарантирует, что они пойдут туда, куда нужно, с потенциально катастрофическими результатами, если они будут вставлены в неправильное место
- , если изменения не интегрированы с другой ДНК, уже находящейся в ядре, изменения могут не распространиться на новые клетки, и человеку, возможно, придется пройти дополнительную терапию позже
- изменение репродуктивных клеток может вызвать события, которые не наблюдались раньше, чем спустя годы, а нежелательные эффекты, возможно, уже были переданы детям пациента
Возражение против дискриминации заключается в следующем.Некоторые люди с физическими, умственными или эмоциональными недостатками являются таковыми в результате унаследованных ими генетических факторов. Такое нарушение может привести к инвалидности в нашем обществе. Люди с ограниченными возможностями часто подвергаются дискриминации из-за того, что у них меньше возможностей, чем у других людей. Верно, что генная терапия может способствовать устранению одного из источников дискриминации и неравенства в обществе, устраняя генетические нарушения и возникающие в результате нарушения. Но в возражении утверждается, что делается неявное предположение, что людей, страдающих генетическими нарушениями, нужно лечить и делать нормальными.В возражении генная терапия рассматривается как форма дискриминации в отношении людей с ограниченными возможностями и лиц с ограниченными возможностями.
Неуместное возражение состоит в том, что генная терапия репродуктивных клеток в некоторых случаях уже может быть заменена экстракорпоральным оплодотворением и селекцией эмбрионов. Если генетическое заболевание таково, что может быть обнаружено у раннего эмбриона, и не все эмбрионы от родительской пары будут иметь его, тогда родители производят несколько эмбрионов посредством экстракорпорального оплодотворения и имплантируют только те, которые не страдают этим заболеванием.В таком случае генная терапия была бы ненужной и неуместной.
Аргументы против генной инженерии
Специалисты по этике в целом были даже больше озабочены возможными проблемами и последствиями применения улучшающей генной инженерии, чем генной терапией. Во-первых, существуют опасения, аналогичные тем, которые касаются генной терапии, о которой недостаточно известно и которые могут иметь непредвиденные опасные последствия. Эти опасения могут быть еще более серьезными, учитывая, что попытки делаются не только в направлении нормальной жизни, но и на незнакомой новой территории, куда люди никогда раньше не заходили.Мы просто не знаем, какие причудливые существа могут появиться в результате неудачных экспериментов.
Ниже приведены некоторые другие важные возражения:
- Генная инженерия противоречит естественному или сверхъестественному порядку. Мысль здесь заключается в том, что Бог или эволюция создали набор генов для людей, которые либо являются тем, что мы должны иметь, либо предлагают нам лучшую ценность для выживания. Это противоречит тому, что Бог или природа намеревались возиться с этим генетическим кодом, не для того, чтобы привести его в нормальное состояние (как в генной терапии), а для создания новых видов существ.Этот тип возражения совместим как с «креационизмом», верой в то, что Бог создал людей такими, какие они есть, так и с верой в эволюцию. Согласно последнему мнению, люди, сознательно улучшающие свои гены, считают иначе, чем позволять естественному процессу эволюции «выбирать» гены, которые у нас есть.
- Генная инженерия дегуманизирует, потому что она создаст нечеловеческих, отчужденных существ. Генно-инженерные люди будут отчуждены от самих себя, или будут чувствовать себя смущенными, или больше не будут чувствовать себя людьми, или человеческая раса будет чувствовать себя отчужденной от себя.У людей, созданных с помощью генной инженерии, не будет ощущения принадлежности к человеческой расе, но у них не будет достаточно общего с другими подобными созданиями, чтобы чувствовать себя принадлежащими кому-либо из них. Люди будут отчуждены даже от своих радикально отличных от генетической инженерии детей, которые вполне могут быть отдельным видом.
- Существа, созданные с помощью генной инженерии, будут устаревать. Компьютеры быстро устаревают по мере появления новых моделей. Но это могло случиться с людьми, созданными с помощью генной инженерии.Улучшение горячих генов за один год станет старой новостью несколько лет спустя. Родители будут устаревать по меркам их детей, а подростки будут безнадежно уступать своим младшим братьям и сестрам.
- Генная инженерия является версией евгеники и вызывает воспоминания об историческом движении евгеники в начале двадцатого века в Америке и нацистской Германии. «Евгеника» – это взгляд на то, что мы должны улучшить генетику человеческого рода; часто пропагандируются такие практики, как селективное разведение, принудительная стерилизация «дефектных» и «нежелательных» (людей с генетическими нарушениями или нежелательными характеристиками или чертами характера, людей с ограниченными возможностями, людей других рас, людей других этнических групп, гомосексуалистов) и эвтаназии. таких популяций.Вероятно, она достигла крайней формы в нацистской Германии, где имели место массовые истребления, но евгенические настроения существовали и до того, как в США. Эта практика сейчас в основном рассматривается как морально отвратительная. Критики генной инженерии рассматривают ее как попытку евгеники с помощью технологий.
Генная терапия становится реальностью, когда вы читаете это. До генной инженерии для улучшения все еще далеко. По обоим вопросам наверняка будет много споров.
Что такое генетическая модификация? | Живая наука
Генетическая модификация – это процесс изменения генетической структуры организма.Это делалось косвенно в течение тысяч лет путем контролируемого или селективного разведения растений и животных. Современная биотехнология упростила и ускорила нацеливание на конкретный ген для более точного изменения организма с помощью генной инженерии.
Термины «модифицированный» и «инженерный» часто используются как синонимы в контексте маркировки генетически модифицированных или ГМО пищевых продуктов. В области биотехнологии ГМО означает генетически модифицированный организм, в то время как в пищевой промышленности этот термин относится исключительно к продуктам питания, которые были специально созданы, а не селективно выведены организмы.Это несоответствие приводит к путанице среди потребителей, поэтому Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) предпочитает термин «генетически модифицированный» (GE) для обозначения пищевых продуктов.
Краткая история генетической модификации
Генетическая модификация восходит к древним временам, когда люди влияли на генетику путем избирательного размножения организмов, согласно статье Габриэля Рангеля, ученого в области общественного здравоохранения из Гарвардского университета. При повторении в течение нескольких поколений этот процесс приводит к резким изменениям вида.
Собаки, вероятно, были первыми животными, которые были целенаправленно генетически модифицированы, и начало этой попытки датируется примерно 32000 лет, согласно Рангелу. Дикие волки присоединились к нашим предкам-охотникам-собирателям в Восточной Азии, где псовых приручили и разводили, чтобы они стали более послушными. На протяжении тысяч лет люди разводили собак с разными желаемыми личностными и физическими качествами, что в конечном итоге привело к появлению большого разнообразия собак, которых мы видим сегодня.
Самое раннее известное генетически модифицированное растение – пшеница.Считается, что эта ценная культура возникла на Ближнем Востоке и в Северной Африке в районе, известном как Плодородный полумесяц, согласно статье 2015 года, опубликованной в Журнале традиционной и дополнительной медицины. Примерно с 9000 г. до н.э. древние земледельцы выборочно разводили пшеничные травы. для создания одомашненных сортов с более крупными зернами и более выносливыми семенами. К 8000 г. до н.э. выращивание одомашненной пшеницы распространилось по Европе и Азии. Продолжающаяся селекционная селекция пшеницы привела к появлению тысяч сортов, выращиваемых сегодня.
Кукуруза также пережила одни из самых драматических генетических изменений за последние несколько тысяч лет. Основная культура была получена из растения, известного как теосинте, дикой травы с крошечными колосьями, на которых было всего несколько зерен. Со временем фермеры выборочно разводили травы теозинте, чтобы получить кукурузу с большими початками, покрытыми зернами.
Помимо этих культур, большая часть продуктов, которые мы едим сегодня, в том числе бананы, яблоки и помидоры, прошла несколько поколений селекционной селекции, согласно Рангелу.
Технология, которая специально разрезает и переносит фрагмент рекомбинантной ДНК (рДНК) от одного организма к другому, была разработана в 1973 году Гербертом Бойером и Стэнли Коэном, исследователями из Калифорнийского университета, Сан-Франциско и Стэнфордского университета, соответственно. Пара перенесла фрагмент ДНК от одного штамма бактерий к другому, что обеспечило устойчивость к антибиотикам у модифицированных бактерий. В следующем году два американских молекулярных биолога, Беатрис Минц и Рудольф Яениш, ввели чужеродный генетический материал в эмбрионы мышей в первом эксперименте по генетической модификации животных с использованием методов генной инженерии.
Исследователи также модифицировали бактерии для использования в качестве лекарств. В 1982 году человеческий инсулин был синтезирован из генно-инженерных бактерий E. coli , став первым генно-инженерным лекарством для человека, одобренным FDA, по словам Рангела.
Кукуруза в том виде, в каком мы ее знаем сегодня, была получена из теосинте, дикой травы с небольшими колосьями и всего несколькими зернами. (Изображение предоставлено: Shutterstock)
Генетически модифицированные продукты питания
По данным Университета штата Огайо, существует четыре основных метода генетической модификации сельскохозяйственных культур:
- Селективное разведение: вводятся и выводятся два штамма растений для получения потомства с определенными особенностями.Может быть затронуто от 10 000 до 300 000 генов. Это самый старый метод генетической модификации, который обычно не включается в категорию продуктов с ГМО.
- Мутагенез: Семена растений намеренно подвергаются воздействию химических веществ или радиации с целью мутации организмов. Потомство с желаемыми чертами сохраняется и далее разводится. Мутагенез также обычно не включается в категорию продуктов с ГМО.
- РНК-интерференция: отдельные нежелательные гены в растениях инактивированы, чтобы удалить любые нежелательные признаки.
- Трансгены: Ген взят от одного вида и имплантирован другому, чтобы привнести желаемый признак.
Последние два перечисленных метода считаются типами генной инженерии. По данным FDA, сегодня некоторые культуры прошли генную инженерию для повышения урожайности, устойчивости к повреждениям насекомыми и иммунитета к болезням растений, а также для повышения питательной ценности. На рынке они называются генетически модифицированными или ГМО-культурами.
«ГМО-культуры представляют большие перспективы в решении сельскохозяйственных проблем», – сказала Нитья Джейкоб, культуролог из Оксфордского колледжа Университета Эмори в Джорджии.
Первой генетически модифицированной культурой, одобренной для выращивания в США, был томат Flavr Savr в 1994 году. (Для выращивания в США генетически модифицированные продукты должны быть одобрены Агентством по охране окружающей среды (EPA) и FDA. Новый помидор имел более длительный срок хранения благодаря деактивации гена, который заставляет помидоры становиться мягкими, как только их собирают. По данным Отделения сельского хозяйства и природных ресурсов Калифорнийского университета, помидор также обещал улучшить вкус.
Сегодня хлопок, кукуруза и соя являются наиболее распространенными культурами, выращиваемыми в США. По данным FDA, почти 93% соевых бобов и 88% кукурузы являются генетически модифицированными. По данным Министерства сельского хозяйства США (USDA), многие ГМО-культуры, такие как модифицированный хлопок, обладают устойчивостью к насекомым, что значительно снижает потребность в пестицидах, которые могут загрязнять грунтовые воды и окружающую среду.
В последние годы повсеместное выращивание ГМО-культур вызывает все больше споров.
«Одна из проблем – это воздействие ГМО на окружающую среду», – сказал Джейкоб. «Например, пыльца от ГМО-культур может дрейфовать на поля с культурами без ГМО, а также в популяции сорняков, что может привести к тому, что не-ГМО приобретают характеристики ГМО из-за перекрестного опыления».
Горстка крупных биотехнологических компаний монополизировала индустрию ГМО-культур, сказал Джейкоб, что затрудняет зарабатывать на жизнь отдельным мелким фермерам. Однако, хотя некоторые фермеры могут быть изгнаны из бизнеса, те, кто работает с биотехнологическими компаниями, могут получить экономические выгоды от повышения урожайности сельскохозяйственных культур и снижения затрат на пестициды, заявило министерство сельского хозяйства США.
Маркировка продуктов питания с ГМО важна для большинства людей в США, согласно опросам, проведенным Consumer Reports, The New York Times и The Mellman Group. Люди, решительно выступающие за маркировку ГМО, считают, что потребители должны иметь возможность решать, хотят ли они покупать генетически модифицированные продукты.
Однако, по словам Джейкоба, нет четких научных доказательств того, что ГМО опасны для здоровья человека.
Генетически модифицирующая животных и людей
Сегодня домашний скот часто селективно разводят, чтобы улучшить скорость роста и мышечную массу и повысить сопротивляемость болезням.Например, согласно статье 2010 года, опубликованной в Journal of Anatomy, некоторые линии цыплят, выращиваемых на мясо, сегодня выращивают на 300 процентов быстрее, чем в 1960-х годах. В настоящее время на рынке США нет продуктов животного происхождения, включая курицу или говядину, которые не были созданы с помощью генной инженерии, и, следовательно, ни одна из них не классифицируется как продукты питания ГМО или ГМ.
В течение последних нескольких десятилетий исследователи генетически модифицируют лабораторных животных, чтобы определить, каким образом биотехнология может однажды помочь в лечении болезней человека и восстановлении повреждений тканей у людей, по данным Национального исследовательского института генома человека.Одна из новейших форм этой технологии называется CRISPR (произносится «четче»).
Технология основана на способности бактериальной иммунной системы использовать области CRISPR и ферменты Cas9 для инактивации чужеродной ДНК, проникающей в бактериальную клетку. По словам Гретхен Эдвальдс-Гилберт, доцента биологии в колледже Скриппса в Калифорнии, та же методика позволяет ученым нацеливаться на конкретный ген или группу генов для модификации.
Исследователи используют технологию CRISPR для поиска лекарств от рака, а также для поиска и редактирования отдельных фрагментов ДНК, которые могут привести к будущим заболеваниям у человека.Эдвальдс-Гилберт сказал, что терапия стволовыми клетками может также использовать генную инженерию для регенерации поврежденных тканей, например, в результате инсульта или сердечного приступа.
В весьма спорном исследовании, по крайней мере, один исследователь утверждает, что протестировали технологию CRISPR на человеческих эмбрионах с целью устранения возможности для некоторых заболеваний. Этот ученый подвергся суровой проверке и на некоторое время был помещен под домашний арест в своей родной стране, Китае.
Моральная дилемма
Технология может быть доступна, но должны ли ученые проводить исследования генетических модификаций на людях? «Это зависит от обстоятельств», – сказала Ривка Вайнберг, профессор философии в Scripps College.
«Когда дело доходит до чего-то вроде [новой] технологии, вы должны подумать о ее предназначении и различных способах ее использования», – сказал Вайнберг.
Большинство медицинских испытаний методов лечения с использованием генной инженерии проводится на добровольных пациентах. Однако генная инженерия плода – это совсем другое дело.
«Эксперименты на людях без их согласия по своей сути проблематичны», – сказал Вайнберг. «Существуют не только риски, [но также] риски, которые не обозначены на карте.Мы даже не знаем, чем мы рискуем ».
Если бы технология следующего поколения была доступна и была доказана ее безопасность, возражения против ее тестирования на людях были бы минимальными, сказал Вайнберг. Но это не так.
«Большая проблема всех этих экспериментальных технологий заключается в том, что они экспериментальные, – сказал Вайнберг. – Одна из основных причин, по которой люди были так напуганы китайским ученым, который использовал технологию CRISPR на эмбрионах, заключается в том, что это такая ранняя стадия развития. экспериментирование.Это не генная инженерия. Вы просто экспериментируете с ними ».
Подавляющее большинство сторонников генной инженерии понимают, что технология еще не готова к испытаниям на людях, и заявляют, что этот процесс будет использоваться во благо. Цель генетической модификации , Сказал Джейкоб, «всегда стремился решать проблемы, с которыми в настоящее время сталкивается человеческое общество».
Дополнительная литература:
Следует ли редактировать гены на человеческих эмбрионах? Наука и технологии объявили, что его лаборатория успешно использовала систему редактирования генов Crispr-Cas9 для создания первых в мире генетически отредактированных человеческих младенцев.Сторонние ученые не подтвердили его утверждения, и его домашний университет планирует провести расследование в отношении его академических нарушений. Но если результаты подтвердятся, эксперимент станет важной вехой в науке и поднимет серьезные этические проблемы. В августовском выпуске журнала
National Geographic за август 2016 года мы предложили участникам взвесить этичность внесения изменений в геном человека, которые унаследуют будущие поколения.
Pro: Исследования по редактированию генов у людей должны продолжаться
Джон Харрис
Джон Харрис – почетный профессор научной этики в Манчестерском университете, США.K., и автор How to be Good, Oxford University Press, 2016.
В феврале этого года Управление по оплодотворению человека и эмбриологии Соединенного Королевства одобрило запрос Института Фрэнсиса Крика в Лондоне об изменении человеческого эмбрионы с использованием новой техники редактирования генов CRISPR-Cas9. Это второй раз, когда человеческие эмбрионы использовались в таких исследованиях, и впервые их использование было санкционировано национальным регулирующим органом. Ученые института надеются пролить свет на раннее развитие эмбриона – работу, которая в конечном итоге может привести к более безопасным и успешным методам лечения бесплодия.
Эмбрионы, предоставленные пациентами, подвергающимися экстракорпоральному оплодотворению, не будут развиваться дольше семи дней. Но теоретически – и, в конечном итоге, на практике – CRISPR можно использовать для модификации генов, вызывающих заболевания, у доношенных эмбрионов, удалив ошибочный сценарий и из генетического кода будущих потомков этого человека. Сторонники такого «редактирования зародышевой линии человека» утверждают, что оно потенциально может снизить или даже устранить заболеваемость многими серьезными генетическими заболеваниями, уменьшая человеческие страдания во всем мире.Противники говорят, что изменение человеческих эмбрионов опасно и неестественно и не принимает во внимание согласие будущих поколений. Кто прав?
Начнем с возражения, что модификация эмбриона неестественна или равносильна игре в Бога. Этот аргумент основан на предпосылке, что натуральное по своей сути хорошо. Но болезни естественны, и миллионы людей заболевают и умирают преждевременно – и все это совершенно естественно. Если бы мы защищали естественные существа и природные явления просто потому, что они естественны, мы не смогли бы использовать антибиотики для уничтожения бактерий или иным образом практиковать медицину, или бороться с засухой, голодом или эпидемиями.Системы здравоохранения, поддерживаемые каждой развитой страной, можно точно охарактеризовать как часть того, что я ранее называл «всеобъемлющей попыткой нарушить естественный ход природы». Естественное – ни хорошо, ни плохо. Натуральные вещества или натуральные методы лечения лучше, чем неестественные, только если доказательства подтверждают такой вывод.
Вопрос о согласии был поднят Фрэнсисом Коллинзом, директором Национальных институтов здравоохранения. «Этические проблемы, возникающие при изменении зародышевой линии таким образом, чтобы это влияло на следующее поколение без их согласия», – сказал он, – представляют собой «веские аргументы против участия» в редактировании генов.
В этом нет никакого смысла. У нас буквально нет выбора, кроме как принимать решения за будущих людей, не учитывая их согласия. Все родители делают это постоянно, либо потому, что дети слишком малы, чтобы дать согласие, либо потому, что их еще нет. Джордж Бернард Шоу и Айседора Дункан знали об этом. Когда якобы она сказала ему: «Почему бы нам не завести ребенка вместе… с моей внешностью и твоими мозгами, это не может подвести», она предлагала намеренное решение по определению зародышевой линии в надежде повлиять на их будущего ребенка.Более трезвый ответ Шоу – «Да, но что, если это будет моя внешность и ваши мозги!» – указывает на другой возможный, но с точки зрения ребенка, столь же необязательный результат. По праву, ни Шоу, ни его возможный партнер не считали, что их решение требует согласия рожденного ребенка.
Излишне говорить, что родители и ученые должны ответственно, основываясь на наилучшей доступной комбинации доказательств и аргументов, думать о том, как их решения повлияют на будущие поколения.Однако их решение просто не может включать согласие будущих детей.
Наконец, есть аргумент, что изменение геномов по своей сути опасно, потому что мы не можем знать все способы, которыми это повлияет на человека. Но те, кто опасается рисков редактирования генов, не принимают во внимание опасности, присущие «естественному» способу размножения. Две трети человеческих эмбрионов не развиваются успешно, большинство из них в течение первого месяца беременности. И каждый год 7,9 миллиона детей – 6 процентов от общего числа рождений во всем мире – рождаются с серьезным дефектом генетического или частично генетического происхождения.Действительно, незащищенный секс настолько рискован, что, если бы он был изобретен как репродуктивная технология, а не был обнаружен как часть нашей развитой биологии, весьма сомнительно, что он когда-либо был бы разрешен для использования человеком.
Конечно, нам нужно знать как можно больше о рисках, связанных с редактированием генов человеческих эмбрионов, прежде чем такое исследование будет продолжено. Но когда можно предотвратить страдания и смерть, вызванные такими ужасными моногенными заболеваниями, как кистозный фиброз и болезнь Хантингтона, решение отложить такие исследования не следует принимать легкомысленно.Подобно тому, как отсрочка правосудия – это отказ в правосудии, так же отсроченная терапия – это отказ в терапии. Это отрицание день за днем стоит человеческих жизней.
Con: Не открывайте дверь редактированию генов у будущих людей
Марси Дарновски
Марси Дарновски, доктор философии, является исполнительным директором Центра генетики и общества. Она говорит и пишет о политике биотехнологии человека.
Инструмент редактирования генов, известный как CRISPR, катапультировался в научные лаборатории и стал популярным несколько лет назад.Вскоре за ним последовало возрождение глубокого противоречия: следует ли использовать эти новые методы для конструирования черт будущих детей, которые передадут свои измененные гены всем последующим поколениям?
Это не совсем новый вопрос. Перспектива создания генетически модифицированных людей открыто обсуждалась еще в конце 1990-х, более чем за полтора десятилетия до появления CRISPR и за несколько лет до того, как был полностью нанесен на карту геном человека.
Вскоре мы увидели провокационные заголовки о дизайнерских младенцах. Биолог из Принстона Ли Сильвер, писавший в журнале Time в 1999 году, представил себе клинику по лечению бесплодия в ближайшем будущем, которая предложит «Органическое улучшение» для всех, включая людей, «не имеющих вообще никаких проблем с фертильностью». Он даже написал копию объявления: «Имейте в виду, вы должны действовать, прежде чем забеременеть. Не сожалей после того, как она родится. Это действительно уникальная возможность для вашего будущего ребенка.
Во время того же сдвига тысячелетия политики в десятках стран пришли к совершенно иному выводу о генетических возможностях на горизонте. Они искренне поддерживали генные методы лечения, которые, как надеялись (и все еще надеются) ученые, могут безопасно, эффективно и по доступной цене бороться с широким спектром заболеваний. Но они отвергли модификацию зародышевой линии человека – использование генетически измененных эмбрионов или гамет для рождения ребенка – и примерно в 40 странах приняли законы против этого.
Проблема модификации зародышевой линии человека оставалась на медленном огне в течение первого десятилетия 21 века.Но в апреле 2015 года все закипело, когда исследователи из Университета Сунь Ятсена объявили, что использовали CRISPR для редактирования геномов нежизнеспособных человеческих эмбрионов. Их эксперимент был не очень успешным с технической точки зрения, но привлек внимание всего мира.
В декабре 2015 года разногласия по поводу использования CRISPR для производства детей были ключевым пунктом повестки дня Международного саммита по редактированию генов человека, организованного национальными академиями наук США, Великобритании и Китая.Почти все ораторы согласились с тем, что в настоящее время внесение необратимых изменений в каждую клетку тела будущих детей и всех их потомков будет представлять собой чрезвычайно рискованный эксперимент над людьми. По общему мнению, слишком много неизвестно о таких проблемах, как нецелевые мутации (непреднамеренное редактирование генома), стойкие эффекты редактирования, генетические механизмы эмбрионального и внутриутробного развития, а также долгосрочные последствия для здоровья и безопасности.
Разговоры о внедрении новых инструментов редактирования генов в клиники репродуктивной медицины необходимо начинать с очевидного, но часто упускаемого из виду пункта: по определению, редактирование генов зародышевой линии не будет удовлетворять медицинские потребности какого-либо существующего человека.В лучшем случае сторонники могут сказать, что это может изменить вес генетической лотереи в пользу других результатов для будущих людей – но неизвестные механизмы CRISPR и биологии человека предполагают, что непредвиденные результаты почти неизбежны.
Помимо технических вопросов, существуют глубокие социальные и политические вопросы. Будет ли редактирование генов зародышевой линии оправданным, несмотря на риски, для родителей, которые могут передавать наследственное заболевание? Конечно, в этом нет необходимости. Родители могут иметь детей, не затронутых заболеванием, которое они переносят или переносят, с помощью сторонних яйцеклеток или спермы, что становится все более распространенным способом создания семьи.Некоторые гетеросексуальные пары могут не решаться использовать этот вариант, потому что они хотят ребенка, который не только избавлен от вредного гена в их родословной, но и генетически связан с ними обоими. Они также могут сделать это с помощью метода скрининга эмбрионов, называемого предимплантационной генетической диагностикой (ПГД), широко доступной процедуры, используемой в сочетании с экстракорпоральным оплодотворением.
PGD сама по себе вызывает социальные и этические опасения по поводу того, какие черты следует выбирать или отменять. Эти вопросы особенно важны с точки зрения прав инвалидов (что означает, что они важны для всех нас).Но скрининг эмбрионов на наличие болезней намного безопаснее для полученных в результате детей, чем разработка новых признаков с помощью редактирования генов зародышевой линии. Тем не менее, эта существующая альтернатива часто не упоминается в спорах о редактировании генов для воспроизводства.
Это правда, что некоторые пары – очень небольшое количество – не смогут произвести незатронутые эмбрионы, и поэтому не могут использовать PGD для предотвращения наследования болезни. Должны ли мы разрешить редактирование генов зародышевой линии ради них? Если да, могли бы мы ограничить его использование случаями серьезного риска заболевания?
С точки зрения политики, как мы можем провести различие между медицинской и улучшающей целью модификации зародышевой линии? К какой категории мы отнесем, например, низкий рост? Мы знаем, что более высокие люди, как правило, зарабатывают больше денег.То же самое и с людьми с более бледной кожей. Следует ли считать медицинским вмешательством организацию для детей с «эффективными» в финансовом или социальном отношении ростом и телосложением?
Вспомните гипотетическую клинику по лечению бесплодия, предлагающую «Органическое улучшение» как «уникальную возможность для вашего будущего ребенка». Вспомните фильм 1997 года « Гаттака», «» об обществе, в котором генетически усовершенствованные – просто воспринимались как более совершенные в биологическом отношении – рождаются в физической реальности тех, кого мы теперь можем назвать одним процентом.
 Он действует как пара «молекулярных ножниц», которые могут разрезать две нити ДНК в определенном месте в геноме, так что кусочки ДНК могут быть добавлены или удалены.
Он действует как пара «молекулярных ножниц», которые могут разрезать две нити ДНК в определенном месте в геноме, так что кусочки ДНК могут быть добавлены или удалены.