Рефрактерная цитопения с однолинейной дисплазией (страница 2)
Страница 2 из 7
Рефрактерная цитопения с однолинейной дисплазией (рефрактерная анемия, рефрактерная нейтропения, рефрактерная тромбоцитопения)
Слово «цитопения» на медицинском языке означает снижение гемоглобина, лейкоцитов или тромбоцитов в крови, а «рефрактерная», или устойчивая, означает, что никакими витаминами, препаратами железа, диетой исправить ситуацию нельзя. Слово «однолинейная» говорит о том, что произошло нарушение взросления одного ростка крови.
Рефрактерная цитопения с однолинейной дисплазией (РЦОД) – это один из видов миелодиспластического синдрома, при котором нарушается созревание клеток одного ростка крови. Если неправильно созревают клетки эритроидного (красного) ростка, то снижается количество гемоглобина. Если изменился лейкоцитарный (белый) росток, то уменьшается количество нейтрофилов. Если расстроен процесс в тромбоцитарном ростке, то в крови не хватает тромбоцитов.
РЦОД – болезнь пожилых людей, средний возраст которых 65-70 лет. Рефрактерная тромбоцитопения и рефрактерная нейтропения встречаются чрезвычайно редко. Чаще всего пожилые люди заболевают рефрактерной анемией, которая составляет 10-20% всех случаев миелодиспластического синдрома. О ней речь и пойдет далее. Поставить диагноз рефрактерной анемии непросто, и обычно до того, как такой больной попадает на прием к гематологу, он длительно лечится у терапевта с диагнозами «идиопатическая анемия», «анемия смешанного генеза» и подобными.
Диагноз
Диагноз «рефрактерная анемия» ставят, если у пациента отсутствует другая причина изменения крови и есть типичные изменения в костном мозге. Больного всесторонне обследуют: делают цитологическое, цитогенетическое и гистологическое исследование костного мозга, другие специальные анализы. Рефрактерная анемия – это диагноз исключения, иначе говоря, его ставят тогда, когда все другие причины снижения гемоглобина исключены.
Лечение
Если гемоглобин пациента снижен незначительно, и он чувствует себя в целом нормально, то с лечением можно повременить. Когда гемоглобин становится ниже порогового (а «порог» у каждого человека свой и зависит от того, как больной ощущает низкий гемоглобин), то врач начинает лечение. Сейчас основным методом лечения рефрактерной анемии является регулярное переливание крови. Иногда пациентам с рефрактерной анемией помогает систематический прием препаратов эритропоэтина. Эритропоэтин – это вещество, которое делает более активными здоровые, незатронутые болезнью клетки красного ростка, что позволяет поддерживать гемоглобин на приемлемом уровне и уменьшить потребность в переливании крови. Если болезнь со временем перешла в острый лейкоз (таких пациентов около 2%), то лечение врач проводит по схемам острых лейкозов. Обычно пациенты с рефрактерной анемией, если своевременно переливать кровь, живут годы и чувствуют себя в целом хорошо.
9 факторов ОНМК или как избежать инсульта
Инсульт — это острое нарушение кровообращения мозга (ОНМК), приводящее к повреждению и отмиранию нервных клеток. Инсульт происходит, если кровеносный сосуд в мозге либо блокируется (бляшкой или тромбом), либо разрывается, вследствие чего часть нервных клеток погибает. Организм утрачивает одну из функций, за которую отвечали погибшие клетки. Может наступить паралич, потеря речи и другие серьезные нарушения. Чем больше область омертвения клеток в мозге, тем более серьезные последствия имеет инсульт.
Инсульт происходит, если кровеносный сосуд в мозге либо блокируется (бляшкой или тромбом), либо разрывается, вследствие чего часть нервных клеток погибает. Организм утрачивает одну из функций, за которую отвечали погибшие клетки. Может наступить паралич, потеря речи и другие серьезные нарушения. Чем больше область омертвения клеток в мозге, тем более серьезные последствия имеет инсульт.
Чтобы избежать столь неприятных последствий и самого инсульта необходимо обратить внимание на свое здоровье и образ жизни. Инсульт не приходит здоровому человек, его нужно заработать, пренебрегая здоровым образом жизни, тем самым становясь заложником все новый и новых заболеваний, способствующих приближению ОНМК. Мы расскажем о 9 факторах риска, способных привести к нарушению мозгового кровообращения:
- Гипертония
Это заболевание вызывает ухудшение состояния кровеносных сосудов. Высокое давление негативно влияет на стенки сосудов, уменьшая их гибкость и прочность. Согласно медицинской статистике, 35 – 73% пациентов с инсультом, также страдают и от гипертонии.
- Диабет
Это вторая по значимости причина возникновения ОНМК, так почти всегда сахарный диабет сопровождает гипертония. - Ожирение
Люди с избыточным весом автоматически попадают в группу риска по таким заболеваниям, как сахарный диабет и артериальная гипертония. - Высокий уровень холестерина
Избыточный холестерин оседает на стенках наших кровеносных сосудов, что может привести к их сужению или закупорке. Если блокада кровеносных сосудов произойдет вблизи области головного мозга, это может привести прекращению притока крови к мозгу, что и вызовет инсульт. - Курение и алкоголь
Эти вредные привычки и привязанности также влияют на состояние сосудов. Стенки сосудов курильщиков более хрупкие, чем у не курящих. - Высокий уровень гемоглобина
Если уровень гемоглобина выше нормы, то существует высокая вероятность ОНМК. - Заболевания сердца
Застойная сердечная недостаточность или клапанные пороки сердца. Необходимо стоять на учете у кардиолога для наблюдения этих заболеваний.
Необходимо стоять на учете у кардиолога для наблюдения этих заболеваний. - >Медикаменты
Необходимо рассказать лечащему врачу про все хронические заболевания при назначении медикаментозного лечения. К примеру, противозачаточные таблетки не подходят для больных гипертонией. - Возраст
Около 80% инсультов возникает у людей старше 65 лет, при этом возраст оказывает большое влияние на исходы инсульта. Увеличение вероятности развития инсульта у пожилых людей обусловлено возрастными изменениями мозга.
Постарайтесь избежать или свести перечисленные факторы в вашей жизни к минимуму, и вы сохраните здоровье на долгие годы.
Для получения дополнительной информации, пожалуйста, свяжитесь с отделением Неврологии или позвоните по телефону Колл-центра -1719.
Тотальное эндопротезирование тазобедренного сустава пациентке 89 лет. Оперировал хирург-ортопед Николаев А.В.
Рассказывает врач ортопед-травматолог Клинического госпиталя на Яузе Николаев Антон Валерьевич.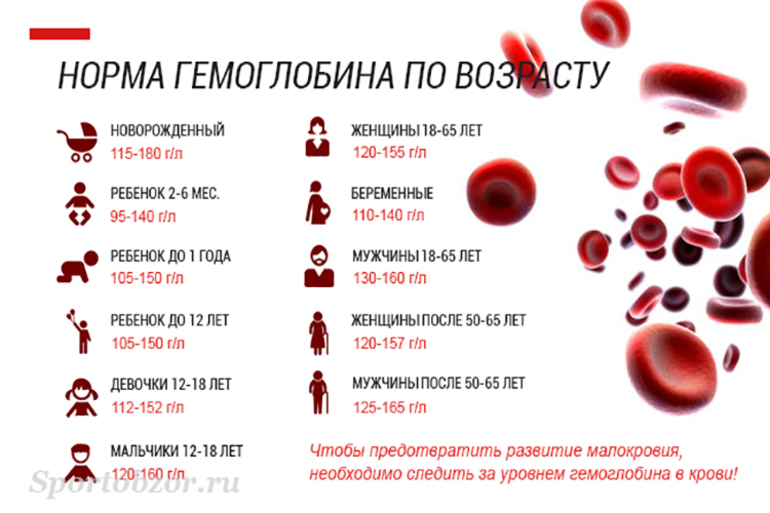
О переломах шейки бедра у пожилых пациентов
Переломы «верхнего», или правильнее называть, проксимального отдела бедренной кости – самая распространенная травма пожилых людей и одна из наиболее распространенных причин их гибели при несвоевременном оказании им специализированной травматологической помощи.
Такая травма на фоне остеопороза (или слабой) кости возникает в результате так называемой «низкоэнергетической травмы», например, падения пациента с высоты собственного роста. Это приводит к утрате прежней степени мобильности, боли в области перелома, необходимости постельного режима (в случае без операции) и, как следствие, усугублению и присоединению других тяжелых заболеваний: в первую очередь – застойной пневмонии и пролежней.
Клинический случай
Недавно в наш стационар поступила женщина 89 лет, 2 месяца назад получившая такой перелом на правой нижней конечности, по поводу чего она была прооперирована в одной из клиник Москвы бедренным штифтом.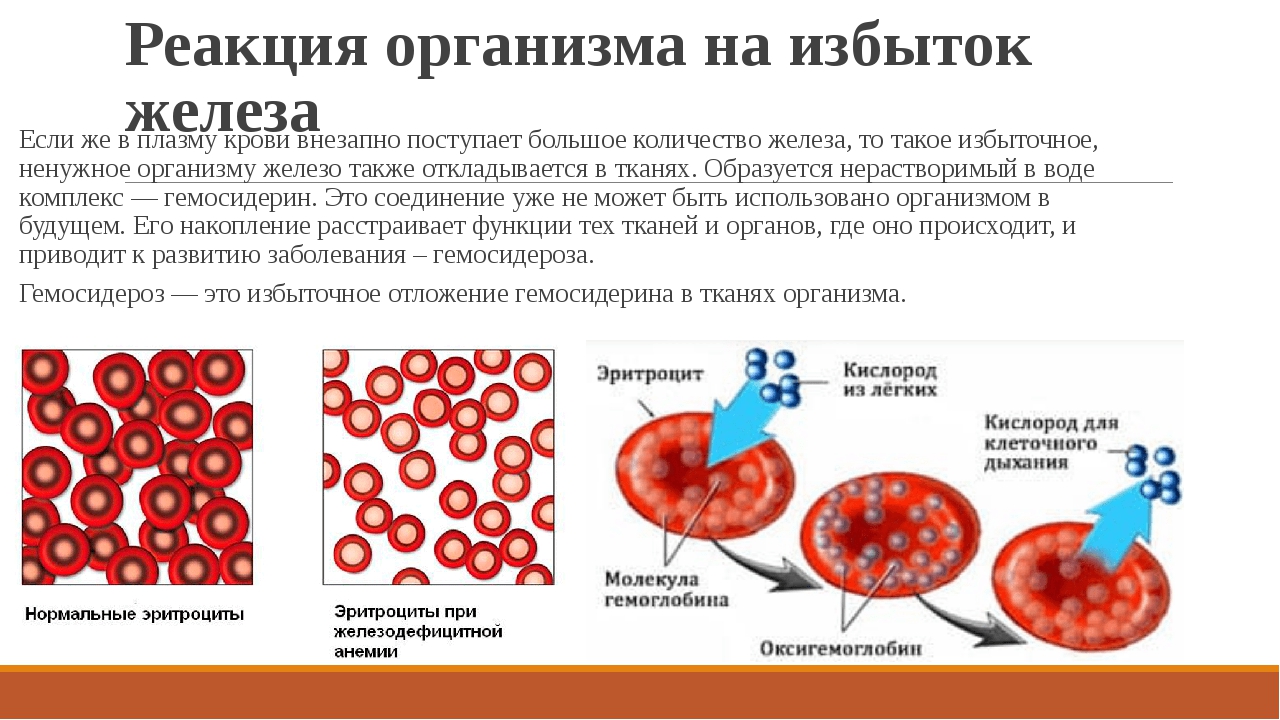 Операция прошла с хорошим рентгенологическим результатом, но пациентка все еще не стала в должной мере активна и проходила реабилитацию.
Операция прошла с хорошим рентгенологическим результатом, но пациентка все еще не стала в должной мере активна и проходила реабилитацию.
Взрослые пациенты часто имеют тяжелые сопутствующие заболевания, такие как хроническая ишемия головного мозга, которая может вызывать головокружение и другие симптомы. Так произошло с нашей пациенткой – на фоне головокружения она упала. Результат падения был безрадостен – у пожилой женщины произошел перелом второго бедра. И именно с такой ситуации началось наше взаимодействие с этой пациенткой в Клиническом Госпитале на Яузе.
Мы понимали, что операцию нужно проводить в ближайшие сроки после травмы, и единственным способом минимизировать послеоперационные риски было придать пациентке активность (возможность вставать и ходить). Но оба этих вопроса требовали промежуточных действий. Во-первых, незамедлительная операция откладывалась из-за низкого уровня гемоглобина, продолжительного времени кровотечения, инфекции мочевыводящих путей, ну и, конечно, общей слабости нашей 89-летней пациентки, которую совсем недавно уже оперировали на другом бедре.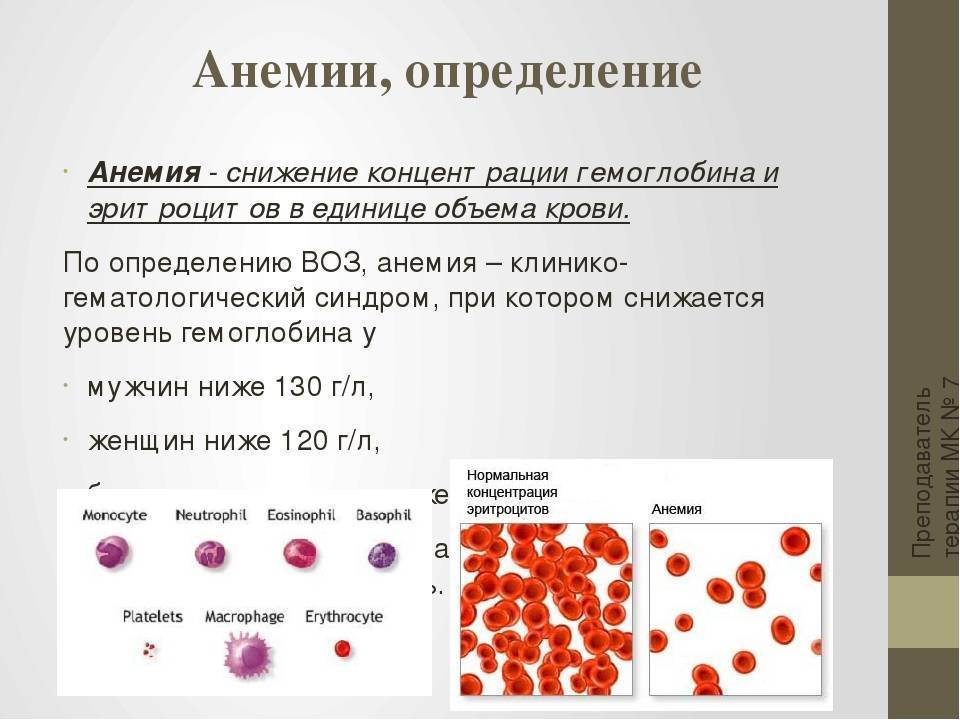
Во-вторых, оперированная стандартной техникой (с установкой штифта) левая конечность не стала бы сразу опорной, а при наличии еще существующих проблем с правой конечностью не позволила бы пациентке быстро начать ходить.
С первым вопросом профессионально разобрались наши великолепные анестезиологи, под руководством зав. отделением Антоненко Д.В. – пациентку «вернули к жизни», перелив кровь, назначив антибиотикотерапию, отрегулировали параметры свертывающей системы крови, восполнили объем циркулирующей крови.
Операция
Второй вопрос, в нашем понимании, требовал несколько нестандартного подхода. Было принято решение провести операцию тотального эндопротезирования левого тазобедренного сустава с использованием специальных компонентов эндопротеза, заместивших собой утраченные опорные части бедренной кости и вертлужной впадины (тазовых костей).
Операция была проведена под эпидуральной анестезией травматологом-ортопедом Николаевым Антоном Валерьевичем. Продолжительность операции составила 1 час 40 минут.
Продолжительность операции составила 1 час 40 минут.
Особенность операции заключалась в сложности перелома, возрастной хрупкости костей и отягощённом анамнезе пациентки (серьёзных сопутствующих заболеваниях, а также недавно перенесенной операции остеосинтеза на второй бедренной кости).
На снимке – 1. Оскольчатый перелом проксимального отдела левой бедренной кости (базальной шейки, большого и малого вертела).
2. Состояние после операции тотального эндопротезирования левого тазобедренного сустава, проведенной врачом травматологом-ортопедом Николаевым А.В.
После операции
На вторые сутки после операции наша пациентка оправдала все ожидания – могла сама садиться, вставать и ходить при помощи ходунков. Через несколько дней она была выписана в реабилитационный стационар, где с ней занимаются специалисты – реабилитологи.
Надо отметить, что наша клиника на фоне пандемии коронавируса сохраняет высокие стандарты безопасности и продолжает оказывать помощь «безковидным» пациентам в прежнем объеме.
записаться к врачу
О ЧЕМ РАССКАЖЕТ КАПЛЯ КРОВИ
Эритроциты похожи на сплюснутые с боков диски.
При некоторых заболеваниях крови эритроциты приобретают серповидную форму.
Тромбоциты – мелкие клеточные элементы, обеспечивающие способность крови к свертыванию.
Лейкоциты имеют много разных форм, но отличить их внешне нелегко. Так выглядят под микроскопом лабораторные мазки, содержащие некоторые виды лейкоцитов.
Палочкоядерный нейтрофил.
Сегментоядерный нейтрофил
Вид и относительный размер основных клеточных элементов крови. Самые мелкие – тромбоциты , диаметром примерно 3 мкм. Эритроциты имеют диаметр около 7 мкм. Размер лейкоцитов зависит от их вида и составляет от 8 до 20 мкм. Самые крупные клетки (до 50 мкм) –
Если пробирку с кровью поместить в центрифугу, содержимое расслоится. Эритроциты занимают нижнюю часть пробирки, затем идет тонкая прослойка лейкоцитов. Жидкая часть крови, плазма, скапливается в верхней части и занимает около 55% объема. В плазме раствор
Жидкая часть крови, плазма, скапливается в верхней части и занимает около 55% объема. В плазме раствор
‹
›
Анализ крови – один из наиболее распространенных методов медицинской диагностики. Всего лишь несколько капель крови позволяют получить важную информацию о состоянии организма.
Кровь – вид соединительной ткани, или, образно говоря, “жидкая ткань”. Она составляет около 7 процентов от массы тела. У взрослого мужчины объем крови равен приблизительно 5,9 литра, у женщины – 3,9 литра. Жидкая часть крови называется плазмой, а в ней во взвешенном состоянии находятся клеточные элементы – эритроциты, лейкоциты и тромбоциты.
*
Красный цвет крови обусловлен эритроцитами. Триста лет назад эритроциты назвали “красными кровяными шариками”. Впервые их обнаружили в крови лягушки. В 1673 году голландский естествоиспытатель А. Левенгук увидел такие же шарики в крови человека. Двести лет люди пребывали в полнейшем неведении о назначении этих клеток. И лишь во второй половине XIX века исследования ученых, в том числе и русского физиолога И. М. Сеченова, помогли выяснить, зачем же эти “шарики” нужны. Здесь следует уточнить, что у человека и других млекопитающих эритроциты похожи вовсе не на шарики: они имеют форму двояковогнутых, то есть приплюснутых посредине, круглых дисков. Исключение – верблюд и олень, у них эритроциты овальные.
И лишь во второй половине XIX века исследования ученых, в том числе и русского физиолога И. М. Сеченова, помогли выяснить, зачем же эти “шарики” нужны. Здесь следует уточнить, что у человека и других млекопитающих эритроциты похожи вовсе не на шарики: они имеют форму двояковогнутых, то есть приплюснутых посредине, круглых дисков. Исключение – верблюд и олень, у них эритроциты овальные.
Главная задача эритроцитов – снабжение тканей кислородом и перенос углекислого газа обратно от тканей к легким. В крошечной капельке крови объемом в 1 кубический миллиметр содержится около 4 млн эритроцитов. В бланке для анализа крови указаны границы нормы в расчете на 1 литр: 4-5×1012 эритроцитов – для мужчин и 3,9-4,7×1012 – для женщин. Интересно, что у новорожденных содержание эритроцитов в первую неделю жизни гораздо выше, до 7,5×1012 на 1 литр. Это объясняется большой интенсивностью обменных процессов, возникающих сразу после рождения (малыши в это время по интенсивности физиологического обмена похожи на низкоорганизованных млекопитающих). Но пройдет всего месяц, и содержание эритроцитов в крови младенцев снизится до уровня взрослого. Обратная картина наблюдает ся у людей пожилого возраста. Обменные процессы замедляются, возникает возрастной остеосклероз: красный костный мозг – производитель эритроцитов – местами заменяется на желтый (жировой), и количество эритроцитов уменьшается. Поэтому у пожилых людей в норме может содержаться приблизительно 3,8×1012 эритроцитов на 1 литр крови.
Но пройдет всего месяц, и содержание эритроцитов в крови младенцев снизится до уровня взрослого. Обратная картина наблюдает ся у людей пожилого возраста. Обменные процессы замедляются, возникает возрастной остеосклероз: красный костный мозг – производитель эритроцитов – местами заменяется на желтый (жировой), и количество эритроцитов уменьшается. Поэтому у пожилых людей в норме может содержаться приблизительно 3,8×1012 эритроцитов на 1 литр крови.
Главный химический компонент эритроцита – дыхательный пигмент гемоглобин. Он, собственно, и осуществляет перенос кислорода из легких к тканям и, наоборот, углекислоты от тканей к легким. Для того чтобы хорошо себя чувствовать, мужчинам необходимо 130-160 г/л гемоглобина, а женщинам – 120-140 г/л. У новорожденных нормальное значение гемоглобина 110-145 г/л.
Падение концентрации эритроцитов и гемоглобина ниже нормы называется анемией или малокровием. Первые симптомы анемии: слабость, быстрая утомляемость, одышка, сердцебиение, бледность.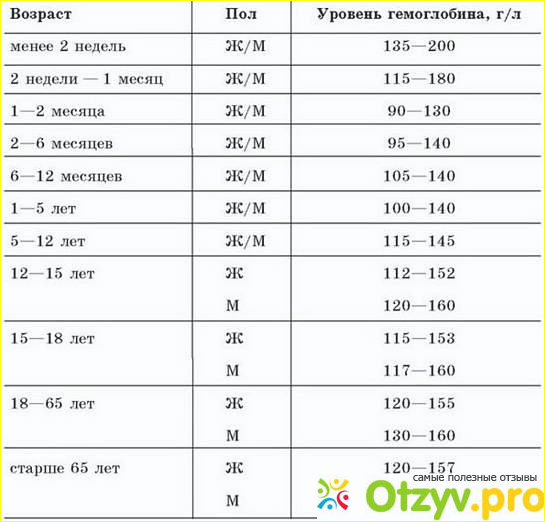 Причины возникновения анемии могут быть разными. Это и потеря крови, и недостаток железа или дефицит витамина B12 в организме. Сейчас эти виды анемий часто встречаются у детей и пожилых людей. Справиться с начинающейся железодефицитной анемией помогут отварная фасоль, чернослив и обыкновенная гречневая каша. Много витамина B12 содержится в печени крупного рогатого скота и свиней. Привычные анемии наблюдаются у жителей высокогорных районов и курильщиков. Число эритроцитов уменьшается при ревматоидных артритах, а также при голодании и употреблении вегетарианской пищи. Поэтому прежде, чем принять решение о переходе к “более здоровому образу жизни”, посоветуйтесь с врачом. Катастрофическое снижение количества эритроцитов (до 1?1012 на 1 л) возникает при лейкозах и метастазах злокачественных опухолей. Увеличение гемоглобина и числа эритроцитов наблюдается у людей с врожденным пороком сердца и хроническим обструктивным бронхитом. Такие больные нуждаются в постоянном диспансерном наблюдении.
Причины возникновения анемии могут быть разными. Это и потеря крови, и недостаток железа или дефицит витамина B12 в организме. Сейчас эти виды анемий часто встречаются у детей и пожилых людей. Справиться с начинающейся железодефицитной анемией помогут отварная фасоль, чернослив и обыкновенная гречневая каша. Много витамина B12 содержится в печени крупного рогатого скота и свиней. Привычные анемии наблюдаются у жителей высокогорных районов и курильщиков. Число эритроцитов уменьшается при ревматоидных артритах, а также при голодании и употреблении вегетарианской пищи. Поэтому прежде, чем принять решение о переходе к “более здоровому образу жизни”, посоветуйтесь с врачом. Катастрофическое снижение количества эритроцитов (до 1?1012 на 1 л) возникает при лейкозах и метастазах злокачественных опухолей. Увеличение гемоглобина и числа эритроцитов наблюдается у людей с врожденным пороком сердца и хроническим обструктивным бронхитом. Такие больные нуждаются в постоянном диспансерном наблюдении.
В норме кровь постоянно обновляется. Молодые эритроциты называют ретикулоцитами. Нормальная доля ретикулоцитов в общем количестве эритроцитов составляет 2-10 промилле (1 промилле равно 0,1%). Доля ретикулоцитов отражает регенеративные способности костного мозга; ее повышение свидетельствует о наличии анемий в кризисной форме, наблюдается на фоне лечения витамином B12, при сильных кровопотерях и в других случаях, когда организм пытается восстановить недостачу эритроцитов в крови. Снижение количества ретикулоцитов отмечается при анемиях с неблагоприятным прогнозом, при снижении восстанавливающей способности крови.
*
Биография тромбоцитов насчитывает не более 150 лет. В 1880-х годах их подробно описал итальянский ученый Биццоцеро (раньше их даже называли бляшки Биццоцеро). В микроскоп тромбоциты выглядят как овальные или округлые гладкие тельца. Они способны к агрегации, то есть слипанию, и благодаря адсорбции удерживают на своей поверхности факторы свертывания крови./GettyImages-157144599-56a0a9365f9b58eba4b28b39.jpg) Эти два свойства обуславливают активное участие тромбоцитов в процессе свертывания крови. В 1 литре нормальной крови насчитывается 180-320 млрд тромбоцитов. Величина эта весьма непостоянна и зависит от тонуса сосудов, состава пищи, фазы менструального цикла у женщин. У спортсменов и людей, занятых тяжелым физическим трудом, наблюдается тромбоцитоз, то есть увеличение количества тромбоцитов. Организм отвечает тромбоцитозом на ожоги и кровопотери, на введение адреналина и травмы мышц. Сильное увеличение числа тромбоцитов может свидетельствовать о наличии опухолевых заболеваний. Нехватка тромбоцитов в крови может быть вызвана ответной реакцией организма на введение лекарственных препаратов (например, гистаминов). Надо отметить, что применение сильнодействующих лекарств вызывает побочные действия, поэтому, проводя курсовое лечение, необходимо контролировать состояние организма в первую очередь по показателям крови. Обычно низкий уровень тромбоцитов свидетельствует об иммунных заболеваниях.
Эти два свойства обуславливают активное участие тромбоцитов в процессе свертывания крови. В 1 литре нормальной крови насчитывается 180-320 млрд тромбоцитов. Величина эта весьма непостоянна и зависит от тонуса сосудов, состава пищи, фазы менструального цикла у женщин. У спортсменов и людей, занятых тяжелым физическим трудом, наблюдается тромбоцитоз, то есть увеличение количества тромбоцитов. Организм отвечает тромбоцитозом на ожоги и кровопотери, на введение адреналина и травмы мышц. Сильное увеличение числа тромбоцитов может свидетельствовать о наличии опухолевых заболеваний. Нехватка тромбоцитов в крови может быть вызвана ответной реакцией организма на введение лекарственных препаратов (например, гистаминов). Надо отметить, что применение сильнодействующих лекарств вызывает побочные действия, поэтому, проводя курсовое лечение, необходимо контролировать состояние организма в первую очередь по показателям крови. Обычно низкий уровень тромбоцитов свидетельствует об иммунных заболеваниях. Первичный симптом – болезненные синяки, особенно у детей. У малышей синяки и ссадины появляются часто, но прежде, чем ругать ребенка, все же спросите, отчего возник кровоподтек, и, если видимой причины нет, немедленно покажите ребенка врачу. Кроме синяков могут возникнуть и необоснованные носовые и другие кровотечения. Если в клиническом анализе крови при нехватке тромбоцитов еще и снижены показатели по эритроцитам, вероятнее всего, врач констатирует анемию, связанную с недостатком витамина B12.
Первичный симптом – болезненные синяки, особенно у детей. У малышей синяки и ссадины появляются часто, но прежде, чем ругать ребенка, все же спросите, отчего возник кровоподтек, и, если видимой причины нет, немедленно покажите ребенка врачу. Кроме синяков могут возникнуть и необоснованные носовые и другие кровотечения. Если в клиническом анализе крови при нехватке тромбоцитов еще и снижены показатели по эритроцитам, вероятнее всего, врач констатирует анемию, связанную с недостатком витамина B12.
*
Представление о лейкоцитах сформировалось приблизительно 100 лет назад,
одновременно с развитием учения о крови и кроветворении. Эти удивительные “клетки-киллеры”
способны самостоятельно передвигаться в токе крови с помощью псевдоножек. Они
приближаются к скоплению болезнетворных микробов, захватывают и переваривают
их. Открыл такие возможности лейкоцитов великий русский физиолог И. И. Мечников.
Его исследования легли в основу развития иммунологии. Главная функция лейкоцитов
Главная функция лейкоцитов
– защитная. Они обеспечивают невосприимчивость организма к различным факторам
(клеткам, веществам), которые несут чужеродную генетическую информацию. Но высокая
активность лейкоцитов может нанести и вред. Например, на пересаженные органы
лейкоциты реагируют так же, как на болезнетворные микроорганизмы, – попросту
разрушают их. И здесь врачам приходится искусственно подавлять лейкоцитарную
активность.
В норме кровь содержит 4,0-9,0 млрд лейкоцитов в расчете на 1 литр. Из них нейтрофилов палочкоядерных – 1-6%, сегментоядерных – 47-72%, эозинофилов – 0,5-5%, базофилов – 0,5-1%, лимфоцитов – 19-37%, моноцитов – 3-11%. Все перечисленные “непонятные” термины обозначают лейкоциты разных типов и их долю в общем количестве лейкоцитов. Увеличение содержания лейкоцитов говорит о наличии в организме воспалительного процесса или инфекции (например, пневмонии или стоматита). Количество нейтрофилов может возрастать при эмоциональной и физической нагрузке, переходе из горизонтального положения тела в вертикальное (особенно после длительного сна), при обильной белковой пище, во второй половине беременности. Такое повышение физиологически нормально и обычно быстро проходит. В других случаях увеличение числа нейтрофилов говорит о развитии острой инфекции или гнойного заболевания.
Такое повышение физиологически нормально и обычно быстро проходит. В других случаях увеличение числа нейтрофилов говорит о развитии острой инфекции или гнойного заболевания.
Весна радует всех, кроме аллергиков. Часто в это время у них начинается сенная лихорадка, течет из носа. Реакция организма проявляется и в повышении содержания эозинофилов в крови. Число эозинофилов увеличивается при бронхиальной астме, кожной и лекарственной аллергии.
Ежегодно, борясь с очередной эпидемией гриппа, врачи отмечают в анализах крови больных частичный лимфоцитоз, то есть возрастание числа лимфоцитов. Такой же признак характерен для заболеваний эндокринной системы (диабет, базедова болезнь). Сильный лимфоцитоз наблюдается при краснухе, коклюше, ветряной оспе. Уменьшение общего числа лимфоцитов, или лейкопения, – очень неприятный клинический фактор. Этот грозный синдром свидетельствует об общем снижении защитных свойств организма. Тяжелая лейкопения возникает при лучевой болезни (например, она наблюдалась у всех чернобыльцев), а также при тяжелых вирусных и бактериальных заболеваниях с неблагоприятным прогнозом. Исследование количества лейкоцитов в динамике помогает оценить течение патологического процесса, спрогнозировать возможности осложнений и исход заболевания, выбрать наиболее подходящее лечение.
Исследование количества лейкоцитов в динамике помогает оценить течение патологического процесса, спрогнозировать возможности осложнений и исход заболевания, выбрать наиболее подходящее лечение.
*
И, наконец – скорость, или реакция, оседания эритроцитов (СОЭ). Норма для мужчин – 2-10 мм/ч, для женщин – 2-15 мм/ч. Не вдаваясь в подробности этого физиологического процесса, отмечу, что увеличение СОЭ связано с наличием острых воспалительных процессов, с инфарктом миокарда. Уже знакомые нам формы малокровия тоже сопровождаются повышением СОЭ на фоне снижения числа эритроцитов (железодефицитная анемия). Сильно увеличивается СОЭ при раковых заболеваниях. Уменьшение значения СОЭ наблюдается у больных с повышенным количеством эритроцитов, а также при активном гепатите и циррозе печени. СОЭ – показатель, который нормализуется медленнее, чем другие. Поэтому не расстраивайтесь, если после болезни в вашем анализе крови все показатели уже в норме, а СОЭ чуть увеличена.
*
Клинический анализ периферической крови иногда дает возможность сразу определить направление дальнейшего диагностического поиска и поставить предварительный диагноз. В амбулаторных условиях часто ограничиваются определением лейкоцитов, гемоглобина и СОЭ, но это не дает полной картины состояния крови, поэтому пациент вправе потребовать провести полное клиническое исследование в соответствии с бланком анализа.
Не только врачам-лаборантам, но и самим пациентам полезно знать некоторые правила взятия крови на анализ. Морфология крови подвержена суточным колебаниям, поэтому исследования лучше проводить в одно и то же время, обычно утром натощак или через 1 час после легкого завтрака. Не рекомендуется брать кровь после физической или умственной нагрузки, приема лекарств, рентгеновских или ядерно-магнитных исследований, физиотерапевтических процедур. Естественно, в экстренных случаях этими условиями можно пренебречь. Как правило, для исследования берут капиллярную кровь из мякоти концевых фаланг пальцев рук, иногда – мочки уха, а у грудных детей – из подошвенной поверхности пятки или большого пальца ноги. Необходимое условие забора крови – одноразовый инструмент. Стерильная одноразовая игла должна быть вынута из герметичной упаковки непосредственно перед взятием крови. Одноразовые иглы для клинического анализа крови появились в российской медицинской практике не так давно. До сих пор не во всех медицинских учреждениях используют одноразовый инструментарий. А ведь, по статистике , до 30% заболеваний вирусным гепатитом возникает из-за заражения в медицинских учреждениях. Право больного – потребовать одноразовый медицинский инструмент. Если же в лечебном учреждении такового нет, лучше приобрести все необходимое самостоятельно в аптеке.
Необходимое условие забора крови – одноразовый инструмент. Стерильная одноразовая игла должна быть вынута из герметичной упаковки непосредственно перед взятием крови. Одноразовые иглы для клинического анализа крови появились в российской медицинской практике не так давно. До сих пор не во всех медицинских учреждениях используют одноразовый инструментарий. А ведь, по статистике , до 30% заболеваний вирусным гепатитом возникает из-за заражения в медицинских учреждениях. Право больного – потребовать одноразовый медицинский инструмент. Если же в лечебном учреждении такового нет, лучше приобрести все необходимое самостоятельно в аптеке.
Нельзя брать кровь рядом с воспаленными или поврежденными участками кожи. Место предполагаемого прокола должно быть теплым. Перед процедурой кончик пальца можно опустить в теплую воду или слегка помассировать. При взятии крови из холодного пальца может быть получен неверный результат. Кожу в предполагаемом месте прокола обрабатывают 70%-ным этиловым спиртом или антисептическим раствором, дают высохнуть, после чего осуществляют манипуляцию.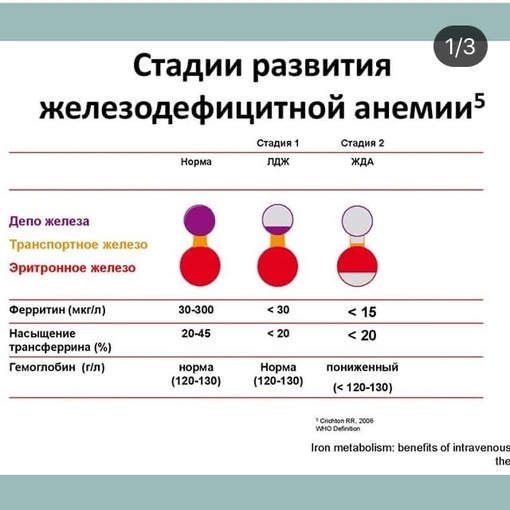 Первая капля крови снимается ватным тампоном. Сильно давить на фалангу не следует, достаточно легкого нажима стерильным тампоном. После окончания процедуры место прокола протирают спиртом или раствором. Ватный тампон надо подержать несколько минут до полной остановки выделения крови.
Первая капля крови снимается ватным тампоном. Сильно давить на фалангу не следует, достаточно легкого нажима стерильным тампоном. После окончания процедуры место прокола протирают спиртом или раствором. Ватный тампон надо подержать несколько минут до полной остановки выделения крови.
Анемия у пожилых людей, связанная со снижением
25 июля 2003 г. – Пожилые люди с анемией в два раза чаще испытывают физические ухудшения, которые могут в конечном итоге лишить их независимости, согласно новому исследованию, поддержанному Национальным институтом старения.
Исследователя университета пущи бодрствования сообщают for the first time что малокровие будет главным фактором риска для возрастной потери физической функции. Ведущий исследователь Бренда Пеннинкс, доктор философии, говорит WebMD, что результаты должны помочь привлечь внимание к состоянию, которое недостаточно диагностируется и не лечится у пожилых людей.
«Хотя в этом исследовании мы не рассматривали лечение, есть надежда, что, исправив анемию, мы сможем предотвратить некоторые наблюдаемые нами физические ухудшения», — говорит она. «Это может удержать пожилых людей от посещения домов престарелых и больниц».
«Это может удержать пожилых людей от посещения домов престарелых и больниц».
Слабость, раздражительность
Примерно 13% людей старше 70 лет страдают анемией, что означает, что их способность переносить кислород в крови нарушена. В результате люди с анемией часто чувствуют слабость, усталость, головокружение или раздражительность. Если его не лечить, это может заставить сердце работать с большей нагрузкой, что приведет к более серьезным последствиям.
У пожилых людей анемия часто может быть вызвана основным заболеванием, таким как рак или почечная недостаточность, или лечением этих заболеваний. Плохое питание является менее распространенной причиной среди пожилых людей, и примерно в 30% случаев причину установить не удается.
Пеннинкс и его коллеги наблюдали за группой из 1146 человек в возрасте старше 70 лет в течение примерно четырех лет, в течение которых они оценивали физические способности, такие как устойчивость в положении стоя, ходьба и способность вставать со стула. К концу исследования у двух третей участников наблюдалось некоторое снижение, а у 30% — существенное снижение.
К концу исследования у двух третей участников наблюдалось некоторое снижение, а у 30% — существенное снижение.
Исследователи также обнаружили, что пожилые люди с анемией были связаны с 150% увеличением риска госпитализации и 200% увеличением риска помещения в дом престарелых.
Было обнаружено, что у людей с пограничной анемией риск в 1,5 раза выше, чем у людей без анемии. Результаты опубликованы в августовском номере The American Journal of Medicine.
«Это исследование предполагает, что даже легкая анемия является фактором риска, связанным с уменьшением способности пожилых людей функционировать в полной мере», — говорит эпидемиолог Джек Гуральник Национального института старения, доктор медицины, доктор философии, в сообщении для печати. «Дальнейшие исследования покажут нам, может ли лечение анемии предотвратить прогрессирующее снижение функции, которое в конечном итоге приводит к инвалидности».
Снадобья, доступные для лечения анемии
Американский представитель общества гериатрии Чарльз Чефалу, доктор медицинских наук, MS, сообщает WebMD, что диагностика анемии среди пожилых пациентов не была приоритетом в прошлом, потому что не было эффективных методов лечения этого состояния. Однако ситуация изменилась с появлением эпоэтина альфа, первого препарата, одобренного для лечения анемии.
Однако ситуация изменилась с появлением эпоэтина альфа, первого препарата, одобренного для лечения анемии.
Инъекционный препарат продается под торговыми марками Epogen и Procrit. Он одобрен специально для лечения анемии, связанной с лечением почечной недостаточности, ВИЧ и рака.
«Я думаю, что анемия среди пожилых людей будет привлекать больше внимания из-за исследований, подобных этому, и потому, что теперь мы можем что-то с этим сделать», — говорит Чефалу. «Нам нужны исследования, чтобы определить, что эти новые методы лечения эффективны для больших групп пациентов с анемией.
Анемия у пожилых | Консультант360
Введение
Анемия у пожилых людей является обычным явлением и часто ошибочно приписывается разрушительным последствиям нормального старения. Уровни гемоглобина не должны изменяться в зависимости от возраста у пожилых пациентов, у которых нет заболеваний, костный мозг не подвергается стрессу. Не всегда ясно, является ли анемия маркером или медиатором заболевания, но даже у долгожителей она обычно является сигналом патологии и связана с повышенной заболеваемостью и смертностью. 1,2 Простая оценка позволит выявить большинство причин и облегчить соответствующее лечение.
Не всегда ясно, является ли анемия маркером или медиатором заболевания, но даже у долгожителей она обычно является сигналом патологии и связана с повышенной заболеваемостью и смертностью. 1,2 Простая оценка позволит выявить большинство причин и облегчить соответствующее лечение.
Эпидемиология
Всемирная организация здравоохранения (ВОЗ) определила нижний предел нормального гемоглобина как 13 г/дл у мужчин и 12 г/дл у женщин. В то время как критерии ВОЗ были основаны на небольшой группе более молодых пациентов, анемия, согласно критериям ВОЗ, связана с повышенным риском смертности у людей старше 85 лет, что указывает на то, что пороговые значения по-прежнему подходят даже для очень пожилых людей. 3,4
Распространенность анемии увеличивается с возрастом. В возрасте до 75 лет анемия чаще встречается у женщин, а в возрасте старше 75 лет — у мужчин. 5 Анемия резко возрастает после 85 лет у представителей обоих полов, в некоторых исследованиях она встречается у 17% женщин и 28% мужчин. 6
6
Распространенность анемии зависит не только от возраста, но и от общего состояния здоровья пациентов. Самые высокие показатели наблюдаются в больницах и домах престарелых, а самые низкие – у пациентов, которые живут дома или в независимых жилых помещениях. 7
Кроветворение и цитокины у пожилых людей
Подобно тому, как другие стареющие системы органов испытывают снижение функционального резерва органов, система кроветворения теряет способность реагировать на стресс. В то время как гемоглобин, количество лейкоцитов и тромбоцитов в обычных условиях являются нормальными, пожилым пациентам может потребоваться больше времени, чтобы восстановиться после эпизода кровотечения, или количество лейкоцитов может не демонстрировать оживленный лейкоцитоз на фоне сепсиса.
Возможны несколько причин. Нормальный гемопоэз требует скоординированного взаимодействия стволовых клеток, модулирующих цитокинов и интактного гемопоэтического микроокружения.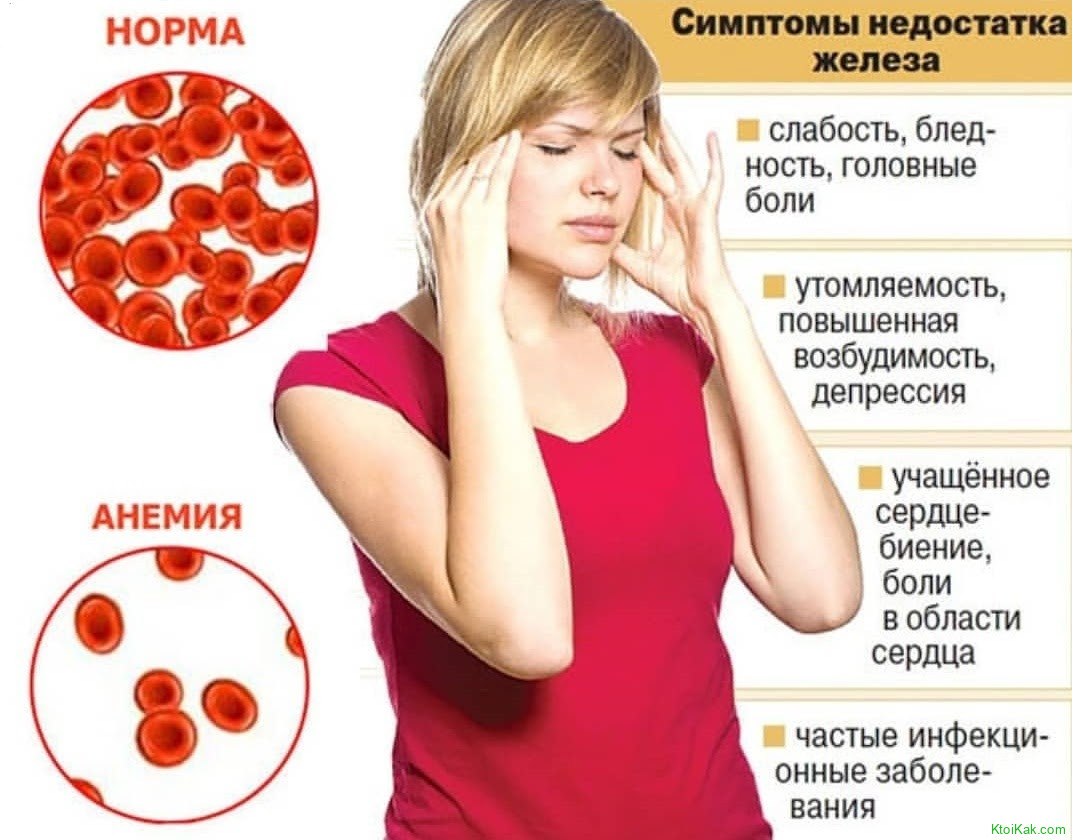 Нарушение любой из этих трех переменных может вызвать отклонения в показателях крови. У пожилых людей может наблюдаться общее снижение концентрации стволовых клеток, продукции гемопоэтических факторов роста и чувствительности к гемопоэтическим цитокинам. 8 Провоспалительные цитокины, такие как интерлейкин (ИЛ)-1, фактор некроза опухоли-альфа и ИЛ-6, регулируют воспалительный процесс при инфекции, травме и стрессе.Повышенные уровни каждого из этих цитокинов связаны с рядом заболеваний, часто встречающихся у пожилых людей, включая атеросклероз, сахарный диабет и рак. Регуляция этих цитокинов снижается с возрастом. В одном популяционном исследовании случай-контроль взрослых в возрасте 74 лет и старше у ослабленных субъектов был значительно более высокий уровень IL-6 и более низкие уровни гемоглобина, чем у здоровых людей. 9 Этот цитокин является одним из вероятных медиаторов в патогенезе синдрома слабости, проявляющегося снижением минеральной плотности костей, снижением мышечной массы тела, низким уровнем холестерина и белка в сыворотке крови и анемией.
Нарушение любой из этих трех переменных может вызвать отклонения в показателях крови. У пожилых людей может наблюдаться общее снижение концентрации стволовых клеток, продукции гемопоэтических факторов роста и чувствительности к гемопоэтическим цитокинам. 8 Провоспалительные цитокины, такие как интерлейкин (ИЛ)-1, фактор некроза опухоли-альфа и ИЛ-6, регулируют воспалительный процесс при инфекции, травме и стрессе.Повышенные уровни каждого из этих цитокинов связаны с рядом заболеваний, часто встречающихся у пожилых людей, включая атеросклероз, сахарный диабет и рак. Регуляция этих цитокинов снижается с возрастом. В одном популяционном исследовании случай-контроль взрослых в возрасте 74 лет и старше у ослабленных субъектов был значительно более высокий уровень IL-6 и более низкие уровни гемоглобина, чем у здоровых людей. 9 Этот цитокин является одним из вероятных медиаторов в патогенезе синдрома слабости, проявляющегося снижением минеральной плотности костей, снижением мышечной массы тела, низким уровнем холестерина и белка в сыворотке крови и анемией.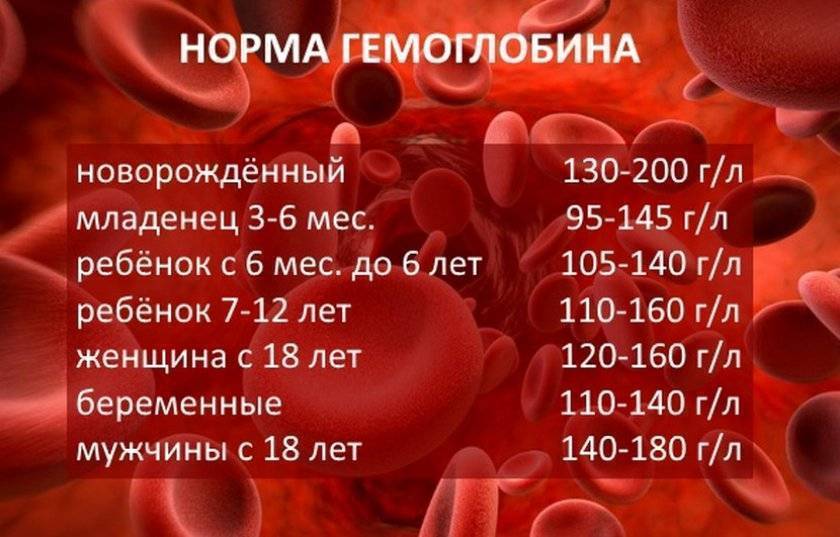 10
10
В Балтиморском лонгитюдном исследовании старения (BLSA) у пациентов, обследованных с интервалом 1–2 года в течение 8–30 лет, уровни эритропоэтина в сыворотке значительно повышались с возрастом, но менее значимо у пациентов с гипертонией или диабетом. Увеличение сывороточного эритропоэтина с возрастом может указывать на компенсацию субклинической кровопотери, увеличение оборота эритроцитов или повышение резистентности к эритропоэтину предшественников эритроцитов. Менее значительный рост у пациентов с артериальной гипертензией и диабетом может отражать возрастное нарушение функции почек, связанное с основным заболеванием.У пациентов с почечной недостаточностью может развиться анемия из-за неадекватности компенсаторного механизма. 11
Последствия анемии у пожилых людей
По-видимому, существуют клинические ассоциации, если не последствия анемии, которые не всегда связаны с системой кроветворения. 12 Патофизиология связи анемии с другими негематологическими системами органов не всегда ясна.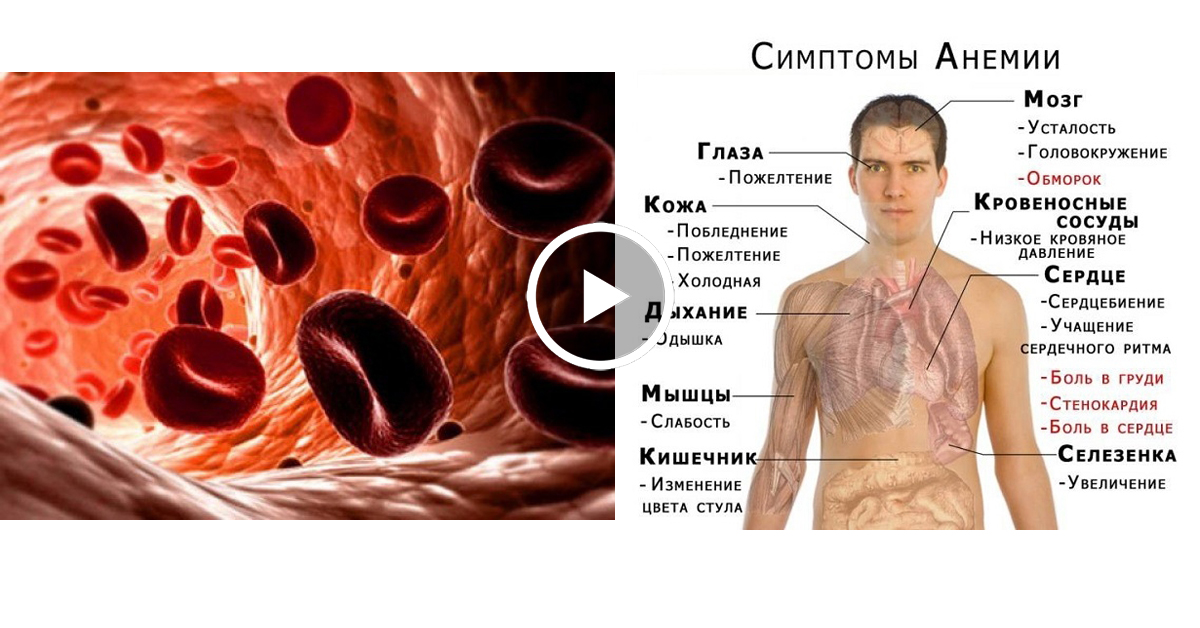
Мышцы и кости
Анемия и остеопороз широко распространены среди пожилых людей. 13 Данные исследования «Invecchiare in Chianti» (Старение в районе Кьянти; InCHIANTI) показали, что существует отрицательная связь между низким уровнем гемоглобина и костной массой. 14 Другое исследование из той же базы данных показало, что более низкие уровни гемоглобина связаны с более низкой силой разгибания голеностопного сустава, меньшей плотностью мышц и меньшей мышечной массой. 15
Подвижность
Исследование по оценке подвижности и анемии с использованием баланса стоя, хронометраж 2.4-метровая ходьба и тест на время пяти подъемов стула в качестве маркеров показали, что анемия была связана с более значительным средним снижением физической работоспособности в течение 4 лет даже у участников, у которых не было заболеваний, которые обычно вызывают анемию. 16
Когорта пожилых женщин, которые жили самостоятельно и участвовали в исследованиях женского здоровья и старения I и II, оценивалась в отношении их способности ходить, быстро вставать со стула и сохранять равновесие. Женщины с уровнем гемоглобина от 13 г/дл до 14 г/дл показали лучшие результаты, в то время как женщины с уровнем гемоглобина ниже 12 г/дл были хуже.Женщины с уровнем от 12 г/дл до 13 г/дл показали промежуточные результаты. Риск проблем с подвижностью у людей с уровнем гемоглобина 12 г/дл был более чем в два раза выше, чем у людей с уровнем гемоглобина 13 г/дл или выше. 17
Женщины с уровнем гемоглобина от 13 г/дл до 14 г/дл показали лучшие результаты, в то время как женщины с уровнем гемоглобина ниже 12 г/дл были хуже.Женщины с уровнем от 12 г/дл до 13 г/дл показали промежуточные результаты. Риск проблем с подвижностью у людей с уровнем гемоглобина 12 г/дл был более чем в два раза выше, чем у людей с уровнем гемоглобина 13 г/дл или выше. 17
Падения
Тридцать процентов людей в возрасте 65 лет и старше падают не реже одного раза в год. Падения и переломы являются серьезными причинами инвалидности, госпитализации и смертности. В трехлетнем исследовании пациентов, которые вели календарь своих падений, люди с анемией оказались значительно слабее с точки зрения мышечной силы и имели более низкую объективно измеренную физическую работоспособность, чем пациенты без анемии, и с большей вероятностью были рецидивирующими падениями. 18
Изучение данных по страховым случаям 47 530 пациентов в возрасте старше 65 лет, включенных в 30 планов медицинского страхования, проведенное с января 1999 г. по апрель 2004 г., показало, что анемия в значительной степени и независимо связана с повышенным риском падений с травмами. Уровень гемоглобина менее 10 г/дл был связан с трехкратной вероятностью падения с травмой бедра и почти двукратной вероятностью травмы головы по сравнению с теми, кто не страдал анемией. 19
по апрель 2004 г., показало, что анемия в значительной степени и независимо связана с повышенным риском падений с травмами. Уровень гемоглобина менее 10 г/дл был связан с трехкратной вероятностью падения с травмой бедра и почти двукратной вероятностью травмы головы по сравнению с теми, кто не страдал анемией. 19
Когниция
Роль анемии в когнитивной сфере, кроме той, что связана с дефицитом витамина B12, является спорной.В лонгитюдном исследовании пациентов в возрасте 75-95 лет, проведенном на базе сообщества, люди с анемией в начале исследования по результатам мини-психологического обследования на 26 и выше баллов имели более высокий риск развития деменции при повторном обследовании через 3 года наблюдения. -вверх. 20 В исследовании Women’s Health and Aging Study II легкая анемия оказалась независимым фактором риска нарушения исполнительной функции у пожилых людей, проживающих вне дома. 21 Было показано, что анемия представляет собой риск функционального и когнитивного снижения в течение 4-летнего периода с учетом возраста, индекса массы тела, функции почек и других показателей общего состояния здоровья.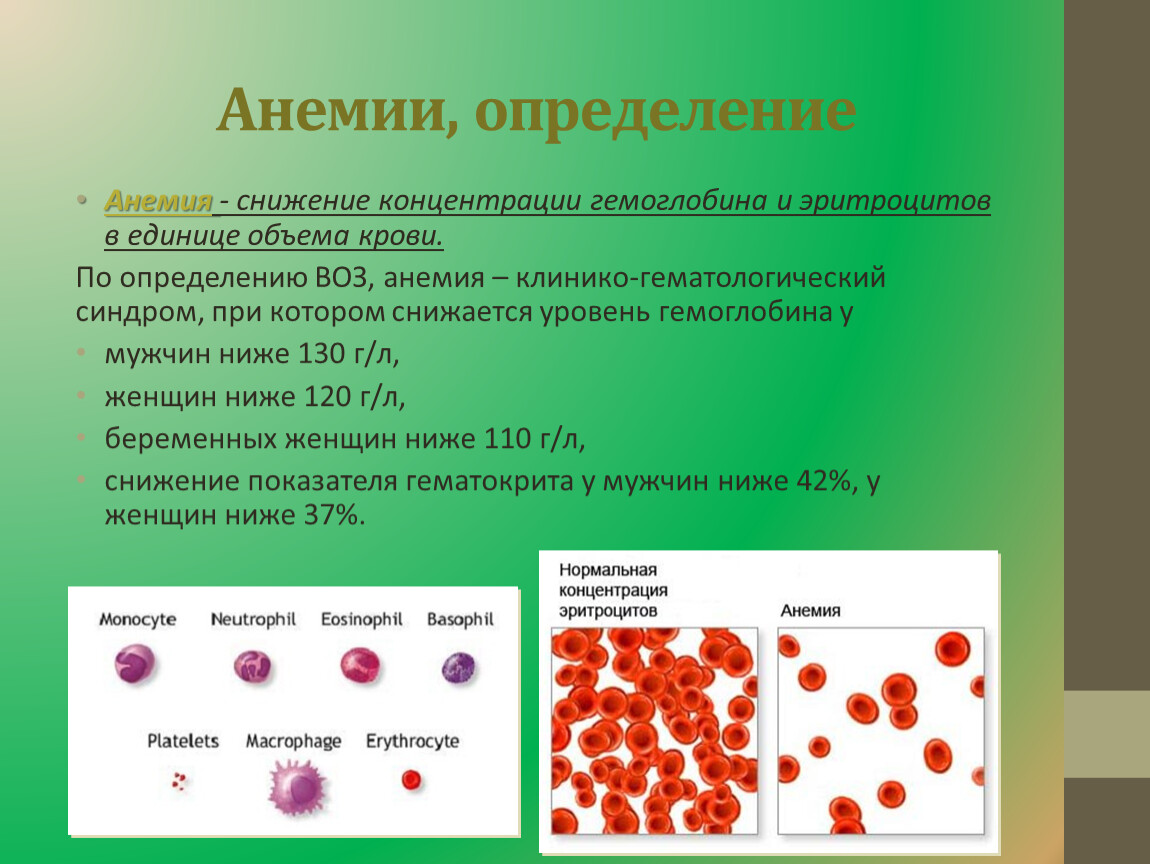 22
22
Заболевания сердца
Острая и хроническая анемия может вызывать застойную сердечную недостаточность у пациентов без болезни сердца и может спровоцировать застойную сердечную недостаточность и стенокардию у пациентов с сопутствующим заболеванием сердца.
У пациентов в возрасте 65 лет и старше с застойной сердечной недостаточностью более низкие уровни гемоглобина связаны с повышенным риском смерти и повторной госпитализации через 1 год. У пациентов с уровнем гематокрита менее 27% смертность в течение 1 года была на 40% выше, чем у пациентов без анемии. 23
Исследование пациентов в возрасте 75 лет и старше, рандомизированных для инвазивной или оптимизированной медицинской стратегии, наблюдали в среднем в течение 4 лет с конечными точками, включая смерть, несмертельный инфаркт миокарда или госпитализацию по поводу ишемической болезни сердца. Анемия оказалась независимым предиктором основных клинических нежелательных явлений, включая смерть, даже у пациентов со стабильной, но симптоматической ишемической болезнью сердца. После поправки на исходные различия снижение гемоглобина на 1 г/дл повышало риск смерти от всех причин на 34%. 24
После поправки на исходные различия снижение гемоглобина на 1 г/дл повышало риск смерти от всех причин на 34%. 24
Двухлетние сердечно-сосудистые исходы в когорте мужчин с острым коронарным синдромом, направленных на коронарографию в медицинский центр по делам ветеранов, продемонстрировали через 24 месяца бессобытийную выживаемость 64% в группе с уровнем гемоглобина менее 13 г/дл. , по сравнению с 84% в группе с уровнем гемоглобина более 13 г/дл. Анемия оказалась сильным и независимым предиктором смерти или острого инфаркта миокарда через 2 года у пациентов с острым коронарным синдромом. 25
Смертность от всех причин
В исследовании женского здоровья и старения I риск смертности был самым низким при нормальном уровне гемоглобина. Он увеличивался по мере падения гемоглобина, даже в пределах нормы, определяемой критериями ВОЗ. 26
В установленной популяции для эпидемиологических исследований пожилых людей (EPESE) анемия сохраняла значительную связь со смертностью, а более высокий уровень гемоглобина был значительно связан с более низкой смертностью и госпитализацией. 27
27
По-видимому, стабильные пожилые жители дома престарелых с уровнем гемоглобина менее 11 г/дл наблюдались в течение 60 месяцев и сравнивались с контрольной группой того же возраста/пола с уровнем гемоглобина более 11 г/дл. Пятилетняя выживаемость пациентов с низким уровнем гемоглобина составила 48%, в то время как в контрольной группе она была значительно выше и составила 67%. 28
Причины анемии у пожилых людей
Причины анемии у населения старше 65 лет относительно немногочисленны.Согласно анализу Третьего национального обследования состояния здоровья и питания (NHANES III), 34% анемии у пожилых людей были вызваны дефицитом фолиевой кислоты, B 12 или дефицитом железа по отдельности или в сочетании. У 20% была анемия хронического заболевания (ACD), 12% были связаны с почечной недостаточностью, а в этом исследовании оставшиеся 34% не были объяснены. 5 В то время как относительные проценты различаются между исследованиями с обследуемой популяцией, причины анемии у всех пожилых пациентов удивительно постоянны ( Таблица ).
Дефицит железа часто наблюдается у пожилых людей и обычно является результатом острой или хронической кровопотери через желудочно-кишечный тракт. ACD связан с несколькими состояниями, более распространенными у пожилых людей: воспалительными заболеваниями, злокачественными новообразованиями, диабетом, сердечной недостаточностью и инсультом.
Нормальный B 12 Всасывание требует желудочного сока, внутреннего фактора (IF) и терминального отдела подвздошной кишки. Аутоиммунная деструкция париетальных клеток, секретирующих ИФ, или пернициозная анемия, встречается примерно у 2% населения старше 60 лет.Атрофический гастрит и гипохлоргидрия могут прогрессировать с возрастом и могут частично быть причиной того, что у 12% пациентов старше 75 лет будет низкий уровень B 12 . У большинства пожилых пациентов с дефицитом витамина B 12 обнаруживается мальабсорбция связанного с белком витамина B 12 . 29 Краткосрочные исследования показывают, что ингибиторы протонной помпы и блокаторы h3 также вызывают мальабсорбцию связанного с белком B 12 путем дальнейшего подавления выработки кислоты. 30,31 Состояния после гастрэктомии, недостаточность поджелудочной железы и заболевание или резекция терминального отдела подвздошной кишки также ухудшают всасывание B 12 .
30,31 Состояния после гастрэктомии, недостаточность поджелудочной железы и заболевание или резекция терминального отдела подвздошной кишки также ухудшают всасывание B 12 .
В большинстве исследований у 15-30% исследованных пациентов не было объяснения анемии. Это может быть функцией интенсивности расследования. У проживающих в домах престарелых идиопатическая анемия может быть связана с более низкой реакцией эритропоэтина на низкий уровень гемоглобина из-за невыявленной почечной дисфункции. 32
Зарегистрированная распространенность миелодиспластического синдрома (МДС) увеличивается у людей в возрасте 70 лет и старше.Анемия является начальной аномалией более чем у половины из них. 33 МДС почти наверняка не диагностируется, поскольку оценка анемии с меньшей вероятностью включает оценку костного мозга из-за дискомфорта процедуры и предполагаемого отсутствия эффективного лечения. 34
У значительного процента пожилых пациентов с анемией есть конкурирующие причины анемии. 35,36 Пожилые пациенты часто принимают несколько препаратов в нескольких комбинациях, и независимо от того, обладает ли препарат угнетающим действием на костный мозг, вероятность перекрывающихся или синергических миелосупрессивных эффектов не поддается измерению.
35,36 Пожилые пациенты часто принимают несколько препаратов в нескольких комбинациях, и независимо от того, обладает ли препарат угнетающим действием на костный мозг, вероятность перекрывающихся или синергических миелосупрессивных эффектов не поддается измерению.
Лечение
Надлежащее лечение анемии зависит от точного диагноза. При лечении железодефицитной анемии дополнительное железо следует давать в разумных дозах, но таким образом, чтобы гериатрический желудок мог его переносить. Железо следует давать достаточно долго, чтобы восстановить нормальный уровень гемоглобина и пополнить запасы железа. Меньшие дозы могут потребовать более длительного лечения, чем это необходимо для более молодых пациентов с дефицитом железа. Преждевременное прекращение приема препаратов железа приведет к рецидиву.
Неизбирательное введение железа гериатрическому пациенту с неоцененной анемией нецелесообразно. Добавки железа для пациентов с ACD или MDS не облегчают анемию, а только способствуют перегрузке железом.
Анемия, вызванная дефицитом B 12 , вторичным по отношению к мальабсорбции B 12 , адекватно и безопасно замещается соответствующей дозой перорального B 12 вместо ежемесячных инъекций. 37 Существуют противоречивые мнения относительно использования перорального B 12 у пациентов с дефицитом IF. 38 Если выбран пероральный путь введения, рекомендуется тщательное наблюдение для документирования наличия или отсутствия ответа. Анемия почечной недостаточности обычно отвечает на дополнительное введение эритропоэтина. В то время как лечение МДС по-прежнему зависит от поддерживающей терапии, недавние достижения в области химиотерапии предоставляют меню хорошо переносимых вариантов лечения, недоступных всего несколько лет назад.
Сводка
Поскольку большинство врожденных анемий диагностируют до старости, количество возможных причин анемии у пожилых людей невелико по сравнению с более молодыми пациентами. Несколько заболеваний и несколько лабораторных тестов позволяют поставить диагноз более чем в 60% случаев. При необходимости могут быть желательны аспирация костного мозга и биопсия.
Несколько заболеваний и несколько лабораторных тестов позволяют поставить диагноз более чем в 60% случаев. При необходимости могут быть желательны аспирация костного мозга и биопсия.
Не всегда ясно, является ли анемия маркером или медиатором заболевания, но даже у долгожителей анемия обычно сопровождается патологическим состоянием. Важно выявить эти причины и по возможности лечить их. Пожилые пациенты с анемией имеют повышенную заболеваемость и смертность.
Автор не сообщает о соответствующих финансовых отношениях.
Доктор Лэндс — адъюнкт-профессор семейной и гериатрической медицины Высшей школы медицины Университета Теннесси, Ноксвилл.
Анемия увеличивает риск смерти у очень пожилых людей — ScienceDaily
Анемия у очень пожилых людей в возрасте 85 лет и старше, по-видимому, связана с повышенным риском смерти, согласно новому изучению в CMAJ (Канадский журнал медицинской ассоциации).
Исследование было частью исследования Leiden 85+, в котором приняли участие 562 человека в возрасте 85 лет в Нидерландах и наблюдали за ними до 90 лет. У 27% участников в начале исследования была анемия (распространенная анемия), а в последующий период случайная анемия развилась у 24% людей без анемии в начале исследования.
У 27% участников в начале исследования была анемия (распространенная анемия), а в последующий период случайная анемия развилась у 24% людей без анемии в начале исследования.
Анемия у пожилых людей обычно связана с повышенной смертностью, а также снижением подвижности, когнитивными нарушениями, депрессией, падениями и переломами, госпитализацией и снижением качества жизни. Это может существенно повлиять на потребности и затраты на здравоохранение в стареющих западных обществах.
В исследуемой группе риск смерти был одинаковым среди мужчин и женщин, а также среди людей в учреждениях длительного ухода и в обществе.
«Мы обнаружили сильную, независимую связь между распространенной анемией у участников в возрасте 85 лет и риском смерти», — пишут г-жа Венди ден Эльзен из Медицинского центра Лейденского университета и соавторы, подтверждая результаты предыдущих исследований людей в Нидерландах и Северная Америка. «Мы обнаружили, что возникшая анемия у участников старше 85 лет оказала даже более сильное влияние на смертность, чем распространенная анемия в возрасте 85 лет. ”
”
После поправки на другие заболевания негативное влияние анемии на когнитивные способности и физическую функцию было нейтрализовано. Авторы приходят к выводу, что связанное с этим функциональное снижение, по-видимому, в основном связано с сопутствующими заболеваниями.
В соответствующем комментарии д-р Марк Кларфилд из Университета Бен-Гуриона и д-р Ора Палтиэль из еврейского университета Хадасса в Израиле пишут: «Что касается необъяснимой анемии у пожилых пациентов, мы, возможно, никогда не сможем понять, является ли первопричиной или анемией ответственный за смерть.«Они предупреждают, что необходимы доказательства того, что рутинная коррекция необъяснимой анемии более полезна, чем вредна».
Источник истории:
Материалы предоставлены Журналом Канадской медицинской ассоциации . Примечание. Содержимое можно редактировать по стилю и длине.
Анемия в пожилом возрасте связана с повышенной смертностью и госпитализацией | Журналы геронтологии: Серия A
Аннотация
Фон . Анемия часто встречается в пожилом возрасте и, как было показано, влияет на физическую функцию пожилых людей. Чтобы более полно понять пагубные последствия анемии для здоровья, мы изучили взаимосвязь анемии со смертностью и исходами госпитализации в большой выборке пожилых людей из местного сообщества.
Анемия часто встречается в пожилом возрасте и, как было показано, влияет на физическую функцию пожилых людей. Чтобы более полно понять пагубные последствия анемии для здоровья, мы изучили взаимосвязь анемии со смертностью и исходами госпитализации в большой выборке пожилых людей из местного сообщества.
Методы . Данные получены от 3607 человек в возрасте 71 года и старше, участвующих в спонсируемом Национальным институтом старения (NIA) исследовании «Установленные группы населения для эпидемиологических исследований пожилых людей» (EPESE).Анемия определялась в соответствии с критериями Всемирной организации здравоохранения (ВОЗ) как концентрация гемоглобина ниже 12 г/дл у женщин и ниже 13 г/дл у мужчин. Данные о последующей смертности и госпитализации в течение 4 лет были получены из записей о смерти и базы данных Medicare.
Результаты . Анемия присутствовала у 451 из 3607 (12,5%) участников. В течение периода наблюдения у лиц с анемией вероятность смерти была выше, чем у лиц без анемии (37,0% против 22,1%, p <. 001). Кроме того, лица с анемией чаще госпитализировались (65,9% против 54,6%, p <0,001) и проводили в больнице больше дней (25,0 против 13,7, p <0,001). После поправки на демографические данные и исходные сопутствующие заболевания анемия значительно предсказывала последующую смертность и госпитализацию (относительный риск = 1,61, 95% доверительный интервал, 1,34–1,93; и относительный риск = 1,27, 95% доверительный интервал, 1,12–1,45 соответственно). После исключения лиц с распространенными заболеваниями на исходном уровне анемия оставалась значимо связанной с повышенным риском смертности и госпитализации.Более высокий уровень гемоглобина был значительно связан с более низкими рисками смертности и госпитализации ( p для тренда <0,001 для обоих).
001). Кроме того, лица с анемией чаще госпитализировались (65,9% против 54,6%, p <0,001) и проводили в больнице больше дней (25,0 против 13,7, p <0,001). После поправки на демографические данные и исходные сопутствующие заболевания анемия значительно предсказывала последующую смертность и госпитализацию (относительный риск = 1,61, 95% доверительный интервал, 1,34–1,93; и относительный риск = 1,27, 95% доверительный интервал, 1,12–1,45 соответственно). После исключения лиц с распространенными заболеваниями на исходном уровне анемия оставалась значимо связанной с повышенным риском смертности и госпитализации.Более высокий уровень гемоглобина был значительно связан с более низкими рисками смертности и госпитализации ( p для тренда <0,001 для обоих).
Выводы . Эти данные показывают, что анемия в пожилом возрасте характерна для лиц, подверженных риску важных клинических последствий для здоровья, и демонстрируют важность клинической осведомленности об анемии, даже если у человека нет явных клинических проявлений заболевания.
АНЕМИЯ, определяемая Всемирной организацией здравоохранения (ВОЗ) как концентрация гемоглобина (Hb) ниже 12 г/дл у женщин и ниже 13 г/дл у мужчин (1), часто встречается в пожилом возрасте с распространенностью примерно 13%. у лиц в возрасте 70 лет и старше (2).В большинстве случаев анемия в пожилом возрасте связана с основным заболеванием, таким как рак, хроническая болезнь почек и застойная сердечная недостаточность (ЗСН), или с недоеданием или дефицитом железа (3,4). Однако в 16–35 % случаев напрямую связать анемию с этими факторами невозможно (3–5).
Независимо от причины, анемия влияет на физическую функцию пожилых людей как в перекрестных, так и в продольных исследованиях (6,7). Эти исследования показали, что анемия увеличивает риск физической инвалидности и связана с нарушением работоспособности и мышечной слабостью.В когортах пожилого возраста, а также в группах больных с конкретным заболеванием анемия увеличивает риск смертности (8–10). Кроме того, два недавних независимых исследования показали, что даже среди лиц без анемии существует обратный градиент риска между концентрацией гемоглобина и исходами соматического состояния, при этом лица, у которых концентрации гемоглобина на 0,1–1 г/дл превышают пороговое значение для анемии, демонстрируют значительно более высокий уровень риска. снижается по сравнению с теми, у кого концентрация гемоглобина выше (6,11).
снижается по сравнению с теми, у кого концентрация гемоглобина выше (6,11).
Для дальнейшего описания и количественной оценки клинических исходов, связанных с анемией, в этом когортном исследовании изучалась последующая смертность, госпитализации и диагнозы при выписке среди лиц с анемией и без нее в соответствии с критериями ВОЗ.Кроме того, была изучена связь между концентрацией гемоглобина и этими клиническими исходами.
Методы
Данные для этого исследования получены из трех сообществ, входящих в состав утвержденных групп населения для эпидемиологических исследований пожилых людей (EPESE). План выборки и методы сбора данных были подробно описаны ранее (12). В период с 1981 по 1983 год в Восточном Бостоне, штат Массачусетс, были опрошены более 10 000 проживающих в общине мужчин и женщин в возрасте 65 лет и старше; Нью-Хейвен, Коннектикут; и округа Айова и Вашингтон в сельской местности Айовы.Последующие интервью проводились ежегодно в течение 6 лет. В общей сложности 5174 человека прошли личное собеседование на дому во время шестого контрольного осмотра в 1988 г. Эта последующая оценка считается исходной для данного исследования, поскольку это была первая оценка, включавшая сбор крови. Из-за отсутствия образца крови ( n = 1567) в настоящий анализ было включено 3607 человек.
В общей сложности 5174 человека прошли личное собеседование на дому во время шестого контрольного осмотра в 1988 г. Эта последующая оценка считается исходной для данного исследования, поскольку это была первая оценка, включавшая сбор крови. Из-за отсутствия образца крови ( n = 1567) в настоящий анализ было включено 3607 человек.
Анемия
С помощью венепункции у участников была получена кровь во время исходного уровня настоящего исследования (оценка 1988 г.).Образцы отправляли в коммерческую лабораторию (Институт Николса, Сан-Клементе, Калифорния), где определяли уровни гемоглобина с помощью счетчика Коултера. Анемию определяли по критериям ВОЗ (1): концентрация гемоглобина ниже 12 г/дл (7,5 ммоль/л) у женщин и ниже 13 г/дл (8,1 ммоль/л) у мужчин. Анализы также проводились с использованием Hb в качестве категориальной переменной (уровень Hb ≥1 г/дл ниже порогового значения для анемии, уровень Hb 0–0,9 г/дл ниже порогового значения для анемии, уровень Hb на 0,1–1 г/дл выше порогового значения для анемии, уровень Hb 1,1– 2 г/дл выше порогового значения анемии, уровень гемоглобина 2. 1–3 г/дл выше порогового значения для анемии и уровень гемоглобина >3 г/дл выше порогового значения для анемии.
1–3 г/дл выше порогового значения для анемии и уровень гемоглобина >3 г/дл выше порогового значения для анемии.
Последующая смертность и госпитализации
Результаты этого исследования включали жизненный статус и госпитализации в период времени с шестой оценки (исходный уровень для этого исследования) до конца 1992 года. Информация о жизненном статусе была получена в результате седьмого последующего наблюдения, контактов с доверенными лицами, некрологов в местных газетах. и связь с Национальным индексом смертности. Свидетельства о смерти кодировались одним нозологом с использованием Девятой редакции Международной классификации болезней (МКБ-9; 13).Информация о дате госпитализации и до пяти диагнозах при выписке для госпитализации каждого участника была собрана из файлов анализа и обзора поставщиков медицинских услуг Управления финансирования здравоохранения (HCFA), которые содержат информацию обо всех лицах, охваченных частью A программы Medicare (97% участников).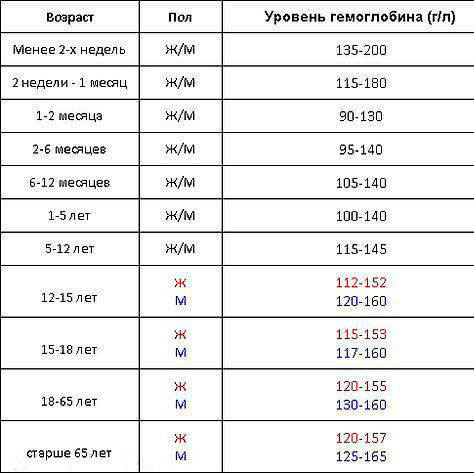 населения США в возрасте 65 лет и старше). Поступление в учреждения квалифицированного сестринского ухода не считалось госпитализацией в этом исследовании. Диагнозы при выписке кодировались в соответствии с клинической модификацией МКБ-9 (13).Во время последующего наблюдения участники были классифицированы как имеющие 0 или ≥1 госпитализаций. Кроме того, были рассмотрены конкретные базовые общие условия, которые были разделены на различные общие категории. Сердечно-сосудистые заболевания включали острый инфаркт миокарда (410,0–410,9), стенокардию (413,0–413,9), ЗСН (428,0–428,9) и инсульт (430,0–432,9, 434, 436). Желудочно-кишечные кровотечения (578.0–578.9, 531.0, 531.2, 531.4, 531.6, 532.0, 532.2, 532.4, 532.6, 533,0, 533.2, 533,4, 533,6) и рака (140,0–212,9). Инфекционные состояния включали пневмонию (480.0–486.9, 507.0) и другие инфекции (МКБ-9, используемые коды клинических модификаций предоставляются по запросу). Другие состояния включали диабет (250,0–250,9), хроническую обструктивную болезнь легких (ХОБЛ; 490,0–496,9), деменцию (290,0–290,9, 294,1, 294,9), пролежни (707,0), переломы (800,0–819,9, 820,0–822,0).
населения США в возрасте 65 лет и старше). Поступление в учреждения квалифицированного сестринского ухода не считалось госпитализацией в этом исследовании. Диагнозы при выписке кодировались в соответствии с клинической модификацией МКБ-9 (13).Во время последующего наблюдения участники были классифицированы как имеющие 0 или ≥1 госпитализаций. Кроме того, были рассмотрены конкретные базовые общие условия, которые были разделены на различные общие категории. Сердечно-сосудистые заболевания включали острый инфаркт миокарда (410,0–410,9), стенокардию (413,0–413,9), ЗСН (428,0–428,9) и инсульт (430,0–432,9, 434, 436). Желудочно-кишечные кровотечения (578.0–578.9, 531.0, 531.2, 531.4, 531.6, 532.0, 532.2, 532.4, 532.6, 533,0, 533.2, 533,4, 533,6) и рака (140,0–212,9). Инфекционные состояния включали пневмонию (480.0–486.9, 507.0) и другие инфекции (МКБ-9, используемые коды клинических модификаций предоставляются по запросу). Другие состояния включали диабет (250,0–250,9), хроническую обструктивную болезнь легких (ХОБЛ; 490,0–496,9), деменцию (290,0–290,9, 294,1, 294,9), пролежни (707,0), переломы (800,0–819,9, 820,0–822,0). , 929,9), обезвоживание или проблемы с электролитами (276.0, 276,5, 276,9).
, 929,9), обезвоживание или проблемы с электролитами (276.0, 276,5, 276,9).
Ковариаты
Исходные социально-демографические данные включали возраст, пол, расу и образование. Показатели исходного состояния здоровья включали статус курения (никогда не куривший, бывший или действующий курильщик) и индекс массы тела (ИМТ; вес в килограммах, деленный на квадрат роста в метрах). Распространенность ишемической болезни сердца (ИБС) определялась любым из следующего: (i) диагноз при выписке с кодами 410–414 по МКБ-9 за 3 года до исходного уровня, как установлено в файлах анализа и обзора поставщиков медицинских услуг HCFA Medicare; (ii) самоотчет о сердечном приступе; или (iii) положительный ответ на стенокардию по опроснику Роуза (14) при любом интервью до исходного уровня.Распространенная ХСН была выявлена, если у участников в течение последних 3 лет было диагностировано это заболевание при выписке из больницы (код МКБ-9 428) или в настоящее время они принимали мочегонные препараты, а также препараты наперстянки или сосудорасширяющие препараты.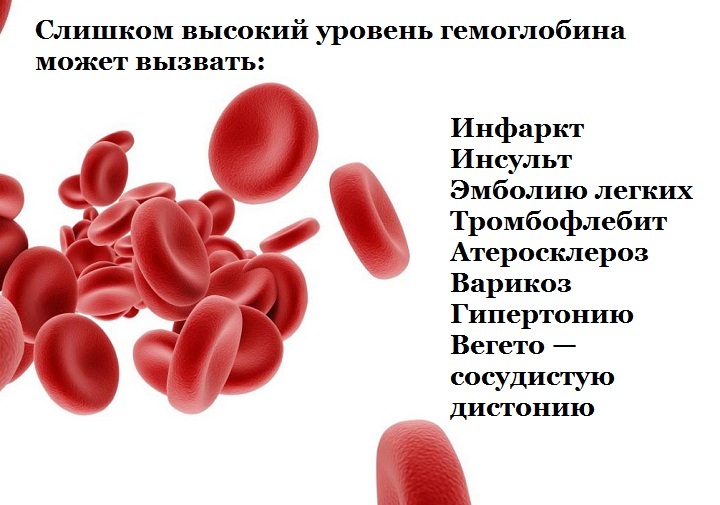 Распространенный диабет, инсульт, рак и заболевания легких считались имеющимися, если респондентам когда-либо сообщал врач об этих заболеваниях или если у них в последние 3 года выписывался диагноз этих заболеваний (код 250 по МКБ-9). диабет, 430-434 для инсульта, 140-208 для рака или 491-493 для болезни легких).Инфекционные заболевания были диагностированы на основании конкретных диагнозов при выписке из стационара за последние 3 года (кодирование по МКБ-9 предоставляется по запросу). Заболевание почек определяли по уровню креатинина в сыворотке >1,5 мг/дл у женщин и >1,7 мг/дл у мужчин.
Распространенный диабет, инсульт, рак и заболевания легких считались имеющимися, если респондентам когда-либо сообщал врач об этих заболеваниях или если у них в последние 3 года выписывался диагноз этих заболеваний (код 250 по МКБ-9). диабет, 430-434 для инсульта, 140-208 для рака или 491-493 для болезни легких).Инфекционные заболевания были диагностированы на основании конкретных диагнозов при выписке из стационара за последние 3 года (кодирование по МКБ-9 предоставляется по запросу). Заболевание почек определяли по уровню креатинина в сыворотке >1,5 мг/дл у женщин и >1,7 мг/дл у мужчин.
Статистический анализ
Различия в пропорциях и средних исходных характеристиках, а также смертности и исходах госпитализации между людьми с анемией и без нее оценивались с использованием статистики критерия Хи-квадрат и теста t соответственно.Модели регрессии пропорциональных рисков Кокса использовались для оценки связи анемии со временем до смерти и первой госпитализации. Лица, выжившие без признаков госпитализации или смерти, подвергались цензуре в конце наблюдения (31 декабря 1992 г.). Что касается исхода госпитализации, то лица, умершие без признаков госпитализации, подвергались цензуре в момент их смерти. Относительные риски (ОР) и 95% доверительные интервалы (ДИ) были скорректированы для ковариатов, которые, как было установлено, однозначно связаны со статусом анемии.Дополнительный регрессионный анализ пропорциональных рисков Кокса был проведен для изучения связи между категориальной переменной для уровней Hb со смертностью и исходами госпитализации.
Лица, выжившие без признаков госпитализации или смерти, подвергались цензуре в конце наблюдения (31 декабря 1992 г.). Что касается исхода госпитализации, то лица, умершие без признаков госпитализации, подвергались цензуре в момент их смерти. Относительные риски (ОР) и 95% доверительные интервалы (ДИ) были скорректированы для ковариатов, которые, как было установлено, однозначно связаны со статусом анемии.Дополнительный регрессионный анализ пропорциональных рисков Кокса был проведен для изучения связи между категориальной переменной для уровней Hb со смертностью и исходами госпитализации.
Результаты
Средний возраст всей выборки на исходном уровне исследования составлял 78,2 года (стандартное отклонение [ SD ] = 5,3 года), и 64,4% были женщинами. Средний уровень гемоглобина в сыворотке крови составлял 14,5 г/дл ( SD = 1,6 г/дл) у мужчин и 13,4 г/дл ( SD = 1).4 г/дл) у женщин. Анемия присутствовала у 451 из 3607 (12,5%) участников. Из этих людей с анемией 38 (8,4%) имели уровень Hb <10 г/дл. Как показано в Таблице 1, участники с анемией чаще были пожилыми, чернокожими и менее образованными, имели более низкий ИМТ и историю ИБС, ЗСН, диабета, рака, инфекционных заболеваний или заболеваний почек по сравнению с теми, у кого не было анемия. В соответствии с этим лица с анемией, как правило, чаще госпитализировались в предыдущем году. В многофакторном логистическом регрессионном анализе следующие исходные характеристики были значительно связаны с более высокой распространенностью анемии: пожилой возраст (RR = 1.06, 95% ДИ, 1,04–1,08), черная раса (ОР = 4,08, 95% ДИ, 2,74–6,09), ИМТ (ОР = 0,97, 95% ДИ, 0,96–0,99), рак (ОР = 1,39, 95% ДИ 1,08–1,77), заболевание почек (ОР = 2,75, 95% ДИ, 2,06–3,68) и госпитализация в предыдущем году (ОР = 1,60, 95% ДИ, 1,21–2,11).
Из этих людей с анемией 38 (8,4%) имели уровень Hb <10 г/дл. Как показано в Таблице 1, участники с анемией чаще были пожилыми, чернокожими и менее образованными, имели более низкий ИМТ и историю ИБС, ЗСН, диабета, рака, инфекционных заболеваний или заболеваний почек по сравнению с теми, у кого не было анемия. В соответствии с этим лица с анемией, как правило, чаще госпитализировались в предыдущем году. В многофакторном логистическом регрессионном анализе следующие исходные характеристики были значительно связаны с более высокой распространенностью анемии: пожилой возраст (RR = 1.06, 95% ДИ, 1,04–1,08), черная раса (ОР = 4,08, 95% ДИ, 2,74–6,09), ИМТ (ОР = 0,97, 95% ДИ, 0,96–0,99), рак (ОР = 1,39, 95% ДИ 1,08–1,77), заболевание почек (ОР = 2,75, 95% ДИ, 2,06–3,68) и госпитализация в предыдущем году (ОР = 1,60, 95% ДИ, 1,21–2,11).
Средний период наблюдения составил 4,1 года ( SD = 1,1 года). В течение этого периода люди с анемией чаще умирали (37,0%), чем люди без анемии (22,1%, p <0,001; см. Таблицу 2). Кроме того, число лиц, госпитализированных во время наблюдения, было значительно выше среди лиц с анемией (65.9%), чем среди лиц без анемии (54,6%, p <0,001). Лица с анемией значительно чаще и дольше оставались в больнице во время наблюдения, чем люди без анемии.
Таблицу 2). Кроме того, число лиц, госпитализированных во время наблюдения, было значительно выше среди лиц с анемией (65.9%), чем среди лиц без анемии (54,6%, p <0,001). Лица с анемией значительно чаще и дольше оставались в больнице во время наблюдения, чем люди без анемии.
В таблице 3 приведено описание последующих диагнозов при выписке из больницы среди лиц с анемией и без нее. Во время наблюдения анемия была в значительной степени связана с различными диагнозами при выписке из больницы: сердечно-сосудистые заболевания (особенно стенокардия и ЗСН), желудочно-кишечные кровотечения, рак, инфекционные состояния, диабет и пролежни.Незначительные тенденции были обнаружены для увеличения частоты госпитализаций по поводу переломов и обезвоживания с анемией.
В таблице 4 показаны риски смертности и госпитализации после корректировки исходных характеристик с (пограничными) значимыми одномерными ассоциациями с анемией: возраст, пол, раса, образование, статус курения, ИМТ, ИБС, ЗСН, диабет, рак, инфекционные заболевания, почки заболеваний и госпитализаций в прошлом году. Анемия значительно увеличивала риск смертности (RR = 1.63, 95% ДИ, 1,37–1,95) и риск госпитализации (RR = 1,23, 95% ДИ, 1,09–1,41). После исключения лиц с важными исходными состояниями (ИБС, ЗСН, диабетом, инсультом, раком, заболеваниями легких, почек и инфекционных заболеваний) связь между анемией и смертностью и результатами госпитализации была очень похожей, если не выше: ОР для смертности = 2,12 (95% ДИ, 1,48–3,04) и ОР для госпитализации = 1,30 (95% ДИ, 1,02–1,66). Связь между анемией и смертностью, а также исходами госпитализации также в значительной степени присутствовала среди лиц с одним или несколькими из этих исходных состояний.Дополнительные анализы, стратифицированные по длительности наблюдения (≤2 лет или >2 лет), показали, что связь между анемией и клиническими исходами наблюдалась не только в первые 2 года наблюдения, но оставалась столь же эффективной в последующие годы наблюдения. вверх.
Анемия значительно увеличивала риск смертности (RR = 1.63, 95% ДИ, 1,37–1,95) и риск госпитализации (RR = 1,23, 95% ДИ, 1,09–1,41). После исключения лиц с важными исходными состояниями (ИБС, ЗСН, диабетом, инсультом, раком, заболеваниями легких, почек и инфекционных заболеваний) связь между анемией и смертностью и результатами госпитализации была очень похожей, если не выше: ОР для смертности = 2,12 (95% ДИ, 1,48–3,04) и ОР для госпитализации = 1,30 (95% ДИ, 1,02–1,66). Связь между анемией и смертностью, а также исходами госпитализации также в значительной степени присутствовала среди лиц с одним или несколькими из этих исходных состояний.Дополнительные анализы, стратифицированные по длительности наблюдения (≤2 лет или >2 лет), показали, что связь между анемией и клиническими исходами наблюдалась не только в первые 2 года наблюдения, но оставалась столь же эффективной в последующие годы наблюдения. вверх.
Наконец, мы рассчитали скорректированный риск смертности и госпитализации в соответствии с повышением категорийного уровня гемоглобина: гемоглобин ≥1 г/дл ниже порогового значения для анемии ( n = 159), гемоглобин на 0–0,9 г/дл ниже порогового значения для анемии ( n = 292), Hb 0. 1–1 г/дл выше порогового значения для анемии ( n = 736), гемоглобина на 1,1–2 г/дл выше порогового значения для анемии ( n = 1109), гемоглобина на 2,1–3 г/дл выше порогового значения для анемии ( n = 820), а Hb ≥3,1 г/дл выше порогового значения анемии ( n = 491) (см. рис. 1). После поправки на ковариаты более высокий уровень Hb был значительно связан с более низким риском смертности ( p для тренда <0,001) и более низким риском госпитализации ( p для тренда = 0,004). По сравнению с людьми с уровнем гемоглобина 1.1-2 г/дл выше порогового значения анемии (контрольная группа), лица с уровнем гемоглобина 0-0,9 г/дл или ≥1 г/дл ниже порогового значения анемии имели повышенный риск смертности 1,66 (95% ДИ, 1,30- 2,12) и 1,91 (95% ДИ, 1,44–2,53) соответственно. Интересно, что лица с уровнем гемоглобина на 0,1–1 г/дл выше порогового значения для анемии также значительно отличались от лиц с уровнем гемоглобина на 1,1–2 г/дл выше порогового значения для анемии (ОР = 1,32, 95% ДИ, 1,08).
1–1 г/дл выше порогового значения для анемии ( n = 736), гемоглобина на 1,1–2 г/дл выше порогового значения для анемии ( n = 1109), гемоглобина на 2,1–3 г/дл выше порогового значения для анемии ( n = 820), а Hb ≥3,1 г/дл выше порогового значения анемии ( n = 491) (см. рис. 1). После поправки на ковариаты более высокий уровень Hb был значительно связан с более низким риском смертности ( p для тренда <0,001) и более низким риском госпитализации ( p для тренда = 0,004). По сравнению с людьми с уровнем гемоглобина 1.1-2 г/дл выше порогового значения анемии (контрольная группа), лица с уровнем гемоглобина 0-0,9 г/дл или ≥1 г/дл ниже порогового значения анемии имели повышенный риск смертности 1,66 (95% ДИ, 1,30- 2,12) и 1,91 (95% ДИ, 1,44–2,53) соответственно. Интересно, что лица с уровнем гемоглобина на 0,1–1 г/дл выше порогового значения для анемии также значительно отличались от лиц с уровнем гемоглобина на 1,1–2 г/дл выше порогового значения для анемии (ОР = 1,32, 95% ДИ, 1,08).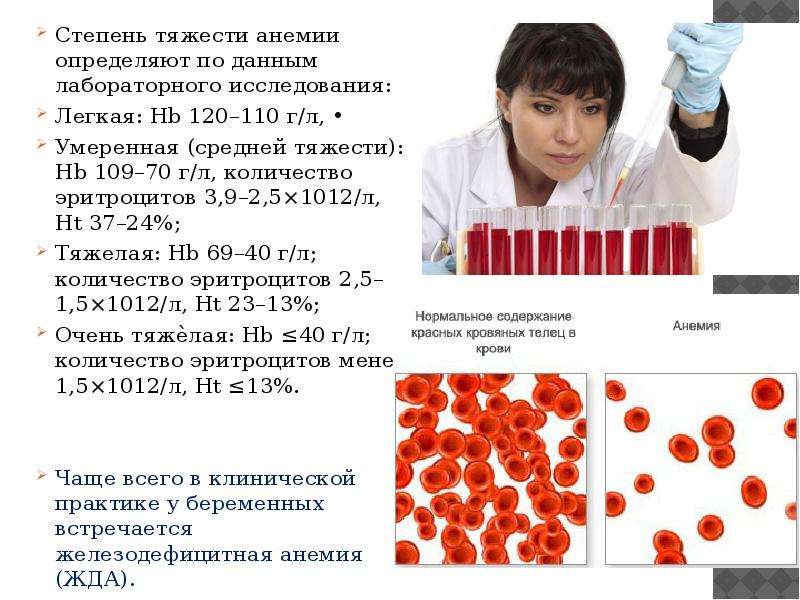 –1,60). Что касается госпитализаций, у лиц с уровнем гемоглобина 0–0,9 г/дл или ≥1 г/дл ниже порогового значения анемии риск 1 был повышен.15 (95% ДИ, 0,97–1,36) и 1,47 (95% ДИ, 1,20–1,80) соответственно по сравнению с контрольной группой.
–1,60). Что касается госпитализаций, у лиц с уровнем гемоглобина 0–0,9 г/дл или ≥1 г/дл ниже порогового значения анемии риск 1 был повышен.15 (95% ДИ, 0,97–1,36) и 1,47 (95% ДИ, 1,20–1,80) соответственно по сравнению с контрольной группой.
Обсуждение
В нашем исследовании было обнаружено, что анемия, определенная в соответствии с критериями ВОЗ, в значительной степени связана с повышенной смертностью и госпитализацией. Эти ассоциации оставались значимыми после поправки на возраст, пол, ИМТ и различные сопутствующие заболевания и были подтверждены среди лиц, у которых исходно не измерялись распространенные заболевания. Диагнозы при выписке из больницы, которые чаще встречались у лиц с анемией, были связаны с раком, инфекционными заболеваниями, сердечно-сосудистыми заболеваниями, диабетом и пролежнями.Кроме того, мы обнаружили значительный обратный градиент риска между концентрацией гемоглобина и последующей смертностью и госпитализацией. Наши результаты согласуются с предыдущими выводами Чавеса и коллег (9) и Изакса и коллег (8), которые сообщили об обратном градиенте риска между уровнем гемоглобина и смертностью среди пожилых женщин и среди выборки лиц в возрасте 85 лет и старше.
Наши результаты согласуются с предыдущими выводами Чавеса и коллег (9) и Изакса и коллег (8), которые сообщили об обратном градиенте риска между уровнем гемоглобина и смертностью среди пожилых женщин и среди выборки лиц в возрасте 85 лет и старше.
Наше исследование подтверждает, что анемия распространена среди пожилых людей. Двенадцать процентов мужчин и женщин в нашей старшей выборке соответствовали критериям ВОЗ для анемии.Этот процент согласуется с другими сообщениями о распространенности 11% у лиц в возрасте 65 лет и старше (5) и 13% у лиц в возрасте 70 лет и старше (2). Как в одномерном, так и в многомерном анализе пожилой возраст был важным фактором, определяющим анемию, что ясно указывало на то, что распространенность анемии увеличивается с возрастом. Среди лиц в возрасте 85 лет и старше 20% страдали анемией, что согласуется с распространенностью, зарегистрированной в других исследованиях пожилых людей (8,15). Другими значительными независимыми детерминантами анемии были диабет, рак, заболевание почек и госпитализация в предыдущем году. Эти результаты отражают то, что некоторые основные хронические заболевания, вероятно, объясняют большую часть распространенности анемии. Предыдущие исследования показывают, что помимо основного заболевания недоедание и недостаточность железа, фолиевой кислоты и витамина B12 по отдельности или в сочетании могут объяснить еще 20–30% случаев анемии. Однако примерно в 16–35 % случаев невозможно связать анемию с основными факторами (3–5). Последнее может быть частично связано с неустановленными фоновыми состояниями, снижением резерва костного мозга, адаптацией к уменьшенной безжировой массе тела со сниженной потребностью в кислороде или сниженной секрецией эритропоэтина (16,17).
Эти результаты отражают то, что некоторые основные хронические заболевания, вероятно, объясняют большую часть распространенности анемии. Предыдущие исследования показывают, что помимо основного заболевания недоедание и недостаточность железа, фолиевой кислоты и витамина B12 по отдельности или в сочетании могут объяснить еще 20–30% случаев анемии. Однако примерно в 16–35 % случаев невозможно связать анемию с основными факторами (3–5). Последнее может быть частично связано с неустановленными фоновыми состояниями, снижением резерва костного мозга, адаптацией к уменьшенной безжировой массе тела со сниженной потребностью в кислороде или сниженной секрецией эритропоэтина (16,17).
Основной вопрос, касающийся анемии у пожилых людей, заключается в том, является ли анемия независимым фактором риска функционального ухудшения или она является просто суррогатным маркером сопутствующих хронических заболеваний или самого процесса старения. Тот факт, что существенных различий между результатами выборки в целом и выборкой без признаков заболевания не наблюдалось, свидетельствует о том, что влияние анемии на клинические исходы не зависит от хронического или острого статуса заболевания. В качестве альтернативы возможно прямое неблагоприятное воздействие анемии, которое объясняет более высокую частоту клинических исходов.Физиологически сердечно-сосудистые и легочные нарушения, характерные для пожилых людей, могут существенно ограничивать эффективность компенсаторных реакций на низкие концентрации гемоглобина. В этом контексте даже низконормальные концентрации гемоглобина могут вызвать снижение доставки кислорода и способствовать развитию неблагоприятных клинических исходов и последующих госпитализаций и смертности.
В качестве альтернативы возможно прямое неблагоприятное воздействие анемии, которое объясняет более высокую частоту клинических исходов.Физиологически сердечно-сосудистые и легочные нарушения, характерные для пожилых людей, могут существенно ограничивать эффективность компенсаторных реакций на низкие концентрации гемоглобина. В этом контексте даже низконормальные концентрации гемоглобина могут вызвать снижение доставки кислорода и способствовать развитию неблагоприятных клинических исходов и последующих госпитализаций и смертности.
Хотя анемия может иметь прямое физиологическое воздействие, вполне вероятно, что часть наших результатов связана с тем фактом, что анемия представляет собой основное заболевание.Наши анализы были скорректированы с учетом распространенных хронических состояний, и результаты были подтверждены в анализах, исключающих лиц с заболеваниями, обычно связанными с анемией. Тем не менее, анемия может отражать тяжесть заболевания, субклинические заболевания или другие заболевания, которые не измеряются (например, заболевания печени и/или поджелудочной железы). В этом контексте анемия представляется эффективным прогностическим маркером неблагоприятных последствий для здоровья и заслуживает дальнейшего клинического изучения.
В этом контексте анемия представляется эффективным прогностическим маркером неблагоприятных последствий для здоровья и заслуживает дальнейшего клинического изучения.
В течение 4-летнего периода наблюдения пожилые люди с анемией чаще госпитализировались по поводу рака, инфекционных заболеваний, сердечно-сосудистых заболеваний (например,g., ХСН и стенокардия), сахарный диабет и пролежни с тенденцией к увеличению числа госпитализаций по поводу переломов. Эти результаты подтверждают, что анемия связана с некоторыми заболеваниями, такими как рак и ЗСН, и что со временем госпитализация по поводу этих состояний становится более вероятной. Кроме того, некоторые другие диагнозы при выписке из больницы, которые чаще встречались у пожилых людей с анемией, включали пролежни, переломы и инфекции, которые можно было бы рассматривать как более общие состояния, указывающие на слабость (18).Эти данные свидетельствуют о том, что анемия, довольно независимая от определенного заболевания, может идентифицировать ослабленных пожилых людей. Это предположение согласуется с недавними данными о том, что низкий уровень гемоглобина связан с слабостью (19, 20) и повышенной инвалидностью, ухудшением физической работоспособности и снижением мышечной силы (6, 7).
Это предположение согласуется с недавними данными о том, что низкий уровень гемоглобина связан с слабостью (19, 20) и повышенной инвалидностью, ухудшением физической работоспособности и снижением мышечной силы (6, 7).
Наши результаты указывают на значительный обратный градиент риска между концентрацией гемоглобина и последующей смертностью и госпитализацией. Даже среди лиц без анемии лица с низким нормальным уровнем гемоглобина (0.на 1–1 мг/дл выше порогового значения анемии) подвергались более высокому риску смерти, чем лица с более высоким уровнем гемоглобина. Эти результаты согласуются с более ранними выводами о том, что низкий нормальный уровень гемоглобина связан с повышенным риском инвалидности и ухудшения физического состояния (11). Возможно, у значительной части лиц с низким уровнем гемоглобина вскоре после исходного обследования развилась анемия, что может объяснить их повышенный риск смертности. Однако может случиться так, что низкий нормальный уровень гемоглобина уже определяет лиц с риском определенных клинических исходов. Для изучения этих вопросов необходимы дальнейшие исследования, поскольку это даст представление о целесообразности корректировки критериев анемии ВОЗ в пожилом возрасте. Таким образом, наши результаты показывают, что из-за повышенного риска смертности и госпитализации уровни Hb ниже нормы у пожилых людей являются причиной клинической осведомленности, даже если у пожилых людей нет явных клинических проявлений заболевания.
Для изучения этих вопросов необходимы дальнейшие исследования, поскольку это даст представление о целесообразности корректировки критериев анемии ВОЗ в пожилом возрасте. Таким образом, наши результаты показывают, что из-за повышенного риска смертности и госпитализации уровни Hb ниже нормы у пожилых людей являются причиной клинической осведомленности, даже если у пожилых людей нет явных клинических проявлений заболевания.
Рисунок 1.
Скорректированные риски (RR) смертности и госпитализации в зависимости от уровня гемоглобина (hb).* С поправкой на возраст, пол, расу, образование, статус курения, индекс массы тела, ишемическую болезнь сердца, застойную сердечную недостаточность, диабет, рак, инфекционные заболевания, заболевания почек и госпитализацию в прошлом году
Рисунок 1.
Скорректированные риски (ОР) смертности и госпитализации в зависимости от уровня гемоглобина (hb). * С поправкой на возраст, пол, расу, образование, статус курения, индекс массы тела, ишемическую болезнь сердца, застойную сердечную недостаточность, диабет, рак, инфекционные заболевания, заболевания почек и госпитализацию в прошлом году
Таблица 1.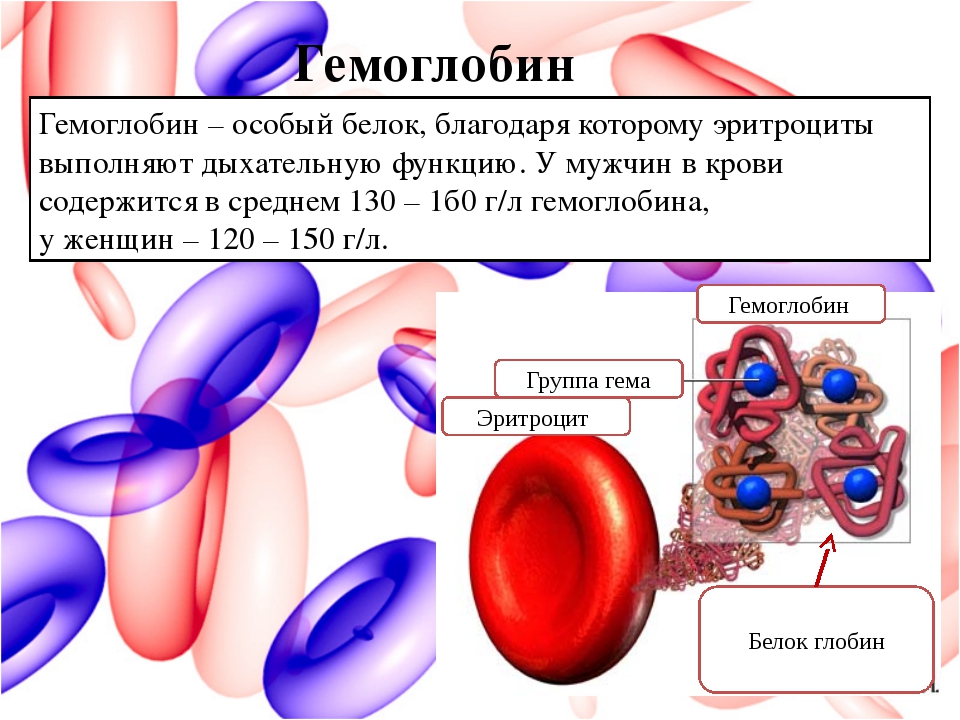
Исходные характеристики в соответствии со статусом анемии.
| Характеристики . | Нет анемии ( N = 3156) . | Анемия ( N = 451) . | р * . | ||
|---|---|---|---|---|---|
| Возраст, средний лет ( SD ) | 78.0 (5.2) | 78,0 (5.2) | 98,0 (5.2) | 98.0443 79.9 (5.8) | <.001 |
| Секс,% Женский | 64.9% | 61,0% 3 61,0% | .10 | .10 | |
| 6.1% | 6.1% | 20,6% | |||
| 0,044446 | |||||
| % Бывший | 27.9% | 30,4% | |||
| % Текущий | 8,3% | 8,3% | 5,3% | ||
| Годы Образования означают ( SD ) | 10. 1 (3.3) 1 (3.3) | 9.3 (3.4) | <.001 | ||
| Mass Mass | 25.1 (6.0) | 24.2 (5.8) | .004 | ||
| Коронарные сердечные заболевания,% | 20.1 % | 29.0446 | 29,0% | <.001 | |
| застойная сердечная недостаточность,% | 9,4% | 14,2% | .001 | ||
| ,% | 8,6% | 9,8% | .40 | ||
| Сахарный диабет, % | 16.6% | 22,6% 3 22,6% | .002 | .002 | |
| Рак,% | 18,6% | 24,6% | .002 | ||
| COMP,% | 7,9% | 7,1% | .56 | ||
| Инфекционные заболевания,% | 5,9% | 5,9% | 9,1% | .01 | |
| Болезнь почек,% | 7,0% | 20,1% | <. 001 001 | ||
| Госпитализация прошлого года,% | 13.2% | 22,2% | <.001 |
| . | Нет анемии ( N = 3156) . | Анемия ( N = 451) . | р * . | ||
|---|---|---|---|---|---|
| Возраст, средний лет ( SD ) | 78.0 (5.2) | 78,0 (5.2) | 98,0 (5.2) | 98.0443 79.9 (5.8) | <.001 |
| Секс,% Женский | 64.9% | 61,0% 3 61,0% | .10 | .10 | |
| 6.1% | 6.1% | 20,6% | |||
| 0,044446 | |||||
| % Бывший | 27.9% | 30,4% | |||
| % Текущий | 8,3% | 8,3% | 5,3% | ||
| Годы Образования означают ( SD ) | 10. 1 (3.3) 1 (3.3) | 9.3 (3.4) | <.001 | ||
| Mass Mass | 25.1 (6.0) | 24.2 (5.8) | .004 | ||
| Коронарные сердечные заболевания,% | 20.1 % | 29.0446 | 29,0% | <.001 | |
| застойная сердечная недостаточность,% | 9,4% | 14,2% | .001 | ||
| ,% | 8,6% | 9,8% | .40 | ||
| Сахарный диабет, % | 16.6% | 22,6% 3 22,6% | .002 | .002 | |
| Рак,% | 18,6% | 24,6% | .002 | ||
| COMP,% | 7,9% | 7,1% | .56 | ||
| Инфекционные заболевания,% | 5,9% | 5,9% | 9,1% | .01 | |
| Болезнь почек,% | 7,0% | 20,1% | <. 001 001 | ||
| Госпитализация прошлого года,% | 13.2% | 22,2% | <0,001 |
Таблица 1. Исходные характеристики
в зависимости от статуса анемии.
| Характеристики . | Нет анемии ( N = 3156) . | Анемия ( N = 451) . | р * . | ||
|---|---|---|---|---|---|
| Возраст, средние годы ( SD ) | 78,0 (5,2) | 79.9 (5.8) | <.001 | ||
| Секс,% Женский | 64,9% | 61,0% | 61,0% | .10 | |
| Race,% Black | 6.1% | 20,6% | <.001 | ||
| статус курильщика | |||||
| % Бывший | 27,9% | 30,4% | |||
| % Текущий | 8,3% | 5,3% | |||
| Годы образования, среднее ( SD ) | 10. 1 (3.3) 1 (3.3) | 9.3 (3.4) | <.001 | ||
| Mass Mass | 25.1 (6.0) | 24.2 (5.8) | .004 | ||
| Коронарные сердечные заболевания,% | 20.1 % | 29.0446 | 29,0% | <.001 | |
| застойная сердечная недостаточность,% | 9,4% | 14,2% | .001 | ||
| ,% | 8,6% | 9,8% | .40 | ||
| Сахарный диабет, % | 16.6% | 22,6% 3 22,6% | .002 | .002 | |
| Рак,% | 18,6% | 24,6% | .002 | ||
| COMP,% | 7,9% | 7,1% | .56 | ||
| Инфекционные заболевания,% | 5,9% | 5,9% | 9,1% | .01 | |
| Болезнь почек,% | 7,0% | 20,1% | <. 001 001 | ||
| Госпитализация прошлого года,% | 13.2% | 22,2% | <.001 |
| . | Нет анемии ( N = 3156) . | Анемия ( N = 451) . | р * . | ||
|---|---|---|---|---|---|
| Возраст, средний лет ( SD ) | 78.0 (5.2) | 78,0 (5.2) | 98,0 (5.2) | 98.0443 79.9 (5.8) | <.001 |
| Секс,% Женский | 64.9% | 61,0% 3 61,0% | .10 | .10 | |
| 6.1% | 6.1% | 20,6% | |||
| 0,044446 | |||||
| % Бывший | 27.9% | 30,4% | |||
| % Текущий | 8,3% | 8,3% | 5,3% | ||
| Годы Образования означают ( SD ) | 10. 1 (3.3) 1 (3.3) | 9.3 (3.4) | <.001 | ||
| Mass Mass | 25.1 (6.0) | 24.2 (5.8) | .004 | ||
| Коронарные сердечные заболевания,% | 20.1 % | 29.0446 | 29,0% | <.001 | |
| застойная сердечная недостаточность,% | 9,4% | 14,2% | .001 | ||
| ,% | 8,6% | 9,8% | .40 | ||
| Сахарный диабет, % | 16.6% | 22,6% 3 22,6% | .002 | .002 | |
| Рак,% | 18,6% | 24,6% | .002 | ||
| COMP,% | 7,9% | 7,1% | .56 | ||
| Инфекционные заболевания,% | 5,9% | 5,9% | 9,1% | .01 | |
| Болезнь почек,% | 7,0% | 20,1% | <. 001 001 | ||
| Госпитализация прошлого года,% | 13.2% | 22,2% | <.001 |
Таблица 2.
Информация о последующей госпитализации и смертности в зависимости от статуса анемии.
| Госпитализация/смертность Переменная . | Нет анемии ( N = 3156) . | Анемия ( N = 451) . | р * . | |
|---|---|---|---|---|
| Средние годы наблюдения ( SD ) | 4.1 (1.0) | 3.6 (1.3) | <.001 | |
| Умерли во время продолжения,% | 22,1% | 37,0% | <.001 | |
| Госпитализированы во время последующего наблюдения,% | 5446% | 54,6% | 65,9% | <.001 |
| Количество госпитализаций во время наблюдения ( SD ) | 1,4 (2.0) | 2.0 (2. 5) 5) | <.001 | |
| Количество дней пребывания в стационаре во время наблюдения ( SD ) | 13.7 (28.1) | 25.0 (47,3) | <.001 | |
| № больничных дней на госпитализацию ( SD ) | 9,2 (9.6) | 10.9 (10.4) | 0,4) |
| Госпитализация/смертность Переменная . | Нет анемии ( N = 3156) . | Анемия ( N = 451) . | р * . | |
|---|---|---|---|---|
| Средняя годы последующего времени ( SD ) | 4.1 (1.0) 3 4.1 (1.0) | 3.6 (1.3) | <.001 | |
| Умерли во время наблюдения,% | 22,1% | 37.0% | 97,0% | <.001 3 <.001 |
| госпитализированы во время последующей деятельности,% | 54,6% | 65,9% | <. 001 001 | |
| Количество госпитализаций во время наблюдения ( SD ) | 1.4 (2.0) | 2.0 (2.5) | <.001 | |
| Количество больничных дней во время наблюдения ( SD ) | 13.7 (28.1) | 25.0 (47,3) | <.001 | |
| № больничных дней на госпитализацию ( SD ) | 9.2 (9.6) | 10.9 (10.4) | 0,4) | .01 |
Таблица 2.
Последующая госпитализация и информация о смертности в соответствии с статусом анемии.
| Госпитализация/смертность Переменная . | Нет анемии ( N = 3156) . | Анемия ( N = 451) . | р * . | ||||
|---|---|---|---|---|---|---|---|
| Средняя годы последующего времени ( SD ) | 4.1 (1.0) 3 4.1 (1.0) | 3.6 (1. 3) 3) | <.001 | ||||
| Умерли во время наблюдения,% | 22,1% | 37,0% | <0,001 | ||||
| Госпитализированы в период наблюдения, % | 54.6% | 65,9% | 65,9% | <.001 | |||
| Количество госпитализаций во время наблюдения ( SD ) | 1.4 (2.0) | 2.0 (2.5) | , больничные дни во время последующего наблюдения ( SD ) | 13,7 (28.1) | 13.7 (28.1) | 25.0 (47.3) | <.001 |
| № больничных дней на госпитализацию ( SD ) | 10,9 (10,4) | .01 |
| Госпитализация/смертность Переменная . | Нет анемии ( N = 3156) . | Анемия ( N = 451) . | р * . | |||||
|---|---|---|---|---|---|---|---|---|
| Средние годы наблюдения ( SD ) | 4. 1 (1.0) 3 4.1 (1.0) 1 (1.0) 3 4.1 (1.0) | 3.6 (1.3) | <.001 | |||||
| Умерли во время последующего наблюдения,% | 22.1% | 37.0446 | 37,0% | <.001 | ||||
| Госпитализированы во время последующего наблюдения,% | 54,6% | 65,9% | <0 | ) ) | 1.4 (2.0) | 2.0 (2.5) | 2,0 (2.5) | <.001 |
| Количество больничных дней во время последующего наблюдения ( SD ) | 13.7 (28.1) | <.001 | ||||||
| №койко-дней на одну госпитализацию ( SD ) | 9,2 (9,6) | 10,9 (10,4) | ,01 |
Таблица 3. Диагнозы
при выписке из больницы во время последующего наблюдения в зависимости от статуса анемии.
| . | Нет анемии ( N = 3156) . | . | Анемия ( N = 451) . | . | . | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Диагностика при выписке . | Н . | % . | Н . | % . | р . | |||||
| Сердечно-сосудистые условия | 768 | 24.3 | 245 | 145 | 145 | 32.2 | 32.2 | <001 | ||
| Острый инфаркт миокарда | 224 | 7.1 | 38 | 8,4 0,31 | ||||||
| стенокардия 180 | 5,7 | 37 | 8.2 .04 | |||||||
| Застойная сердечная недостаточность | 432 | 13,7 | 101 22.4 | <.001 | ||||||
| 219 | 219 | 6.9 | 6.9 | 34 | 7 9 | 7. 5 5 | 0,64 | 0,64 | ||
| 40 | 8,9 <0,001 | |||||||||
| Рак 313 | 9,9 | 74 | 16,4 <0,001 | |||||||
| 539 | 17,1 | 26.6 | <.001 | |||||||
| Pneumonia | 305 | 9.7 | 9,7 | 61 | 61 | 0,5 | 0.01 | |||
| Острые и хронические инфекции | 330 | 10.5 | 85 | 18,8 <0,001 | ||||||
| Диабет 324 | 10,3 | 60 | 13,3 | |||||||
| COMD | 320 | 320 | 10.1 | 10.1 | 47 | 47 | 10.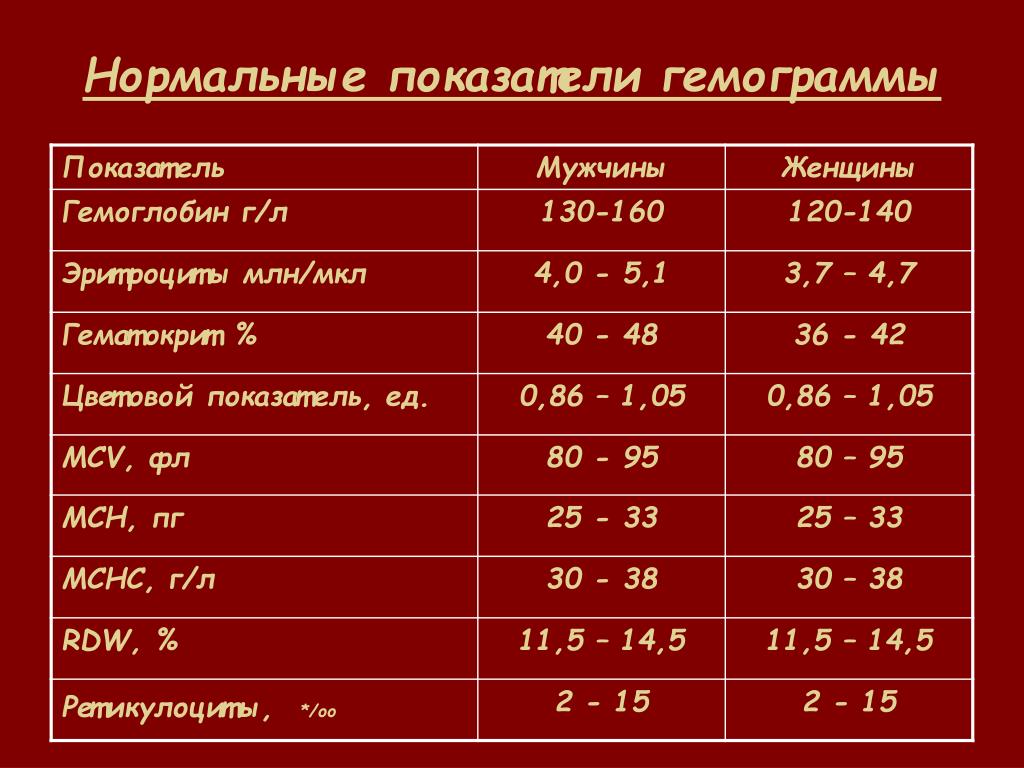 4 4 | 0,40446 | 0,85 | 9 |
| Dehydration | 285 | 9.0 | 50 | 11,1 | ||||||
| Переломы 249 | 7,9 45 | 10,0 | ||||||||
| Деменция 79 | 2,5 | 12 | .84 | |||||||
| Decubitus Zeracer | 27 | 0,9 | 9 | . 2,0 | . 0 | 0,02 | ||||
| . | Нет анемии ( N = 3156) . | . | Анемия ( N = 451) . | . | . | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Диагностика при выписке . | Н . | % . | Н . | % . | р .  | |||||||||||
| 768 | 24,3 | 145 | 32,2 | <.001 | ||||||||||||
| Острый инфаркт миокарда | 224 | 7.1 38 | 8,4 | |||||||||||||
| Angina | 180 | 180 | 5.7 | 57 | 37 | 8.2 | 8.2 | 0,04 | 0,04 | |||||||
| Застойная сердечная недостаточность | 432 | 13.7 | 101 | 22,4 | <.001 | |||||||||||
| Инсульт 219 | 6,9 | 34 | 7,5 | |||||||||||||
| 144 | 4,6 40 | 8.9 | <.001 | |||||||||||||
| рак | 313 | 99 | 94 | 74 | 74 | 16 4 | 16.4 | <0.001 | ||||||||
| Инфекционные заболевания | 539 | 17.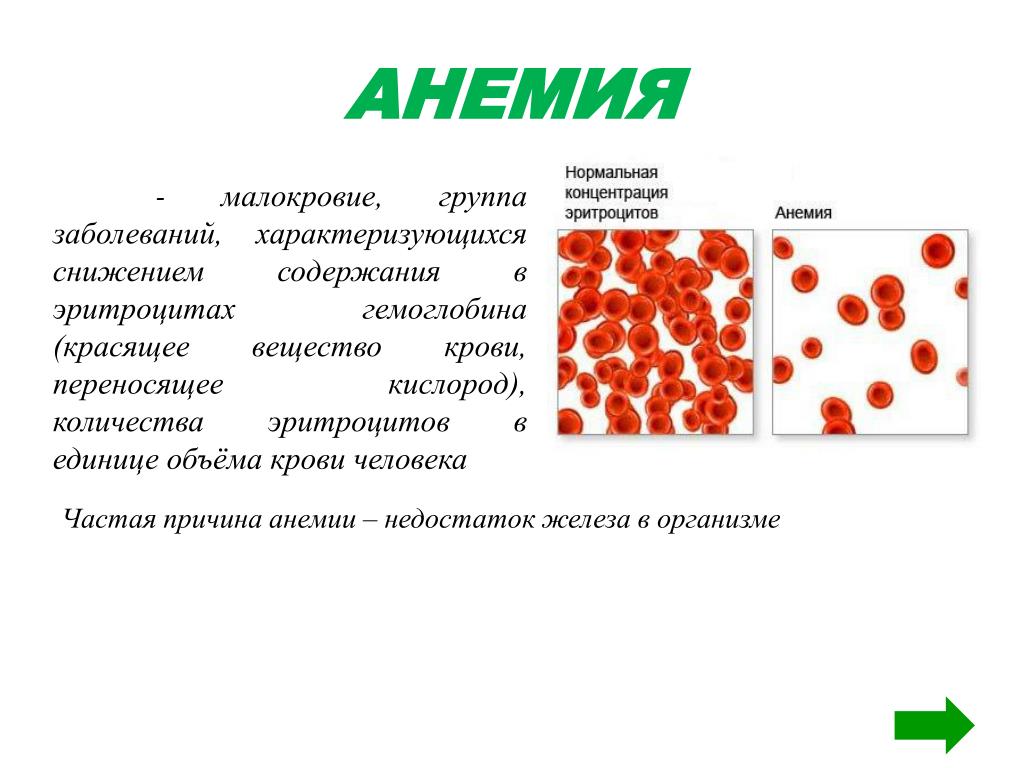 1 1 | 120 | 26,6 | <.001 | |||||||||||
| Пневмония 305 | 9,7 61 | 13,5 | ||||||||||||||
| Острые и хронические инфекции | 330 | 10,5 | 85 | 18.8 | <.001 | |||||||||||
| Другие условия | ||||||||||||||||
| Диабет | 324 | 324 | 10.3 | 60 | 13,3 | |||||||||||
| ХОЗЛ 320 | 10,1 | 47 | 10,4 | |||||||||||||
| Обезвоживание 285 | 9,0 | 50 | .16 | .16 | ||||||||||||
| Обшивки | 249 | 249 | 79 | 45 | 45 | .13 | .13 | |||||||||
| Деменция | 79 | 2.5 | 12 | 12 | 12 | 2 | 2. 7 7 | .84 | 9 9 | |||||||
| 27 | 0,9 | 9 6| 9 | 2.0 | 02 | 0,02 | | ||||||||||
Таблица 3.
Диагностики больницы в течение продолжения Статус анемии.
| . | Нет анемии ( N = 3156) . | . | Анемия ( N = 451) . | . | . | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Диагностика при выписке . | Н . | % . | Н . | % . | р . | ||||||
| Сердечно-сосудистые заболевания | 768 | 24,3 | 145 | 32,2 | <.001 | ||||||
| Острый инфаркт миокарда | 224 | 7.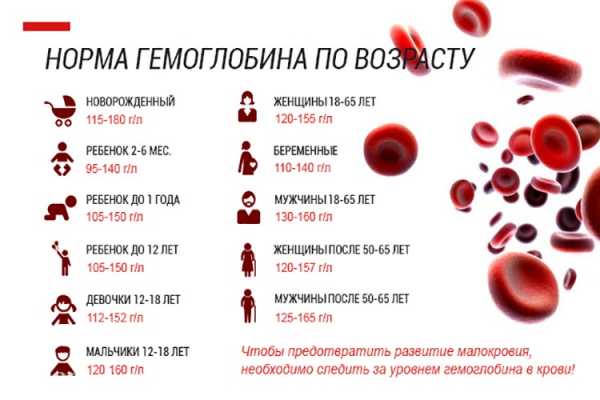 1 38 1 38 | 8,4 | ||||||||
| стенокардия 180 | 5,7 | 37 | 8.2 .04 | ||||||||
| Застойная Сердечная недостаточность | 432 | 13.7 | 101 | 101 | 22,4 | 22.001 | <001 | ||||
| 219 | 219 | 6.9 | 34 | 7,5 | |||||||
| 144 | 4,6 40 | 8,9 <0,001 | |||||||||
| Рак 313 | 9,9 | 74 | 16.4 | <.001 | |||||||
| 539 | 171 | 170 | 120 | 26.6 | 26.6 | <.001 | |||||
| Pneumonia | 305 | 9.7 | 61 | 13,5 | |||||||
| Острые и хронические инфекции | 330 | 10,5 | 85 | 18,8 <0,001 | |||||||
| Диабет | 3 | 324 | 10. 3 3 | 10.3 | 604446 | 13.3 | 0.05 | 0,05 | |||
| COMD | 320 | 10 | 10.1 | 47 | 10,4 | ||||||
| осушки 285 | 9,0 | 50 | 11,1 | ||||||||
| Переломы 249 | 7,9 45 | 10,0 | .13 | ||||||||
| 99 | 79 | 25 | 2 9 | 12 | 2 9 | 2,74 | 0,74 | 0,84 | 0,84 | ||
| Tecubitus Icer | 27 | 0.9 | 9 | 2.0 | .02 | ||||||
| . | Нет анемии ( N = 3156) . | . | Анемия ( N = 451) . | . | . | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Диагностика при выписке .  | Н . | % . | Н . | % . | р . | |||||
| 768 | 24,3 | 145 | 32,2 | <.001 | ||||||
| Острый инфаркт миокарда | 224 | 7.1 38 | 8,4 | |||||||
| Стенокардия | 180 | 5.7 | 37 | 8.2 .04 | ||||||
| Застойная сердечная недостаточность | 432 | 13,7 | 101 | 22,4 | <.001 | |||||
| Инсульт 219 | 6,9 | 34 | 7.5 | .64 | .64 | . 64 | ||||
| желудочно-кишечный кровоизлияние | 144 | 144 | 4,6 | 40 | 8 9 | 8 9 9 | <.001 | |||
| Рак | 9. 9 9 | 74 | 16,4 <0,001 | |||||||
| 539 | 17,1 | 120 | 26,6 | <.001 | ||||||
| Пневмония 305 | 9,7 61 | 13,5 | ||||||||
| Острые и хронические инфекции | 330 | 10,5 | 85 | 18,8 <0,001 | ||||||
| Диабет | 324 | 10.3 | 60 | 13,3 | ||||||
| ХОЗЛ 320 | 10,1 | 47 | 10,4 | |||||||
| Обезвоживание 285 | 9,0 | 50 | .16 | .16 | ||||||
| Обшивки | 249 | 249 | 79 | 45 | 45 | .13 | .13 | |||
| Деменция | 79 | 2. 5 5 | 12 | 12 | 2 | 2.7 | .84 | 94 | ||
| Decubitus Icer | 27 | 0,9 | 9 | 2.0 | 0,02 | |||||
Таблица 4.
Скорректированный риск смертности и госпитализации в зависимости от статуса анемии*.
| . | . | Смертность . | . | Госпитализация . | . | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| . | Н . | Скорректированный ОР (95% ДИ) . | р . | Скорректированный ОР (95% ДИ) . | р . | |||||
| Общая выборка | ||||||||||
| Нет анемия | 3156 | 1 | 1 | |||||||
| Анемия 451 | 1. 63 (1.37-1.95) 63 (1.37-1.95) | <.001 3 <.001 | 1.23 (1.09-1.41) | .001 | 9 | |||||
| человек без базовых заболеваний † | ||||||||||
| Нет анемии | 1396 | 1 | 1 | |||||||
| Анемия | 142 | 142 | 142 | 212 (1.48-3.04) | <0,01 | 1.30 (1.02-1.66) | .03 | |||
| Лица с исходными заболеваниями † | ||||||||||
| Нет анемия | 1760 | 1 | 1 | |||||||
| Анемия | 309 | 1,43 (1.16-1.76) | .001 | 1.21 (1.04-1.41) | . 09446 | .01 | 9 | 9 | ||
| События в первых 2 года последующего до | ||||||||||
| Нет Anemia | 3156 | 1 | 1 | |||||||
| Анемия | 451 | 451 | 1. 63 (1.23-2.17) 63 (1.23-2.17) | .001 | .001 | 1.26 (1.07-1.50) | .007 | .007 | 9 6 | |
| События после первых 2 лет последующих | ||||||||||
| Нет anemia | 3156 | 1 | 1 | |||||||
| анемия | 451 | 451 | 451 | 1,51 (1.19-1,92) | .001 | 1.20 (0,98-1,46) | .08 | |||
| . | . | Смертность . | . | Госпитализация . | . | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| . | Н . | Скорректированный ОР (95% ДИ) . | р . | Скорректированный ОР (95% ДИ) .  | р . | |||||
| Общая выборка | ||||||||||
| Нет анемия | 3156 | 1 | 1 | |||||||
| Анемия | 451 | 1,63 (1,37 -1,95) | <.001 | 1,23 (1.09-1.41) | .001 | |||||
| Лица без базовых заболеваний † | ||||||||||
| Нет анемия | 1396 | 1 | 1 | |||||||
| Анемия | 142 | 2.12 (1.48-3.04) | <.001 3 <.001 | 1.30 (1.02-1.66) | .03 | |||||
| человек с базовыми заболеваниями † | ||||||||||
| No Anemia | 1760 | 9 | анемия | 309 | 309 | 1,43 (1. 16-1.76) 16-1.76) | .001 | .001 (1.04-1.41) | .01 | |
| События в первые 2 лет из последующих | ||||||||||
| Нет анемия | 3156 | 1 | 1 | |||||||
| анемия 451 | 1.63 (1.23-2.17) | .001 | .001 | 1.26 (1.07-1.50) | .007 | .007 | 9 6 | |||
| События после первых 2 лет последующих | ||||||||||
| Нет anemia | 3156 | 1 | 1 | |||||||
| анемия | 451 | 451 | 451 | 1,51 (1.19-1,92) | .001 | 1.20 (0,98-1,46) | .08 | |||
Таблица 4.
Скорректированный риск смертности и госпитализации в зависимости от статуса анемии*.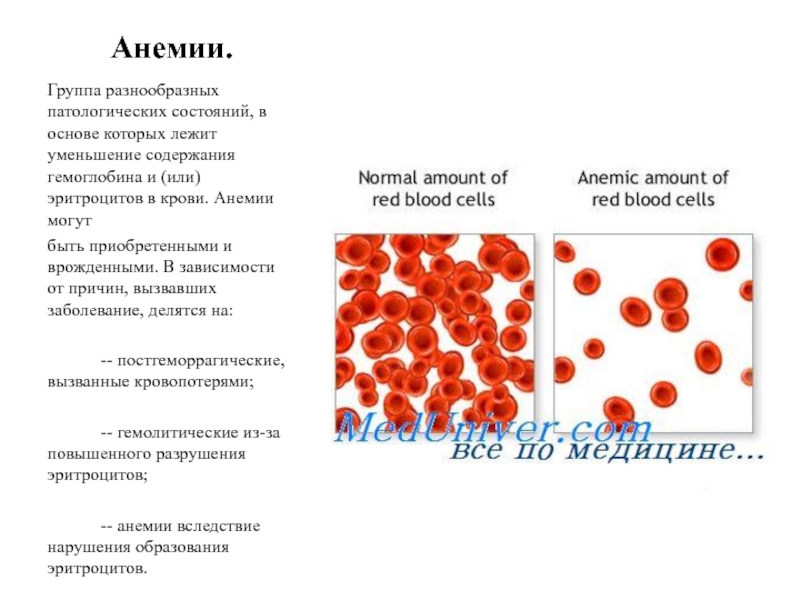
| . | . | Смертность . | . | Госпитализация . | . | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| . | Н . | Скорректированный ОР (95% ДИ) . | р . | Скорректированный ОР (95% ДИ) . | р . | ||||||
| Общая выборка | |||||||||||
| Нет анемия | 3156 | 1 | 1 | ||||||||
| Анемия | 451 | 1,63 (1,37 –1,95) | <.001 | 1,23 (1.09-1.41) | .001 | ||||||
| Лица без базовых заболеваний † | |||||||||||
| Нет анемией | 1396 | 1 | |||||||||
| анемия | 142 | 142 | 212 (1. 48-3.04) 48-3.04) | <.001 | 1.30 (1.0246 | 1.30 (1.0243. 0 | .03 | ||||
| человек с базовыми заболеваниями † | |||||||||||
| No Anemia | 1760 | 1 | 1 | ||||||||
| Анемия | 309 | 1.43 (1.16-1.76) | .001 | .001 | 1.21 (1.04-1.41) | .01 | . 0 | ||||
| События в первых 2 года последующей деятельности | |||||||||||
| нет анемия | 3156 | 1 | 1 | ||||||||
| анемия | 451 | 1,63 (1.23-2.17) | .001 | 1,26 (1.07-1.50) | .007 | ||||||
| События после первых 2 лет и последующих | |||||||||||
| Нет анемия | 3156 | 1 | 1 | ||||||||
| анемии | 451 | 1. 51 (1,19–1,92) 51 (1,19–1,92) | ,001 | 1,20 (0,98–1,46) | ,08 | ||||||
| . | . | Смертность . | . | Госпитализация . | . | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| . | Н . | Скорректированный ОР (95% ДИ) . | р . | Скорректированный ОР (95% ДИ) . | р . | ||||||
| Общая выборка | |||||||||||
| Нет анемия | 3156 | 1 | 1 | ||||||||
| Анемия | 451 | 1,63 (1,37 –1,95) | <.001 | 1,23 (1.09-1.41) | .001 | ||||||
| Лица без базовых заболеваний † | |||||||||||
| Нет анемией | 1396 | 1 | |||||||||
| анемия | 142 | 142 | 212 (1. 48-3.04) 48-3.04) | <.001 | 1.30 (1.0246 | 1.30 (1.0243. 0 | .03 | ||||
| человек с базовыми заболеваниями † | |||||||||||
| No Anemia | 1760 | 1 | 1 | ||||||||
| Анемия | 309 | 1.43 (1.16-1.76) | .001 | .001 | 1.21 (1.04-1.41) | .01 | . 0 | ||||
| События в первых 2 года последующей деятельности | |||||||||||
| нет анемия | 3156 | 1 | 1 | ||||||||
| анемия | 451 | 1,63 (1.23-2.17) | .001 | 1,26 (1.07-1.50) | .007 | ||||||
| События после первых 2 лет и последующих | |||||||||||
| Нет анемия | 3156 | 1 | 1 | ||||||||
| анемии | 451 | 1. 51 (1,19–1,92) 51 (1,19–1,92) | .001 | 1,20 (0,98–1,46) | ,08 | ||||||
Работа выполнена при поддержке Национального института старения AG-6-2102 и N01-AG-6-2103) и при поддержке Ortho Biotech Products, LP
Drs. Пеннинкс, Гуральник и Пахор были оплачиваемыми консультантами Ortho Biotech Products, LP. Доктор Вудман является сотрудником Ortho Biotech Products, LP
Ссылки
1
Всемирная организация здравоохранения. Пищевые анемии. Доклад научной группы ВОЗ . Серия технических отчетов № 405. Женева, Швейцария: Всемирная организация здравоохранения; 1968.
2
Salive ME, Cornoni-Huntley J, Guralnik JM, et al. Анемия и уровень гемоглобина у пожилых людей: связь с возрастом, полом и состоянием здоровья.
J Am Geriatr Soc.
1992
;
40
:
489
-496.3
Йостен Э., Пелеманс В., Хиле М., Нойен Дж., Верхаге Р., Бугертс М.А. Распространенность и причины анемии у гериатрической госпитализированной популяции.
Геронтология.
1992
;
38
:
111
-117.4
Аня Б.Дж., Суман В.Дж., Фэрбенкс В.Ф., Радемахер Д.М., Мелтон Л.Дж., III. Заболеваемость анемией у пожилых людей: эпидемиологическое исследование в четко определенной популяции.
J Am Geriatr Soc.
1997
;
45
:
825
-831.5
Гуральник Дж.М., Эйзенштадт Р.С., Ферруччи Л., Кляйн Х.Г., Вудман Р.С. Распространенность анемии среди лиц в возрасте 65 лет и старше в Соединенных Штатах: свидетельство высокой частоты необъяснимой анемии.
Кровь.
2004
;
104
:
2263
-2268.6
Penninx BW, Guralnik JM, Onder G, Ferrucci L, Wallace RB, Pahor M. Анемия и снижение физической работоспособности среди пожилых людей.
Am J Med.
2003
;
115
:
104
-110,7
Penninx BW, Pahor M, Cesari M, et al. Анемия связана с инвалидностью и снижением физической работоспособности и мышечной силы у пожилых людей.
J Am Geriatr Soc.
2004
;
52
:
719
-724.8
Изакс Г.Дж., Вестендорп Р.Г., Кнук Д.Л. Определение анемии у пожилых людей.
ЯМА.
1999
;
281
:
1714
-1717.9
Чавес П.Х., Сюэ К.Л., Гуральник Дж.М., Ферруччи Л., Вольпато С., Фрид Л.П. Что представляет собой нормальный уровень гемоглобина у пожилых женщин-инвалидов, проживающих в общине?
J Am Geriatr Soc.
2004
;
52
:
1811
-1816.10
Косибород М., Смит Г.Л., Рэдфорд М.Дж., Фуди Дж.М., Крумхольц Х.М. Прогностическое значение анемии у больных сердечной недостаточностью.
Am J Med.
2003
;
114
:
112
-119.11
Чавес П.Х., Ашар Б., Гуральник Дж.М., Фрид Л.П. Рассмотрение взаимосвязи между концентрацией гемоглобина и преобладающими затруднениями при передвижении у пожилых женщин. Следует ли пересмотреть критерии, используемые в настоящее время для определения анемии у пожилых людей?
J Am Geriatr Soc.
2002
;
50
:
1257
-1264. 12
12
Cornoni-Huntley J, Ostfeld AM, Taylor JO, et al. Установленные группы населения для эпидемиологических исследований пожилых людей: дизайн и методология исследования.
Старение (Милан).
1993
;
5
:
27
-37.13
Всемирная организация здравоохранения. Руководство по Международной статистической классификации болезней, травм и причин смерти . Женева, Швейцария: Всемирная организация здравоохранения; 1977.
14
Роуз Г. Диагностика ишемической боли в сердце и перемежающейся хромоты при полевых обследованиях.
Bull World Health Organ.
1962
;
27
:
645
-658.15
Timiras ML, Brownstein H. Распространенность анемии и корреляция гемоглобина с возрастом в гериатрической клинике скрининга населения.
J Am Geriatr Soc.
1987
;
35
:
639
-643.16
Forbes GB, Halloran E. Снижение мышечной массы у взрослых.
Гум Биол.
1976
;
48
:
162
-173. 17
17
Карио К., Мацуо Т., Кодама К., Накао К., Асада Р. Снижение секреции эритропоэтина при старческой анемии.
Am J Гематол.
1992
;
41
:
252
-257.18
Penninx BW, Ferrucci L, Leveille SG, Rantanen T, Pahor M, Guranik JM. Показатели нижних конечностей у здоровых пожилых людей как предиктор последующей госпитализации.
J Gerontol Med Sci.
2000
;
55A
:
M691
-M697.19
Leng S, Chaves P, Koenig K, Walston J. Сывороточный интерлейкин-6 и гемоглобин как физиологические корреляты при гериатрическом синдроме слабости: экспериментальное исследование.
J Am Geriatr Soc.
2002
;
50
:
1268
-1271.20
Chaves PH, Semba RD, Leng SX, et al. Влияние анемии и сердечно-сосудистых заболеваний на состояние слабости пожилых женщин, проживающих в общине: исследования женского здоровья и старения I и II.
J Gerontol A Biol Sci Med Sci.
2005
;
60А
:
729
-735.
Геронтологическое общество Америки
Связь анемии со способностью к передвижению у пожилых людей: национальное поперечное исследование населения Кореи | BMC Geriatrics
Дизайн исследования
Это популяционное перекрестное исследование с использованием Национальной базы данных медицинской информации (NHID) в Корее.Участниками были 66-летние мужчины и женщины, прошедшие обследование NSPTA в период с 2007 по 2015 год. Все оценки проводились в день обследования NSPTA. Мы стремились сравнить результаты теста TUG между нормальными и анемичными группами, используя множественный логистический регрессионный анализ.
Источники данных
Корейская национальная служба медицинского страхования (KNHIS) — это общедоступный план медицинского страхования, обеспечивающий всеобщее медицинское страхование почти всем корейцам, за исключением получателей Medicaid, которые составляют < 3% населения.KNHIS отвечает за Национальную программу скрининга (NSP), программу скрининга здоровья, проводимую раз в два года. KNHIS добавил NSPTA к NSP в 2007 году. Целью добавления NSPTA является адаптация NSP к возрасту и полу участников и усиление консультирования после обследования. Только участники NSPTA в возрасте 66 лет проходят тесты TUG и тесты на одноногую стойку для оценки способности к мобильности.
KNHIS добавил NSPTA к NSP в 2007 году. Целью добавления NSPTA является адаптация NSP к возрасту и полу участников и усиление консультирования после обследования. Только участники NSPTA в возрасте 66 лет проходят тесты TUG и тесты на одноногую стойку для оценки способности к мобильности.
KNHIS создал NHID. NHID включает данные об использовании медицинских услуг, результаты медицинского осмотра NSPTA, социально-демографическую информацию и данные о смертности более 50 миллионов человек в Корее [26].Детали NSPTA описаны в другом месте [27].
Исследуемая группа
База данных Национальной службы медицинского страхования и Национальной когорты скрининга здоровья (NHIS-HEALS) NHID включала 515 867 случайно выбранных субъектов, что составляет примерно 10% корейских участников в возрасте 40–79 лет, которые участвовали как минимум в NSP. один раз в 2002–2003 гг. В исследование были включены субъекты в возрасте 66 лет, прошедшие обследование NSPTA в период с 2007 по 2015 год. Мы исключили участников с ограниченными возможностями на исходном уровне (т.д., зарегистрированные лица с ограниченными возможностями и лица с ограниченными возможностями в повседневной деятельности). После исключения субъектов, которые были зарегистрированы как лица с ограниченными возможностями в Корейском национальном реестре инвалидов (KNDR), лиц с отсутствующими результатами теста TUG и лиц с нарушениями в ADL, было включено 81 473 субъекта (рис. 1).
Мы исключили участников с ограниченными возможностями на исходном уровне (т.д., зарегистрированные лица с ограниченными возможностями и лица с ограниченными возможностями в повседневной деятельности). После исключения субъектов, которые были зарегистрированы как лица с ограниченными возможностями в Корейском национальном реестре инвалидов (KNDR), лиц с отсутствующими результатами теста TUG и лиц с нарушениями в ADL, было включено 81 473 субъекта (рис. 1).
Рис. 1
Поток субъектов исследования. а. Субъекты базы данных Национальной службы медицинского страхования – Национальной когорты медицинского осмотра Корейской национальной службы медицинского страхования (2002–2015 гг.).*Сокращение: NSPTA, Национальная программа скрининга переходного возраста в Корее; KNDR, Корейский национальный реестр инвалидов; ADL, Активность повседневной жизни; TUG, Timed up and go
База данных включала демографические характеристики участников, предыдущую историю болезни и поведение в отношении здоровья, а также результаты скрининговых тестов. Регистрируемые факторы включали рост, вес, окружность живота, а также результаты тестов физических функций (т. е. TUG и тесты стояния на одной ноге) и лабораторных тестов.
Регистрируемые факторы включали рост, вес, окружность живота, а также результаты тестов физических функций (т. е. TUG и тесты стояния на одной ноге) и лабораторных тестов.
Протокол исследования был одобрен Наблюдательным советом больницы Сеульского национального университета (IRB № E-1703-020-836), который отменил требование информированного согласия, поскольку база данных KNHIS была создана после анонимизации в соответствии со строгими принципами конфиденциальности. . Мы, авторы, получили разрешение на доступ к базе данных Национальной службы распределения медицинского страхования (NHIS-2018-2-201). И это исследование использовало базу данных NHID, созданную KNHIS, с разрешения.По этой причине данное исследование не зарегистрировано отдельно в реестре клинических испытаний.
Переменные
Независимые переменные
Анемия
Анемия и концентрация гемоглобина (Hb) были независимыми переменными в этом исследовании. Анемия определялась в соответствии с критериями ВОЗ как концентрация гемоглобина < 13,0 г/дл у мужчин и < 12,0 г/дл у женщин [28] на основании результатов лабораторных анализов, зарегистрированных NSPTA. Оптимальную концентрацию Hb, связанную с самым быстрым временем TUG, определяли путем оценки концентрации Hb как непрерывной переменной.
Анемия определялась в соответствии с критериями ВОЗ как концентрация гемоглобина < 13,0 г/дл у мужчин и < 12,0 г/дл у женщин [28] на основании результатов лабораторных анализов, зарегистрированных NSPTA. Оптимальную концентрацию Hb, связанную с самым быстрым временем TUG, определяли путем оценки концентрации Hb как непрерывной переменной.
Переменная результата
Мобильность
Результат теста TUG был переменной результата в этом исследовании, отражающей способность к мобильности участников исследования. Каждый субъект выполнял тест TUG в день физического осмотра NSPTA в клинических условиях районной больницы каждого субъекта в соответствии с руководством NSPTA. Участникам было предложено сесть на стул (т. е. на обычное клиническое кресло без подлокотников), встать, пройти 3 м с комфортной скоростью, вернуться к стулу и снова сесть на стул в обычной обуви и/или использование вспомогательных средств для ходьбы. Время от стояния до повторного сидения измеряли один раз, и время более 10 с классифицировали как отклонение от нормы. Согласно руководству NSPTA, результат теста TUG > 10 с считается требующим внимания, а результат теста TUG > 20 с считается нарушенным. Тем не менее, предыдущее исследование с использованием данных NSPTA показало, что только небольшое количество участников было классифицировано как ослабленное, когда 20 с были использованы в качестве порогового значения результата теста TUG для 66-летних в Корее [2]. По этой причине мы использовали 10 s в качестве порога.Подробности проведения теста TUG в NSPTA описаны в другом месте [29].
Время от стояния до повторного сидения измеряли один раз, и время более 10 с классифицировали как отклонение от нормы. Согласно руководству NSPTA, результат теста TUG > 10 с считается требующим внимания, а результат теста TUG > 20 с считается нарушенным. Тем не менее, предыдущее исследование с использованием данных NSPTA показало, что только небольшое количество участников было классифицировано как ослабленное, когда 20 с были использованы в качестве порогового значения результата теста TUG для 66-летних в Корее [2]. По этой причине мы использовали 10 s в качестве порога.Подробности проведения теста TUG в NSPTA описаны в другом месте [29].
Потенциальные вмешивающиеся переменные
В наш анализ мы включили потенциальные вмешивающиеся факторы, которые, как было показано в предыдущих исследованиях, влияют на физическую работоспособность и для которых данные были доступны в базе данных, такие как хронические заболевания, ожирение, когнитивные нарушения и депрессия. Данные о хронических заболеваниях, таких как артериальная гипертензия, сахарный диабет и дислипидемия, были собраны из анкеты и результатов лабораторных исследований NSPTA.Каждое состояние определяли, как описано ранее [30]. Субъекты, которые принимали лекарства от гипертонии, сахарного диабета или дислипидемии, считались имеющими соответствующее заболевание. Кроме того, артериальная гипертензия определялась как систолическое артериальное давление (САД) ≥140 мм рт.ст. или диастолическое артериальное давление (ДАД) ≥90 мм рт.ст.; сахарный диабет как концентрация глюкозы в сыворотке крови натощак ≥126 мг/дл; и дислипидемия как концентрация общего холестерина (ТС) в сыворотке ≥240 мг/дл.
Данные о хронических заболеваниях, таких как артериальная гипертензия, сахарный диабет и дислипидемия, были собраны из анкеты и результатов лабораторных исследований NSPTA.Каждое состояние определяли, как описано ранее [30]. Субъекты, которые принимали лекарства от гипертонии, сахарного диабета или дислипидемии, считались имеющими соответствующее заболевание. Кроме того, артериальная гипертензия определялась как систолическое артериальное давление (САД) ≥140 мм рт.ст. или диастолическое артериальное давление (ДАД) ≥90 мм рт.ст.; сахарный диабет как концентрация глюкозы в сыворотке крови натощак ≥126 мг/дл; и дислипидемия как концентрация общего холестерина (ТС) в сыворотке ≥240 мг/дл.
Индекс массы тела (ИМТ), когнитивные нарушения и ADL определяли, как описано ранее [29].ИМТ рассчитывали как вес, деленный на рост в квадрате (кг/м 2 ). Нормальный ИМТ был определен как от 18,5 до 23 кг/м 2 , а ожирение было определено как ≥25 кг/м 2 в соответствии с азиатскими критериями.
Когниция оценивалась с использованием корейского опросника для скрининга деменции (KDSQ-C). KDSQ-C представляет собой самоуправляемый тест, состоящий из 15 пунктов, каждый из которых оценивается по трехбалльной шкале Лайкерта (0, 1 или 2, при этом более высокий балл считается худшим). Когда совокупный балл участников ≥ 6, они считались когнитивными нарушениями.KDSQ-C является утвержденным опросником [31] и интегрирован в опросник NSPTA.
Анкета NSPTA включала шесть пунктов ADL, полученных из корейских версий анкет ADL (K-ADL) и инструментальной ADL (K-IADL) [32]. Следующие четыре вопроса, взятые из K-ADL: «Вы принимаете ванну самостоятельно без посторонней помощи?», «Одеваетесь ли вы сами без посторонней помощи?», «Едите ли вы сами без посторонней помощи, если еда приготовлена?» и « Вы сами ходите в туалет без посторонней помощи?» Следующие два пункта взяты из K-IADL: «Готовите ли вы себе еду самостоятельно, без посторонней помощи?» и «Выходите ли вы сами на улицу в места, до которых можно дойти пешком?» Если участники ответили «Нет» на один или несколько из этих вопросов, они были классифицированы как имеющие нарушения в ADL.
Для оценки депрессивного настроения использовались три вопроса, взятые из утвержденной корейской версии гериатрической шкалы депрессии [33]. Вопросы были следующими: «Чувствуете ли вы, что ваша активность или желание в последнее время уменьшились?», «Чувствуете ли вы, что в настоящее время вы бесполезны?» и «Чувствуете ли вы, что в настоящее время вы безнадежны?» Если участники отвечали «да» на любой из этих вопросов, они были отнесены к категории страдающих депрессией.
Статистический анализ
Базовые характеристики выражены в виде частот и процентов.Непрерывные переменные представляются как среднее ± стандартное отклонение (SD), а категориальные переменные — как частоты и проценты.
Множественные модели логистической регрессии использовались для оценки связи между результатами теста TUG и анемией. В этих анализах все переменные были выражены как категориальные переменные, как определено выше. Для этих анализов были построены четыре модели: грубая модель и три скорректированные модели. Модель 1 была скорректирована с учетом пола; Модель 2 была скорректирована с учетом пола, депрессивного настроения и когнитивных нарушений; и Модель 3 была скорректирована по всем факторам Модели 2, а также ИМТ, хроническим заболеваниям (т.э., артериальная гипертензия, сахарный диабет, дислипидемия) и концентрация креатинина. Для каждой модели были рассчитаны отношения шансов (OR) и 95% доверительные интервалы (CI).
Участники с аномальными результатами теста TUG, которые, как считается, указывают на риск, были идентифицированы с помощью стратифицированного анализа в Модели 3, где участники были стратифицированы по полу, депрессивному настроению, когнитивным нарушениям, ожирению, хроническим заболеваниям и сердечно-сосудистым заболеваниям.
Кроме того, мы построили графики предсказания дробного полинома с 95% ДИ, чтобы продемонстрировать предсказание результатов теста TUG в соответствии с концентрациями Hb, выраженными как непрерывные переменные.
Статистический анализ проводили с использованием программного обеспечения Stata (версия 15.1; StataCorp, Колледж-Стейшн, Техас). Значение P < 0,05 считалось значимым.
Есть ли у этого пожилого пациента железодефицитная анемия и какова ее основная причина?
Основой правильного ведения дефицита железа является точная валидация диагноза с последующим выявлением основной причины, отсюда требование, чтобы тесты на статус железа сочетали высокую степень чувствительности с сопоставимыми степенями специфичности, поскольку «дальнейшая идентификация причина истощения или запасов железа обязательно приведет к утомительному клиническому и лабораторному исследованию».1
Определение
Дефицит железа является результатом длительного периода отрицательного баланса железа, кульминацией которого является истощение запасов железа в организме. Однако только когда концентрация гемоглобина падает ниже нижней границы нормального диапазона (то есть <120 г/л и <130 г/л у пожилых женщин и мужчин соответственно)2, пациент может быть полностью определен как больной. прогрессирование до статуса железодефицитной анемии.3
Распространенность среди пожилых людей
Задокументированная распространенность дефицита железа составляет 4–7% среди мужчин и женщин Северной Америки в возрасте >70 лет, при этом соответствующая распространенность анемии, возникающей в результате недостаточности кроветворения, составляет 2% в этой возрастной группе при пороговых концентрациях гемоглобина 118 г/л. л и 124 г/л для самок и самцов соответственно.4 При обследовании мужчин и женщин в возрасте старше 70 лет железодефицитная анемия превышала по распространенности анемию хронических заболеваний5, но у пациентов старше 65 лет, встречающихся в больничной практике, наблюдалась обратная картина6.
Подтверждение дефицита железа
Хотя отсутствие окрашиваемого железа в костном мозге считается окончательным маркером дефицита железа6, это не может быть безошибочным критерием, учитывая несоответствие в окрашиваемом железе между срезами игольной биопсии и одновременно аспирированными мазками, поэтому рекомендуется не только аспирировать большое количество стромы, но и подтвердить результаты, где это возможно, биопсией костного мозга.7
Валидация с помощью гипоферритинемии является альтернативной стратегией5, пороговая концентрация, рекомендованная комитетом экспертов Всемирной организации здравоохранения, составляет 12 мкг/л8, что совпадает с концентрацией, предложенной Lipschitz et al на основе их анализа 250 госпитализированных пациентов с анемией и/или нарушениями метаболизма железа.9 Из-за способности сывороточного ферритина также вести себя как белок острой фазы сосуществование дефицита железа и различных воспалительных заболеваний (включая хроническое заболевание почек и заболевание печени, соответственно) может быть связанным с нормальной концентрацией ферритина в сыворотке10, что требует использования других диагностических параметров (помимо аспирации костного мозга и/или биопсии) для подтверждения этого гематинового дефицита.Одним из таких параметров является отношение правдоподобия, полученное из истинно положительного результата по сравнению с ложноположительным показателем дефицита железа при заданном уровне ферритина в сыворотке, при этом одним результатом является >95% вероятность дефицита железа у пожилых пациентов с сывороточным ферритином <18 мкг/мл. l.11 В более поздних разработках используется оценка концентраций рецепторов трансферрина в сыворотке (TfR), которые увеличиваются прямо пропорционально количествам TfR, экспрессируемым на эритроидных предшественниках, чтобы позволить последним более успешно конкурировать за снижение концентрации железа в тканях во время Эволюция железодефицитного состояния.В сочетании с логарифмическим преобразованием уровня ферритина в сыворотке (log ферритина) для получения параметра, обозначаемого как TfR/log ферритина (индекс TfR-F), можно добиться надежного разделения между субъектами, характеризующимися сосуществованием железодефицитной анемии и анемии. хронических заболеваний по сравнению с пациентами с единственным диагнозом анемии хронических заболеваний.1 Самым убедительным косвенным доказательством железодефицитной анемии является повышение уровня гемоглобина более чем на 20 г/л после трех недель заместительной терапии железом.12 Документация клинических признаков дефицита железа также наводит на размышления, принимая во внимание тот факт, что койлонихия также может возникать после воздействия едких агентов, тогда как атрофический глоссит и ангулярный стоматит могут также проявляться при мегалобластной недостаточности и дефиците рибофлавина соответственно.3
Вставка 1: Дифференциальный диагноз микроцитарной гипохромной анемии
Гематологические проявления
Хотя дефицит железа обычно характеризуется средним корпускулярным объемом (MCV) и средней концентрацией корпускулярного гемоглобина (MCH) <80 мкл и <26 пг соответственно,13 вопрос о том, какой из двух параметров имеет большее прогностическое значение, является спорным. .7 Сопоставимые изменения MCV и MCH наблюдаются при анемии, связанной с сепсисом, хроническим воспалением, злокачественными новообразованиями, хронической болезнью почек,10 14 15 и даже при циррозе печени,16 а также при талассемии и сидеробластной анемии соответственно (вставка 1)7. 17 Тромбоцитоз является еще одним гематологическим проявлением дефицита железа, документируемым даже при отсутствии острого кровотечения, 18 и тот факт, что он может также возникать у лиц с дефицитом железа, страдающих анемией при хронических заболеваниях,19 увеличивает диагностическую путаницу между двумя заболеваниями.В последнем случае сосуществование тромбоцитоза и нарушения гемоглобинизации эритроцитов объясняется ролью цитокинов в тромбопоэзе и в мобилизации железа из ретикулоэндотелиальных макрофагов.20
Основные причины дефицита железа
Примером железодефицитной анемии, находящейся в стадии изучения, является исследование, показывающее, что в одном медицинском округе желудочно-кишечные исследования для выявления основной причины этой гематической недостаточности проводились только у 63% из 109 железодефицитных пациентов в возрасте >50,21, независимо от возраста связанная распространенность желудочно-кишечных причин этого расстройства.Интуитивное ожидание того, что первопричина будет выявлена путем систематического анализа симптомов и признаков17, должно быть умерено признанием того факта, что даже при отсутствии симптомов до 44% взрослых с железодефицитной анемией имеют желудочно-кишечные поражения, способные вызывая хроническую кровопотерю.22 При наличии симптомов положительная прогностическая ценность для поражений верхних отделов желудочно-кишечного тракта (диапазон 18-86%, медиана 60%) может быть почти в два раза выше, чем для патологии нижних отделов желудочно-кишечного тракта (диапазон 28). %–52%, медиана 35%).23-28 Это может быть отражением того факта, что анализ 1207 пациентов, составленный из 10 исследований, в каждом из которых участвовало более 70 пациентов с целью выявления основных причин железодефицитной анемии и/или скрытого желудочно-кишечного кровотечения, дал соотношение 491. v 283 для пациентов с поражением верхних отделов желудочно-кишечного тракта v нижних отделов желудочно-кишечного тракта, обе локализации одновременно поражались примерно в 104 случаях. поражения регистрировались в два раза чаще, чем поражения нижних отделов желудочно-кишечного тракта.33 Однако ввиду более высокой распространенности злокачественных новообразований нижних отделов желудочно-кишечного тракта по сравнению с верхними, пациентам с дефицитом железа в возрасте старше 50 лет, включая пациентов с доброкачественными поражениями верхних отделов желудочно-кишечного тракта, почти всегда следует предлагать колоноскопию, поскольку именно в этой возрастной группе колоректальная патология может сосуществовать с доброкачественными поражениями верхних отделов желудочно-кишечного тракта.33 Когда эта стратегия была испытана в проспективном исследовании 89 пациентов со средним возрастом 65 лет, у 26 пациентов были обнаружены поражения как верхних, так и нижних отделов желудочно-кишечного тракта.Исследователи были настолько тщательны, что целых 14 испытуемых были подвергнуты ирригационной клизме тонкой кишки. получают все большее признание, энтероскопия34, клизма тонкой кишки (энтероклизис)35 и компьютерно-томографический энтероклизис36 являются лишь тремя из расширяющегося списка методов, направленных на то, чтобы исключить ошибку, связанную с игнорированием наличия опухолей тонкой кишки (рис. 1). с убывающей частотой.Индекс подозрения также необходимо поддерживать в отношении кровопотери вне желудочно-кишечного тракта, например, из мочевыводящих путей (рис. 2) и матки.
Рисунок 1
Гистологическое изображение веретенообразных клеток (указаны стрелками) злокачественной стромальной опухоли тонкой кишки (гематоксилин и эозин × 200), диагностированной только при вскрытии, у 88-летней женщины с трехлетней историей железодефицитной анемии, требующей частых переливаний крови при Заместительная терапия железом оказалась недостаточной для поддержания нормальной концентрации гемоглобина.
фигура 2
Ультрасонографическое изображение опухоли мочевого пузыря (указано стрелкой) у 73-летнего мужчины с железодефицитной анемией и гематурией.
Одним из наиболее важных достижений последнего времени является признание степени этиопатогенетической роли глютеновой болезни в развитии железодефицитной анемии, включая документальное подтверждение того факта, что при распространенности 39% эта гематологическая недостаточность является единственным наиболее частым заболеванием. внекишечное проявление этого расстройства, 37 и что пациенты в возрасте > 60 лет составляют до 19% взрослого населения с глютеновой болезнью.38
Диетический дефицит, если его специально искать, может быть единственной причиной железодефицитной анемии всего у 5% пожилых пациентов, придерживающихся западной диеты.24 Не менее важно признание того, что гипохлоргидрия (обычно связанная с аутоиммунным гастритом) может ухудшить биодоступность пищевого железа с последующей железодефицитной анемией, как у 22 пациентов с гистаминовой быстрой ахлогидрией и антителами к париетальным клеткам, сосуществующая мальабсорбция витамина B 12 , являющаяся особенностью в подгруппе из семи человек.39 Также не менее важно знать тот факт, что при сосуществовании двух гематологических дефицитов микроцитарно-гипохромный гематологический профиль может полностью скрыть наличие дефицита витамина B 12 40 , 40 единственным случайным признаком является интеркуррентная тромбоцитопения. Однако тромбоцитопения сама по себе может быть редким проявлением железодефицитной анемии.41 Дивертикулярная болезнь толстой кишки не является признанной причиной дефицита железа,29
32, и он может ввести в заблуждение в диагностическом отношении, когда при клизме с барием создается впечатление, что это единственный диагноз, а сопутствующая карцинома толстой кишки обнаруживается только при последующей колоноскопии.42 Даже после интенсивного обследования до 40% пациентов в возрасте >50 лет могут не иметь идентифицируемой основной причины дефицита железа.33 Последующее наблюдение в среднем в течение 39 месяцев у 69 таких пациентов не выявило злокачественных поражений при контрольной колоноскопии, а анемия сама разрешилась у 71%.43 У одного пациента, у которого впоследствии была обнаружена дуоденальная ангиодисплазия, дефицит железа был достаточно тяжелым, чтобы потребовать периодических переливаний крови, а у большинства остальных, по-видимому, была сосуществующая анемия хронических заболеваний.
Последний вопрос касается чувствительности и специфичности тестов на скрытую кровь в кале при подозрении на хроническую желудочно-кишечную кровопотерю. Чувствительность снижена до 50-55%,25
26 с положительными прогностическими значениями 17–43% и 16–26% для поражений верхних и нижних отделов желудочно-кишечного тракта соответственно.25
27
32
44 Положительные тесты плохо различают поражения верхних и нижних отделов желудочно-кишечного тракта, как показали два исследования с участием 119 и 134 пациентов, соответственно, 17–59,6% из которых имели поражения верхних отделов желудочно-кишечного тракта, колоректальная патология характерна для 16–45%.От 5 до 10 процентов имели поражения на обоих участках.32
45 Даже когда колоноскопия полностью отрицательна, у 37% пациентов с положительным результатом анализа на скрытую кровь в кале обнаруживаются источники хронической кровопотери в верхних отделах желудочно-кишечного тракта. потерь при использовании стандартизированных опросников и/или анализов кала на скрытую кровь, как показало проспективное исследование 80 пациентов с дефицитом железа в среднем в возрасте 70 лет (диапазон 37–91 год), у которых наблюдались значительные поражения верхних или нижних отделов желудочно-кишечного тракта. тракта, независимо от наличия или отсутствия симптомов или наличия скрытой крови в кале.46 Даже при глютеновой болезни до 47% взрослых могут иметь положительный анализ кала на скрытую кровь.47
вопросов
- (1)
- Верен ли диагноз железодефицитной анемии при нормальной концентрации ферритина в сыворотке?
- (2)
- Какова физиологическая основа для оценки уровней рецепторов трансферрина в сыворотке крови при дефиците железа и как этот параметр может увеличить полезность сывороточного ферритина у пациентов с микроцитарной гипохромной анемией?
- (3)
- Насколько надежны желудочно-кишечные симптомы для прогнозирования места желудочно-кишечной кровопотери?
- (4)
- Насколько надежен анализ кала на скрытую кровь при различении кровотечений из верхних и нижних отделов желудочно-кишечного тракта?
- (5)
- Что является основанием для проведения колоноскопии у большинства пациентов с дефицитом железа в возрасте старше 50 лет, несмотря на выявление незлокачественных причин кровотечения из верхних отделов желудочно-кишечного тракта?
- (6)
- Какие три наиболее ярких признака глютеновой болезни вы узнали из этой презентации?
Ответы
- (1)
- Да.Когда дефицит железа сочетается с анемией хронических заболеваний, поведение сывороточного ферритина как реагента острой фазы противодействует ожидаемому падению сывороточного ферритина, приводя к «ложной нормализации» этого параметра.
- (2)
- В ходе развития железодефицитного состояния уровни циркулирующих рецепторов трансферрина (TfR) и количество этого вещества, экспрессируемого на поверхности эритроидных предшественников, увеличиваются в ответ на снижение уровня железа в тканях.Соотношение TfR/log ферритина, по-видимому, обеспечивает четкое разделение между сопутствующим дефицитом железа и анемией хронических заболеваний по сравнению с анемией хронических заболеваний как единственным диагнозом.
- (3)
- Симптоматика имеет низкую локализационную специфичность.
- (4)
- Анализы кала на скрытую кровь также имеют низкую специфичность к месту проведения.
- (5)
- Хотя поражения верхних отделов желудочно-кишечного тракта чаще всего встречаются при дефиците железа, а также с большей вероятностью являются доброкачественными, чем злокачественными, поражения толстой кишки, хотя и реже, но чаще являются злокачественными и могут сосуществовать с доброкачественными поражениями верхних отделов желудочно-кишечного тракта.
- (6)
- Железодефицитная анемия является наиболее частым внекишечным проявлением целиакии; пациенты старше 60 лет составляют до 19% взрослого населения с глютеновой болезнью; положительные тесты на скрытую кровь в кале могут встречаться у 47% взрослых с глютеновой болезнью.
Благодарности
Выражаю благодарность доктору GR Dixon MRCPath, консультанту-патологоанатому из больницы общего профиля Tameside за отчет о вскрытии и последующую микрофотографию, относящуюся к рисунку 1.Я в долгу перед г-жой А. Рассел за подготовку этой рукописи.
границ | Дефицит железа у пожилых людей, пересмотренный в эпоху гепсидина
Анемия у пожилых людей, распространенность и определение
Анемия является распространенным многофакторным заболеванием у пожилых людей. Действительно, распространенность анемии увеличивается с возрастом, представляя собой серьезную проблему для здоровья пожилых людей. Крупные исследования пожилых людей, проживающих в общинах, в Соединенных Штатах и Европе показали, что уровень распространенности анемии колеблется от 8 до 25% (Patel, 2008).Одно из крупнейших обследований населения, т. е. третье Национальное обследование здоровья и питания США (NHANES III), показало, что 10,2% женщин и 11% мужчин старше 65 лет страдали анемией (Guralnik et al., 2004). Эти доли возрастали до 26,1 и до 20,1% у лиц старше 85 лет у мужчин и женщин соответственно (Гуральник и др., 2004).
Ведутся споры о том, какое пороговое значение гемоглобина (Hb) следует использовать для определения анемии у населения в целом и особенно у пожилых людей (Beutler and Waalen, 2006).Во многих исследованиях анемия определялась в соответствии с критериями Всемирной организации здравоохранения (ВОЗ) (Blanc et al., 1968) как уровень гемоглобина <13 г/дл у мужчин и <12 г/дл у женщин соответственно. Однако эти критерии подвергались критике, поскольку они были основаны на статистических распределениях (т. е. эквивалентны двум стандартным отклонениям ниже среднего) в контрольных выборках, не включавших лиц старше 65 лет, что делало невозможным их применение к пожилым людям (Mindell et al. др., 2013).Поскольку значения Hb у практически здоровых пожилых людей, как правило, ниже, чем у молодых людей, а различия между мужчинами и женщинами, как правило, исчезают с возрастом (Patel, 2008), значение Hb < 12 г/дл в настоящее время обычно считается признаком анемии у пожилых людей. пожилые люди обоих полов (Izaks et al., 1999; Andrès et al., 2013).
Анемия у пожилых людей, как правило, гипорегенеративная и относительно легкая, с уровнем гемоглобина около 10–11 г/дл у большинства субъектов (Guralnik et al., 2004). Тем не менее, это связано с рядом неблагоприятных исходов, включая более длительную госпитализацию, инвалидность и повышенный риск смертности (Chaves et al., 2004; Закаи и др., 2005 г.; Каллетон и др., 2006 г.; Денни и др., 2006 г.; Пеннинкс и др., 2006 г.; ден Эльзен и др., 2009 г.; Прайс и др., 2011). Более того, он также значительно влияет на качество жизни, будучи связанным с утомляемостью, когнитивной дисфункцией, депрессией, снижением мышечной силы, падениями и «слабостью», даже когда уровень гемоглобина ниже нормы (Woodman et al., 2005; Эйзенштадт и др., 2006).
Примерно треть случаев анемии у пожилых людей может быть связана с хроническим заболеванием (воспалением и хроническими заболеваниями почек), а одна треть связана с дефицитом питательных веществ (фолиевой кислоты, В12 и железа).Дефицит железа (ЖД), отдельно или в сочетании с дефицитом других питательных веществ, составляет более половины этой группы. Последняя треть остается «необъяснимой» (Гуральник и др., 2004). Примечательно, что у значительной части пожилых пациентов с анемией (30–50%) предполагается наличие множественных причин анемии (Петросян и др., 2012). Поскольку пожилые пациенты, как правило, страдают несколькими различными патологическими состояниями (мультиморбидность) и обычно принимают длинный список лекарств, часто трудно определить точную этиологию анемии у конкретного человека (Andrès et al., 2013), а иногда остается «необъяснимым», несмотря на обширные исследования (Гуральник и др., 2004). Мышление с точки зрения мультиморбидности является ключом к пониманию, диагностике и лечению анемии у пожилых людей.
Дефицит железа у пожилых людей
По данным ВОЗ, ДЗ является наиболее распространенным и широко распространенным нарушением питания во всем мире (http://www.who.int/nutrition/topics/ida/en/), которым, по оценкам, страдает один миллиард человек, что представляет собой состояние здоровья эпидемических масштабов.Помимо большого числа детей и молодых женщин, пострадавших в развивающихся странах, ДЖ является единственным дефицитом питательных веществ, который также значительно распространен в промышленно развитых странах [Всемирная организация здравоохранения (ВОЗ), 2001; Hershko, Camaschella, 2013], где дополнительная категория риска представлена пожилыми людьми (Guyatt et al., 1990).
Синдром дефицита железа включает ряд различных состояний (Goodnough, 2012). « Абсолютный » ID определяется отсутствием запасов железа (Cook, 2005; Fairweather-Tait et al., 2013). В физиологических условиях общее количество железа в организме (около 3–4 г) поддерживается за счет тонкого баланса между тремя различными факторами: потребностями организма, снабжением железом (в зависимости от потребления железа с пищей и всасывания в двенадцатиперстной кишке) и кровопотерями. В то время как повышенная потребность в железе является основной причиной ДЖ у детей и женщин детородного возраста, недостаточное потребление железа с пищей, нарушение всасывания в желудочно-кишечном тракте (ЖКТ) и/или повышенные кровопотери являются наиболее распространенными причинами ДЖ у пожилых людей (см. ниже).
В отличие от «абсолютного» ID, многие расстройства характеризуются так называемым « функциональным » или « относительным » ID, определяемым как возникновение ограниченного железом эритропоэза при нормальном или даже повышенном количестве тела. магазины железа. Это явление часто связано с нарушением транспорта железа (т.д., при гемоглобинопатиях, хронических гемолитических анемиях или лечении препаратами, стимулирующими эритропоэз). Поскольку основное внимание в этой статье уделяется этиологии, диагностике и лечению абсолютного ДЖ у пожилых людей, читатели могут обратиться к другим превосходным обзорам для получения подробной информации о синдромах функционального ДЖ (Goodnough et al., 2010, Goodnough, 2012; Auerbach et al.). др., 2013а).
Каким бы ни был механизм, как абсолютная, так и функциональная ДЖ снижают доступность железа для эритроидных предшественников с развитием ограниченного железом эритропоэза и, наконец, анемии.В частности, можно выделить две стадии ДЗ: а) начальную, характеризующуюся сниженной сатурацией трансферрина, но без анемии; и (б) запущенная, когда становится очевидной микроцитарная, гипохромная железодефицитная анемия (ЖДА).
У пожилых людей ЖЖ и ЖДА почти всегда обусловлены хроническими заболеваниями ЖКТ, которые, в свою очередь, приводят к потере железа и нарушению всасывания, что нередко происходит в комбинации на индивидуальном уровне (рис. 1). Действительно, наиболее частой причиной являются хронические кровопотери из верхних и нижних отделов желудочно-кишечного тракта из-за эзофагита, гастрита, пептической язвы, рака толстой кишки или предраковых полипов, воспалительного заболевания кишечника или ангиодисплазии (Eisenstaedt et al., 2006). Распространенность большинства из этих состояний увеличивается с возрастом, что особенно верно для неопластических поражений (Eddy, 1990) и ангиодисплазии (Sami et al., 2014). Примечательно, что кровотечение из желудочно-кишечного тракта обычно увеличивается при одновременном приеме лекарств от состояний, широко распространенных у пожилых людей, таких как нестероидные противовоспалительные препараты при остеоартрите и антитромботическая терапия при сердечно-сосудистых заболеваниях, особенно при мерцательной аритмии.
РИСУНОК 1.Заболевания желудочно-кишечного тракта, являющиеся наиболее частыми причинами ЖЖ и ЖДА у пожилых пациентов . Следует отметить, что более чем одно из этих состояний нередко сосуществует у данного человека. Кровотечению часто способствуют антитромботические препараты для лечения сердечно-сосудистых заболеваний, которые широко распространены в этой возрастной группе. Предлагаемые диагностические инструменты представлены справа. ААГ, аутоиммунный атрофический гастрит; CD, целиакия; ЖКТ, желудочно-кишечный тракт; HP, Helicobacter pylori ; ВЗК, воспалительное заболевание кишечника; ИПП, ингибиторы протонной помпы; ВКЭ, видеокапсульная эндоскопия.
Нарушение всасывания железа также относительно часто встречается у пожилых людей. Действительно, другие состояния, распространенность которых обычно увеличивается с возрастом, представлены инфекцией Helicobacter pylori (HP) (Pounder and Ng, 1995) и атрофическим гастритом. Следует отметить, что хотя в течение длительного времени глютеновая болезнь (ЦБ) в первую очередь считалась энтеропатией детей и молодых взрослых, в ряде эпидемиологических исследований сообщалось о повышении частоты выявления у пожилых людей, причем до одной трети впервые диагностированных у пациентов старше 65 лет (Patel et al., 2005; Раштак и Мюррей, 2009 г.; Вилппула и др., 2009). В этой возрастной группе мультифакториальная анемия является наиболее частым клиническим проявлением (Harper et al., 2007), при этом основной причиной является дефицит микронутриентов (особенно ДЖ). По малопонятным причинам классическая триада симптомов мальабсорбции, включающая диарею, потерю массы тела и боль в животе, у пожилых людей встречается реже (Freeman, 2008), в связи с чем в этой возрастной категории диагноз часто не ставится. Другим фактором, который теоретически может способствовать нарушению всасывания железа у пожилых пациентов, является частое длительное использование ингибиторов протонной помпы (ИПП), поскольку желудочная кислота необходима для оптимального всасывания элемента в кишечнике (Ganz, 2013).Однако только в нескольких отчетах конкретно рассматривался этот вопрос, который остается спорным (Reimer, 2013).
Как правило, все вышеупомянутые состояния, нарушающие всасывание железа, имеют общий клинический фенотип рефрактерности к пероральной терапии препаратами железа, недавно получивший название «приобретенная IRIDA» (железорефрактерная ЖД анемия; обзор см. в Hershko and Camaschella, 2013). Эти состояния следует всегда учитывать у пожилых пациентов с ЖДА и без признаков желудочно-кишечной кровопотери.
Наконец, недоедание является очевидным фактором, способствующим ДЖ у пожилых людей.Однако, поскольку потребность в железе (1-2 мг/день) соответствует только около 10% среднего суточного потребления железа, недостаточность питания редко бывает достаточной, чтобы вызвать ЖДА, по крайней мере, в промышленно развитых странах. Тем не менее, оценка состояния питания пациента играет важную роль в диагностическом подходе к анемии у пожилых людей.
Гепсидин, ключевой регулятор гомеостаза железа
Гепсидин, дефензин-подобный гормон, синтезируемый в основном печенью, был обнаружен в 2001 году и признан главным регулятором метаболизма железа (Ganz and Nemeth, 2011).Активная форма гепсидина представляет собой пептид из 25 аминокислот, полученный из предшественника из 84 аминокислот, но по крайней мере две другие изоформы, укороченные на N-конце, то есть гепсидин-20 и гепсидин-22, также были идентифицированы в биологических жидкостях. (Кастанья и др., 2010). Биологическое значение этих изоформ до сих пор неясно (Campostrini et al., 2012). Гепсидин действует путем связывания со своим рецептором, трансмембранным белком ферропортином, который в настоящее время представляет собой единственный известный клеточный экспортер железа у млекопитающих (De Domenico et al., 2011). У людей ферропортин в основном экспрессируется в клетках, играющих ключевую роль в гомеостазе железа, таких как энтероциты двенадцатиперстной кишки (поглощение пищевого железа), макрофаги селезенки и печени (переработка железа из эритрофагоцитоза) и гепатоциты (запасы железа). Связывание гепсидина с ферропортином индуцирует эндоцитоз и лизосомную деградацию обеих молекул, что приводит к снижению всасывания в кишечнике и высвобождению железа из рециркулирующих макрофагов, что в конечном итоге приводит к снижению концентрации железа в плазме (Ganz and Nemeth, 2011).Регуляция синтеза гепсидина довольно сложна и включает ряд различных путей [подробные недавние обзоры см. в Ganz (2013) and Meynard et al. (2014)]. ЖД и повышенная эритропоэтическая активность подавляют продукцию гепсидина, а подавленные или очень низкие концентрации гормона наблюдаются при ЖДА или анемиях с высокой эритропоэтической активностью (Ganz et al., 2008). Хотя природа супрессивного сигнала до сих пор неизвестна, есть некоторые свидетельства того, что, по крайней мере, в условиях стимулированного эритропоэза, он может быть представлен циркулирующим фактором, продуцируемым эритроидными предшественниками в костном мозге (Kautz et al., 2013). С другой стороны, гепсидин сильно индуцируется воспалением (Nemeth et al., 2003, 2004), в частности, провоспалительным цитокином интерлейкином-6 (IL-6), и он отвечает за ограниченный железом эритропоэз у пациентов. с острыми и хроническими воспалительными состояниями (Ganz, 2003; McCranor et al., 2013). Тем не менее недавние исследования на моделях мышей (Gardenghi et al., 2014; Kim et al., 2014) показали, что железодефицитная анемия, вызванная воспалением, вероятно, имеет более сложный патогенез, лишь частично зависящий от гепсидина.
В настоящее время доступны два основных метода измерения уровня гепсидина в крови и моче: иммуноанализ на основе антител к гепсидину и анализ на основе масс-спектрометрии (МС) (Castagna et al., 2010; Kroot et al., 2011). Последние, как правило, предпочтительнее, поскольку они позволяют отличить биоактивную 25-мерную изоформу железа от других изоформ неопределенного значения, что противоречит неполной специфичности доступных антител (Castagna et al., 2010; Kroot et al., 2011). Сывороточный гепсидин демонстрирует четко определенные возрастные и половые вариации на уровне популяции, как показано ниже (Galesloot et al., 2011; Траглиа и др., 2011). Измерение гепсидина в биологических жидкостях представляет собой многообещающий инструмент для диагностики и лечения состояний, характеризующихся измененным гомеостазом железа, включая ЖЖ/ЖДА. Однако метод «золотого стандарта», доступный для ежедневной клинической практики по разумной цене, по-прежнему отсутствует.
Уровни гепсидина у пожилых людей
«Необъяснимая» анемия пожилых людей была связана с двумя предполагаемыми механизмами, а именно с прогрессивной резистентностью клеток-предшественников эритроидов костного мозга к эритропоэтину (ЭПО) и хроническим субклиническим провоспалительным состоянием (Vanasse and Berliner, 2010).В этом контексте гепсидин теоретически может играть существенную роль, учитывая его участие как в воспалении, так и в регуляции доступности железа для эритропоэза. Действительно, предыдущие исследования показали умеренное увеличение маркеров воспаления, таких как фактор некроза опухоли альфа (TNF-α) и IL-6, основной индуктор гепсидина, у пожилых людей (Andrews, 2004; Ferrucci et al., 2005; Maggio et al. ., 2006). На сегодняшний день только два исследования, биомедицинские исследования в Неймегене (NBS; Galesloot et al., 2011) и исследования Вал Борбера (VBS; Traglia et al., 2011) исследовали уровни гепсидина в сыворотке на популяционном уровне у практически здоровых субъектов, включая группы пожилых людей. Оба исследования показали, что перед менопаузой уровень гепсидина у женщин почти на 50% ниже, чем у мужчин соответствующего возраста. После менопаузы уровни гепсидина, как правило, одинаковы у обоих полов, с небольшим снижением у старших групп. Это было очевидно у обоих полов в VBS (рис. 2), но только у мужчин в NBS. Хотя эти исследования специально не предназначались для изучения анемии пожилых людей, они, как правило, исключали устойчивое повышение уровня гепсидина у пожилых людей.Соответственно, в двух исследованиях у пожилых пациентов с анемией не удалось обнаружить повышенный уровень гепсидина в моче (Ferrucci et al., 2010) и в сыворотке (Waalen et al., 2011) и даже корреляцию между гепсидином и IL-6 или TNF-. α (Ферруччи и др., 2005).
РИСУНОК 2. Уровни гепсидина (А) и ферритина (В) в сыворотке, стратифицированные по десятилетиям, у здоровых добровольцев старше 50 лет . Субъекты были из исследования Вал Борбера, большого опроса населения, включающего 1657 человек. Адаптировано из Traglia et al.(2011).
Напротив, Leiden 85-plus Study, популяционное проспективное исследование с участием 85-летних субъектов из Лейдена (Нидерланды), показало, что в этой возрастной группе С-реактивный белок (прокси для IL-6) был значимый предиктор уровня циркулирующего гепсидина, который, в свою очередь, был относительно выше в небольшой подгруппе ( n = 29) с необъяснимой анемией (den Elzen et al., 2013). Эти расхождения в уровнях гепсидина у пожилых людей с анемией могут объясняться несколькими причинами, включая различные лабораторные методы и клинические условия (Goodnough and Schrier, 2014).Большинство данных являются ретроспективными, и прежде чем делать определенные выводы, необходимы правильно спланированные крупномасштабные исследования. На данный момент имеющиеся доказательства в целом преуменьшают первоначальную гипотезу о гепсидине как о главном детерминанте необъяснимой анемии у пожилых людей. Это, вероятно, остается сложным состоянием из-за сочетания нескольких возрастных изменений, таких как старение стволовых клеток, слабовыраженное хроническое воспаление, субклиническое нарушение функции почек, андрогенная недостаточность и другие, до сих пор неизвестные (Guralnik et al., 2004; Макипур и др., 2008).
Диагностика ЖДА у пожилых людей
Было предложено несколько руководств и рекомендаций по диагностике ЖДА у населения в целом (Cook, 2005; Goddard et al., 2011), но нет единого мнения относительно оптимального подхода к диагностике и лечению ЖДА у пожилых людей. Тем не менее, ясно, что, помимо добавок железа, общий принцип поиска и, если возможно, лечения основной причины (причин) следует проводить также у пожилых пациентов (Andrès et al., 2013). Поскольку желудочно-кишечные заболевания являются наиболее распространенной причиной ЖДА у пожилых людей (рис. 1), диагностическое обследование должно часто, по крайней мере теоретически, включать относительно инвазивные исследования, такие как эндоскопические процедуры. Это особенно верно, поскольку, например, ЖДА у пожилых людей часто свидетельствует о наличии скрытой злокачественной опухоли ЖКТ. Конечно, пожилой возраст сам по себе не является противопоказанием к таким процедурам, но от каждого индивидуального и ослабленного пожилого пациента требуется особый клинический навык для тщательной оценки соотношения риска и пользы, а также прогностических последствий.
В любом случае, несмотря на то, что диагностическое обследование должно быть по возможности всесторонним, некоторые состояния заслуживают особого внимания у пожилых пациентов с ЖДА.
По нашему опыту, особенно сложное состояние представлено желудочно-кишечной ангиодисплазией, которая, в свою очередь, является потенциально излечимым заболеванием (Richter et al., 1984). Примечательно, что кровотечение при желудочно-кишечной ангиодисплазии часто бывает прерывистым, с возможным ложноотрицательным результатом анализа кала на скрытую кровь. Более того, хотя большинство поражений ангиодисплазии желудочно-кишечного тракта локализуются в толстой кишке (54–82% в слепой кишке и восходящей ободочной кишке), они могут ускользнуть от однократной эндоскопии или локализоваться в тонкой кишке, которая обычно не исследуется.В этом случае необходимо дополнительное тестирование с помощью видеокапсульной эндоскопии (ВКЭ) (Sami et al., 2014). Наконец, отличительной особенностью желудочно-кишечной ангиодисплазии является ее частая ассоциация с другим относительно распространенным состоянием у пожилых людей, а именно аортальным стенозом, который встречается почти у трети пациентов (Batur et al., 2003). Эта ассоциация, известная как синдром Хейде, особенно характеризуется коагулопатией, т. е. приобретенной болезнью фон Виллебранда (Vincentelli et al., 2003), из-за опосредованного напряжением сдвига потребления высокомолекулярных мультимеров фактора фон Виллебранда (Loscalzo, 2012).Поскольку последний является наиболее гемостатически компетентной формой фактора фон Виллебранда, это способствует возникновению порочного круга, усугубляющего кровотечение из желудочно-кишечной ангиодисплазии и, как следствие, ЖДА.
С лабораторной точки зрения точная диагностика ЖДА у пожилых также затруднена из-за высокой распространенности сопутствующих хронических заболеваний, затрудняющих интерпретацию традиционных биомаркеров. Средний объем эритроцитов (MCV) часто является исходным показателем при обследовании пациента с анемией, поскольку при ЖДА он обычно снижен.Однако снижение MCV у пожилых людей часто отсутствует на ранних стадиях и/или притупляется другими сопутствующими дефицитами питательных веществ, такими как дефицит фолиевой кислоты или витамина B12. Точно так же другие распространенные лабораторные маркеры «абсолютной» ДЖ, т. е. низкий уровень ферритина в сыворотке и насыщение трансферрина, а также повышенный уровень трансферрина, имеют низкую чувствительность у пожилых людей (Fairweather-Tait et al., 2013). Например, классическое пороговое значение сывороточного ферритина ≤12–15 мкг/л, которое обычно определяет ДЖ у молодых людей (Lipschitz et al., 1974; Али и др., 1978; Carmel, 2008), считается слишком строгим для пожилых пациентов. Действительно, у этих субъектов истинный ID часто возникает при более высоких значениях ферритина, поскольку ферритин per se повышается с возрастом (Casale et al., 1981) и является реагентом острой фазы, который увеличивается при воспалении, инфекции, злокачественных новообразованиях и других заболеваниях. болезни, характерные для пожилых людей. В исследовании, проведенном на госпитализированных пожилых пациентах, уровень ферритина в сыворотке <50 мкг/л оказался более надежным для прогнозирования ИД, чем другие традиционные пороговые значения (Joosten et al., 1991). Низкая чувствительность традиционных биомаркеров железа подтверждается также тем фактом, что пожилые пациенты с анемией иногда реагируют на добавки железа, даже если их исходные показатели железа не являются аномальными (Price et al., 2011).
Растворимый рецептор трансферрина (sTfR), полученный в результате протеолиза мембранного рецептора трансферрина (TR), отражает эритропоэтическую активность и обратно коррелирует с количеством железа, доступного для эритропоэза. В прошлом некоторые данные подтверждали, что измерение sTfR является новым маркером ЖД у пожилых людей, учитывая, что его уровни не увеличиваются с возрастом и не зависят от наличия воспаления (Mast et al., 1998). В частности, сывороточный sTfR, разделенный на логарифм ферритина (индекс sTfR-ферритин), оказался полезным для классификации пациентов с ACD и сопутствующей ЖДА (Punnonen et al., 1997; Rimon et al., 2002). Однако в настоящее время отсутствие стандартизированных реагентов для анализа sTfR усложняет интерпретацию индекса sTfR-ферритина в различных исследованиях и ограничивает его использование в клинической практике (Pfeiffer et al., 2007).
В последнее десятилетие гепсидин был предложен в качестве многообещающего диагностического маркера заболеваний, связанных с железом (Goodnough et al., 2010; Крут и др., 2011). При ЖДА уровни гепсидина в сыворотке и моче обычно снижены и часто не обнаруживаются с помощью доступных в настоящее время анализов (Bozzini et al., 2008; Ganz et al., 2008; Castagna et al., 2010). Подавление гепсидина также является чувствительным индикатором ИД без анемии, поскольку снижение уровня наблюдалось до определяемого снижения гемоглобина или гематокрита (Ganz et al., 2008; Pasricha et al., 2011). Как упоминалось выше, гепсидин индуцируется воспалительными цитокинами и способствует патогенезу так называемой анемии хронических заболеваний (АХЗ), которая характеризуется нарушением утилизации железа наряду с неадекватной продукцией ЭПО и цитокин-индуцированным ингибированием эритроидных предшественников. (Вайс и Гуднаф, 2005).Противоположная тенденция гепсидина при ЖДА по сравнению с АКД теоретически может дифференцировать эти состояния, как широко распространенные у пожилых людей, так и нередко сосуществующие. Следует отметить, что доклинические исследования показали, что сопутствующая ИД имеет тенденцию притуплять гепсидиновый ответ на провоспалительные цитокины (Theurl et al., 2009; Darshan et al., 2010), что указывает на возможность различения у отдельного пациента с анемией наличия ЖДА или смешанная ЖДА/АКД (оба с низкими или неопределяемыми уровнями гепсидина) от одной только АЦД (с высокими уровнями гепсидина).Предварительные данные о пациентах с ревматоидным артритом (van Santen et al., 2011) или воспалительным заболеванием кишечника (Bergamaschi et al., 2013) согласуются с этой возможностью, но для подтверждения требуется больше данных, особенно у пожилых людей, где различие между Ожидается, что IDA и ACD будут особенно сложными.
Лечение ЖДА у пожилых людей
В настоящее время не существует конкретных руководств по лечению анемии у пожилых людей. В недавнем обзоре рекомендуется сначала проверять статус железа у каждого пожилого пациента (Goodnough and Schrier, 2014).После того, как ЖДА будет четко установлена или считается вероятной (из-за неоднозначных результатов маркеров железа, как обсуждалось выше), следует назначить терапевтическое испытание с пероральным железом с целью коррекции как анемии, так и запасов железа. Этот подход первой линии, предпочтительно с использованием двухвалентных соединений, таких как сульфат железа или глюконат, из-за их превосходной биодоступности (Clark, 2009), обычно считается более безопасным для пациента и с лучшим соотношением затрат и эффективности по сравнению с парентеральным введением железа.
В целом ожидается, что уровни Hb будут повышаться примерно на 1–2 г/дл каждые две недели после начала пероральной терапии препаратами железа (Clark, 2008), которую следует продолжать в течение 3 месяцев после коррекции анемии для восполнения запасов железа. Необходимое время может быть еще больше у пожилых пациентов из-за более медленной реакции костного мозга. Это приводит к плохой приверженности, особенно когда сопутствующая мультиморбидность требует принятия огромного количества таблеток в день. Более того, пероральные добавки железа часто плохо переносятся пожилыми пациентами, особенно из-за дискомфорта в животе, а также плохо всасываются из-за относительно высокой распространенности нарушений всасывания (см. выше).
Таким образом, пожилым пациентам с ЖДА часто требуется внутривенное (в/в) замещение железа (Silverstein and Rodgers, 2004; Clark, 2009; Pasricha et al., 2010). Большинство препаратов железа для внутривенного введения, как правило, эффективны, хорошо переносятся и имеют более низкую частоту серьезных побочных реакций (например, анафилаксии), чем принято считать многими клиницистами (Fishbane, 2003; Auerbach and Ballard, 2010; Auerbach et al., 2013a). Еще несколько лет назад наиболее широко используемыми препаратами в Европе были глюконат железа или сахароза железа, которые являются относительно нестабильными соединениями с ограниченными максимальными дозами на одну инфузию, т.е.е., 125 и 200 мг соответственно. Поскольку средняя общая доза железа, обычно необходимая для коррекции анемии и восстановления уровня железа, составляет 1000–1500 мг, необходимы многочисленные госпитализации для повторных инфузий. У пожилых пациентов с ограниченной автономией это не только увеличивает прямые и косвенные социальные издержки, но и может существенно затруднить осуществимость лечения.
В последнее время фармацевтическая промышленность добилась значительного прогресса в производстве более стабильных соединений железа, которые можно безопасно вводить в высоких дозах за одну инфузию, т.е.е., 1000–1500 мг, что позволяет проводить однократное лечение (см. обзор Auerbach et al., 2013a). К ним относятся низкомолекулярный декстран железа (Auerbach et al., 2011), ферумокситол (Auerbach et al., 2013b), изомальтозид железа (Wikstrom et al., 2011) и карбоксимальтоза железа (Evstatiev et al., 2011; Onken et al., 2011). др., 2014). Эти препараты значительно упрощают внутривенную терапию препаратами железа, эффект, который, как ожидается, будет особенно полезен у пожилых пациентов с ЖДА. Однако для подтверждения этих захватывающих обещаний необходимы специальные испытания в этих условиях.Кроме того, внутривенное введение железа теоретически может вызывать окислительный стресс и выработку воспалительных цитокинов, а также повышать восприимчивость к определенным инфекциям, поэтому его долгосрочные эффекты также нуждаются в дальнейших исследованиях в будущем (Auerbach and Ballard, 2010; Goodnough et al., 2010). ).
Поскольку гепсидин ингибирует всасывание железа в двенадцатиперстной кишке, было высказано предположение, что измерение уровня гормонов может помочь определить a priori лучший способ введения железа, пероральный или внутривенный, у данного индивидуума.Действительно, в недавнем ретроспективном исследовании было доказано, что уровни гепсидина полезны для выявления пациентов с ЖДА, которые не реагировали на пероральные добавки железа (Bregman et al., 2013). Следует отметить, что пороговое значение уровня гепсидина в сыворотке, позволяющее различить респондентов (R) и не респондеров (NR) при пероральном приеме железа, не было особенно высоким (20 нг/мл) и находилось в пределах «нормального» диапазона для используемого метода ( Брегман и др., 2013). Положительное прогностическое значение NR для уровней гепсидина >20 нг/мл составило 81,4%. Напротив, у большинства пациентов с R уровень гепсидина был от очень низкого до полного подавления (неопределяемый), что является общим правилом для пациентов с ЖДА (см. выше).Если эти данные будут подтверждены дальнейшими исследованиями, анализ на гепсидин действительно может помочь индивидуализировать терапию препаратами железа, избегая траты времени на плохо переносимую пероральную терапию, когда уровни гормонов высоки или «псевдонормальны», особенно у пожилых пациентов. В ближайшем будущем возможный алгоритм диагностики и лечения ЖДА у пожилых людей, основанный на самых последних патофизиологических и терапевтических достижениях в этой области, изображен на рисунке 3.
РИСУНОК 3.Возможный алгоритм диагностики и лечения ЖДА у пожилых людей в сценарии ближайшего будущего . Предлагаемый алгоритм основан на самых последних патофизиологических и терапевтических достижениях в этой области. Пунктирные линии для оценки уровней гепсидина указывают на то, что имеющиеся данные, предлагающие этот подход (Bregman et al., 2013), нуждаются в подтверждении будущими исследованиями. Точно так же, прежде чем этот подход войдет в клиническую практику, необходима лучшая стандартизация анализов гепсидина. ААГ, аутоиммунный атрофический гастрит; AI, анемия воспаления; CD, целиакия; ХБП, хроническая болезнь почек; ЖКТ, желудочно-кишечный тракт; Hb, гемоглобин; HM, гематологические злокачественные новообразования; HP, Helicobacter pylori; ЖДА, железодефицитная анемия; МДС, миелодиспластический синдром; TS, насыщение трансферрина.
Заключение
Дефицит железа является основной причиной анемии у пожилых пациентов, и его всегда следует искать в качестве первого диагностического шага. ЖДА у пожилых нередко является многофакторной и трудно диагностируемой, поскольку традиционные биохимические маркеры статуса железа в этой возрастной группе относительно неоднозначны. Рассуждение с точки зрения мультиморбидности является центральным для правильного подхода к ЖДА у пожилых людей. Поскольку желудочно-кишечная кровопотеря является основной причиной ЖДА у пожилых людей, правильная идентификация источника кровотечения может спасти жизнь, особенно когда в основе лежит скрытое злокачественное новообразование.Открытие гепсидина произвело революцию в нашем понимании метаболизма железа, и измерение уровня гормонов может помочь как в диагностике, так и в выборе наилучшего варианта лечения, особенно в связи с тем, что внутривенная терапия становится проще, чем когда-либо, с появлением новых соединений железа.
Вклад авторов
Фабиана Бусти и Наташа Кампострини написали статью в соавторстве. Никола Мартинелли проанализировал данные. Доменико Джирелли разработал работу и стал соавтором статьи. Все авторы одобрили окончательный вариант рукописи.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была частично поддержана Министерством университетов и исследований Италии (грант № 200989KXFN) и Fondazione Cariverona, проект Verona Nanomedicine Initiative Domenico Girelli.
Ссылки
Али, М.А., Лакстон, А.В., и Уокер, У.Х. (1978). Концентрация ферритина в сыворотке и запасы железа в костном мозге: проспективное исследование. Кан. Мед. доц. Дж . 118, 945–946.
Опубликовано Резюме | Опубликован полный текст
Андрес Э., Серрадж К., Федеричи Л., Фогель Т. и Кальтенбах Г. (2013). Анемия у пожилых пациентов: новый взгляд на старое расстройство. Гериатр. Геронтол. Междунар. 13, 519–527. doi: 10.1111/ggi.12017
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Ауэрбах, М.и Баллард, Х. (2010). Клиническое применение внутривенного железа: введение, эффективность и безопасность. Гематология Am. соц. Гематол. Образовательный Программа 2010, 338–347. doi: 10.1182/asheducation-2010.1.338
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Ауэрбах М., Штраус В., Ауэрбах С., Ринер С. и Бахрейн Х. (2013b). Безопасность и эффективность инфузии общей дозы 1020 мг ферумокситола, вводимой в течение 15 мин. утра. Дж. Гематол. 88, 944–947.doi: 10.1002/ajh.23534
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Ауэрбах, М., Паппадакис, Дж. А., Бахрейн, Х., Ауэрбах, С. А., Баллард, Х., и Даль, Н. В. (2011). Безопасность и эффективность быстрого введения (один час) одного грамма низкомолекулярного декстрана железа (INFeD) для лечения железодефицитной анемии. утра. Дж. Гематол. 86, 860–862. дои: 10.1002/ajh.22153
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Батур, П., Stewart, WJ, and Isaacson, JH (2003). Повышенная распространенность аортального стеноза у больных с артериовенозными мальформациями желудочно-кишечного тракта при синдроме Хейде. Арх. Стажер Мед . 163, 1821–1824 гг. doi: 10.1001/archinte.163.15.1821
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Bergamaschi, G., Di Sabatino, A., Albertini, R., Costanzo, F., Guerci, M., Masotti, M., et al. (2013). Сывороточный гепсидин при воспалительных заболеваниях кишечника: биологическое и клиническое значение. Воспаление. Кишечник Дис. 19, 2166–2172. дои: 10.1097/MIB.0b013e31829a6e43
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Бейтлер, Э., и Ваален, Дж. (2006). Определение анемии: какова нижняя граница нормы концентрации гемоглобина в крови? Кровь 107, 1747–1750. doi: 10.1182/blood-2005-07-3046
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Блан Б., Финч К.А., Халлберг Л., Герберт В., Lawkowicz, W., и Layriss, M., et al. (1968). Отчет о алиментарных анемиях научной группы ВОЗ. Всемирный орган здравоохранения. Тех. Респ. сер. 405, 1–40.
Bozzini, C., Campostrini, N., Trombini, P., Nemeth, E., Castagna, A., Tenuti, I., et al. (2008). Измерение уровня гепсидина в моче с помощью SELDI-TOF-MS при HFE-гемохроматозе. Клетки крови Мол. Дис. 40, 347–352. doi: 10.1016/j.bcmd.2007.10.001
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Брегман, Д.Б., Моррис Д., Кох Т.А., Хе А. и Гуднаф Л.Т. (2013). Уровни гепсидина позволяют прогнозировать отсутствие реакции на пероральную терапию препаратами железа у пациентов с железодефицитной анемией. утра. Дж. Гематол. 88, 97–101. doi: 10.1002/ajh.23354
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Кампострини Н., Траглиа М., Мартинелли Н., Корбелла М., Кокка М., Манна Д. и др. (2012). Уровни сыворотки изоформы гепсидина-20 в большой общей популяции: исследование Вал Борбера. J. Proteomics 76 Spec No.:28–35. doi: 10.1016/j.jprot.2012.08.006
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Казале Г., Бонора К., Мильявакка А., Зурита И. Э. и де Никола П. (1981). Ферритин сыворотки и старение. Возраст Старение 10, 119–122. doi: 10.1093/старение/10.2.119
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Кастанья, А., Кампострини, Н., Занинотто, Ф., и Джирелли, Д. (2010). Анализ гепсидина в сыворотке с помощью SELDI-TOF-MS и других подходов. J. Протеомика 73, 527–536. doi: 10.1016/j.jprot.2009.08.003
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Чавес, П. Х., Сюэ, К. Л., Гуральник, Дж. М., Ферруччи, Л., Вольпато, С., и Фрид, Л. П. (2004). Что представляет собой нормальный уровень гемоглобина у пожилых женщин-инвалидов, проживающих в общине? Дж. Ам. Гериатр. соц. 2, 1811–1816 гг. doi: 10.1111/j.1532-5415.2004.52502.x
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Каллетон, Б.Ф., Маннс, Б.Дж., Чжан, Дж., Тонелли, М., Кларенбах, С., и Хеммельгарн, Б.Р. (2006). Влияние анемии на госпитализацию и смертность пожилых людей. Кровь 107, 3841–3846. doi: 10.1182/blood-2005-10-4308
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Даршан Д., Фрейзер Д. М., Уилкинс С. Дж. и Андерсон Г. Дж. (2010). Тяжелый дефицит железа притупляет реакцию гена регуляции железа Hamp и провоспалительных цитокинов на липополисахарид. Haematologica 95, 1660–1667. doi: 10.3324/гематол.2010.022426
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
den Elzen, W.P., de Craen, A.J., Wiegerinck, E.T., Westendorp, R.G., Swinkels, D.W., и Gussekloo, J. (2013). Уровень гепсидина в плазме и анемия в пожилом возрасте. Лейденское исследование 85+. Гематология 98, 448–454. doi: 10.3324/гематол.2012.068825
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
ден Эльцен, В.П., Виллемс Дж. М., Вестендорп, Р. Г. Дж., де Краен, А. Дж., Ассендефт, В. Дж., и Гуссеклоо Дж. (2009). Влияние анемии и сопутствующих заболеваний на функциональное состояние и смертность в пожилом возрасте: результаты исследования Leiden 85-plus. CMAJ 181, 151–157. doi: 10.1503/cmaj.0
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Денни, С. Д., Кучибхатла, М. Н., и Коэн, Х. Дж. (2006). Влияние анемии на смертность, когнитивные функции и функции пожилых людей, проживающих в сообществе. утра. Дж. Мед . 119, 327–334. doi: 10.1016/j.amjmed.2005.08.027
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Евстатиев Р., Марто П., Икбал Т., Халиф И. Л., Штейн Дж., Бокемейер Б. и др. (2011). FERGIcor, рандомизированное контролируемое исследование карбоксимальтозы железа при железодефицитной анемии при воспалительном заболевании кишечника. Гастроэнтерология 141, 846–853. doi: 10.1053/j.gastro.2011.06.005
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Ферруччи, Л., Corsi, A., Lauretani, F., Bandinelli, S., Bartali, B., Taub, D.D., et al. (2005). Причины возрастного провоспалительного состояния. Кровь 105, 2294–2299. doi: 10.1182/blood-2004-07-2599
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Ferrucci, L., Semba, R.D., Guranik, J.M., Ershler, W.B., Bandinelli, S., Patel, K.V., et al. (2010). Провоспалительное состояние, гепсидин и анемия у пожилых людей. Кровь 115, 3810–3816. doi: 10.1182/blood-2009-02-201087
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Гейлслут, Т.E., Vermeulen, S.H., Geurts-Moespot, A.J., Klaver, S.M., Kroot, J.J., van Tienoven, D., et al. (2011). Гепсидин сыворотки: референтные диапазоны и биохимические корреляты в общей популяции. Кровь 117, e218–e225. doi: 10.1182/blood-2011-02-337907
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Ганц Т., Олбина Г., Гирелли Д., Немет Э. и Вестерман М. (2008). Иммуноанализ на гепсидин сыворотки человека. Кровь 112, 4292–4297. дои: 10.1182/кровь-2008-02-139915
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Gardenghi, S., Renaud, T.M., Meloni, A., Casu, C., Crielaard, B.J., Bystrom, L.M., et al. (2014). Различная роль гепсидина и интерлейкина-6 в выздоровлении от анемии у мышей, которым инъецировали умерщвленную нагреванием Brucella abortus. Кровь 123, 1137–1145. doi: 10.1182/blood-2013-08-521625
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Годдард, А.Ф., Джеймс М.В., Макинтайр А.С., Скотт Б.Б. и Британское общество гастроэнтерологов. (2011). Рекомендации по лечению железодефицитной анемии. Гут 60, 1309–1316. doi: 10.1136/gut.2010.228874
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Гуральник, Дж. М., Эйзенштадт, Р. С., Ферруччи, Л., Кляйн, Х. Г., и Вудман, Р. К. (2004). Распространенность анемии среди лиц в возрасте 65 лет и старше в Соединенных Штатах: свидетельство высокой частоты необъяснимой анемии. Кровь 104, 2263–2268. doi: 10.1182/blood-2004-05-1812
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Guyatt, G.H., Patterson, C., Ali, M., Singer, J., Levine, M., Turpie, I., et al. (1990). Диагностика железодефицитной анемии у пожилых. утра. Дж. Мед . 88, 205–209. дои: 10.1016/0002-9343(90)
-2
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Харпер, Дж. В., Холлеран, С. Ф., Рамакришнан, Р., Бхагат Г. и Грин П. Х. (2007). Анемия при целиакии имеет многофакторную этиологию. утра. Дж. Гематол. 82, 996–1000. doi: 10.1002/ajh.20996
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Каутц, Л., Немет, Э., и Ганц, Т. (2013). Эритроидный фактор эритроферрон и его роль в гомеостазе железа. утра. Дж. Гематол. 88, Е24.
Ким А., Фунг Э., Парих С. Г., Валоре Э. В., Габаян В., Немет Э. и др. (2014).Мышиная модель анемии воспаления: сложный патогенез с частичной зависимостью от гепсидина. Кровь 123, 1129–1136. дои: 10.1182/кровь-2013-08-521419
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Крут, Дж. Дж., Тьялсма, Х., Флеминг, Р. Э., и Свинкелс, Д. В. (2011). Гепсидин при заболеваниях железа у человека: диагностическое значение. клин. хим. 57, 1650–1669. doi: 10.1373/clinchem.2009.140053
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Липшиц, Д.А., Кук, Дж. Д., и Финч, К. А. (1974). Клиническая оценка сывороточного ферритина как показателя запасов железа. Н. англ. Дж. Мед. 290, 1213–1216. дои: 10.1056/NEJM1974053021
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
McCranor, B.J., Langdon, J.M., Prince, O.D., Femnou, L.K., Berger, A.E., Cheadle, C., et al. (2013). Изучение роли интерлейкина-6 и антимикробного пептида гепсидина в развитии анемии с возрастом. Haematologica 98, 1633–1640.doi: 10.3324/гематол.2013.087114
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Маджио М., Гуральник Дж. М., Лонго Д. Л. и Ферруччи Л. (2006). Интерлейкин-6 при старении и хронических заболеваниях: великолепный путь. Дж. Геронтол. биол. науч. Мед. Наука . 61, 575–584. doi: 10.1093/gerona/61.6.575
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Маст, А. Э., Блиндер, М. А., Гроновски, А. М., Чамли, К., и Скотт, М.Г. (1998). Клиническая полезность растворимого рецептора трансферрина и сравнение с сывороточным ферритином в нескольких популяциях. клин. хим. 44, 45–51.
Опубликовано Резюме | Опубликован полный текст
Минделл, Дж., Муди, А., Али, А., и Хирани, В. (2013). Использование продольных данных обследования состояния здоровья в Англии для устранения расхождений в пороговых значениях гемоглобина у пожилых людей. Бр. Дж. Гематол. 160, 368–376. doi: 10.1111/bjh.12121
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Немет, Э., Ривера С., Габаян В., Келлер С., Таудорф С., Педерсен Б.К. и соавт. (2004). ИЛ-6 опосредует гипоферремию воспаления, индуцируя синтез гормона регуляции железа гепсидина. Дж. Клин. Вкладывать деньги. 113, 1271–1276. дои: 10.1172/JCI200420945
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Немет Э., Валоре Э. В., Террито М., Шиллер Г., Лихтенштейн А. и Ганц Т. (2003). Гепсидин, предполагаемый медиатор анемии воспаления, является белком острой фазы II типа. Кровь 101, 2461–2463. doi: 10.1182/blood-2002-10-3235
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Онкен, Дж. Э., Брегман, Д. Б., Харрингтон, Р. А., Моррис, Д., Ас, П., Акрайт, Б., и соавт. (2014). Многоцентровое рандомизированное исследование с активным контролем для изучения эффективности и безопасности внутривенного введения карбоксимальтозы железа у пациентов с железодефицитной анемией. Переливание 54, 306–315. doi: 10.1111/trf.12289
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Пасрича, С.R., Flecknoe-Brown, S.C., Allen, K.J., Gibson, P.R., McMahon, L.P., Olynyk, J.K., et al. (2010). Диагностика и лечение железодефицитной анемии: клиническое обновление. Мед. Дж. Ауст . 193, 525–532.
Опубликовано Резюме | Опубликован полный текст
Пасрича С.Р., Маккуилтен З., Вестерман В., Келлер А., Немет В., Ганц Т. и др. (2011). Гепсидин сыворотки как диагностический тест дефицита железа у женщин-доноров крови в пременопаузе. Гематология 96, 1099–1105.doi: 10.3324/гематол.2010.037960
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Пеннинкс, Б.В., Пахор, М., Вудман, Р.К., и Гуральник, Дж.М. (2006). Анемия в пожилом возрасте связана с повышенной смертностью и госпитализацией. Дж. Геронтол. биол. науч. Мед. Наука . 61, 474–479. doi: 10.1093/gerona/61.5.474
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Петросян И., Блейсон Г., Андрес Э. и Федеричи Л.(2012). Анемия у пожилых: этиологический профиль в проспективной когорте из 95 госпитализированных пациентов. евро. Дж. Стажер. Мед . 23, 524–528. doi: 10.1016/j.ejim.2012.03.013
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Пфайффер, К.М., Кук, Дж.Д., Мей, З., Когсвелл, М.Е., Лукер, А.С., и Лачер, Д.А. (2007). Оценка автоматизированного анализа растворимого рецептора трансферрина (sTfR) на анализаторе Roche Hitachi и его сравнение с двумя анализами ELISA. клин. Чим. Acta 382, 112–116. doi: 10.1016/j.cca.2007.04.008
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Паундер Р.Э. и Нг Д. (1995). Распространенность инфекции Helicobacter pylori в разных странах. Алимент. Фармакол. тер. 9, 33–39.
Опубликовано Резюме | Опубликован полный текст
Пуннонен, К., Ирьяла, К., и Раджамаки, А. (1997). Ферритин сыворотки и его соотношение с ферритином сыворотки при диагностике дефицита железа. Кровь 89, 1052–1057.
Опубликовано Резюме | Опубликован полный текст
Рихтер, Дж. М., Хедберг, С. Е., Атанасулис, К. А., и Шапиро, Р. Х. (1984). Ангиодисплазия. Клиническая картина и колоноскопическая диагностика. Коп. Дис. науч. 29, 481–485. дои: 10.1007/BF01296266
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Римон Э., Леви С., Сапир А., Гельзер Г., Пелед Р., Эргас Д. и др. (2002). Диагностика железодефицитной анемии у пожилых людей по индексу трансферрин-рецептор-ферритин. Арх. Стажер Мед . 162, 445–449. doi: 10.1001/archinte.162.4.445
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Сами, С. С., Аль-Араджи, С. А., и Рагунат, К. (2014). Обзорная статья: желудочно-кишечная ангиодисплазия – патогенез, диагностика и лечение. Алимент. Фармакол. тер. 39, 15–34. doi: 10.1111/кв.12527
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Терл, И., Айгнер, Э., Терл, М., Nairz, M., Seifert, M., Schroll, A., et al. (2009). Регуляция гомеостаза железа при анемии хронических заболеваний и железодефицитной анемии: диагностическое и терапевтическое значение. Кровь 113, 5277–5286. doi: 10.1182/blood-2008-12–195651
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Traglia, M., Girelli, D., Biino, G., Campostrini, N., Corbella, M., Sala, C., et al. (2011). Ассоциация генетических вариантов HFE и TMPRSS6 с параметрами железа и эритроцитов лишь частично зависит от концентрации гепсидина в сыворотке. J. Med. Гене . 48, 629–634. doi: 10.1136/jmedgenet-2011-100061
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Ванасс, Г. Дж., и Берлинер, Н. (2010). Анемия у пожилых пациентов: новая проблема 21 века. Гематология Am. соц. Гематол. Образовательный Программа 2010, 271–275. doi: 10.1182/asheducation-2010.1.271
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
ван Сантен С., ван Донген-Ласес Э.C., de Vegt, F., Laarakkers, C.M., van Riel, P.L., van Ede, A.E., et al. (2011). Показатели содержания гепсидина и гемоглобина в диагностике дефицита железа у больных ревматоидным артритом с анемией. Ревматоидный артрит. 63, 3672–3680. doi: 10.1002/art.30623
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Вилппула А., Каукинен К., Луостаринен Л., Крекеля И., Патрикайнен Х., Вальв Р. и др. (2009). Растущая распространенность и высокая заболеваемость целиакией у пожилых людей: популяционное исследование. ВМС Гастроэнтерол. 9:49. doi: 10.1186/1471-230X-9–49
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Винсентелли, А., Сузен, С., Ле Турно, Т., Сикс, И., Фабр, О., Жютье, Ф., и др. (2003). Приобретенный синдром фон Виллебранда при аортальном стенозе. Н. англ. Дж. Мед . 349, 343–349. дои: 10.1056/NEJMoa022831
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Ваален, Дж., фон Лоннейсен, К., Ли, П., Сюй, X.и Фридман, Дж. С. (2011). Уровни эритропоэтина, GDF15, IL6, гепсидина и тестостерона в большой группе пожилых людей с анемией известной и неизвестной причины. евро. Дж. Гематол. 87, 107–116. doi: 10.1111/j.1600-0609.2011.01631.x
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Wikstrom, B., Bhandari, S., Barany, P., Kalra, P.A., Ladefoged, S., Wilske, J.J., et al. (2011). Изомальтозат железа 1000: новый внутривенный препарат железа для лечения дефицита железа при хроническом заболевании почек. Дж. Нефрол. 24, 589–596. doi: 10.5301/JN.2011.6248
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
Всемирная организация здравоохранения (ВОЗ). (2001). Железодефицитная анемия: оценка, профилактика и контроль. Руководство для руководителей программ . Женева: Всемирная организация здравоохранения (WHO/NHD/01.3).
Zakai, N.A., Katz, R., Hirsch, C., Shlipak, M.G., Chaves, P.H., Newman, A.B., et al. (2005). Проспективное исследование состояния анемии, концентрации гемоглобина и смертности в группе пожилых людей: исследование здоровья сердечно-сосудистой системы. Арх. Стажер Мед . 165, 2214–2220. doi: 10.1001/archinte.165.19.2214
Опубликовано Резюме | Опубликован полный текст | Полный текст перекрестной ссылки
.
 Необходимо стоять на учете у кардиолога для наблюдения этих заболеваний.
Необходимо стоять на учете у кардиолога для наблюдения этих заболеваний.