сода (ru)
Сода имеет очень широкий спектр применения. В кулинарии она служит разрыхлителем, в домашнем хозяйстве средством для чистки. В медицине её используют против изжоги.
Общая информация:
Из Википедии: “Гидрокарбонат натрия (Natrii hydrocarbonas) NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) — кислая соль угольной кислоты и натрия. Обыкновенно представляет собой мелкокристаллический порошок белого цвета. Используется в пищевой промышленности, в кулинарии, в медицине как нейтрализатор ожогов кожи и слизистых оболочек человека кислотами и снижения кислотности желудочного сока”.
Применение в промышленности:
“Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Применение:
- в химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения диоксида углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- в легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей).
- в пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков”.
Применение в кулинарии:
“Основное применение пищевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, вместе с карбонатом аммония) и в готовых смесях для выпечки (кексы, торты и пр. )”.
)”.
Применение в медицине:
“Раствор питьевой соды используется для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета»). Коррекция метаболического ацидоза в условиях реанимации”.
Химическая реакция:
“2NaHCO3 -> Na2CO3 + CO2 + H2O”
ИСТОРИЯ, ТЕХНОЛОГИИ ПРОИЗВОДСТВА, СВОЙСТВА И ПРИМЕНЕНИЕ ПИЩЕВОЙ СОДЫ. Статьи компании «ООО “Компания “Химснабжение”»
ИСТОРИЯ, ТЕХНОЛОГИИ ПРОИЗВОДСТВА, СВОЙСТВА И ПРИМЕНЕНИЕ ПИЩЕВОЙ СОДЫ
Введение.
(натрон, бикарбонат натрия, гидрокарбонат натрия) – нейтрализующая кислоту натриевая соль. Питьевая сода – это гидрокарбонат натрия NaHCO3, двууглекислый натрий. В общем случае «сода» представляет собой техническое название натриевых солей угольной кислоты H2CO3. В зависимости от химического состава соединения различается питьевая сода (пищевая сода, бикарбонат натрия, двууглекислый натрий, гидрокарбонат натрия) – NaHCO3, кальцинированная сода (карбонат натрия, безводный углекислый натрий) – Na2CO3 и кристаллическая сода – Na2CO3•10H2O, Na2CO3•7H2O, Na2CO3•H2O. Искусственная пищевая сода (NaHCO3) – белый кристаллический порошок.
В зависимости от химического состава соединения различается питьевая сода (пищевая сода, бикарбонат натрия, двууглекислый натрий, гидрокарбонат натрия) – NaHCO3, кальцинированная сода (карбонат натрия, безводный углекислый натрий) – Na2CO3 и кристаллическая сода – Na2CO3•10H2O, Na2CO3•7H2O, Na2CO3•H2O. Искусственная пищевая сода (NaHCO3) – белый кристаллический порошок.
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Серлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США).
В США природная сода удовлетворяет более 40% потребности страны в этом полезном ископаемом. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
Сода была известна человеку примерно за полторы-две тысячи лет до нашей эры, а может быть, и раньше. Ее добывали из содовых озер и извлекали из немногочисленных месторождений в виде минералов. Первые сведения о получении соды путем упаривания воды содовых озер относятся к 64 году нашей эры. Алхимикам всех стран вплоть до 18 века представлялась неким веществом, которое шипело с выделением какого-то газа при действии известных к тому времени кислот – уксусной и серной. Во времена римского врача Диоскорида Педания о составе соды никто не имел понятия. В 1736 году французский химик, врач и ботаник Анри Луи Дюамель де Монсо впервые смог получить из воды содовых озер очень чистую соду. Ему удалось установить, что сода содержит химический элемент «Натр». В России еще во времена Петра Первого соду называли «зодой» или «зудой» и вплоть до 1860 года ее ввозили из-за границы. В 1864 году в России появился первый содовый завод по технологии француза Леблана. Именно благодаря появлению своих заводов сода стала более доступной и начала свой победный путь в качестве химического, кулинарного и даже лекарственного средства.
Ее добывали из содовых озер и извлекали из немногочисленных месторождений в виде минералов. Первые сведения о получении соды путем упаривания воды содовых озер относятся к 64 году нашей эры. Алхимикам всех стран вплоть до 18 века представлялась неким веществом, которое шипело с выделением какого-то газа при действии известных к тому времени кислот – уксусной и серной. Во времена римского врача Диоскорида Педания о составе соды никто не имел понятия. В 1736 году французский химик, врач и ботаник Анри Луи Дюамель де Монсо впервые смог получить из воды содовых озер очень чистую соду. Ему удалось установить, что сода содержит химический элемент «Натр». В России еще во времена Петра Первого соду называли «зодой» или «зудой» и вплоть до 1860 года ее ввозили из-за границы. В 1864 году в России появился первый содовый завод по технологии француза Леблана. Именно благодаря появлению своих заводов сода стала более доступной и начала свой победный путь в качестве химического, кулинарного и даже лекарственного средства.
Что такое пищевая сода.
В промышленности, торговле и в быту под названием сода встречаются несколько продуктов: кальцинированная сода – безводный углекислый натрий Na2СO3, двууглекислая сода – бикарбонат натрия NaНСO3, часто называемая также питьевой содой, кристаллическая сода Na2СO3•10Н2O и Nа2СO3•Н2O и каустическая сода, или едкий натр, NаОН. Обыкновенная сода, в зависимости от способа приготовления, бывает леблановская и аммиачная. Последняя представляет собой более чистый продукт. Кроме того сода бывает либо в виде кальцинированной (безводной, прокаленной), либо кристаллической. Эта сода содержит 10 частей воды.
Современная пищевая сода – типичный промышленный продукт. Однако она была известна человечеству задолго до нашей эры в естественном состоянии и уже применялась в кулинарии Древнего Египта, на территории которого существовали содовые озера, выделявшие на жгучем солнце пустыни осадочную соду.
В природе сода встречается в твердом виде в небольших залежах в составе минерала трона Na2CO3 NaHCO3•2H2O, в виде раствора – в воде некоторых содовых озер и щелочных минеральных источников и в золе некоторых растений. До начала XIX в. использовалась почти исключительно природная сода, но с ростом потребления соды возникла необходимость производства соды в больших масштабах искусственным путем. В настоящее время добыча природной соды крайне мала. Имеются содовые озера (в Кулундинской степи), однако природная сода составляет небольшой процент в общем ее производстве. Промышленное производство очищенного продукта тесно связано с содовым производством, поскольку в качестве сырья для получения очищенной пищевой соды применяется карбонат (или сырой гидрокарбонат) натрия, а также диоксид углерода известковых печей.
В настоящее время в мире производится несколько миллионов тонн соды в год для промышленного производства, пищевой и медицинской промышленности.
Искусственно сода была получена лишь в конце XVIII века во Франции химиком Лебланом (1791 год). Секрет получения, как тогда водилось, долго держался в тайне, вследствие чего сода стала впервые активно применяться именно во французской кулинарии, особенно во французском кондитерском производстве, и в первую очередь при изготовлении бисквитов и других французских печений, в то время как кондитерское производство в других странах – например, в Австрии, в России – развивалось в ином направлении, с использованием других, преимущественно дрожжевых тестоподъемных средств. Вот почему во Франции, кроме бисквитов, доминировали сухие и слоеные печенья, а в Германии и Польше, где работали французские учителя-повара, получило развитие песочное содовое тесто, в то время как Вена вплоть до XX века оставалась центром пышных кондитерских изделий и знаменита превосходным дрожжевым «венским тестом» – верхом искусного применения дрожжей в кондитерском деле. Лишь в 1861 году бельгийский химик Э. Сольве разработал современный способ получения соды, на который во второй половине XIX – начале XX века перешли все европейские страны и США.
Лишь после Первой мировой войны и революции 1917 г. содовые кондитерские изделия получили развитие в СССР, в 20-30-х годах, в основном через сеть общественного питания, ибо содовое тесто дает возможность достигать стереотипности, стандарта выпечных изделий (одинаковости в их весе, виде, форме). А после Второй мировой войны содовые кондитерские изделия заняли в России основное место в домашнем приготовлении за счет утраты навыков новых поколений к созданию традиционных национальных русских сладостей, а также в связи с редким появлением в продаже дрожжей и разнообразных пряностей, применяемых ранее в русском кондитерском деле (бадьян, калган, корица, имбирь, черный перец, померанцевая цедра).
Характеристики пищевой соды.
Химические свойства.
Гидрокарбонат натрия – кислая натриевая соль угольной кислоты. Молекулярная масса (по международным атомным массам 1971 г.) – 84,00.
Реакция с кислотами.
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
NaHCO3 + HCl → NaCl + H2CO3
H2CO3 → H2O + CO2↑
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Сода хорошо растворяется в воде. Водный раствор питьевой соды имеет слабощелочную реакцию. Шипение соды – результат выделения углекислого газа CO2 в результате химических реакций.
Водный раствор питьевой соды имеет слабощелочную реакцию. Шипение соды – результат выделения углекислого газа CO2 в результате химических реакций.
Термическое разложение.
При температуре 60° C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200° C):
2NaHCO3 → Na2CO3 + H2O + CO2↑
При дальнейшем нагревании до 1000° C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Na2CO3 → Na2O + CO2.
Физико-химические показатели.
Бикарбонат натрия представляет собой кристаллический порошок белого цвета со средним размером кристал лов 0,05 – 0,20 мм. Молекулярная масса соединения равна 84,01, плотность составляет 2200 кг/м³, насыпная плотность – 0,9 г/см³. Теплота растворения бикарбоната натрия исчисляется 205 кДж (48,8 ккал) на 1 кг NaHCO3, теплоемкость достигает 1,05 кДж/кг•К(0,249 ккал/кг•°С).
Гидракарбонат натрия термически малоустойчив и при нагревании разлагается с образованием твердого карбоната натрия и выделением диоксида углерода, а также воды в газовую фазу:
2NaHCO3(тв.) ↔ Na2CO3(тв.) + CO2(г.) + H2O(пар) – 126 кДж (- 30 ккал) Аналогично разлагаются и водные растворы бикарбоната натрия:
2NaHCO3(р.) ↔ Na2CO3(р.) + CO2(г.) + H2O(пар) – 20,6 кДж (- 4,9 ккал) Водный раствор бикарбоната натрия имеет слабо выраженный щелочной характер, в связи с чем на животные и растительные ткани он не действует. Растворимость гидрокарбоната натрия в воде невелика и с повышением температуры она несколько повышается: с 6,87 г на 100 г воды при 0° С до 19,17 г на 100 г воды при 80° С.
Вследствие небольшой растворимости плотность насыщенных водных растворов бикарбоната натрия сравнительно мало отличается от плотности чистой воды.
Температура кипения (разлагается): 851° C;
Температура плавления: 270° C;
Плотность: 2,159 г/см³;
Растворимость в воде, г/100 мл при 20° C: 9.
Применение.
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Широко примененяется в:
- химической промышленности – для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- легкой промышленности – в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож).

- текстильной промышленности (отделка шелковых и хлопчатобумажных тканей). Применение бикарбоната натрия в производстве резиновых изделий также обусловлено выделением CO2 при нагревании, способствующем приданию резине необходимой пористой структуры.
- пищевой промышленности – хлебопечении, производстве кондитерских изделий, приготовлении напитков.
- медицинской промышленности – для приготовления инъекционных растворов, противотуберкулезных препаратов и антибиотиков.
- металлургии – при осаждении редкоземельных металлов и флотации руд.
Кулинария.
Основное применение питьевой соды – кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), изготовлении кондитерских изделий, производстве газированных напитков и искусственных минеральных вод, самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смеси с карбонатом аммония), например, в бисквитном и песочном тесте. Это связано с легкостью ее разложения при 50-100° С.
Это связано с легкостью ее разложения при 50-100° С.
Пищевая сода, применяемая преимущественно при изготовлении мелкого печенья, кондитерских крошек, листов для тортов и слоеных пирожков. В последнюю четверть XIX в. началось ее применение в кондитерском деле, вначале только во Франции и Германии и лишь в самом конце XIX века и в начале XX столетия – также в России.
Применение соды открыло путь к фабричному производству современного печенья – штамповочного. Вместе с тем многие старые виды печенья – бисквитные, слоеные, битые, пряничные, вздувные, меренги – отошли в область прошлого, исчезли не только из общественного, но и из домашнего обихода.
Сода – необходимый повседневный помощник на кухне для мытья посуды, тары для косервирования, некоторых плодов и ягод перед сушкой. Она обладает свойством нейтрализовать и убивать запахи.
Ошибочно думать, что сода – специя только для кондитерского дела. Помимо кондитерского производства, сода применяется также для приготовления английских мармеладов, в мясные фарши для блюд молдавской, румынской и узбекской кухни (калийная сода) и при приготовлении напитков. Количества соды, вносимые во все перечисленные изделия, крайне малы – от “на кончике ножа” до щепотки и четверти чайной ложки. В напитках с содой доля ее гораздо выше – по половине и полной чайной ложке на литр жидкости. Для кондитерских и других целей соду кладут по предписанию рецептов, обычно это очень малые дозы. Хранят ее в герметичной таре, берут сухим предметом.
Количества соды, вносимые во все перечисленные изделия, крайне малы – от “на кончике ножа” до щепотки и четверти чайной ложки. В напитках с содой доля ее гораздо выше – по половине и полной чайной ложке на литр жидкости. Для кондитерских и других целей соду кладут по предписанию рецептов, обычно это очень малые дозы. Хранят ее в герметичной таре, берут сухим предметом.
Получение соды промышленным способом дало широкие возможности в приготовлении многих видов современной кондитерской продукции в европейских странах. Россия долгое время шла традиционным путем, предпочитая дрожжевое и другие виды теста.
В России совершенно не применяли до второй половины XIX века соду в хлебопечении и кондитерском деле. Да и в самом конце XIX века изделия такого рода производились более всего на Украине и в Польше, а также в Прибалтике. У русского населения, привыкшего испокон веков к натуральным видам теста – либо дрожжевого, заквасочного, либо медово-яичного, где в качестве подъемного средства не применялись искусственные химические вещества, а использовались естественно возникавшие при печении газы, в результате взаимодействия таких продуктов, как мед (сахар), яйца, сметана, алкоголь (водка) или винный уксус, – содовое печенье имело крайне низкую популярность и невысокий спрос.
Кондитерские изделия на соде считались «немецкими» и игнорировались как из чисто кулинарно-вкусовых, так и из «патриотических» соображений.
Кроме того, русские национальные кондитерские изделия – медовые пряники и коврижки, глазированные жемки и вареные в меду орешки – имели столь неповторимо превосходный вкус, что успешно конкурировали с западно-европейскими, более утонченными по форме, но «хлипкими» с точки зрения сытости, добротности и вкуса французскими бисквитами, где привлекательность достигалась вовсе не особым характером теста, а применением экзотических пряностей, в основном ванили.
Кроме кондитерских изделий, сода в русской кухне никогда не применялась и не применяется фактически до сих пор. Между тем в Прибалтике, Молдове, Румынии, на Балканах соду применяют как разрыхляющее средство в ряде блюд, приготавливаемых путем жарения. Так, соду вносят в разнообразные полутестяные жареные блюда: оладьи из картофеля, куда входит и пшеничная мука; разнообразные блинчики, сметанные лепешки и пышки, сырники, приготовленные из сочетания творога и муки, а также в мясные фарши, если они состоят только из мяса и лука, без добавления мучных компонентов (муки, белого хлеба, панировочных сухарей). Такой сырой мясной фарш (говяжий, свиной) оставляют с содовой добавкой на выстойку в холодильнике на несколько часов, а затем легко формуют из этого фарша «сосиски», которые быстро (за 10-15 минут) гриллируют в духовом шкафу любой домашней плиты (газовой, дровяной или электрической).
Такой сырой мясной фарш (говяжий, свиной) оставляют с содовой добавкой на выстойку в холодильнике на несколько часов, а затем легко формуют из этого фарша «сосиски», которые быстро (за 10-15 минут) гриллируют в духовом шкафу любой домашней плиты (газовой, дровяной или электрической).
Аналогичное использование соды в мясные фарши известно и в армянской кухне, с той только разницей, что в таких случаях фарш не выстаивается, а подвергается сразу же интенсивному взбиванию с добавлением нескольких капель (5-8) коньяка, и превращается фактически в мясное суфле, используемое для приготовления различных национальных блюд (в основном калолаков).
В англоязычных странах Европы и Америки (Англии, Шотландии, на Восточном побережье США и в Канаде) соду применяют как непременную добавку в варенье из цитрусовых (апельсинов, пампельмозов, лимонов, грейпфрутов), а также для приготовления цукатов. В результате достигается особая развариваемость цитрусов, их жестких корок, превращение такого варенья в подобие густого мармелада, и одновременно снижается (но не исчезает совсем!) степень неприятной горечи, всегда присутствующей в кожуре цитрусовых плодов. Корки апельсинов, составляющих у нас своего рода балласт, отходы при употреблении этих фруктов, с помощью соды становятся ценным сырьем для получения ароматного, высокопитательного мармелада.
Корки апельсинов, составляющих у нас своего рода балласт, отходы при употреблении этих фруктов, с помощью соды становятся ценным сырьем для получения ароматного, высокопитательного мармелада.
В среднеазиатских кухнях сода применяется при приготовлении некондитерских видов простого теста с целью придать ему особую эластичность и превратить в вытяжное тесто без применения для этого растительного масла, как это принято в южноевропейских, средиземноморских и балканских кухнях. В Средней Азии кусочки простого пресного теста после обычной получасовой выстойки смачивают небольшим количеством воды, в котором растворены 0,5 чайной ложки соли и 0,5 чайной ложки соды, а затем растягивают их руками в тончайшую лапшу (т. н. дунганская лапша), которая обладает нежным, приятным вкусом и идет на приготовление национальных блюд (лагмана, монпара, шимы и др.).
Соду в качестве мизерных добавок к любой пище в процессе приготовления, и именно во время тепловой обработки, добавляют во многих национальных кухнях, учитывая, что это дает в ряде случаев не только неожиданный вкусовой эффект, но и обычно очищает пищевое сырье и все блюдо от различных случайных побочных запахов и привкусов.
Вообще роль соды на кухне, даже помимо кулинарного процесса, – весьма значительна. Ведь без соды практически невозможна идеальная чистка столовой и кухонной эмалированной, фарфоровой, стеклянной и фаянсовой посуды, а также кухонного инструментария и оборудования от посторонних запахов и различных налетов и патины. Особенно незаменима и необходима сода при чистке чайной посуды – заварочных чайников и чашек от образующегося на их стенках чайного налета, пленки.
Столь же необходимо применение соды при мытье посуды, в которой приготавливалась рыба, чтобы отбить рыбный запах. Обычно поступают следующим образом: стойкий рыбный запах отбивают тем, что протирают посуду луком, а затем уничтожают (смывают) луковый запах, чистя эту посуду содой.
Словом, сода – непременный компонент кухонного производства, и на хорошей кухне без нее нельзя обойтись. Более того, ее отсутствие в арсенале повара или хозяйки немедленно становится заметным, ибо оно связывает того, кто работает у плиты или за разделочным столом, во многих его действиях.
Современные экологические обстоятельства вызвали еще одно новое применение соды на кухне как средства, повышающего качество овощного сырья. Можно, например, рекомендовать обмывать все обработанные, но еще не нарезанные овощи – перед их закладкой в котел или на сковородку – в растворе соды в воде. Или засыпать одной-двумя чайными ложками соды уже очищенный картофель, залитый холодной водой и предназначенный для отваривания или приготовления пюре. Это не только очистит картофель от химикатов, которые использовались при его выращивании, но и сделает сам продукт светлее, чище, красивее, снимет все побочные запахи, приобретенные при транспортировке или неправильном хранении, а также порче. Сам картофель станет после готовности рассыпчатым, вкусным. Таким образом, применение соды до приготовления, при холодной обработке (затем продукт тщательно промывается холодной водой), способно повысить качество овощного пищевого сырья, в частности у крахмалосодержащих овощей, у корнеплодов и листовых культур (капусты, салатов, шпината, петрушки и т. д.).
д.).
Сода столь прочно заняла место щелочного агента, что до сих пор ничем не удалось сдвинуть ее с этой позиции. Пищевая сода как разрыхлитель может действовать двояко. Во-первых, она разлагается при нагревании по реакции:
2NaHCO3 (сода) → Na2CO3 (соль) + H2O (вода) + CO2 (углекислый газ).
И в этом случае, если добавить в песочное тесто излишнее количество соды, за небольшое время выпечки она может не успеть термически разложиться без остатка и печенье или кекс получат неприятный «содовый» привкус.
Точно так же, как и поташ, сода реагирует с кислотами, содержащимися в тесте или добавленными туда искусственно:
NaHCO3 (сода) + R-COOH (кислота) → R-COONa (соль) + H2O (вода) + CO2 (углекислый газ)
Множество различных фирменных пакетиков и их доступность не отменяют развлечения для юных химиков – самостоятельно изготовить порошок для выпечки.
пропорциональный состав такого традиционного порошка:
2 части кислой виннокаменной соли,
1 часть пищевой соды,
1 часть крахмала или муки.
Медицина.
Как выглядит сода, прекрасно знают все – это белый порошок, который впитывает воду и отлично в ней растворяется. Но мало кто знает об удивительных целебных свойствах этого «простого» вещества. Между тем, сода – гидрокарбонат натрия – один из главных ингредиентов нашей крови. Результаты исследования влияния соды на организм человека превзошли все ожидания. Оказалось, что сода способна выравнивать кислотно-щелочное равновесие в организме, восстанавливать обмен веществ в клетках, улучшать усвоение кислорода тканями, а также препятствовать потере жизненно необходимого калия. Помогает сода при изжоге, при морской болезни, при простудах, при сердечных заболеваниях и головных болях, при кожных заболеваниях. Как видите, сода – лекарство первой помощи.
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») или для устранения ацидоза и т. п.
п.
Пищевая сода применяется для лечения заболеваний, связанных с повышенной кислотностью; раствор питьевой соды применяется для полоскания горла, для промывания кожи при попадании кислот.
Бикарбонат натрия (пищевая сода) может замедлять развитие хронического заболевания почек. К такому выводу пришли ученые из Королевской клиники Лондона (Royal London Hospital), Великобритания. Они исследовали 134 человека с запущенным хроническим заболеванием почек и метаболическим ацидозом.
Одна группа испытуемых проходила обычное лечение, а вторая помимо традиционного лечения ежедневно получала небольшое количество пищевой соды в виде таблеток. У тех больных, кто пил бикарбонат натрия, функции почек ухудшались на 2/3 медленнее, чем у прочих.
Быстрое прогрессирование заболевания почек наблюдалось только у 9% подопытных из «содовой группы» против 45% испытуемых, лечившихся традиционно. Кроме того, у принимавших соду реже развивалась терминальная стадия почечной недостаточности, которая требует диализа. Примечательно, что повышение содержания бикарбоната натрия в организме не вызывало у больных повышения кровяного давления.
Примечательно, что повышение содержания бикарбоната натрия в организме не вызывало у больных повышения кровяного давления.
Cода является недорогим и эффективным средством лечения хронического заболевания почек. Однако исследователи предостерегают: прием соды должен проходить под наблюдением врача, который должен правильно рассчитать дозировку для больного.
Лечебные свойства пищевой соды.
Раньше гидрокарбонат натрия применялся очень широко (как и другие щелочи) в качестве антацидного средства при повышенной кислотности желудочного сока, язвенной болезни желудка и 12-типерстной кишки. При приеме внутрь пищевая сода быстро нейтрализует соляную кислоту желудочного сока и оказывает выраженный антацидный эффект. Однако применение соды заключается не только в блестяще отмытой посуде и избавлении от изжоги. Пищевая сода занимает достойное место в домашней аптечке.
Как и древние египтяне, получавшие природную соду из озерных вод методом выпаривания, люди использовали и другие свойства соды. Она обладает нейтрализующими качествами, используется в медицинской практике для лечения гастритов с повышенной кислотностью. Способна убивать микробов, используется как дезинфицирующее средство: соду применяют для ингаляций, полосканий, очищения кожи.
Она обладает нейтрализующими качествами, используется в медицинской практике для лечения гастритов с повышенной кислотностью. Способна убивать микробов, используется как дезинфицирующее средство: соду применяют для ингаляций, полосканий, очищения кожи.
Широкое применение сода имеет и в здравохранении.
Профилактика кариеса.
Кислоты, образующиеся во рту в результате жизнедеятельности бактерий, разрушают эмаль зубов. Эти кислоты можно нейтрализовать, несколько раз в день полоща рот раствором пищевой соды. Можно поступить иначе: смочите зубную щетку водой, опустите ее в соду и почистите зубы. Сода, кроме того, оказывает легкое абразивное действие: она отполирует зубы, не повреждая эмали.
От неприятного запаха ног.
Добавленная в воду для ножной ванны сода нейтрализует выделяемые бактериями кислоты, которые и придают ногам неприятный запах. Сода поможет также устранить резкий запах пота под мышками.
При укусах насекомых.
Не расчесывайте до крови укусы комаров и прочих кровососов. Лучше приготовьте кашеобразную смесь из воды и соды и нанесите на место укуса. Содовая кашица облегчит также зуд, вызванный ветряной оспой или контактом кожи с борщевиком, крапивой.
Лучше приготовьте кашеобразную смесь из воды и соды и нанесите на место укуса. Содовая кашица облегчит также зуд, вызванный ветряной оспой или контактом кожи с борщевиком, крапивой.
При опрелостях.
Содовые примочки значительно улучшают состояние малышей с опрелостями. Они уменьшают зуд и ускоряют заживление кожи.
При цистите.
Болезнетворные бактерии живут в мочевом пузыре в слегка кислой среде. Если ваш мочевой пузырь пал жертвой инфекции, идеальный послеобеденный напиток для вас – шипучий коктейль из пищевой соды с водой.
При солнечных ожогах.
Добавьте в теплую ванну немного пищевой соды: она смягчит воду, превратив ее в успокаивающую примочку для раздраженной кожи.
От боли в горле.
Размешайте 0,5 чайн. ложки соды в стакане воды и каждые 4 часа полощите горло приготовленным раствором: он нейтрализует кислоты, вызывающие боль. Полоскание таким раствором рта поможет снять и воспаление слизистой ротовой полости.
От неприятного запаха изо рта.
В сочетании с перекисью водорода пищевая сода дает мощный окислительный эффект и разрушает бактерии, порождающие неприятный запах во рту. Добавьте 1 стол. ложку соды в стакан раствора перекиси водорода (2-3%) и прополощите рот.
При простуде.
Полезно делать ингаляцию. Для этого можно взять небольшой чайник, вскипятить в нем 1 стакан воды с 1 чайн. ложкой соды. Сделать из твердой бумаги трубочку, надеть ее на носик чайника и вдыхать пар в течение 10-15 минут. Данная ингаляция очень помогает для отделения мокроты.
Для отхаркивания вязкой мокроты 2 раза в день выпивать натощак по 1/2 стакана теплой воды, в которой растворены 0,5 чайн. ложки соды и щепотка соли.
При частых мигренях.
Каждый день принимать раствор кипяченой воды с пищевой содой. В 1-й день за 30 минут до обеда выпивать 1 стакан раствора (0,5 чайн.ложки соды + вода), 2-й день – 2 стакана и т.д., доведя до 7 стаканов. После уменьшать дозу в обратном порядке.
Прочее.
При ринитах, стоматитах, ларингитах, конъюнктивитах применяют 0,5-2% раствор соды.
Для обеззараживания слизистой оболочки рта полезно полоскать рот некрепким раствором (сода – 85 г, соль – 85 г, мочевина – 2,5 г) после еды.
Средство от курения: полоскать рот раствором пищевой соды (1 столовая ложка на 200 мл воды).
При сухости кожи, сухих дерматитах, ихтиозе и псориазе полезны лечебные ванны (сода – 35 г, карбонат магнезии – 20 г, перборат магния – 15 г). Температура воды должна быть не выше 38-39° С, сначала нужно садиться просто в теплую ванну, потом постепенно увеличивать температуру. Длительность ванны 15 минут.
Пожаротушение.
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Очистка оборудования. Технология абразиво-струйной очистки (АСО).
Производится очистка оборудования и поверхностей от различных покрытий и загрязнений с применением технологии абразиво-струйной очистки (АСО) оборудования. В качестве абразива используется бикарбонат натрия (пищевая сода, двууглекислый натрий, гидрокарбонат натрия, NaHCO3, кислый углекислый натрий).
Технология АСО с применением бикарбоната натрия – это новый эффективный способ очистки оборудования с помощью «мягкого» абразива. Абразив приведен в движение сжатым воздухом, производимым компрессором. Этот способ получил коммерческое признание и широко используется в Европе и США уже в течение 25 лет благодаря своей универсальности и экономической целесообразности.
Обработка поверхности оборудования подобна обычной пескоструйной очистке. Различие заключается в том, что частицы соды являются «мягким» абразивным материалом, то есть не повреждают саму поверхность.
Принцип:
Хрупкая частица кислого углекислого натрия при соприкосновении с очищаемой поверхностью взрывается.
Энергия, выпущенная этой вспышкой, и удаляет загрязнение от очищаемой поверхности. Абразивные частицы соды полностью разбиваются в тонкую пыль, которая легко разлетается в разные стороны перпендикулярно падению, увеличивая очистительный эффект. В целях пылеподавления содо-струйная очистка оборудования обычно выполняется с применением увлажнения, то есть гидро-абразиво-струйной очистки (ГАСО) оборудования. Углекислый натрий растворяется в воде. Поэтому использованный абразив будет растворен или может смываться после окончания чистки.
Углекислый натрий растворяется в воде. Поэтому использованный абразив будет растворен или может смываться после окончания чистки.
Это отличие от кварцевого песка, который срезает покрытие. Кварцевый песок также еще стирает часть очищаемой поверхности, которую сода оставляет фактически невредимой. Существует еще много различий между этими видами очистки оборудования, но они являются уже следствием свойств абразивов.
Растворимые абразивы на основе бикарбоната натрия специально разработаны для абразиво-струйной очистки оборудования. Сыпучие качества абразивов уменьшают плотность потока, связанную с плохой текучестью обычного углекислого натрия.
Технологии производства соды.
Сода впервые была получена в 1793 г. Лебланком, однако пищевая, очищенная сода была изготовлена в 1861 г. Сольвэ.
В конце XVIII и начале XIX в. для получения искусственной соды стали применять способ Леблана, сущность которого заключается в следующем: из поваренной соли действием на нее серной кислотой вначале получали сульфат натрия, затем сульфат натрия сплавляли при высокой температуре с углекислым кальцием и углем. Из полученного сплава соду выщелачивали водой. Раствор затем выпаривали.
Из полученного сплава соду выщелачивали водой. Раствор затем выпаривали.
Изобретение бельгийским ученым Э. Сольвэ в середине XIX столетия аммиачного способа получения соды способствовало интенсивному ее внедрению в первую очередь в кондитерское дело. Основной способ искусственного получения соды в настоящее время во всех странах – аммиачный способ производства кальцинированной соды, являющейся материалом для получения остальных содовых продуктов. Сначала Франция и Германия использовали соду как технологическую добавку для разрыхления теста с целью увеличения его объема, улучшения качества. Сода делает тесто мягким, пышным, легко усвояемым. С конца XIX-начала XX века соду стали применять другие страны, в том числе Россия.
Добывают соду сейчас промышленным аммиачным способом (способ Сольве).
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20° C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140 – 160° C, при этом он переходит в карбонат натрия:
2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O
Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O возвращают в производственный цикл.
Аммонизация раствора необходима для введения в него углекислого газа, малорастворимого в насыщенном растворе. Выпавший в виде кристаллов бикарбонат натрия отфильтровывают от раствора, содержащего хлористый аммоний и непрореагировавший NaCl, и прокаливают (кальцинируют). При этом происходит образование кальцинированной соды.
Выделяющиеся при кальцинации газы, содержащие углекислоту СO2, используют для карбонизации. Таким образом, часть затраченной углекислоты регенерируется.
Необходимую для процесса углекислоту получают обжигом известняка или мела. Обожженную известь СаО гасят водой.
Гашеная известь Са(ОН)2 замешивается с водой. Образовавшееся известковое молоко используют для регенерации аммиака из раствора (фильтровой жидкости), полученного после отделения бикарбоната и содержащего хлористый аммоний.
Для производства соды используют раствор поваренной соли (рассол) концентрации около 310 г/л, полученный в естественных условиях подземным выщелачиванием залежей поваренной соли. В естественном рассоле, помимо NaCl, обычно содержатся соли кальция и магния. При аммонизации и карбонизации рассола в результате взаимодействия этих примесей с NH3 и СО2 будут выпадать осадки, что приведет к загрязнению аппаратов, нарушению теплообмена и нормального хода процесса. Поэтому рассол предварительно очищают от примесей: осаждают их, добавив к рассолу строго определенное количество реактивов – суспензии соды в очищенном рассоле и известкового молока. Этот способ очистки называется содово-известковым. Выпавшие при этом осадки гидрата магния и карбоната кальция отделяют в отстойниках.
Этот способ очистки называется содово-известковым. Выпавшие при этом осадки гидрата магния и карбоната кальция отделяют в отстойниках.
Очищенный и осветленный рассол поваренной соли направляют в барботажную абсорбционную колонну. Верхняя часть колонны служит для промывки рассолом газа, отсасываемого вакуум-насосом из вакуум-фильтров, и газа из карбонизационных колонн. В этих газах содержится небольшое количество аммиака и углекислоты, которые целесообразно отмыть свежим рассолом и, таким образом, более полно использовать их в производстве. Нижняя часть колонны служит для насыщения рассола аммиаком, поступающим из дистилляционной колонны. Полученный аммиачно-соляной рассол далее направляют в барботажную карбонизационную колонну, где происходит основная реакция превращения исходного сырья в бикарбонат натрия. Необходимая для этой цели углекислота СO2 поступает из шахтной известково-обжигательной печи и печи кальцинации бикарбоната натрия и нагнетается снизу в колонну.
Карбонизация аммиачно-соляного рассола является важнейшей стадией производства соды. Образование бикарбоната натрия при карбонизации происходит в результате протекания в карбонизационной колонне сложных химических процессов. В верхней части колонны идет образование углекислого аммония из аммиака, содержащегося в рассоле, и углекислоты, подаваемой в колонну.
Образование бикарбоната натрия при карбонизации происходит в результате протекания в карбонизационной колонне сложных химических процессов. В верхней части колонны идет образование углекислого аммония из аммиака, содержащегося в рассоле, и углекислоты, подаваемой в колонну.
По мере прохождения рассола в колонне сверху вниз углекислый аммоний, реагируя с избытком углекислоты, поступающей снизу колонны, переходит в двууглекислый аммоний (бикарбонат аммония).
Примерно в середине верхней неохлаждаемой части колонны начинается реакция обменного разложения, сопровождающаяся выпадением кристаллов бикарбоната натрия и образованием в растворе хлористого аммония. В средней части колонны, где идет образование кристаллов бикарбоната натрия за счет экзотермичности реакции, температура рассола несколько повышается (до 60 – 65° C), однако охлаждать его не надо, так как такая температура способствует формированию более крупных хорошо фильтрующихся кристаллов бикарбоната натрия. Внизу колонны охлаждение необходимо для уменьшения растворимости бикарбоната натрия и увеличения его выхода.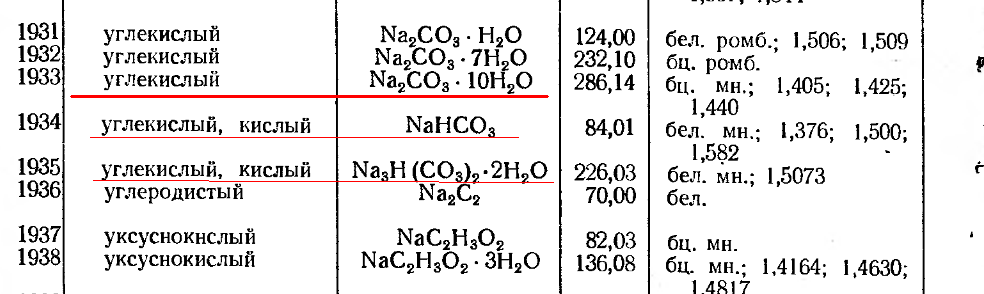 В зависимости от температуры, содержания NaCl в рассоле, степени насыщения его аммиаком и углекислотой и других факторов выход бикарбоната составляет 65-75%. Практически невозможно полное превращение поваренной соли в осадок бикарбоната натрия. В этом заключается один из существенных недостатков производства соды аммиачным методом.
В зависимости от температуры, содержания NaCl в рассоле, степени насыщения его аммиаком и углекислотой и других факторов выход бикарбоната составляет 65-75%. Практически невозможно полное превращение поваренной соли в осадок бикарбоната натрия. В этом заключается один из существенных недостатков производства соды аммиачным методом.
Способы производства бикарбоната натрия.
Бикарбонат натрия выступает промежуточным продуктом промышленного получения кальцинированной соды по методу Сольве, предусматривающему пропускание через насыщенный раствор хлорида натрия эквимолярных (т.е. содержащих равные количества молей) количеств газообразных аммиака и диоксида углерода, что имитирует ввод в систему гидрокарбоната аммония NH4HCO3:
NH3 + H2O + CO2 + NaCl / NH4HCO3 → NaHCO3 + NH4Cl.
В образующемся растворе наименее растворимой солью является бикарбонат натрия, который выпадает в виде кристаллического осадка. При этом важно отметить, что товарным видом данной продукции выступает очищенный двууглекислый натрий.
При этом важно отметить, что товарным видом данной продукции выступает очищенный двууглекислый натрий.
Наиболее широко распространенным способом очистки солей от примесей в общем случае выступает их перекристаллизация из растворов, причем в качестве растворителя наиболее часто используется вода. В основе данного способа лежит свойство большинства солей увеличивать растворимость при повышении температуры.
Согласно методу перекристаллизации, очищаемая соль растворяется в воде при высокой температуре, после чего раствор доводится до насыщенияч, а затем охлаждается, причем началу последнего из перечисленных процессов предшествует удаление нерастворенных примесей посредством фильтрации. В ходе же охлаждения раствора растворимость соли уменьшается, она выпадает в осадок и отфильтровывается. Вследствие предпринимаемых мер чистота соли повышается, поскольку все примеси, входящие в ее состав до осуществления процесса, растворяются в воде и переходят в фильтрат, представляющий собой маточную жидкость, возвращаемую на начальную стадию. По мере циркуляции маточной жидкости в ней накапливаются примеси, что в конечном счете негативно отражается на чистоте получаемой продукции и обуславливает необходимость периодического вывода из цикла части фильтрата.
По мере циркуляции маточной жидкости в ней накапливаются примеси, что в конечном счете негативно отражается на чистоте получаемой продукции и обуславливает необходимость периодического вывода из цикла части фильтрата.
Однако в том случае, если соль, подобно бикарбонату натрия, плохо растворима в воде, очищать ее методом перекристаллизации представляется экономически невыгодным, так как в системе для получения единицы массы чистого продукта должно циркулировать большое количество маточной жидкости, требующей попеременного нагревания и охлаждения. В связи с этим обстоятельством в промышленных масштабах очищенную пищевую соду получают не методом перекристаллизации, но карбонизацией содового раствора путем пропускания диоксида углерода под давление в насыщенном растворе карбоната натрия при температуре около 75° С согласно реакции:
Na2CO3(р.) + CO2(г.) + H2O(ж.) ↔ 2NaHCO3(тв.) + 52,4 кДж (+ 12,5 ккал).
Практическое применение метода карбонизации позволяет значительно сократить объем жидкости, необходимой для получения единицы бикарбоната натрия, поскольку растворимость кальцинированной соды в несколько раз превышает соответствующий показатель гидрокарбоната натрия.
Содовый раствор для карбонизации получается путем растворения в воде твердой технической соды, образующейся при кальцинации сырого бикарбоната (этот процесс носит название «сухого» способа) или же разложением двууглекислого натрия в водной среде при нагревании («мокрый» способ), которое называется декарбонизацией, согласно реакции:
2NaHCO3(р.) ↔ Na2CO3(р.) + CO2(г.) + H2O(пар) – 20,6 кДж (- 4,9 ккал).
Выпадающая при насыщении содового раствора диоксидом углерода чистая пищевая сода отделяется, а маточная жидкость, содержащая смесь карбоната и бикарбоната натрия, а также растворенных примесей (например, NaCl), возвращается в начало процесса для получения исходного раствора. Вследствие многократной циркуляции маточной жидкости в ней накапливаются примеси, способные засорить очищенный продукт. В результате этого часть маточной жидкости выводится из цикла и направляется в общем случае на рассолоочистку с целью разбавления крепкого содового раствора.
Вследствие многократной циркуляции маточной жидкости в ней накапливаются примеси, способные засорить очищенный продукт. В результате этого часть маточной жидкости выводится из цикла и направляется в общем случае на рассолоочистку с целью разбавления крепкого содового раствора.
Для производства очищенного бикарбоната натрия используются так называемые «сухой» и «мокрый» способы. В основе процесса обычная реакция карбонизации, т.е. насыщение раствора углекислым газом. Происходит перекристаллизация. Способы отличаются приготовлением раствора. При сухом способе берется готовая кальцинированная сода и растворяется водой, а при мокром используется технический бикарбонат. Колонное оборудование по принципу действия почти идентично тому, что задействовано при производстве кальцинированной соды, но выполнено из высококачественной нержавеющей стали. Чистота в цехе и чистота готовой продукции находятся под постоянным контролем органов государственного санитарно-эпидемиологического надзора.
Пищевая сода – применение, состав, производство
Первые упоминания о соде ученые нашли примерно за полторы-две тысячи лет до нашей эры. Раньше ее получали из содовых озер, а также из редких месторождений в виде минералов. Однако, о добыче соды методом выпаривания воды содовых озер стало известно в 64 году нашей эры. О точном составе соды долгие годы ничего не было известно. Лишь в 1736 году французский химик, врач и ботаник Анри Луи Дюамель де Монсо первым в мире получил из воды содовых озер очень чистую соду. Он установил, что в составе соды присутствует химический элемент «Натр».
Раньше ее получали из содовых озер, а также из редких месторождений в виде минералов. Однако, о добыче соды методом выпаривания воды содовых озер стало известно в 64 году нашей эры. О точном составе соды долгие годы ничего не было известно. Лишь в 1736 году французский химик, врач и ботаник Анри Луи Дюамель де Монсо первым в мире получил из воды содовых озер очень чистую соду. Он установил, что в составе соды присутствует химический элемент «Натр».
Интересно, что на территории России еще во времена Петра Первого соду называли «зодой» или «зудой» и до 1860 года она было импортным продуктов. В 1864 году в России открыли единственный содовый завод, который функционировал по технологии француза Леблана. На сегодняшний день содовые озера имеются в Забайкалье и в Западной Сибири. Также соду добывают из озера Натрон в Танзании и озера Серлс в Калифорнии.
Характеристики пищевой соды.
Сода пищевая – гидрокарбонат натрия, натрия бикарбонат, питьевая сода, натрий двууглекислый – это кислая соль натрия и угольной кислоты. Что же представляет собой пищевая сода? Вещество это является щелочью. На вид это белый кристаллический порошок, который хорошо растворяется в воде, взрывобезопасный, пожароустойчивый и нетоксичный.
Что же представляет собой пищевая сода? Вещество это является щелочью. На вид это белый кристаллический порошок, который хорошо растворяется в воде, взрывобезопасный, пожароустойчивый и нетоксичный.
Из главных химических взаимодействий отметим следующие:
- молекулярная масса (согласно международным атомным массам 1971 г.) составляет 84,00
- состав соды пищевой позволяет ей вступать в реакцию с кислотами. При этом выделяется соль и угольная кислота, которая сразу же распадается на углекислый газ и воду: NaHCO3 + HCl → NaCl + H2CO3, H2CO3 → H2O + CO2↑
- в кулинарном деле более популярна реакция с уксусной кислотой, вследствие чего образуется ацетат натрия: NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
- сода отлично растворяется в воде. Для водного раствора питьевой соды характерна слабощелочная реакция
- при 60° C начинается распад гидрокарбоната натрия на карбонат натрия, углекислый газ и воду.
 Пик эффективности достигается при 200° C – 2NaHCO3 → Na2CO3 + H2O + CO2↑
Пик эффективности достигается при 200° C – 2NaHCO3 → Na2CO3 + H2O + CO2↑ - если продолжать нагревать до 1000° C (к примеру, в процессе тушения пожара порошковыми системами), карбонат натрия разлагается на углекислый газ и оксид натрия: Na2CO3 → Na2O + CO2.
Из физико-химических показателей отметим:
- белый кристаллический порошок, средний размер кристаллов который составляет 0,05 – 0,20 мм
- плотность равняется 2200 кг/м³. При этом насыпная плотность составляет 0,9 г/см³
- теплота растворения равняется 205 кДж (48,8 ккал) на 1 кг NaHCO3, а уровень теплоемкости – 1,05 кДж/кг•К(0,249 ккал/кг•°С)
- закипает раствор при температуре 851° C
- плавится при 270° C.
Производство пищевой соды
Натуральную соду получают из минерала трона (египетской соли), а также из воды содовых озер. Однако, поскольку залежи трона на планете крайне скудны, а содовых озер лишь несколько штук, то объем добычи соды не может даже наполовину покрыть потребности населения и промышленности. Для обеспечения необходимого количества соды работают специальные содовые заводы.
Для обеспечения необходимого количества соды работают специальные содовые заводы.
Первую соду искусственным путем получил в 1793 г. Лебланк. Но, пищевую, очищенную соду получили только в 1861 году.
Из чего делают соду пищевую сегодня? В XIX веке искусственную соду начали получать по методу Леблана, суть которого состоит в следующем: из поваренной соли в присутствии серной кислоты образовывался сульфат натрия, который далее подвергали сплавлению при высокой температуре с углекислым кальцием и углем. Полученный таким образом сплав подвергают выщелачиванию водой. Далее раствор выпаривают и получают чистую соду.
Разработанный бельгийским ученым Э. Сольвэ аммиачный метод получения соды привел к активному ее использованию, прежде всего в кондитерском деле. Первыми соду для выпечки начали применять Франция и Германия. Тесно становилось более рыхлым и объемным, легче усваивалось. В начале XX века популярность соды распространилась и на другие государства, среди которых и Россия.
Сегодня промышленное производство соды выглядит следующим образом:
- через высококонцентрированный раствор хлорида натрия пропускают эквимолярный объем газообразного аммиака и диоксида углерода: NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.

- полученный осадок малорастворимого (9,6 г на 100 г воды при 20° C) гидрокарбоната натрия фильтруют и подвергают кальцинированию (обезвоживанию) путем нагревания до 140 – 160° C. Таким образом, он превращается в карбонат натрия: 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O
- после этого диоксид углерода и аммиак ( которые были выделены из маточного раствора на первой стадии) процесса по реакции: 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O, возвращают снова в производство
- процесс аммонизации нужен, чтобы ввести в него углекислый газ, плохо растворим в насыщенном растворе
- бикарбонат натрия выпадает в осадок в виде кристаллов. Его нужно отфильтровать от раствора, в котором присутствует хлористый аммоний и непрореагировавший NaCl, а потом прокаливают (кальцинируют). Таким образом, образуется кальцинированная сода
- гашеную известь Са(ОН)2 замешивают с водой.
 Полученное известковое молоко необходимо для регенерации аммиака из раствора (фильтровой жидкости), которую получили в процессе отделения бикарбоната
Полученное известковое молоко необходимо для регенерации аммиака из раствора (фильтровой жидкости), которую получили в процессе отделения бикарбоната - от температуры, объема NaCl в рассоле, уровня насыщения его аммиаком и углекислотой, а также прочих факторов выход бикарбоната достигает 65-75%.
Использование пищевой соды
Пищевая сода применяется в фармацевтической промышленности, цветной металлургии, в быту, кулинарной промышленности. Она является зарегистрированной пищевой добавкой E500. Для чего нужна пищевая сода в различных отраслях, рассмотрим более подробно:
- в химическом производстве ее используют при изготовлении красителей, пенопластов и прочих органических веществ, фторорганических соединений, изделий бытовой химии, а также наполнителей в огнетушителях. Кроме этого, сода является реагентом для отделения диоксида углерода, сероводорода из газовых смесей, к примеру, отходящих газов в топливосжигающих установках
- в лёгкой промышленности соду используют для изготовления резины для подошв обуви, а также в изготовлении искусственных кож, кожевенном производстве в процессе дубления и для нейтрализации кожи по окончанию кислого дубления.
 Текстильная промышленность использует соду в процессе отделки шёлковых и хлопчатобумажных тканей
Текстильная промышленность использует соду в процессе отделки шёлковых и хлопчатобумажных тканей - в пищевой промышленности — в хлебопечении, создании кондитерских изделий, а также приготовлении газированных напитков. Добавление пищевой соды в кислое тесто приводит к реакции с молочной кислотой, которая продуцируется во время заквашивания молочнокислыми и бифидо микроорганизмами. Вследствие этого выделяется углекислый газ, который вспучивает тесто. Можно добавлять соду и в пресное тесто. Углекислый газ из нее будет выделяться во время выпечки, вследствие реакции термического разложения
- в медицине раствором питьевой соды дезинфицируют зубы и дёсны при зубных болях, а также полость рта и горла, при кашле, ангине, фарингите. Кроме этого, раствор соды употребляют внутрь в качестве средства от изжоги и болей в желудке. Редко используют внутривенно для быстрого устранения метаболического ацидоза в процессе реанимационных действий
- гидрокарбонат натрия и карбонат аммония являются наполнителем в огнетушителях с сухой смесью, а также в традиционных системах сухого пожаротушения.
 В этом деле сода популярна, потому что вследствие высокой температуры в очаге горения выделяется много углекислого газа, атмосфера которого не допускает кислород воздуха в очаг горения
В этом деле сода популярна, потому что вследствие высокой температуры в очаге горения выделяется много углекислого газа, атмосфера которого не допускает кислород воздуха в очаг горения - в быту сода применяется для безопасной очистки разных поверхностей, кроме деревянных, так как сода может окрасить древесину в красный цвет
- сода используется в качестве нейтрализатора следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов.
Пищевая сода, применение которой не теряет популярности, является дешевым и эффективным продуктом во многих сферах жизнедеятельности человека.
Химия поп-музыки | Поговорим о науке
АБ
Химия 20 (2007 г., обновление 2014 г.)
11
Модуль B: Формы материи: газы
АБ
Химия 20 (2007 г., обновление 2014 г.)
11
Модуль C: Материя в виде растворов, кислот и оснований
АБ
Химия 30 (2007 г., обновление 2014 г.)
12
Раздел D: Химическое равновесие с акцентом на кислотно-основные системы
АБ
Наука о знаниях и трудоустройстве 10-4 (2006)
10
Модуль A: Исследование свойств материи
АБ
Наука о знаниях и трудоустройстве 20–4 (2006 г. )
)
11
Модуль A: Применение материи и химических изменений
АБ
Наука о знаниях и трудоустройстве 8, 9 (пересмотрено в 2009 г.)
9
Модуль C: Экологическая химия
АБ
Наука 10 (2005 г., обновлено в 2015 г.)
10
Модуль A: Энергия и материя в химическом изменении
АБ
Наука 14 (2003 г., обновлено в 2014 г.)
10
Модуль A: Исследование свойств материи
АБ
Наука 20 (2007 г., обновлено в 2014 г.)
11
Блок A: Химические изменения
АБ
Наука 24 (2003 г., обновлено в 2014 г.)
11
Модуль A: Применение материи и химических изменений
АБ
Наука 7-8-9 (2003 г., обновлено в 2014 г.)
9
Модуль C: Экологическая химия
До нашей эры
Химия 11 (июнь 2018 г.)
11
Большая идея: материя и энергия сохраняются в химических реакциях.
До нашей эры
Химия 11 (июнь 2018 г.)
11
Большая идея: растворимость в растворе определяется природой растворенного вещества и растворителя.
До нашей эры
Химия 11 (июнь 2018 г. )
)
11
Большая идея: моль — это величина, используемая для того, чтобы сделать атомы и молекулы измеримыми.
До нашей эры
Химия 12 (июнь 2018 г.)
12
Большая идея: Сила кислоты или основания зависит от степени диссоциации ионов.
До нашей эры
Химия 12 (июнь 2018 г.)
12
Большая идея: динамическое равновесие может быть смещено изменением окружающих условий.
До нашей эры
Химия 12 (июнь 2018 г.)
12
Большая идея: насыщенные растворы — это системы, находящиеся в равновесии.
До нашей эры
Естествознание 10 класс (март 2018 г.)
10
Большая идея: требуется изменение энергии, поскольку атомы перестраиваются в химических процессах.
МБ
Химия 11 класс (2006)
11
Тема 2: Газы и атмосфера
МБ
Химия 11 класс (2006)
11
Тема 4: Решения
МБ
Химия 12 класс (2013)
12
Тема 1: Реакции в водных растворах
МБ
Химия 12 класс (2013)
12
Тема 4: Химическое равновесие
МБ
Химия 12 класс (2013)
12
Тема 5: Кислоты и основания
МБ
Старший 2 науки (2001)
10
Кластер 2: Химия в действии
NB
Химия 111/112 (2009)
11
Блок 2: Стехиометрия
NB
Химия 121/122 (2009)
12
Модуль 2: От решений к кинетике и равновесию
NB
Химия 121/122 (2009)
12
Блок 3: Кислоты и основания
NB
Chimie 11e Année 52311/52312 (2007) (только на французском языке)
11
1. Материя и связи
Материя и связи
NB
Chimie 11e Année 52311/52312 (2007) (только на французском языке)
11
3. Решения
NB
Chimie 11e Année 52311/52312 (2007) (только на французском языке)
11
4. Газ
NB
Наука 10 класс (2002)
10
Физические науки: химические реакции
Нидерланды
Химия 2202 (2018)
11
Блок 1: Стехиометрия
Нидерланды
Химия 2202 (2018)
11
Модуль 2: От структур к свойствам
Нидерланды
Химия 3202 (2005)
12
Модуль 1: От кинетики к равновесию
Нидерланды
Химия 3202 (2005)
12
Блок 2: Кислоты и основания
Нидерланды
Наука 1206 (2018)
10
Блок 2: Химические реакции
Нидерланды
Наука 3200 (2005)
12
Блок 1: Химические реакции
Нидерланды
Наука 7 класс (2013)
7
Блок 3: Смеси и растворы
NS
Химия 12 (2009)
12
Кислоты и основания
NS
Химия 12 (2009)
12
Решения, кинетика и равновесие
NS
Наука 10 (2012)
10
Физические науки: химические реакции
NT
Химия 20 (Альберта, 2007 г. , обновлено в 2014 г.)
, обновлено в 2014 г.)
11
Модуль B: Формы материи: газы
NT
Химия 20 (Альберта, 2007 г., обновлено в 2014 г.)
11
Модуль C: Материя в виде растворов, кислот и оснований
NT
Химия 30 (Альберта, 2007 г., обновлено в 2014 г.)
12
Раздел D: Химическое равновесие с акцентом на кислотно-основные системы
NT
Наука о знаниях и трудоустройстве 10-4 (Альберта, 2006 г.)
10
Модуль A: Исследование свойств материи
NT
Наука о знаниях и трудоустройстве 20–4 (Альберта, 2006 г.)
11
Модуль A: Применение материи и химических изменений
NT
Наука о знаниях и трудоустройстве 9 (Альберта, редакция 2009 г.)
9
Модуль C: Экологическая химия
NT
Science 10 (Альберта, 2005 г., обновлено в 2015 г.)
10
Модуль A: Энергия и материя в химическом изменении
NT
Наука 14 (Альберта, 2003 г., обновлено в 2014 г.)
10
Модуль A: Исследование свойств материи
NT
Science 20 (Альберта, 2007 г., обновлено в 2014 г.)
11
Блок A: Химические изменения
NT
Наука 24 (Альберта, 2003 г. , обновлено в 2014 г.)
, обновлено в 2014 г.)
11
Модуль A: Применение материи и химических изменений
НУ
Химия 20 (Альберта, 2007 г., обновлено в 2014 г.)
11
Модуль B: Формы материи: газы
НУ
Химия 20 (Альберта, 2007 г., обновлено в 2014 г.)
11
Модуль C: Материя в виде растворов, кислот и оснований
НУ
Химия 30 (Альберта, 2007 г., обновлено в 2014 г.)
12
Раздел D: Химическое равновесие с акцентом на кислотно-основные системы
НУ
Наука о знаниях и трудоустройстве 10-4 (2006)
10
Модуль A: Исследование свойств материи
НУ
Наука о знаниях и трудоустройстве 20–4 (Альберта, 2006 г.)
11
Модуль A: Применение материи и химических изменений
НУ
Наука 10 (2005 г., обновлено в 2015 г.)
10
Модуль A: Энергия и материя в химическом изменении
НУ
Наука 14 (2003 г., обновлено в 2014 г.)
10
Модуль A: Исследование свойств материи
НУ
Science 20 (Альберта, 2007 г., обновлено в 2014 г.)
11
Блок A: Химические изменения
НУ
Наука 24 (Альберта, 2003 г. , обновлено в 2014 г.)
, обновлено в 2014 г.)
11
Модуль A: Применение материи и химических изменений
НА
Химия, 11 класс, университет (СЧ4У)
11
Цепь C: Химические реакции
НА
Химия, 11 класс, университет (СЧ4У)
11
Цепь E: растворы и растворимость
НА
Химия, 11 класс, университет (СЧ4У)
11
Направление F: газы и химия атмосферы
НА
Химия, 12 класс, университет (СЧ5У)
12
Направление E: химические системы и равновесие
НА
Естествознание, 10 класс, академический (SNC2D)
10
Цепь C: Химические реакции
НА
Прикладные науки 10 класса (SNC2P) (2008 г.)
10
Цепь C: химические реакции и их практическое применение
НА
Наука, 12 класс, рабочее место (SNC4E)
12
Направление C: Химические вещества в потребительских товарах
ЧП
Химия 521А (проект 2021 г.)
11
Знание содержания: CK 2 .3
ЧП
Химия 621А (проект 2021 г.)
12
Знание контента: CK 2 .1
ЧП
Химия 621А (проект 2021 г.)
12
Знание контента: CK 2 . 3
3
ЧП
Химия 621А (проект 2021 г.)
12
Знание контента: CK 3.1, 3.2, 3.3
ЧП
Наука 421А (2019)
10
Знание контента: CK 2.2
ЧП
Наука 431A (без даты)
10
Блок 2: Химические реакции
КК
Прикладная наука и технологии
Раздел III
Материальный мир
КК
Химия
Раздел V
Химическое равновесие
КК
Химия
Раздел V
Газы
КК
Экологические науки и технологии
Раздел IV
Материальный мир
КК
Наука и технология
Раздел I
Материальный мир: организация
КК
Наука и технология
Раздел II
Материальный мир: организация
КК
Наука и технология
Раздел III
Материальный мир
КК
Наука и технология
Раздел IV
Материальный мир
КК
Наука и окружающая среда
Раздел IV
Материальный мир
СК
Химия 30 (2016)
12
Химические равновесия
СК
Физические науки 20 (2016)
11
Основы химии
ЮТ
Химия 11 (Британская Колумбия, июнь 2018 г.)
11
Большая идея: материя и энергия сохраняются в химических реакциях.
ЮТ
Химия 11 (Британская Колумбия, июнь 2018 г.)
11
Большая идея: растворимость в растворе определяется природой растворенного вещества и растворителя.
ЮТ
Химия 11 (Британская Колумбия, июнь 2018 г.)
11
Большая идея: моль — это величина, используемая для того, чтобы сделать атомы и молекулы измеримыми.
ЮТ
Химия 12 (Британская Колумбия, июнь 2018 г.)
12
Большая идея: Сила кислоты или основания зависит от степени диссоциации ионов.
ЮТ
Химия 12 (Британская Колумбия, июнь 2018 г.)
12
Большая идея: динамическое равновесие может быть смещено изменением окружающих условий.
ЮТ
Химия 12 (Британская Колумбия, июнь 2018 г.)
12
Большая идея: насыщенные растворы — это системы, находящиеся в равновесии.
ЮТ
Наука, 10 класс (Британская Колумбия, июнь 2016 г.)
10
Большая идея: требуется изменение энергии, поскольку атомы перестраиваются в химических процессах.
Почему вы всегда должны тянуться к воде: опасности сладких напитков
Вторник, 23 июля 2019 г.
Лето на юге жаркое и влажное. Проводите любое количество времени на свежем воздухе, особенно если это связано с бегом, и вам захочется чего-нибудь, чтобы вылечить обезвоживание.Но, к сожалению, для многих людей на юге это лекарство включает в себя что-то сладкое и сладкое, например газировку.
«Примерно половина взрослого населения США выпивает газировку в день», — заявил семейный врач SouthCoast Health Леланд Дампьер, доктор медицинских наук. «Грузия входит в пятерку штатов с самым высоким уровнем потребления сахара: примерно каждый третий взрослый грузин пьет газировку в день. Но я уверен, что если бы больше взрослых знали, что они делают со своим телом, они бы усердно работали, чтобы никогда больше не пить газировку.
Чтобы объяснить, почему всегда лучше пить воду, особенно в жаркие летние месяцы, мы обсудим, почему лучше избегать газированных напитков и вместо этого пить прохладный стакан воды.
Почему нельзя пить газировку
Вы, наверное, слышали множество причин, по которым вам следует избегать газированных напитков. На самом деле существует бесчисленное множество исследований и статей, в которых перечислено множество страшных причин избегать газированных напитков, например, как сладкие газированные напитки приводят к резистентности к инсулину или повышенному риску слабоумия.
На самом деле существует бесчисленное множество исследований и статей, в которых перечислено множество страшных причин избегать газированных напитков, например, как сладкие газированные напитки приводят к резистентности к инсулину или повышенному риску слабоумия.
Мы собрали несколько основных причин, по которым вам не следует пить газировку, но знайте, что это лишь часть полного списка.
- Ознакомьтесь с информацией о пищевой ценности на обратной стороне газировки. Вы, вероятно, не удивитесь, увидев, что они не имеют для вас абсолютно никакой питательной ценности, за исключением того факта, что они содержат большое количество сахара и калорий. Эта комбинация приводит к более высокому риску ожирения, диабета и дисбаланса сахара в крови.
- Даже если вы потянетесь за газировкой, чтобы утолить жажду в жаркий летний день, это не принесет вам должного.Газированные напитки на самом деле обезвоживают, а это означает, что они имеют противоположный эффект, чем чашка воды.

- Помимо того, что сахар вызывает привыкание, у потребителей кофеина также были обнаружены симптомы, похожие на привыкание. Это означает, что в формуле газировки содержится не одно, а два привыкания. Дети и подростки часто являются самыми большими потребителями газированных напитков, а это означает, что, когда они вырастут во взрослую жизнь, им может быть труднее придерживаться более здоровой диеты, и у них может быть задержка работы мозга.
- Поскольку газировка содержит много сахара, неудивительно, что газировка также приводит к кариесу.На самом деле, у людей, которые регулярно пьют газированные напитки, гораздо больше шансов иметь кариес и отсутствие зубной эмали.
- Камни в почках и газировка тоже имеют отношение. Те, кто пьет больше газированных напитков, особенно темных, чаще испытывают болезненные камни в почках, поскольку высокий уровень фосфорной кислоты в газированных напитках ослабляет ваши почки и печень.
- Это исследование фактически показало, что у тех, кто ежедневно выпивает порцию газированных напитков на 12 унций, риск сердечно-сосудистых заболеваний увеличивается в общей сложности на 19 процентов.

- Помимо вышеперечисленных проблем, потребление большого количества газированных напитков также приводит к усталости, головным болям, повышенному риску развития СДВГ, нехватке кальция, большему количеству жира в печени, повышенному риску рака, подавлению иммунной системы, капризности и снижению функции мозга. .
Преимущества питьевой воды
Вы, наверное, слышали, что в день нужно выпивать около восьми чашек воды. Хотя этот факт на самом деле не доказан научно, хорошо бы стрелять в цель, потребляющую воду, аналогичную.На самом деле, легче не пить достаточно воды, чем переувлажнять себя. Если вы сомневаетесь, выпейте стакан воды.
Как и в случае с причинами, по которым следует избегать газированных напитков, есть бесчисленные преимущества питьевой воды. Мы собрали некоторые из наших фаворитов ниже!
- Когда вы полностью увлажняете себя, вы также сохраняете свою кровь счастливой и здоровой, а это означает, что кислород легче проходит через ваше тело.
 Кроме того, ваша кровь станет гуще, если вы не пьете достаточно воды, что приведет к повышению артериального давления.
Кроме того, ваша кровь станет гуще, если вы не пьете достаточно воды, что приведет к повышению артериального давления. - Если вы обезвожены, ваша кожа более подвержена кожным заболеваниям и морщинам.
- Питьевая вода поддерживает чистоту рта и производит достаточное количество слюны для правильного переваривания пищи. Кроме того, вода поддерживает рот, нос и глаза влажными, как и должно быть.
- Употребление большего количества газированных напитков приводит к увеличению жира. Однако употребление большего количества воды приводит к потере веса. На самом деле, если вы будете пить воду перед каждым приемом пищи, это поможет вам быстрее чувствовать себя сытым, предотвращая переедание.
- Собираетесь тренироваться более 30 минут? Исследования показывают, что если вы приходите в спортзал обезвоженным, ваши результаты тренировок будут крайне ограниченными. Пейте достаточно воды, чтобы повысить эффективность тренировок.
- Вода помогает вывести из организма все отходы жизнедеятельности.
 Если вы не пьете достаточно, у вас будут проблемы с пищеварением, такие как запоры, повышенный риск изжоги и даже язвы желудка.
Если вы не пьете достаточно, у вас будут проблемы с пищеварением, такие как запоры, повышенный риск изжоги и даже язвы желудка. - Очень важно сохранять прохладу, особенно летом.Лучший способ сделать это — пить достаточное количество воды, что приводит к здоровому потоотделению. Это основной способ вашего тела регулировать температуру.
- Недостаточное употребление алкоголя влияет даже на ваш мозг! Без достаточного количества воды страдают гормоны и нейротрансмиттеры, а это означает, что мышление и рассуждения могут выйти из строя.
- У вас сильная летняя аллергия? Пейте больше воды! Если вы обезвожены, ваши дыхательные пути становятся ограниченными, а это означает, что аллергия и астма усугубляются.
- Одними из худших физических симптомов обезвоживания являются головные боли и мигрени. Если вы обезвожены и испытываете головную боль, употребление большего количества воды может помочь облегчить эту боль.
Летом в Саванне жарко. В следующий раз, когда вам захочется чего-нибудь прохладного и освежающего, не забудьте взять стакан воды и оставить газировку.
Если у вас есть дополнительные вопросы о вреде газировки или пользе воды, щелкните здесь, чтобы записаться на прием к любому из врачей общей практики SouthCoast Health.
Независимо от того, ищете ли вы лечащего врача, педиатра или другого медицинского специалиста, SouthCoast Health предоставит вам широкий спектр медицинских услуг мирового класса, доступных на всей территории Прибрежной Империи и Нидерландов. Компания SouthCoast Health, основанная в 1996 году, насчитывает 120 врачей и медицинских работников в 17 местах в Саванне, Ричмонд-Хилле, Пулере, Ринконе, Баксли, Блаффтоне, Хилтон-Хед, Хайнсвилле и Стейтсборо. SouthCoast Health предлагает комплексные медицинские услуги, включая: семейную медицину, внутреннюю медицину, педиатрию, аллергологию и иммунологию, кардиологию, эндокринологию, офтальмологию, визуализацию, инфекционные заболевания, нефрологию, неврологию, физиотерапию, подологию, медицину сна, хирургию, клинические исследования. , учебные занятия по диабетическому самоконтролю, диетическое консультирование, клиника рака молочной железы с высоким риском, лабораторные услуги, массаж, магазин оптики, аптека и неотложная помощь.
Можно ли детям газированную воду?
Лучше подождать, пока вашему ребенку исполнится не менее 2 лет, чтобы давать ему газированную или минеральную воду. Даже в этом случае обычная вода или молоко являются лучшими напитками для малышей.
Детям младше 6 месяцев следует пить только грудное молоко или молочную смесь, которые содержат всю необходимую ребенку воду даже в жаркую погоду. (Грудное молоко и молочная смесь на 85 процентов состоят из воды.)
Как только ваш ребенок станет достаточно взрослым, чтобы пить воду, лучше придерживаться простого вида.
Газированная вода не является хорошей идеей, потому что газировка происходит из-за газа, и это именно то, что она вызовет у вашего младенца или ребенка. Это может привести к обильному срыгиванию и отрыжке, а также к болям и дискомфорту в животе.
Газировка может вызвать проблемы с животиком в любом возрасте, и часто она является причиной газовых болей и дискомфорта в животе у детей, поэтому лучше подождать, пока ваш ребенок подрастет, чтобы дать ему газированные напитки любого вида.
Можно ли пить минеральную воду детям?
FDA определяет минеральную воду как воду, поступающую из подземного источника и содержащую определенный процент растворенных твердых частиц.Минералы, содержащиеся в минеральной воде, обычно представляют собой натрий, кальций и магний, хотя FDA не регулирует, какие минералы или сколько их может быть в воде — просто минералы должны естественным образом встречаться в воде и не могут быть добавлены позже.
Производители минеральной воды не обязаны указывать минералы на бутылке, поэтому не всегда понятно, что именно находится в бутылке, когда вы ее покупаете, и, в зависимости от бренда, найти эту информацию в Интернете может быть сложно. Некоторая минеральная вода может содержать слишком много натрия и других минералов, с которыми почкам ребенка может быть трудно справиться.
После двухлетнего возраста небольшое количество обычной минеральной воды не страшно для вашего ребенка (их почки к этому времени уже достаточно созрели, чтобы справляться с минеральными нагрузками), но и не несет никакой дополнительной пользы для вашего ребенка. . (Они, вероятно, получают достаточное количество минералов с пищей, что делает минеральную воду ненужной.) Минеральная вода не имеет реальных преимуществ перед обычной водой, и ее безопасность не регулируется так, как другие типы воды (например, обычная бутилированная вода или вода из-под крана).
. (Они, вероятно, получают достаточное количество минералов с пищей, что делает минеральную воду ненужной.) Минеральная вода не имеет реальных преимуществ перед обычной водой, и ее безопасность не регулируется так, как другие типы воды (например, обычная бутилированная вода или вода из-под крана).
Какие кислоты содержатся в газированных напитках?
Крупный план нескольких банок газировки.
Изображение предоставлено: scanrail/iStock/Getty Images
Большинство безалкогольных напитков содержат одну или несколько из трех распространенных кислот: лимонную кислоту, угольную кислоту и фосфорную кислоту. Безалкогольные напитки со специфическими ароматизирующими ингредиентами могут также содержать другие менее распространенные кислоты. Уровень кислотности в газированных напитках может быть довольно высоким, и многие стоматологи выражают сожаление по поводу их долгосрочного воздействия на ваши зубы.
Самые распространенные кислоты
Тремя наиболее распространенными кислотами в безалкогольных напитках являются лимонная, угольная и фосфорная кислоты. Лимонная кислота содержится в цитрусовых продуктах, и любой безалкогольный напиток с цитрусовым вкусом будет содержать ее. Химическая формула: H(3)C(6)H(5)O(7). Углекислота образуется из растворенного углекислого газа, который присутствует почти во всех безалкогольных напитках. Химическая формула представляет собой просто комбинацию H(2)O воды и CO(2) двуокиси углерода, что дает H(2)CO(3). Производители безалкогольных напитков часто добавляют в колу фосфорную кислоту, чтобы придать ей острый вкус и замедлить рост плесени и бактерий. Большая часть кислотности колы происходит от фосфорной кислоты, химическая формула которой H(3)PO(4).
Лимонная кислота содержится в цитрусовых продуктах, и любой безалкогольный напиток с цитрусовым вкусом будет содержать ее. Химическая формула: H(3)C(6)H(5)O(7). Углекислота образуется из растворенного углекислого газа, который присутствует почти во всех безалкогольных напитках. Химическая формула представляет собой просто комбинацию H(2)O воды и CO(2) двуокиси углерода, что дает H(2)CO(3). Производители безалкогольных напитков часто добавляют в колу фосфорную кислоту, чтобы придать ей острый вкус и замедлить рост плесени и бактерий. Большая часть кислотности колы происходит от фосфорной кислоты, химическая формула которой H(3)PO(4).
Другие
Некоторые газированные напитки содержат кислоты в дополнение к трем наиболее распространенным. Яблочная кислота присутствует в некоторых фруктах и их соках, и производители негазированных напитков иногда добавляют ее в больших количествах для аромата и в качестве консерванта. По тем же причинам некоторые морсы содержат фумаровую кислоту в качестве добавки.
Кислотность
Показателем кислотности вещества является относительная концентрация ионов водорода, измеряемая его рН.Шкала рН логарифмическая; ноль — самый кислый, а 7.0 — полностью нейтральный. Чистая вода имеет рН 7,0. Каждое круглое число на шкале представляет собой десятикратное количество кислотности предыдущего числа. Кола измеряет около 2,5 по шкале рН. Аккумуляторная кислота для сравнения имеет pH около 1,0, что в 30 раз более кисло, чем у самых едких безалкогольных напитков. Корневое пиво является наименее кислым из газированных напитков: оно не содержит фосфорной кислоты и обычно менее газировано.
Последствия
Кислотность безалкогольных напитков может быть более вредной для зубов, чем содержащийся в них сахар.Промышленные пользователи фосфорной кислоты наносят ее на стальные детали, чтобы очистить их до металла перед покраской. Академия общей стоматологии предупреждает, что содержание кислоты в безалкогольных напитках может привести к повреждению зубов, и рекомендует ограничить их потребление, особенно для детей.
A Метод анализа главных компонентов
4. ВЫВОДЫ И РЕКОМЕНДАЦИИ
Анализ главных компонентов (АГК) является эффективным средством
уменьшения размерности большого набора переменных до небольшого числа
факторов.В этом исследовании было рассмотрено двенадцать (12) химических
составов 25 образцов безалкогольных напитков, проданных в Нигерии с
за последние двадцать (20) лет. Результаты показали
, что все, кроме кислотности и антиоксиданта, имеет значительную положительную связь между химическими составами. Доля
дисперсии переменной, которая может быть интерпретирована или
объяснена химическим составом, указывает на то, что все
химические составы, кроме кислотности, выше 0.5.
Таким образом, анализ основных компонентов предложил удалить
кислотность из анализа и сохранить первые три
основных компонента, поскольку они объясняют до 82,465 на
цента общей изменчивости. Также было замечено, что
Также было замечено, что
газированная вода, фруктоза, сахароза, основная концентрация,
стабилизатор, E412, краситель и желатин были важными
составами безалкогольных напитков в Нигерии, поскольку они имели
сильный положительный результат (более 0.5) Собственные векторы.
Распространение химических составов безалкогольных напитков
в Нигерии показало, что; вода газированная, фруктоза, сахароза,
основная концентрация, стабилизатор и Е412 составили значимые
составы Фанта, семерка, кока-кола, легкая кока-кола, диетическая кока-кола,
ти, спрайт, миринда. Солод Schweppes, limca, Afri-cola, Pepsi,
Maltina, Maltonic, Amstel и Hi
содержат большое количество антиоксидантов, консервантов и глюкозу.Напротив, 5-
живое, чивита, витальное молоко, горная роса, крест, газированная вода, тоник Fanta
, Fanta Lemon, Fanta ананас имели высокую концентрацию красителя
и желатина в качестве важных химических составов безалкогольных напитков
. .
.
На основании результатов этого исследования предлагаются следующие
рекомендации. Клиенты, страдающие аллергией
на сахар или страдающие диабетом, должны избегать употребления безалкогольных напитков
, перечисленных в компоненте один (1), из-за высокой концентрации сахара
.Что касается потребности в энергии,
потребители должны рассмотреть возможность употребления напитков с высокими баллами по компоненту два (2).
Компании по производству безалкогольных напитков, производящие напитки с высоким содержанием сахара
, должны учитывать своих клиентов, страдающих диабетом и
аллергией на высокое содержание сахара.
БЛАГОДАРНОСТЬ
Авторы признательны Департаменту статистики,
факультета естественных наук Университета Абуджи, Нигерия, за их
поддержку и поощрение на протяжении всего периода написания
этого исследования.
ССЫЛКИ
[1] Gatenby (2003). Энциклопедия пищевых наук и
питания (второе издание). Elsevier Science Ltd.
Elsevier Science Ltd.
[2] Жаклин Б.М. (2013). МС, РД, ЛД, ЦНС, ФАДА.
Кулинарное питание, Elsevier/Academic Press.
[3] Ведзича Б.Л. (2003). Энциклопедия пищевых наук
и питания (второе издание).
https://www.sciencedirect.com/science/article/pii/B012
227055X00969X.
[4] Stratford, M., Capell, CJ (2003). Энциклопедия продуктов питания
Науки и питание (второе издание).
https://www.sciencedirect.com/science/article/pii/B012
227055X011032.
[5] Хорхе, К. (2003). Энциклопедия пищевых наук и
питания (второе издание). https://doi.org/10.1016/B0-
12-227055-X/01101-9
[6] Кирк Р.С., Сойер Р., Пирсон Д. (1991). Состав
и анализ пищевых продуктов, 9-е издание.Харлоу: Longman
Научно-технический.
[7] Амблер, Т., Стайлз, К. (1996). Разработка бренда по сравнению с
разработка нового продукта: к модели процесса
расширенных решений. Маркетинговая разведка и планирование,
14(7): 10-19.
https://doi.org/10.1108/02634509610152664
[8] EFSA (Европейское управление по безопасности пищевых продуктов). (2011). Установка
профилей питательных веществ для пищевых продуктов с указанием пищевой ценности и
заявлений о пользе для здоровья в соответствии со статьей 4 Регламента (EC.)
№ 1924/2006: Научное заключение комиссии по диетическим продуктам
, питанию и аллергии. Журнал EFSA, 6 (2).
https://doi.org/10.2903/j.efsa.2008.644
[9] Дхармасена, К.А. (2010). Рынок безалкогольных напитков
в США: взаимосвязь спроса,
динамика, вопросы питания и вероятностный прогноз
оценка (кандидатская диссертация). Техасский университет A&M.
http://hdl.handle.net/1969.1/ETD-TAMU-2010-05-7911.
[10] Филипп, Б.Б., Шитту, А.М., Ашаолу, О.Ф. (2013).
Спрос на безалкогольные напитки среди городских
домохозяйств на юго-западе Нигерии. Африканский журнал
Продовольственное сельское хозяйство и развитие питания, 13(3):
7853-7869.
[11] Асиегбу, И.Ф., Ава, Х.О., Акпоту, К., Огбонна У.Б.
(2011). Развитие компетенции Salesforce и
маркетинговая деятельность промышленных и бытовых
фирм, выпускающих продукцию в Нигерии.Дальневосточный журнал психологии
и Бизнес, 2(4): 43-59.
[12] Pofahl, GM, Capps O., Jr., Clauson, Jr. A. (2005).
Спрос на безалкогольные напитки: свидетельство
панели сканирования AC-Nelson Home. Документ представлен на ежегодном собрании
Американской сельскохозяйственной экономической ассоциации
, Провиденс, Род-Айленд.
https://doi:10.22004/ag.econ.19441
[13] Engwa, A.G., Ihekwoaba, C.J., Ilo, U.S., Unaegbu, M.,
, Ayuk, L.E., Osuji, A.G. (2015). Определение некоторых
компонентов безалкогольных напитков и загрязнения некоторыми тяжелыми
металлами в Нигерии, Toxicology Report, 2: 384-390.
https://doi.org/10.1016/j.toxrep.2015.01.014
[14] Jimoh, J.K. (2015). Динамизм на нигерийском рынке газированных напитков
Динамизм на нигерийском рынке газированных напитков
безалкогольных напитков. LinkedIn.
https://www.linkedin.com/pulse/big-war-nigerian-
carbonated-soft-drink-market-jimoh-jelili-kolawole.
[15] Адеподжу-Белло, А.А., Огунтибежу, О.О., Онуэгбу, М.Т.,
, Айоола, Г., Кокер, Х. (2012). Анализ отдельных металлических примесей
в безалкогольных напитках, продаваемых в Лагосе,
Нигерия. African Journal of Biotechnology, 11(20): 4676-
4680.
[16] Aloh, GS, Obeagu, EI, Ifeanyi, Emeka, OC, Kanu, S.,
Ngozika, Ezechukwu, KO, Ezechukwu, Нка, Дж., Воскресенье.
(2015). Оценка сахара в безалкогольных напитках.World
Journal of Pharmacy and Pharmaceutical Sciences, 4(3):
112-125.
https://www.researchgate.net/publication/301327449_E
STIMATION_OF_SUGAR_IN_SOFT_DRINKS.
[17] Ramasami, P., Jhaumeer-Laulloo, S., Rondeau, P., Cadet,
F., Seepujak H., Seeruttun, A. (2004) Количественная оценка
сахаров в безалкогольных напитках и фруктах соков по плотности,
рефрактометрии, инфракрасной спектроскопии и статистическим
методам. Южноафриканский химический журнал, 57: 24-27.
Южноафриканский химический журнал, 57: 24-27.
Опасность безалкогольных напитков по сравнению с водой
Итак, вам нравится вкус этих сладких, ох уж вкусных безалкогольных напитков из морозильной камеры заправочной станции? Или, может быть, наполнить чашку, похожую на термос, битком набитую кубиками льда и увенчанную гибкой соломинкой?
Кто нет? Но вот плохие новости (и вы знали, что они будут).Эти супер-вкусные напитки ох, так плохо для вас. Особенно по сравнению с водой. Большинство из нас, взрослых, знают это. К сожалению, многие американские дети этого не делают.
По данным Национальной ассоциации безалкогольных напитков (NSDA), потребление безалкогольных напитков в настоящее время составляет более 600 порций по 12 унций (12 унций) на человека в год. С 1978 года потребление газированных напитков в США утроилось для мальчиков и удвоилось для девочек. Молодые мужчины в возрасте от 12 до 29 лет потребляют более 160 галлонов в год, то есть почти 2 литра в день.На этих уровнях калории из безалкогольных напитков составляют до 10 процентов от общего дневного потребления калорий для растущего мальчика.
Загрязнители бутилированной воды
Огромный рост потребления безалкогольных напитков не случаен — он связан с интенсивными маркетинговыми усилиями корпораций по производству безалкогольных напитков. Coca Cola, например, поставила перед собой цель увеличить потребление своей продукции в США не менее чем на 25 процентов в год. Рынок для взрослых находится в состоянии стагнации, поэтому целью являются дети.
Согласно статье в Beverage, январь 1999 г., «Влияние на учеников начальной школы очень важно для маркетологов безалкогольных напитков». С 1960-х годов промышленность увеличила размер одной порции со стандартной бутылки на 6 1/2 унции до бутылки на 20 унций. В кинотеатрах и магазинах 7-Eleven самым популярным размером сейчас является «Double Gulp» весом 64 унции. Компании по производству безалкогольных напитков тратят миллиарды на рекламу. Большая часть этих маркетинговых усилий направлена на детей через игровые площадки, игрушки, мультфильмы, фильмы, видео, благотворительные организации и парки развлечений; и через конкурсы, лотереи, игры и клубы через телевидение, радио, журналы и Интернет.Их усилия окупились. В прошлом году продажи безалкогольных напитков только в США превысили 57 миллиардов долларов, что является колоссальной суммой.
Итак, какие альтернативы пить детям? И какая альтернатива может выдержать такие масштабные маркетинговые усилия?
Ответ: старая добрая вода. Трудность заключается в том, чтобы сделать воду жизнеспособной альтернативой подросткам. Поскольку они привыкли потреблять много безалкогольных напитков, вкус воды может быть не таким уж привлекательным.
Трудность заключается в том, чтобы сделать воду жизнеспособной альтернативой подросткам. Поскольку они привыкли потреблять много безалкогольных напитков, вкус воды может быть не таким уж привлекательным.
Что ж, есть много способов получить больше воды в организме себя или подростка. Во-первых, ограничьте количество потребляемых безалкогольных напитков. Сахар и кофеин должны быть переработаны вашим телом, а для этого нужна вода — вода, которую вы пьете недостаточно. Не нравится вкус воды? Иногда простое питье холодным льдом делало вкус лучше. Мой любимый способ – колотый лед с долькой лимона. Есть водные ароматизаторы, которые вы можете купить в местном магазине здоровой пищи. Также рассмотрите возможность добавления стевии.Стевия — очень сладкая трава, которую диабетики часто используют в качестве заменителя сахара. Вы также можете найти его в магазине здоровой пищи.
Если вас устраивает вкус водопроводной воды, это прекрасно. Если нет, у вас или вашего подростка есть несколько вариантов. Конечно, вы можете купить бутилированную воду, но если это слишком дорого, подумайте о приобретении фильтра для воды, чтобы поставить его на кран дома. Вы можете купить различные фильтры для воды, которые отфильтровывают минералы и другие добавки, добавляемые местным управлением водоснабжения.Вкус сразу улучшится. Как и все новое, добавление достаточного количества воды в свой рацион требует плана. Это нелегко, если вы не выросли, делая это.
Конечно, вы можете купить бутилированную воду, но если это слишком дорого, подумайте о приобретении фильтра для воды, чтобы поставить его на кран дома. Вы можете купить различные фильтры для воды, которые отфильтровывают минералы и другие добавки, добавляемые местным управлением водоснабжения.Вкус сразу улучшится. Как и все новое, добавление достаточного количества воды в свой рацион требует плана. Это нелегко, если вы не выросли, делая это.
Рекламные ролики постоянно торгуют новейшими чудо-напитками, а удобные автоматы по продаже закусок продают безалкогольные напитки, от которых сложно отказаться. Как избежать некоторых проблем, связанных с сладкими безалкогольными напитками? Возьмите с собой на работу бутылку с водой и посвятите месяц своей новой привычке. Вы заметите, что такие мучительные проблемы, как головная боль и несварение желудка, исчезнут.
Читать дальше: Удивительный целебный эффект от помещения лимона в теплую воду
Потребление сладких напитков и риск развития рака: результаты проспективной когорты NutriNet-Santé здоровье, а также детерминанты пищевого поведения и статуса питания.Эта когорта была подробно описана ранее.30 Участники в возрасте старше 18 лет, имеющие доступ к Интернету, с мая 2009 г. непрерывно рекрутировались среди населения в целом с помощью крупных мультимедийных кампаний. Анкеты заполняются онлайн на специальном сайте. За участниками следует использование онлайн-платформы, связанной с их адресом электронной почты. Исследование NutriNet-Santé зарегистрировано на ClinicalTrials.gov как NCT03335644.
Сбор данных
При включении участники заполнили набор из пяти анкет, касающихся социально-демографических характеристик и образа жизни (например, дата рождения, пол, уровень образования, статус курения, количество детей),31 антропометрии (рост, вес), 3233 приема пищи (см. ниже), 343536 физической активности (утвержденный семидневный Международный вопросник физической активности)37 и состояние здоровья (например, личный и семейный анамнез заболеваний, менопаузальный статус, употребление наркотиков, включая гормональное лечение менопаузы и оральные контрацептивы).Вес набирали каждые полгода. Антропометрический вопросник для самостоятельного заполнения в Интернете сравнивался с традиционным бумажным вопросником,33 и указанный вес также проверялся по сравнению с весом, измеренным с помощью калиброванных весов (BC-418MA, TANITA, Токио, Япония) обученными исследователями в рамках проверочного исследования на подвыборка, 32 показывает высокую согласованность. Другие веб-анкеты, используемые для сбора исходных характеристик участников (например, социально-демографические данные и данные об образе жизни), также были протестированы в сравнении с традиционными бумажными анкетами,31 показывая очень высокую согласованность между двумя методами и даже более низкую долю отсутствующих или аномальных значений.
ниже), 343536 физической активности (утвержденный семидневный Международный вопросник физической активности)37 и состояние здоровья (например, личный и семейный анамнез заболеваний, менопаузальный статус, употребление наркотиков, включая гормональное лечение менопаузы и оральные контрацептивы).Вес набирали каждые полгода. Антропометрический вопросник для самостоятельного заполнения в Интернете сравнивался с традиционным бумажным вопросником,33 и указанный вес также проверялся по сравнению с весом, измеренным с помощью калиброванных весов (BC-418MA, TANITA, Токио, Япония) обученными исследователями в рамках проверочного исследования на подвыборка, 32 показывает высокую согласованность. Другие веб-анкеты, используемые для сбора исходных характеристик участников (например, социально-демографические данные и данные об образе жизни), также были протестированы в сравнении с традиционными бумажными анкетами,31 показывая очень высокую согласованность между двумя методами и даже более низкую долю отсутствующих или аномальных значений. в веб-анкете благодаря интегрированным элементам управления, обязательным полям и шаблонам условного пропуска.Другие методологические исследования были проведены для проверки надежности данных, заявленных участниками в Интернете, и также выявили очень высокий уровень согласованности.38 Например, согласованность между заявленной информацией о поле, дате рождения и отделении рождения в выборке участников и первые цифры их номера социального страхования были проверены.
в веб-анкете благодаря интегрированным элементам управления, обязательным полям и шаблонам условного пропуска.Другие методологические исследования были проведены для проверки надежности данных, заявленных участниками в Интернете, и также выявили очень высокий уровень согласованности.38 Например, согласованность между заявленной информацией о поле, дате рождения и отделении рождения в выборке участников и первые цифры их номера социального страхования были проверены.
Что касается сбора данных о питании, на исходном уровне и каждые шесть месяцев (чтобы варьировать сезон завершения), участников попросили заполнить три непоследовательных проверенных сетевых 24-часовых записи о питании, случайным образом распределенных в течение двухнедельного периода (два дня в неделю). и один выходной день, чтобы учесть изменчивость рациона в течение недели).Расчет среднего суточного рациона питания за период исследования был взвешен с учетом соотношения 5:7 и 2:7 будних и выходных дней. были обязательными для включения в анализ питания. В Приложении 1 приведены подробные сведения о качественной и количественной оценке потребления продуктов питания и напитков, выполненной в NutriNet-Santé. Диетическое занижение было выявлено на основе метода, предложенного Блэком, с использованием скорости основного обмена и порога Голдберга, а заниженные данные о потреблении энергии были исключены (20.0%).40 В Приложении 2 подробно описывается метод выявления лиц, не сообщающих данные.
В Приложении 1 приведены подробные сведения о качественной и количественной оценке потребления продуктов питания и напитков, выполненной в NutriNet-Santé. Диетическое занижение было выявлено на основе метода, предложенного Блэком, с использованием скорости основного обмена и порога Голдберга, а заниженные данные о потреблении энергии были исключены (20.0%).40 В Приложении 2 подробно описывается метод выявления лиц, не сообщающих данные.
Потребление напитков
Таблица состава NutriNet-Santé включала 97 наименований сладких напитков и 12 наименований напитков с искусственными подсластителями. В группу сладких напитков вошли все подслащенные сахаром напитки, содержащие более 5% простых углеводов, а также 100% фруктовые соки (без добавления сахара). Он включал безалкогольные напитки (газированные или нет), сиропы, 100% сок, морсы, горячие напитки с сахаром, напитки с сахаром на молочной основе, спортивные напитки и энергетические напитки.Среднее содержание сахара в сладких напитках составило 10,7 г/100 мл. Затем группу сладких напитков разделили на 100% фруктовые соки (средний уровень сахара 10,3 г/100 мл) и сладкие напитки, за исключением 100% фруктовых соков (средний уровень сахара 10,9 г/100 мл). В группу искусственно подслащенных напитков вошли все напитки, содержащие некалорийные подсластители, такие как диетические безалкогольные напитки, сиропы без сахара и диетические напитки на молочной основе.
Затем группу сладких напитков разделили на 100% фруктовые соки (средний уровень сахара 10,3 г/100 мл) и сладкие напитки, за исключением 100% фруктовых соков (средний уровень сахара 10,9 г/100 мл). В группу искусственно подслащенных напитков вошли все напитки, содержащие некалорийные подсластители, такие как диетические безалкогольные напитки, сиропы без сахара и диетические напитки на молочной основе.
Взятие биологических проб и клиническое обследование
Участники исследования NutriNet-Santé были приглашены на добровольной основе в один из местных центров, специально созданных для взятия биологических проб и клинического обследования, включая измерения биоимпеданса, в каждом регионе (83 госпитальных центра).Индекс висцерального жира рассчитывали с помощью калиброванного импедансного анализатора состава тела (BC-418MA, TANITA, Токио, Япония) на основе общей оценки тела и регионарного процента жира, которые ранее были проверены с помощью двухэнергетической рентгеновской абсорбциометрии. 41 В более общем плане , оценки жира с помощью анализатора состава тела были подтверждены двухэнергетической рентгеновской абсорбциометрией в нескольких исследованиях.4243 Индекс висцерального жира колеблется от 0 до 60 единиц и считается чрезмерным, если он превышает 12 единиц. Эти биологические и клинические данные были собраны для 19 772 участников когорты, среди которых 15 637 относились к исследуемой выборке настоящего исследования.
41 В более общем плане , оценки жира с помощью анализатора состава тела были подтверждены двухэнергетической рентгеновской абсорбциометрией в нескольких исследованиях.4243 Индекс висцерального жира колеблется от 0 до 60 единиц и считается чрезмерным, если он превышает 12 единиц. Эти биологические и клинические данные были собраны для 19 772 участников когорты, среди которых 15 637 относились к исследуемой выборке настоящего исследования.
Выявление случая
События в области здравоохранения были объявлены самостоятельно с помощью ежегодной анкеты, специальной анкеты для осмотра (каждые три месяца) или в любое время через специальный интерфейс на веб-сайте исследования. Каждое заявление об обнаружении рака контролировалось врачом из исследовательской группы, который связывался с участниками и просил их предоставить любые соответствующие медицинские записи. Когда требовалась дополнительная информация, мы связывались с лечащим врачом пациента, или с больницей, или с обоими. Все медицинские данные были рассмотрены комиссией врачей. Когорта NutriNet-Santé связана с медико-административными базами данных национальной системы медицинского страхования (базы данных SNIIRAM) и французским национальным регистром смертности от конкретных причин (CépiDC). Основываясь на этих базах данных, мы могли заполнить информацию о событиях со здоровьем и смертях, тем самым ограничив любую потенциальную предвзятость из-за участников с раком, которые могли не сообщить о своем заболевании исследователям. Случаи рака классифицировали с использованием МКБ-10 (международная классификация болезней, 10-й пересмотр).В этом исследовании мы считали все первые первичные виды рака, диагностированные между датой включения и 11 января 2018 года, случаями, за исключением базально-клеточного рака кожи, который не считался раком. Медицинские записи были получены для более чем 90% случаев рака. Из-за высокой достоверности самоотчетов (95% случаев рака, о которых сообщали сами, для которых были получены медицинские записи, были подтверждены нашими врачами), все участники, которые сами сообщили о случаях рака, были включены в качестве случаев, если только они не были идентифицированы как участники, не участвующие в исследовании.
Все медицинские данные были рассмотрены комиссией врачей. Когорта NutriNet-Santé связана с медико-административными базами данных национальной системы медицинского страхования (базы данных SNIIRAM) и французским национальным регистром смертности от конкретных причин (CépiDC). Основываясь на этих базах данных, мы могли заполнить информацию о событиях со здоровьем и смертях, тем самым ограничив любую потенциальную предвзятость из-за участников с раком, которые могли не сообщить о своем заболевании исследователям. Случаи рака классифицировали с использованием МКБ-10 (международная классификация болезней, 10-й пересмотр).В этом исследовании мы считали все первые первичные виды рака, диагностированные между датой включения и 11 января 2018 года, случаями, за исключением базально-клеточного рака кожи, который не считался раком. Медицинские записи были получены для более чем 90% случаев рака. Из-за высокой достоверности самоотчетов (95% случаев рака, о которых сообщали сами, для которых были получены медицинские записи, были подтверждены нашими врачами), все участники, которые сами сообщили о случаях рака, были включены в качестве случаев, если только они не были идентифицированы как участники, не участвующие в исследовании. по патологоанатомическому заключению.
по патологоанатомическому заключению.
Статистический анализ
Мы определили исходный уровень как дату включения в когорту (когда участники завершили заполнение набора исходных вопросников по диете, физической активности, здоровью, социально-демографическим характеристикам и антропометрии). Мы включили 101 257 участников без рака на исходном уровне, которые представили по крайней мере две достоверные записи о питании за 24 часа в течение первых двух лет наблюдения. Приложение 3 показывает ход исследования. Приложение 4 сравнивает включенных и исключенных участников.
Мы выполнили снижение дисперсии путем расчета обычного ежедневного потребления напитков с помощью метода, предложенного Национальным институтом рака США (макросы SAS %MIXTRAN, за которым следует %INDIVINT), чтобы скорректировать изменчивость внутри человека и между людьми и устранить нули (неупотребление 44. В этом проспективном анализе мы рассчитали ежедневное потребление пищи, приняв во внимание все 24-часовые записи о питании, доступные в течение первых двух лет наблюдения за каждым участником, и использовали их в качестве исходного обычного потребления пищи. Мы использовали метод множественного вменения с помощью цепных уравнений с полностью условной спецификацией (15 вмененных наборов данных) для обработки отсутствующих данных в ковариатах для следующих переменных: статус курения (0,1% отсутствующих данных), уровень образования (6,3%), уровень физической активности. (14,0%), рост (0,6%) и ИМТ (0,6%).45 Мы оценили прибавку в весе во время наблюдения как процент прибавки в весе между включением участников и последним заявленным на сегодняшний день весом (за исключением данных о весе, в течение двух лет, предшествующих заболеванию раком).Мы определили кварталы потребления каждого вида сладких напитков в зависимости от пола. Участники были включены в разные даты входа, имели разную продолжительность последующего наблюдения и цензурированные данные. Изучаемыми видами рака были общий рак, рак молочной железы, предстательной железы и колоректальный рак (наиболее частые локализации рака в когорте) и рак легких во вторичном анализе.
Мы использовали метод множественного вменения с помощью цепных уравнений с полностью условной спецификацией (15 вмененных наборов данных) для обработки отсутствующих данных в ковариатах для следующих переменных: статус курения (0,1% отсутствующих данных), уровень образования (6,3%), уровень физической активности. (14,0%), рост (0,6%) и ИМТ (0,6%).45 Мы оценили прибавку в весе во время наблюдения как процент прибавки в весе между включением участников и последним заявленным на сегодняшний день весом (за исключением данных о весе, в течение двух лет, предшествующих заболеванию раком).Мы определили кварталы потребления каждого вида сладких напитков в зависимости от пола. Участники были включены в разные даты входа, имели разную продолжительность последующего наблюдения и цензурированные данные. Изучаемыми видами рака были общий рак, рак молочной железы, предстательной железы и колоректальный рак (наиболее частые локализации рака в когорте) и рак легких во вторичном анализе.
Поскольку основной целью было сравнить риск развития рака при различных уровнях потребления сладких напитков (закодированных как непрерывные переменные или кварталы) с учетом конкурирующих событий (смертность и другие локализации рака, отличные от той, которая изучалась в анализе локализации рака) , мы использовали многомерные модели Файна и Грея с возрастом в качестве основной временной шкалы и усечением влево для вычисления коэффициентов риска подраспределения и их 95% доверительных интервалов.
Эта модель оценивает абсолютную частоту интересующего события, что позволяет нам непосредственно смоделировать связь между переменной воздействия и уровнем заболеваемости раком после учета конкурирующих рисков и прямого (но не числового) вывода о риске раком.4647 Таким образом, отношение рисков подраспределения можно интерпретировать как изменение частоты рака в зависимости от потребления сладких напитков у пациентов, которые либо не имеют событий, либо перенесли конкурирующее событие:48 отношение рисков подраспределения значительно >1 отражает повышенный риск и отношение рисков подраспределения значительно <1 отражают снижение риска.В качестве анализа чувствительности был протестирован еще один подход к учету конкурирующего риска с использованием моделей Кокса для конкретных причин, обеспечивающих коэффициенты риска для конкретных причин.
Мы проверили предположение о пропорциональных рисках модели Файна и Грея, используя перемасштабированные остатки Шенфельда, вычисленные вместе с макросом SAS %PSHREG, как описано Колем и его коллегами. 49 Соответствующие значения P были получены путем проверки корреляций Пирсона между остатками и журнал(длительность наблюдения) (приложение 5).
49 Соответствующие значения P были получены путем проверки корреляций Пирсона между остатками и журнал(длительность наблюдения) (приложение 5).
В непрерывных моделях приращение для различных типов напитков было адаптировано в соответствии с распределением их потребления. Прибавка в 100 мл/день была адаптирована для сладких напитков, но она была чрезмерной для искусственно подслащенных напитков с точки зрения диапазона их потребления в этом исследовании (как показано на графиках распределения, приложение 6). Таким образом, для искусственно подслащенных напитков было выбрано приращение 10 мл/день. Прибавка по сахару из сладких напитков составила 10 г/сутки.
Мы оценили и протестировали потенциальные нелинейные эффекты переменных непрерывного воздействия, используя ограниченные кубические сплайн-преобразования в многопараметрических моделях конкурирующих конечных точек (приложение 7).50 Участники предоставили личное время до даты постановки диагноза рака, даты последнего заполнения анкеты, даты смерти или 11 января 2018 г. , в зависимости от того, что наступит раньше. Мы провели стратификацию по менопаузальному статусу для анализа рака молочной железы. Для них женщины вносили вклад в человека в пременопаузальную модель до их возраста в менопаузе и в постменопаузальную модель с их возраста в менопаузе.
, в зависимости от того, что наступит раньше. Мы провели стратификацию по менопаузальному статусу для анализа рака молочной железы. Для них женщины вносили вклад в человека в пременопаузальную модель до их возраста в менопаузе и в постменопаузальную модель с их возраста в менопаузе.
Основная модель была скорректирована с учетом возраста (временная шкала), пола, потребления энергии без алкоголя (ккал/сутки, непрерывно), потребления сахара из других пищевых источников (все источники, кроме сладких напитков), алкоголя, натрия, липидов и фруктов и потребление овощей (г/сутки, непрерывно), индекс массы тела (кг/м 2 , непрерывно), рост (см, непрерывно), физическая активность (высокая, умеренная, низкая, рассчитанная в соответствии с рекомендациями Международного опросника физической активности), 37 статус курения (никогда не куривший, бывший, нынешний курильщик), количество записей о питании за 24 часа (непрерывно), рак в семейном анамнезе (да или нет), уровень образования (ниже среднего образования, менее двух лет после окончания средней школы, два или более года после окончания средней школы) и следующие распространенные состояния на исходном уровне: диабет 2 типа (да или нет), гипертония (да или нет), серьезное сердечно-сосудистое событие (инфаркт миокарда или инсульт; да или нет) и дислипидемия. (триглицериды или холестерин, или оба; кодируется как 0, 1, 2, по количеству дислипидемий).Мы внесли дополнительные поправки на количество биологических детей (непрерывно), менопаузальный статус на исходном уровне (менопауза или не менопауза), гормональное лечение менопаузы на исходном уровне и во время последующего наблюдения (для постменопаузальных анализов; да или нет) и оральные контрацептивы. использование на исходном уровне и во время последующего наблюдения (для пременопаузальных анализов; да или нет) для анализов рака молочной железы.
(триглицериды или холестерин, или оба; кодируется как 0, 1, 2, по количеству дислипидемий).Мы внесли дополнительные поправки на количество биологических детей (непрерывно), менопаузальный статус на исходном уровне (менопауза или не менопауза), гормональное лечение менопаузы на исходном уровне и во время последующего наблюдения (для постменопаузальных анализов; да или нет) и оральные контрацептивы. использование на исходном уровне и во время последующего наблюдения (для пременопаузальных анализов; да или нет) для анализов рака молочной железы.
Мы провели стратифицированный анализ в соответствии с исходным ИМТ (< или ≥25 кг/м 2 ) и процентным увеличением веса по сравнению с исходным (≤ или >5%).Поскольку некоторые антиоксиданты могут взаимодействовать с табачным дымом,51 мы проверили взаимодействие между потреблением фруктовых соков (а также других видов сладких напитков) и статусом курения на риск развития рака . Мы проверили другие переменные воздействия в многовариантных моделях, таких как потребление энергии из сладких напитков, а также газированных напитков с сахаром. Мы применили бутстрэп-подход к оценке обычного потребления пищи путем уменьшения дисперсии в качестве анализа чувствительности с последующим тестированием моделей Файна и Грея для учета дополнительных вариаций.Нижняя и верхняя границы эмпирических доверительных интервалов были определены соответственно как 2,5-й и 97,5-й центиль распределения коэффициентов опасности подраспределения, полученных на всех итерациях (n = 200). В Приложении 11 представлены методы и результаты ряда других анализов чувствительности.
Мы применили бутстрэп-подход к оценке обычного потребления пищи путем уменьшения дисперсии в качестве анализа чувствительности с последующим тестированием моделей Файна и Грея для учета дополнительных вариаций.Нижняя и верхняя границы эмпирических доверительных интервалов были определены соответственно как 2,5-й и 97,5-й центиль распределения коэффициентов опасности подраспределения, полученных на всех итерациях (n = 200). В Приложении 11 представлены методы и результаты ряда других анализов чувствительности.
Мы провели линейную регрессию с несколькими переменными в качестве вторичного анализа, чтобы исследовать связь между квартальным потреблением сладких напитков и индексом висцерального ожирения, принимая во внимание потенциальные искажающие факторы: возраст, пол, потребление энергии без алкоголя, потребление сахара из других пищевых источников. , потребление алкоголя, индекс массы тела, физическая активность, статус курения, количество записей о питании за 24 часа и уровень образования.

 Пик эффективности достигается при 200° C – 2NaHCO3 → Na2CO3 + H2O + CO2↑
Пик эффективности достигается при 200° C – 2NaHCO3 → Na2CO3 + H2O + CO2↑
 Полученное известковое молоко необходимо для регенерации аммиака из раствора (фильтровой жидкости), которую получили в процессе отделения бикарбоната
Полученное известковое молоко необходимо для регенерации аммиака из раствора (фильтровой жидкости), которую получили в процессе отделения бикарбоната Текстильная промышленность использует соду в процессе отделки шёлковых и хлопчатобумажных тканей
Текстильная промышленность использует соду в процессе отделки шёлковых и хлопчатобумажных тканей В этом деле сода популярна, потому что вследствие высокой температуры в очаге горения выделяется много углекислого газа, атмосфера которого не допускает кислород воздуха в очаг горения
В этом деле сода популярна, потому что вследствие высокой температуры в очаге горения выделяется много углекислого газа, атмосфера которого не допускает кислород воздуха в очаг горения

 Кроме того, ваша кровь станет гуще, если вы не пьете достаточно воды, что приведет к повышению артериального давления.
Кроме того, ваша кровь станет гуще, если вы не пьете достаточно воды, что приведет к повышению артериального давления. Если вы не пьете достаточно, у вас будут проблемы с пищеварением, такие как запоры, повышенный риск изжоги и даже язвы желудка.
Если вы не пьете достаточно, у вас будут проблемы с пищеварением, такие как запоры, повышенный риск изжоги и даже язвы желудка.